弱光胁迫对烟草幼苗抗氧化系统及相关基因表达的影响
2019-09-10关晓溪隋常玲胡海军吴亚男吴燕
关晓溪 隋常玲 胡海军 吴亚男 吴燕




摘要:【目的】探討弱光胁迫对烟草幼苗抗氧化系统及相关基因表达的影响,为后续开展烟草遗传改良提供科学依据。【方法】以自然光(12000 lx)为对照(CK),设T1(7500 lx)、T2(4500 lx)和T3(2500 lx)3个弱光胁迫处理,于烟苗生长至大十字期时随机取样测定不同光照处理下烟草幼苗的抗氧化系统相关指标,利用实时荧光定量PCR(qRT-PCR)检测调控响应光信号内源物质相关基因的差异表达模式,并分析基因表达对胁迫抗性的影响。【结果】一定程度的弱光(7500和4500 lx)胁迫可使烟苗叶片的脯氨酸(Pro)含量上升,可溶性蛋白含量下降,丙二醛(MDA)含量升高,超氧阴离子产生速率提高,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性提高;而重度弱光(2500 lx)胁迫导致抗氧化酶活性大幅度下降,证明重度弱光导致烟苗生长过弱,其体内的防御酶系统不足以抵抗逆境胁迫。在此过程中,烟草生长素早期反应基因GH3.6、过氧化物酶类似物基因peroxidase P7-like和细胞色素基因P450的表达均在轻度弱光(7500 lx)胁迫时下调,在重度弱光(2500 lx)胁迫时进一步下调;抗病蛋白基因RGA3在重度弱光胁迫下显著下调(P<0.05)。【结论】一定程度的弱光胁迫能激活烟草幼苗抗氧化系统,抑制幼苗内源物质相关基因的表达,推测其参与了烟草的光信号应激反应。
关键词: 烟草幼苗;弱光胁迫;生长发育;基因表达
中图分类号:S572.01 文献标志码: A 文章编号:2095-1191(2019)05-0957-07
Abstract:【Objective】The effect of low light intensity stress on tobacco seedlings antioxidant system and expression of related genes were explored to provide scientific basic for tobacco genetic improvement in the future. 【Method】Taking natural light(12000 lx) as control(CK),three low light stress treatments T1(7500 lx),T2(4500 lx) and T3(2500 lx) were set up. Antioxidant system indexes of randomly sample of tobacco seedlings during the big cross period in different light treatments were determined. Then real-time fluorescence quantitative PCR(qRT-PCR) method was used to analyze the expression patterns of genes involved in endogenous substances responding to low light intensity stress in tobacco seedlings. Finally,the influence of gene expressions on stress resistance was also analyzed. 【Result】A certain degree of low light stress(7500 and 4500 lx)initiated a dramatic increase of the proline(Pro) and malonaldehyde(MDA) contents in tobacco leaves,superoxide anion production rate and antioxidant enzyme activity,including superoxide dismutase(SOD),peroxidase(POD) and catalase(CAT),while a decrease of soluble protein content. However,serious stress(2500 lx) led to antioxidant enzyme activity decrease to a very low level,which proved that serious light stress led to the weak growth of the seeding,and the internal defensive enzyme system was insufficient to resist stress. In this process,the expression of auxin early response gene GH3.6,peroxidase analog gene peroxidase P7-like and cytochrome gene P450 were all down-regulated under mild low light stress(7500 lx),further down-regulated under severe low light stress(2500 lx),and disease resistance protein(RGA3) was down-regulated significantly under severe low light stress(P<0.05). 【Conclusion】The results show that a certain degree of low light stress activates tobacco seedlings antioxidant system and inhibits the expression of these genes,which might be involved in the light signal stress response in tobacco.
Key words: tobacco seeding; low light intensity stress; development and growth; gene expression
0 引言
【研究意义】烟草(Nicotiana tabacum L.)为喜光作物。贵州是我国西南烟草种植区的重要组成部分,也是重要的优质烤烟产地,拥有得天独厚的生态环境;但贵州地处我国西南部,全年太阳辐射和日照时数较少,且冬季育苗时通常选择设施育苗,在保证温度条件的同时加剧了弱光胁迫作用,直接影响到烟苗品质。已有研究表明,一定程度的弱光胁迫会引起植物抗氧化酶系统中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性升高,同时引起脯氨酸(Pro)和丙二醛(MDA)含量的显著响应(Iriti and Faoro,2009)。因此,探讨弱光胁迫对烟草幼苗抗氧化系统的影响和相关基因的表达,对烟草的抗性育苗及贵州烤烟生产的发展具有重要意义。【前人研究进展】近年来,有关弱光胁迫对植物光合、生理生化等影响的研究多集中在低温弱光两因素胁迫,研究对象多以设施蔬菜幼苗为主,包括辣椒和番茄等(张淑杰等,2014;王春萍等,2015;王勤礼等,2015;李雅洁等,2018)。侯伟等(2015)研究發现,低温弱光胁迫下西瓜幼苗的MDA含量上升,SOD和POD活性先上升后下降,CAT活性持续下降。马晓丽(2015)研究发现,随着光照强度减弱,大白菜幼苗的抗氧化酶活性整体呈升高趋势,同时结合干旱胁迫处理,发现其过氧化氢(H2O2)和MDA含量并未发生变化,抗氧化酶活性也维持原有水平。围绕弱光下植物抗氧化系统的相应响应,何静雯等(2018)对弱光胁迫下葡萄抗氧化酶系统及相关基因表达的研究表明,随着胁迫程度的加深,植株叶片中CAT、SOD和POD活性先升高后快速下降,与可溶性蛋白含量变化一致,Pro和MDA含量与胁迫程度呈正相关,MYC2和TRX基因表达先上调后下降;刘新等(2018)研究表明,随光强减弱,金银花叶片的SOD、CAT和POD活性先升后降,MDA含量增加;罗亢等(2018)研究表明,耐弱光胁迫型晚稻品种的叶片在弱光胁迫下能维持较高的CAT和SOD活性,POD活性差异不显著。关于弱光胁迫对烟草生理特性的研究多集中于成苗移栽后的生长和品质调查(倪国仕等,2014;李正付等,2016),而有关苗期抗氧化系统的相关研究较少。烟草苗期在逆境胁迫下极易引发病害,抗病基因同源物(RGA)参与植物抗病反应过程,目前多集中于基因克隆和结构分类研究(Meyers et al.,2003;袁清华等,2014)。GH3(Gretchen Hagen 3)基因是一类生长素早期响应基因家族,响应参与生长素途径相关的早期胁迫反应(Lavy and Estellle,2016)。细胞色素P450参与植物多种代谢活动,且在此过程中产生一些增强抵御逆境胁迫及病虫害的次生代谢产物。Fu等(2009)利用基因组学分析烟草P450基因家族的某些成员表现组织特异性表达,推测其与烟草抗性相关。可见,这些基因对于提高烟草抗逆性具有重要意义。【本研究切入点】目前,对弱光胁迫下烟草苗期抗氧化物质的调查,尤其是有关特异性调控烟草响应弱光胁迫的内源物质相关基因表达分析的研究尚无报道。【拟解决的关键问题】以烤烟品种云烟87为试验材料,于烟苗大十字期随机取样测定不同光照处理烟苗的抗氧化系统指标,利用实时荧光定量PCR(qRT-PCR)检测调控响应光信号内源物质相关基因的差异表达模式,并分析基因表达对胁迫抗性的影响,探讨弱光胁迫对烟草幼苗抗氧化系统的影响及相关基因表达,为后续开展烟草遗传改良提供科学依据。
1 材料与方法
1. 1 试验材料
试验在遵义师范学院人工气候室进行。供试烤烟品种为云烟87(贵州省遵义市烟草公司遵义县乐山烟草科技园提供),采用16×10穴盘漂浮育苗。
1. 2 试验方法
以自然光(12000 lx)为对照(CK),由人工气候室提供相应环境条件,设T1(7500 lx)、T2(4500 lx)和T3(2500 lx)3个弱光胁迫处理,光周期设定12 h/12 h(昼/夜),培养温度为28 ℃/25 ℃(昼/夜)。每处理3次重复。于烟苗大十字期随机取样测定烟草幼苗抗氧化系统相关指标;取T1和T3处理幼苗叶片进行qRT-PCR检测。其他管理参照常规育苗方法。
1. 3 测定项目及方法
可溶性蛋白含量采用考马斯亮蓝G-250法测定;MDA含量采用硫代巴比妥酸法测定;Pro含量采用茚三酮显色法测定;超氧阴离子产生速率采用羟胺氧化法测定;SOD活性采用NBT法测定;CAT活性采用过氧化氢法测定;POD活性采用愈创木酚法测定。
相关基因表达qRT-PCR分析选用的植物总RNA提取试剂盒、FastQuant RT Super Mix试剂盒购自天根生化科技(北京)有限公司,方法参照试剂盒说明。基于研究团队前期构建的烟草幼苗转录组数据库,获取调控抗性内源物质相关目的基因序列信息,应用DNAMAN软件设计目的基因表达qRT-PCR分析特异引物(表1),委托生工生物工程(上海)股份有限公司合成。参照天根Talent荧光定量检测试剂盒(SYBR Green)的方法,参考BIO-RAD公司CFX Connect Real-Time System的qRT-PCR程序进行qRT-PCR检测。设置3次生物学重复,扩增程序:95 ℃预变性3 min;95 ℃ 5 s,60 ℃ 15 s,进行40个循环。
1. 4 统计分析
利用Excel 2007和SPSS 20.0进行试验数据的统计分析和作图,采用LSD法进行差异显著性检验。
2 结果与分析
2. 1 不同光照处理对烟苗Pro和可溶性蛋白含量的影响
Pro是一种重要的渗透调节物质,逆境胁迫可使Pro在植物体内大量积累。由图1-A可看出,随着光照强度的减弱,烟苗叶片的Pro水平迅速增加,光照强度为4500 lx(T2处理)时Pro含量达最大值,为104.5 µg/gFW;光照强度继续减弱至2500 lx(T3处理)时,烟苗叶片的Pro含量则出现大幅度下降,显著低于其他处理(P<0.05,下同)。由此可知,一定程度的弱光诱导可显著上调烟苗叶片的Pro含量,光照强度过低反而会导致Pro含量大幅度衰减,可能是由于幼苗生长过弱所导致。
可溶性蛋白是植物体内一种重要的结构性物质,不良环境会降低其在植物体内的含量,影响植物正常的代谢平衡。由图1-B可看出,随着光照强度的持续减弱,烟苗叶片的可溶性蛋白含量显著下降,光照强度为2500 lx(T3处理)时达最低值,且各处理间差异均达显著水平。
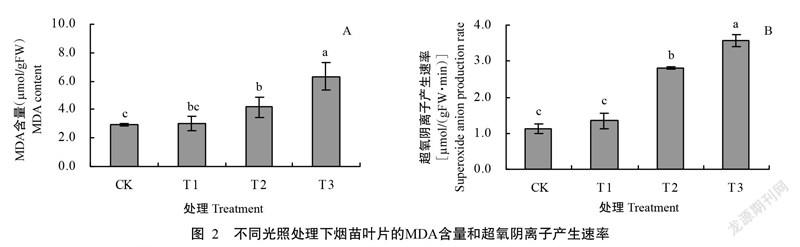
2. 2 不同光照处理对烟苗MDA含量和超氧阴离子产生速率的影响
逆境胁迫会使细胞膜系统受损,MDA是膜脂过氧化最重要的产物之一;多种不良环境还会导致植物体内产生大量的活性氧与自由基,其含量的积累能反映植物受外界环境胁迫的程度。由图2可看出,光照强度减弱使烟苗叶片的MDA含量和超氧阴离子产生速率均持续上升;光照强度为4500 lx(T2处理)时,两个指标均较CK显著升高;光照强度为2500 lx(T3处理)时,二者均达最大值。由此可见,弱光胁迫可导致烟苗叶片内MDA积累量显著升高,超氧阴离子产生速率也随弱光胁迫程度的加深而加快。
2. 3 不同光照處理对烟苗抗氧化保护酶系统的影响
抗氧化保护酶系统能清除逆境胁迫下植物体内产生的活性氧与自由基,缓解逆境伤害。SOD是保护酶系统的第一道防线,可歧化自由基和活性氧为H2O2,CAT和POD是清除H2O2的保护酶。由图3可看出,光照强度减弱使烟苗叶片的抗氧化酶活性迅速增加;与CK相比,T1和T2处理显著上升,且均在T2处理达最大值;但光照强度继续减弱时,3种抗氧化酶活性均出现较大幅度下降。由此可知,一定程度的弱光刺激会显著提高烟苗体内的SOD、CAT和POD活性,但光照强度过低会抑制保护酶系统的各种酶活性,出现此情况的原因可能是弱光导致植株生长过弱,抗氧化保护系统酶活性过低,削弱了植株的抗氧化能力。
2. 4 弱光胁迫下烟草幼苗内源物质相关基因的差异表达
取T1和T3处理下大十字期烟草幼苗叶片分析其内源物质相关基因的表达情况。由图4可知,烟草生长素早期反应基因GH3.6、过氧化物酶类似物基因peroxidase P7-like和细胞色素基因P450的表达均在轻度弱光胁迫时显著下调,在重度弱光胁迫时进一步显著下调;而抗病蛋白基因RGA3在轻度弱光胁迫下的表达与CK无显著差异(P>0.05),在重度弱光胁迫下显著下调。可见,上述基因对弱光胁迫表现特异性响应,轻度胁迫或重度胁迫下表达受到不同程度的抑制,可能参与了烟草在弱光胁迫下的应激反应。
3 讨论
当一定程度的逆境胁迫阻碍植物体合成蛋白时,植物会增加某些蛋白的含量来适应环境。植物体内可溶性蛋白和Pro等渗透调节物质均会响应环境胁迫,Pro是细胞渗透调节物质之一,在胁迫环境下调节一系列代谢反应(Zhang et al.,2015)。何静雯等(2018)研究发现,弱光胁迫下葡萄叶片的Pro含量与胁迫程度呈正相关,而可溶性蛋白含量先升高后下降,证明适度遮阴在一定程度上有利于葡萄生长,但重度胁迫造成的伤害不可逆,植物自身已无法通过适应反应进行应激调节。本研究结果表明,苗期一定程度的弱光诱导可显著上调烟苗叶片内的Pro含量,但随着弱光胁迫程度的加深,Pro含量开始大幅降低;而可溶性蛋白含量随胁迫程度的加剧同步下降,与何静雯等(2018)的结论不完全相同,可能是由于重度弱光胁迫严重破坏了烟苗内部的生理平衡,使其无法积累更多的Pro来抵御不良环境的伤害。
胁迫条件下植物细胞膜脂过氧化加剧会导致MDA大量积累,使细胞受损,而抗氧化酶系统中CAT、POD和SOD等保护酶能清除活性氧和自由基,与植物抗逆密切相关(Sridevi and Chellamuthu,2015)。杨兴有等(2008)研究表明,随着光强的降低,成苗移栽后烟草叶片内MDA含量逐渐升高,同时POD活性降低。倪国仕等(2014)研究表明,与全光照相比,一定程度的遮光能刺激烟草叶片成熟期POD和SOD活性提高。李正付等(2016)研究表明,烟草成苗移栽后,弱光胁迫可使其体内MDA含量上升,旺长期MDA含量增加,导致膜脂过氧化,影响烟苗最终的生长发育及品质形成。本研究发现,随着弱光胁迫加剧,烟苗叶片内的超氧阴离子产生速率提高,MDA含量亦显著升高,与杨兴有等(2008)、李正付等(2016)的研究结果相似;同时苗期弱光刺激显著提高了烟苗体内的SOD、CAT和POD活性;但随着弱光胁迫程度的加深,抗氧化酶活性开始大幅度下降,说明烟苗内部的代谢被破坏,自我调节能力减弱,体内的防御酶系统不足以抵抗由于胁迫而产生的自由基与活性氧,导致有害物质在烟苗体内积累过量,致使烟苗的生长发育受阻,与侯伟等(2015)对西瓜幼苗的研究一致。
作为植物的重要保护酶类,POD基因在植物的胁迫响应中发挥着重要作用(Ren et al.,2014)。目前研究表明,植物POD基因在同种或不同种胁迫下的表达并不一致。银杏在干旱及ABA胁迫下其POD1基因表达下调,同时其表达被重金属及一些伤害显著诱导(程华等,2010);而甘蔗POD2基因在干旱、ABA及盐胁迫下其表达量上调(苏亚春等,2017),同时其表达受H2O2诱导;对白杨的研究显示,其POD1基因在干旱胁迫下表达亦下调(Bae et al.,2006);王海波等(2017)对小桐子的研究发现,其POD73基因被低温诱导表达上调。烟草POD是一类具有功能多样性的基因家族,目前已有相关克隆和表达分析。杨尚谕等(2018)对克隆得到的烟草POD1基因进行多种胁迫条件下的表达模式分析,结果发现NtPOD1基因的表达受盐胁迫抑制,并受H2O2和低钾胁迫的诱导上调。此外,有学者结合POD活性及其基因表达分析展开相关研究。黄瓜叶片的POD活性在胁迫14 d以前升高,而后下降,同时其POD基因在第14 d表达上调,而后下调(张之为等,2017);同样利用高温处理,对两个水稻品种的调查发现,其POD活性在胁迫第3 d前升高,而后下降,同时在胁迫第7 d,G725品种POD基因表达大幅下调,而II838品种POD基因表达上调(王艳等,2015)。本研究发现,烟苗叶片的POD活性随光照强度的减弱而提高,但重度弱光胁迫时下降,同时peroxidase P7-like基因在轻度弱光胁迫时下调,在重度弱光胁迫时进一步下调。由此可见,POD及其类似物基因在不同物种、不同胁迫条件下的表达存在差异。
GH3(Gretchen Hagen 3)基因是一类生长素早期响应基因家族,目前已陆续在植物中克隆获得(曾文芳等,2015)。研究表明,除在植物生长发育生理进程中的作用外,大豆GH2/4还被H2O2、盐及重金属等胁迫信号诱导,参与某些胁迫的反应过程。对拟南芥幼苗形态学的观察发现,其子叶、真叶和根部的生长受氧化胁迫影响,而这种影响与GH3蛋白调控生长素的含量水平和机体内的动态分配有直接关系(Pasternak et al.,2005)。基因芯片结果显示,在所检测的207个烟草腺毛优势表达基因中,P450基因与生物碱代谢及防御反应等密切相关(Cui et al.,2011)。本研究发现,GH3.6和P450基因在轻度弱光胁迫时下调,在重度弱光胁迫时进一步下调,证明其可能参与了烟草的光信号应激反应。本研究发现重度弱光胁迫使抗病基因同源物(RGA)表达大幅下调,暗示胁迫干扰光信号途径生理反应的同时,可能伴随其他抗性因子的协同响应。
4 结论
一定程度的弱光胁迫能激活烟草幼苗抗氧化系统,抑制幼苗内源物质相关基因的表达,推测其可能参与了烟草的光信号应激反应。
参考文献:
程华,李琳玲,王燕,程水源. 2010. 银杏过氧化物酶基因POD1的克隆及表达分析[J]. 华北农学报,25(6):44-51. [Cheng H,Li L L,Wang Y,Cheng S Y. 2010. Molecular cloning,characterization and expression of POD1 gene from Ginkgo biloba L.[J]. Acta Agriculturae Boreali-Sinica,25(6):44-51.]
何静雯,李晨,邱甜,吴燕燕,沈梓力,吴月燕. 2018. 弱光胁迫下鄞红葡萄生理生化特性及相关基因的研究[J]. 华北农学报,33(6):123-129. [He J W,Li C,Qiu T,Wu Y Y,Shen Z L,Wu Y Y. 2018. Effects of weak light stress on physiological and biochemical characteristics and relative gene expression of Yinhong grape[J]. Acta Agriculturae Boreali-Sinca,33(6):123-129.]
侯伟,孙爱花,杨福孙,周兆德,陈汇林,吴翠玲. 2015. 低温弱光对西瓜幼苗光合作用和抗氧化酶活性的影响[J]. 热带作物学报,36(7):1232-1237. [Hou W,Sun A H,Yang F S,Zhou Z D,Chen H L,Wu C L. 2015. Effects of low temperature and low light on photosynthesis and antioxidant enzyme activities of watermelon seedlings[J]. Chinese Journal of Tropical Crops,36(7):1232-1237.]
李雅洁,张其安,陆晓民. 2018. 不同外源物质对低温弱光次生盐渍化复合逆境下黄瓜幼苗生长、抗氧化系统及光合作用的影响[J]. 江苏农业学报,34(2):404-410. [Li Y J,Zhang Q A,Lu X M. 2018. Effect of different exogenous substances on the growth,antioxidant system and photosynthesis of cucumber seedling under the adverse temperature,light,salt complex condition[J]. Jiangsu Journal of Agricultural Sciences,34(2):404-410.]
李正付,彭金良,顏成生,郭维,易镇邪. 2016. 弱光胁迫及光照转换对烤烟生理特性及品质的影响[J]. 作物研究,30(7):771-775. [Li Z F,Peng J L,Yan C S,Guo W,Yi Z X. 2016. Effects of low light stress and light intensity transfer on pysiological characteristics and quality of flue-cured tobacco[J]. Crop Research,30(7):771-775.]
刘新,王梦皎, 李一鸣, 房海灵, 亓希武,于盱,梁呈元. 2018. 光强对金银花药材性状、光合特性及抗氧化酶活性的影响[J]. 江西农业学报,30(9):58-62. [Liu X,Wang M J,Li Y M,Fang H L,Qi X W,Yu X,Liang C Y. 2018. Effects of light intensity on medicinal characters,photosynthetic traits and antioxidative enzyme activities of Lonicera japonica[J]. Acta Agriculturae Jiangxi,30(9):58-62.]
罗亢,曾勇军,胡启星,陈乐,易艳红,睢峰,黎星. 2018. 不同时期弱光胁迫对晚稻不同耐弱光品种源库特征及叶片保护酶活性的影响[J]. 中国水稻科学,32(6):581-590. [Luo K,Zeng Y J,Hu Q X,Chen L,Yi Y H,Sui F,Li X. 2018. Effects of weak light stress at different stages on sink-source characteristics and protective enzyme activities in leaf of late rice varieties with different tolerance[J]. Chinese Journal of Rice Science,32(6):581-590.]
马晓丽. 2015. 弱光对干旱胁迫下大白菜幼苗抗氧化系统的影响[J]. 北方园艺,(21):14-17. [Ma X L. 2015. Effect of weak light stresses on antioxidative system in Chinese cabbage under drought stess[J]. Northern Horticulture,(21):14-17.]
倪国仕,左梅,王瑞,吴文昊,向必坤,许自成. 2014. 光照强度对白肋烟光合特性及中性致香成分的影响[J]. 中国烟草科学,35(4):58-63. [Ni G S,Zuo M,Wang R,Wu W H,Xiang B K,Xu Z C. 2014. Effects of light intensity on photosynthetic characteristics and neutral aroma constituents of burley tobacco[J]. Chinese Tobacco Science,35(4):58-63.]
苏亚春,王竹青,李竹,刘峰,许莉萍,阙友雄,戴明剑,陈允浩. 2017. 甘蔗过氧化物ScPOD02的克隆与功能鉴定[J]. 作物学报,43(4):510-521. [Su Y C,Wang Z Q,Li Z,Liu F,Xu L P,Que Y X,Dai M J,Chen Y H. 2017. Molecular cloning and functional identification of peroxidase gene ScPOD02 in sugarcane[J]. Acta Agronomica Sinica,43(4):510-521.]
王春萍,黄启中,雷开荣,吕中华,静一,黄任中,林清,郑勇. 2015. 低温弱光下辣椒幼苗叶绿素荧光特性及其与品种耐性的关系[J]. 园艺学报,42(9):1798-1806. [Wang C P,Huang Q Z,Lei K R,Lü Z H,Jing Y,Huang R Z,Lin Q,Zheng Y. 2015. Chlorophyll fluorescence characteristics of pepper seedlings under low temperature and weak light and their relationship to varieties tolerance[J]. Acta Horticulturae Sinica,42(9):1798-1806.]
王海波,郭俊云,赵志军,张礼菊,龚明. 2017. 小桐子过氧化物酶73基因的克隆及表达分析[J]. 核农学报,31(1):29-36. [Wang H B,Guo J Y,Zhao Z J,Zhang L J,Gong M. 2017. Cloning and expression analysis of the gene enco-ding peroxidase 73 in Jatropha curcas[J]. Journal of Nuclear Agricultural Sciences,31(1):29-36.]
王勤礼,许耀照,闫芳,杨虹天,侯梁宇,张文斌. 2015. 低温弱光盐胁迫对辣椒幼苗生长和生理特性的影响[J]. 中国农学通报,31(22):111-114. [Wang Q L,Xu Y Z,Yan F,Yang H T,Hou L Y,Zhang W B. 2015. Effects of low temperature,weak light and salt stress on growth and physiological characteristics of pepper seedling[J]. Chinese Agricultural Science Bulletin,31(22):111-114.]
王艷,高鹏,黄敏,陈浩,杨志荣,孙群. 2015. 高温对水稻开花期剑叶抗氧化酶活性及基因表达的影响[J]. 植物科学学报,33(3):355-361. [Wang Y,Gao P,Huang M,Chen H,Yang Z R,Sun Q. 2015. Effect of high temperature on the activity and expression of antioxidative enzymes in rice flag leaves during the flowering stage[J]. Plant Science Journal,33(3):355-361.]
杨尚谕,李立芹,陈倩,卓维,刘仑,鲁黎明. 2018. 烟草过氧化物酶基因NtPOD1的克隆及表达模式分析[J]. 华北农学报,33(3):106-112. [Yang S Y,Li L Q,Chen Q,Zhuo W,Liu L,Lu L M. 2018. Cloning and expression pattern analysis of tobacco peroxidase gene NtPOD1 in Nicotiana tabacum[J]. Acta Agriculturae Boreali-Sinica,33(3):106-112.]
杨兴有,崔树毅,刘国顺,邢小军,余祥文,叶协锋,张建慧. 2008. 弱光环境对烟草生长、生理特性和品质的影响[J]. 中国生态农业学报,16(3):635-639. [Yang X Y,Cui S Y,Liu G S,Xing X J,Yu X W,Ye X F,Zhang J H. 2008. Effect of weak light on the growth,physiology and quality of tobacco[J]. Chinese Journal of Eco-Agriculture,16(3):635-639.]
袁清华,谢锐鸿,张振臣,马柱文,李集勤,李淑玲,陈俊标. 2014. 烟草表达抗病基因同源物(RGA)的鉴定及RGA-SSR标记的开发[J]. 作物学报,40(2):240-252. [Yuan Q H,Xie R H,Zhang Z C,Ma Z W,Li J Q,Li S L,Chen J B. 2014. Identification of expressed resistance gene analogues(RGAs) and development of RGA-SSR Markers in Nicotiana[J]. Acta Agronomica Sinica,40(2):240-252.]
曾文芳,潘磊,牛良,鲁振华,崔国朝,王志强. 2015. 桃GH3基因家族的生物信息学分析及其在果实发育中的表达[J]. 园艺学报,42(5):833-842. [Zeng W F,Pan L,Niu L,Lu Z H,Cui G C,Wang Z Q. 2015. Bioinformatics analysis and expression of the nectarine indole-3-acetic-acid-amido synthase(GH3) gene family during fruit development[J]. Acta Horticulturae Sinica,42(5):833-842.]
张淑杰,杨再强,陈艳秋,韩秀君,吴曼丽,赵先丽,李广霞. 2014. 低温、弱光、高湿胁迫对日光温室番茄花期生理生化指标的影响[J]. 生态学杂志,33(11):2995-3001. [Zhang S J,Yang Z Q,Chen Y Q,Han X J,Wu M L,Zhao X L,Li G X. 2014. Effects of low temperature,weak light and high humidity stresses on the physiological and biochemical indicators of greenhouse tomato during flowering period[J]. Chinese Journal Ecology,33(11):2995-3001.]
张之为,李晓静,白金瑞,陈帅,范梦轩. 2017. 高温条件下CO2对黄瓜SOD、POD和CAT活性及其基因表達的影响[J]. 华北农学报,32(4):67-72. [Zhang Z W,Li X J,Bai J R,Chen S,Fan M X. 2017. Effect of CO2 on cucumber leaf SOD,POD and CAT activity and gene expression under high temperature[J]. Acta Agriculturae Boreali-Sinica,32(4):67-72.]
Bae E,Lee H,Lee J,Noh E,Jo J. 2006. Molecular cloning of a peroxidase gene from poplar and its expression in response to stress[J]. Tree Physiology,26:1405-1412.
Cui H,Zhang S T,Yang H J,Ji H,Wang X J. 2011. Gene expression profile analysis of tobacco leaf trichomes[J]. BMC Plant Blology,11(1):76.
Fu C J,Xiong J,Miao W. 2009. Genome-wide identification and characterization of cytochrome P450 monooxygense genes in the ciliate Tetrahymena thermophila[J]. BMC Genomics,10:208.
Iriti M,Faoro F. 2009. Chemical diversity and defence metabo-lism:howplants cope with pathogens and ozone pollution[J]. Internationnal Journal of Molecular Sciences,10(8):3371-3399.
Lavy M,Estellle M. 2016. Mechanisms of auxin signaling[J]. The Company of Biologists,143:3226-3229.
Meyers B C,Kozik A,Griego A,Kuang H,Michelmore R W. 2003. Genome-wide analysis of NBS-LRR-Encoding genes in Arabidopsis[J]. Plant Cell,15(4):809-834.
Pasternak T,Potters G,Caubergs R,Jansen M A K. 2005. Complementary interactions between oxidative stress and auxin control plant growth responses at plant,organ,and cellular level[J]. Journal of Experimental Botany,56(418):1991-2001.
Ren L L,Liu Y J,Qian T T,Qi L W,Wang X R,Zeng Q Y. 2014. Subcellular relocalization and positive selection play key roles in the retention of duplicate genes of po-pulus Class Ⅲ Peroxidase Family[J]. Plant Cell,26(6):2404-2419.
Sridevi V,Chellamuthu V. 2015. Impact of weather on rice-A review[J]. International Journal of Applied Research,1(9):825-831.
Zhang G Y,Ren Y,Sun H H,Guo S G,Zhang F,Zhang J,Zhang H Y,Jia Z C,Fei Z J,Xu Y,Li H Z. 2015. A high-density genetic map for anchoring genome sequences and identifying QTLs associated with dwarf vine in pumpkin(Cucurbita maxima Duch.)[J]. BMC Genomics,16:1101.
(责任编辑 王 晖)
