木质纤维生物质半纤维素分离研究进展
2019-09-10岳盼盼付亘悫胡亚洁李艳霏彭锋孙润仓
岳盼盼 付亘悫 胡亚洁 李艳霏 彭锋 孙润仓

摘 要:在一体化的木质纤维生物质精炼过程中,选择性分离半纤维素非常关键。本文对传统和新型溶剂体系分离半纤维素的方法进行了详细综述,综合阐述了国内外研究学者在半纤维素分离方面的相关研究成果,并对不同的分离方法进行了比较和讨论。
关键词:半纤维素;分离;木质纤维生物质;溶剂体系
中图分类号:TS721
文献标识码:A
DOI:10.11980/j.issn.0254 508X.2019.06.011
Research Advance in Isolation of Lignocellulosic Biomass Hemicelluloses
YUE Panpan1 FU Genque1 HU Yajie1 LI Yanfei1 PENG Feng1,* SUN Runcang2
(1. College of Materials Science and Technology, Beijing Key Lab of lignocellulosic Chemistry, Beijing Forestry University, Beijing,
100083; 2. School of Light Industry and Chemical Engineering, Dalian Polytechnic University, Dalian, Liaoning Province, 116034)
(*E mail: fengpeng@bjfu.edu.cn)
Abstract:Selective isolation of hemicelluloses is critical in an integrated lignocellulosic biorefinery. The isolation of hemicelluloses used traditional and novel solvent systems are detailed reviewed, and the results of hemicelluloses isolation conducted by researchers at home and abroad are comprehensively expounded. Additionally, the advantages and disadvantages of these methods are compared and discussed.
Key words:hemicelluloses; isolation; lignocellulosic biomass; solvent system
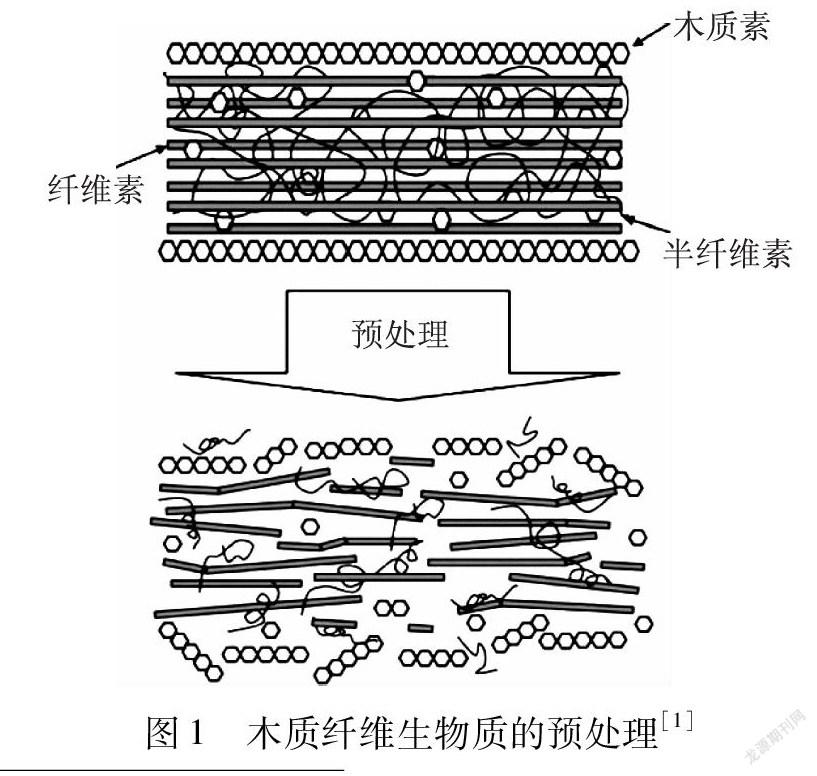
近年來,木质纤维生物质资源的充分开发和利用成为全球研究热点之一。木质纤维生物质资源是自然界中的巨大宝藏,使用有效地预处理方法破坏复杂的生物质结构,可以经济地生产一系列燃料和有价值的平台化合物。生物质细胞壁主要由纤维素、半纤维素和木质素组成,对这3种组分进行有效地分离、纯化以及高值化利用是当下备受关注的焦点(见图1)[1]。
半纤维素作为木质纤维生物质资源的重要组分之一,因其独特的结构和绿色环保等性质逐渐展现出重要的市场前景和应用价值。实现半纤维素高值化应用的前提是将其从植物细胞壁中进行高效分离。半纤维素是一种低相对分子质量、无定形,并且具有多官能团(包括乙酰基、甲基、葡萄糖醛酸、肉桂酸以及半乳糖醛酸)的杂多糖[2]。半纤维素与木质素之间存在共价键(主要是α 苄基醚键),且半纤维素与纤维素以非共价键(氢键)结合,这都在一定程度上限制了半纤维素的分离。本文综述了目前文献中用于从木质纤维生物质中分离半纤维素的几种方法,并比较了各种方法的优缺点。
1 传统预处理方法
1.1 碱溶液提取法
碱提取半纤维素主要是通过断裂木质素的醚键、皂化半纤维素和木质素间的酯键、减弱纤维素和半纤维素间的氢键作用、以及溶胀纤维素降低其结晶度,从而溶解出半纤维素。在碱处理的条件下,溶液的pH值可高达10,达到乙酰基分裂的条件,使得O 乙酰基容易裂解。目前已经建立了几种碱溶液从木质纤维原料中分离半纤维的方法。一种方法是用碱溶液从综纤维素中分离半纤维素,通过该方法分离的半纤维素呈浅棕色且含有较少的缔合木质素,可用于半纤维素的表征,也是制备商用半纤维素的方法之一[3]。另一种碱溶液提取方法是直接从脱蜡原料中提取半纤维素,通过调节碱提取液的pH值,浓缩,加入乙醇析出半纤维素,浓缩上清液,然后调节其pH值至2~3,析出木质素[4 5]。这是一种较为环保的半纤维素提取方法,但是所得半纤维素的纯度较低,与直接从综纤维素提取得到的半纤维素相比,含有较高的木质素。此外,笔者所在课题组一直关注基于逐步增加碱浓度连续碱提取半纤维素的方法。Peng等人[6]使用H2O,NaOH,以及60%碱性乙醇60℃下反应3 h,逐步从脱蜡竹子中提取得到的7种半纤维素组分,总得率达到80.1%。与一步碱提取方法相比,梯度碱浓度模式的多步连续碱提取法获得的半纤维素得率更高,且半纤维素组分结构多样。此外,碱种类(NaOH、KOH、LiOH、Ba(OH)2、Ca(OH)2和NH3·H2O等)、碱浓度、时间和温度都对半纤维素的提取率有显著的影响。其中,从半纤维素的得率来看,NaOH和KOH是较为优选的碱种[7]。并且,在相同浓度下,NaOH比KOH能够更有效地分离半纤维素,但KOH可以得到纯度较高的半纤维素[8]。另有研究表明[9],碱浓度对半纤维素提取率的影响要大于温度和时间的影响。
1.2 有机溶剂提取法
有机溶剂提取半纤维素的方法包括纯的有机溶剂体系以及与水、碱、酸等复合的有机溶剂体系两种。常用的有机溶剂包括:甲醇、乙醇、二甲基亚砜(DMSO)、丙酮和二氧六环。其中,DMSO是最常用的中性(非破坏性)溶剂,常用于从综纤维素中提取半纤维素。Ebringerova等人[10]研究发现,DMSO和DMSO/水混合液是低分支度聚木糖的有效提取溶剂,可在不断裂乙酰基和糖苷键的情况下提取半纤维素,这有助于半纤维素结构的研究,在一定程度上弥补了碱提取半纤维素导致的结构不完整性。此外,在生物质预处理过程中,向有机溶剂中添加酸性和碱性催化剂,可以提高半纤维素的提取效率[11]。Xu等人[12]比较了各种有机溶剂混合物预处理秸秆的差异性,发现提取半纤维素的最佳条件是使用甲酸、乙酸和水(体积比为30∶60∶10)的混合溶液。另有研究使用有机溶剂与碱溶液逐级处理禾本科原料,比较了不同级分半纤维素的提取率并对其进行结构表征[13 14]。有机溶剂提取半纤维素具有溶剂易回收、保持半纤维素结构完整性等优点。然而,一般有机溶剂都具有毒性、不易降解,且處理大量有机溶剂成本高,这都在一定程度上限制了其大规模的应用。
1.3 热处理法
自水解,也称为“水热预处理”,以水作为反应试剂,是一种成本低、工艺简单、环境友好且抽提物易于分离和纯化的预处理方法。在自水解过程中,水合氢离子可与阔叶木中聚木糖侧链上的乙酰基反应得到乙酸,乙酸作为催化剂可促进更多乙酰基团的脱除,使得更多半纤维素聚糖溶出[15]。自水解条件对木材中半纤维素的溶出影响很大。袁梅婷等人[16]研究发现,麦草自水解温度为130℃时,半纤维素脱除率仅为1.3%;而当温度为170℃时,半纤维素的脱除率显著提高,在保温60 min前的快速脱除和60 min后的慢速脱除两个阶段分别可达到65.0%和16.7%。Svrd等人[17]比较了使用自水解和碱提取的方法从油菜秸秆中提取出的半纤维素,发现二者具有相似的相对分子质量,但自水解预处理得到的半纤维素富含半乳葡甘露聚糖,而碱提取半纤维素主要是聚木糖。
蒸汽爆破预处理是热处理方法的一种,与其他预处理方法相比,用高压饱和蒸汽处理生物质原料,瞬间降低压力时产生的冲击力导致原料内部结构发生爆炸性分解,从而达到分离的效果。在蒸汽预处理期间会形成醋酸和其他有机酸性物质,其可催化半纤维素的进一步水解以及木质素的软化和部分降解。Teng等人[18]使用蒸汽爆破预处理和酶水解的方法研究玉米芯低聚木糖的生产,发现玉米芯的最佳蒸汽爆破条件为196℃下保持5 min,半纤维素的回收率达到22.8%。此外,影响蒸汽爆破分离效果的重要操作条件包括:保压时间、温度和原料的尺寸。蒸汽爆破的处理过程通常与其他方法结合使用。Wang等人[19 20]研究了蒸汽爆破与碱/水/乙醇溶液结合处理胡枝子,充分讨论了蒸汽爆破时间和压力对纤维素、半纤维素和木质素之间理化性质的影响。研究发现在较短的蒸汽爆破时间内,自水解主要发生在半纤维素和纤维素的无定形区域;反应时间的增加显著增强了半纤维素的溶解。蒸汽爆破是一种能耗低、环境友好、危险性较小的工艺化学过程。然而,蒸汽爆破也存在设备成本高、分离的半纤维素相对分子质量较低以及难以控制纤维素、半纤维素和木质素的降解等问题。
1.4 微波和超声波辅助法
目前为止,已经投入了大量的精力来开发环境友好的半纤维素提取过程,其中涉及通过非传统能源(如微波和超声波)的方式产生高能量的微环境。微波可以改变生物质原料的超分子结构,使得纤维素的结晶度和晶区尺寸增大[21]。微波辅助提取主要是通过电磁辐射加热原料,使得原料中的水分子在短时间内升温,从而对半纤维素进行萃取。彭缔等人[22]采用微波辅助的方法从玉米芯中提取半纤维素,研究了微波辅助条件下提取介质、稀碱稀酸浓度、处理时间以及提取温度等对半纤维素得率及平均相对分子质量的影响。微波辅助稀碱抽提半纤维素得率高于常规稀碱抽提得率;并且微波辐射可以促进热水或碱从木屑中提取聚木糖。Hou等人[23]使用微波和离子液体组合的新型预处理策略,有效地解构桉木粉中的木质素和半纤维素,破坏其结晶区域,并导致孔状和不规则的微观形态的形成,这将有利于酶水解以及高的糖得率的形成。微波辅助和离子液体组合预处理在生物质精炼中具有较高的应用潜力,这项工作为预处理技术提供了有益的技术参考。微波辅助提取具有快速、节能、环保等优势,但是半纤维素的得率相对较低且难以得到大规模的工业化应用。与传统的碱抽提法相比,微波辅助法缩短了提取时间,减少了聚阿拉伯糖 木糖的分解和乙酰基的损失。
超声波具有的机械效应、空化效应和热效应能够破碎木质纤维的细胞,增加溶剂渗透性,从而使得有效成分溶出。超声波预处理使得多糖糖苷键断裂,利用其进行原料的分离,可以显著改善多糖的提取。Li等人[24]开发了一种玉米芯和固体酸催化剂的混合球磨体系与超声波相结合的处理方法。此方法可以有效地破坏玉米芯的复杂结构,大多数半纤维素可以在随后的水热反应中从玉米芯细胞壁中释放出来。超声波辅助法已被证明在碱溶液提取过程中具有积极的作用,可以增强纤维素、半纤维素和木质素的分离以及提高半纤维素的得率,并且基本不会破坏半纤维素的分子结构[25 26]。超声辅助法反应时间短,所得半纤维素的分支度较小,酸性基团较少,且缔合木质素含量低,相对分子质量和热稳定性较高,与传统碱抽提法获得的半纤维素没有实质性差异。
2 新型溶剂体系分离方法
目前,绿色技术是化学和化学相关领域中的重要关注点之一,旨在保护环境和减少人类各种生产活动产生的负面影响。其中,将绿色溶剂用于生物质的提取/分离和转化是开发基于生物质的新的可持续发展的重要挑战。到目前为止,可用的绿色溶剂的数量有限,离子液体(IL)、γ 戊内酯(GVL)以及低共熔溶剂(DES)是最有希望的绿色溶剂类型。
2.1 离子液体
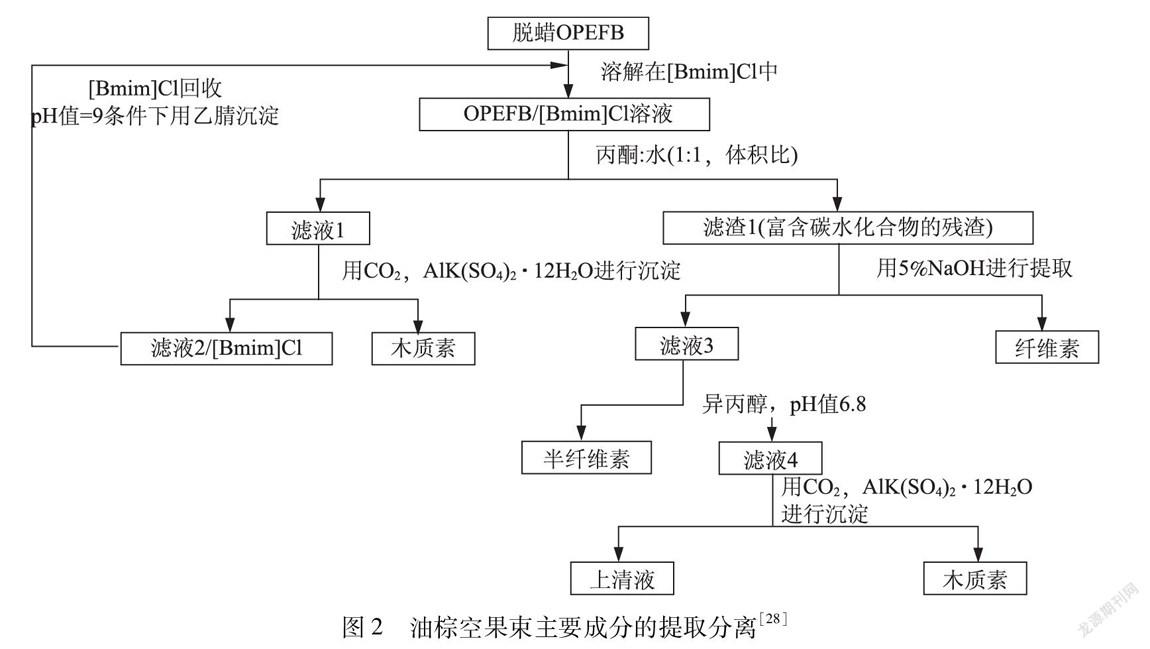
离子液体是一种具有低蒸汽压、不可燃性及热化学稳定性的独特绿色溶剂,而且对大多数的有机物和无机物具有较好的溶解性。离子液体的优异溶剂化特性可以减少纤维素的结晶度,除去木质素的位阻,增加原料的表面积,从而更有效地破坏纤维素 半纤维素 木质素的紧密连接结构。Miyafuji等人[27]提出了一种利用离子液体([C2mim]Cl)溶解日本山毛榉(Fagus crenata)的反应机理,在反应的初始阶段,离子液体渗入到木材内部主要溶解多糖,并且伴随少量木质素的溶解;在反应过程中,纤维素比半纤维素更早发生溶解,待所有的多糖从木材中洗脱出来后,木质素的溶解速率才开始增加。该项研究机理的揭示为今后木质纤维素生物质的溶解和分离提供了研究基础。Mohtar等人 [28 29]利用离子液体([Bmim]Cl)和碱处理油棕空果束原料,分离得到的半纤维素得率为(27.17±1.68)%(见图2)。通过上述所提出的分离技术不能获得完全无定形的半纤维素部分。此外,离子液体可以重复使用,但其效率在随后的实验周期中会有所降低。当利用离子液体处理植物纤维原料时,离子液体中的阴阳离子具有重要的作用,能够通过离子液体阴阳离子的种类及性质判断其对聚木糖的溶解性能。Raj等人[30]探索了5种离子液体用于生产可发酵糖的生物质预处理过程,结果发现利用[C4mim][OAc]和[C2mim][OAc]预处理秸秆,可以有效分离聚木糖。离子液体阴离子在半纤维素分离方面起关键作用,多糖的羟基与离子液体阴离子之间的氢键相互作用可以在一定程度上破坏纤维素和半纤维的分子内/分子间的氢键,从而完成聚木糖的分离。另有研究发现在聚木糖/离子液体溶液中,离子液体的阳离子与聚木糖的作用远大于其阴离子与聚木糖的作用,并且阳离子的咪唑环及侧链均与聚木糖相互作用[31]。离子液体阴阳离子与半纤维素相互作用机理的复杂性难以用一种或者多种测试方法一次性观察清楚。
离子液体具有一定优势,但也存在许多弊端,如缺乏离子液体的毒性研究、样品回收困难、部分离子液体的可生物降解性较差、成本高及容易造成环境污染等。此外,生物质组分间的复杂聚合物网络结构的存在,使得离子液体分离的效率有限,分离的各组分仍有部分杂质,不利于所得组分进一步应用。因此,进一步开发新型的生物相容性好、可降解的离子液体对保护环境具有重要的意义。
2.2 γ 戊内酯(GVL)
目前,关于生物质来源化合物的应用受到人们广泛的关注。γ 戊内酯(GVL)可以通过C6和C5糖得到的乙酰丙酸(LA)中间体合成,是一种很有发展前景的可再生平台化合物。GVL在水和空气中能够稳定存在,是一种无毒、可生物降解以及性能优异的绿色有机溶剂,并且是极性非质子型溶剂的理想代替品。因此,GVL为生物质衍生物替代石油衍生化学品和燃料提供了新机会。GVL可以和水以任意比例互溶,并且不会形成共沸物。目前,有很多研究集中在利用不同比例的GVL/H2O体系对生物质原料进行预处理。Shuai等人[32]利用80%GVL和20% H2O的溶剂体系在温度120℃下以75 mmol/L H2SO4的酸负载量预处理阔叶木(固液比1∶5)。结果发现聚木糖成功从木材中分离,且预处理后可回收高达96%的原始聚木糖;与乙醇、四氢呋喃(THF)以及稀碱等溶剂相比,使用GVL作为溶剂可以更好地将聚木糖从阔叶木中分离。此外,这种分离方法也可以应用于针叶木、农业残留物以及能源作物等原料。Wu等人[33]使用与酶促水解相结合的GVL/H2O体系进行温和酸水解处理,结果发现在不同的GVL/H2O比例中,C5糖的得率通常要高于C6糖的得率,表明半纖维素在GVL/H2O体系中比纤维素更容易溶解。还发现在含有80% GVL和20%H2O的体系下,半纤维素水解形成的低聚物转化成为单体(木糖)的情况更为显著,这可以归因于GVL和水的协同作用。Alonso等人[34]报道了一种整体转化木质纤维生物质的半纤维素和纤维素的方法,该方法中GVL既是溶剂又是一种反应产物,这一过程不仅可以利用半纤维素和纤维素同时生产燃料和化学品,还可以从消除预处理和萃取/分离步骤中获益。
2.3 低共熔溶剂(Deep eutectic solvents, DES)
2003年,Abbott课题组[35]首次发现尿素和氯化胆碱可以组成熔点低于室温的溶剂,并将其命名为低共熔溶剂(DES)。DES至少由一个氢键受体(HBA)和氢键供体(HBD)组成,当它们混合时,可以形成强烈的氢键相互作用并且熔点较低。DES与离子液体具有相似的物理化学性质(低挥发性、低熔点、低蒸汽压、不可燃性、热稳定性、高溶解度和可调节性等),因此又被称为离子液体类似物或替代物。此外,DES还可以克服离子液体的制备复杂性、成本高和生物降解性差等限制性缺点,它们作为绿色溶剂的潜力引起了人们的极大关注[36]。DES的独特性质及其简单的制备方法使其成为各种应用的理想介质,可以用来分离木质纤维生物质的主要组分(木质素和多糖)。氢键在DES的形成以及多糖的溶解性和加工性能中必不可少,因此DES能够有效地破坏多糖分子间氢键,促进它们的有效溶解/加工。纯的DES通常具有较高的黏度,阻碍了它的应用,但是DES水溶液可比纯DES更好地发挥作用[37]。Morais等人[38]研究了阔叶木中的半纤维素(即聚木糖)在DES水溶液中的溶解性,聚木糖溶解度的测试结果表明,用50%氯化胆碱(ChCl)/尿素(U)(1∶2)获得的最高聚木糖溶解度高于83.3%乙酸胆碱水溶液中的聚木糖溶解度。最重要的是,聚木糖在50% ChCl/U(1∶2)中的溶解度与在常规介质碱水溶液中的溶解度相似,这进一步凸显了DES分离聚木糖的潜力。此外,将苯 醇抽提后的木屑置于ChCl/U(1∶2)、NaOH及水中处理,当固液比为1∶25时,ChCl/U(1∶2)处理原料获得的聚木糖得率优于NaOH和水。此外,在DES的溶解/回收过程中,聚木糖的回收率较高并且几乎保留了聚木糖结构的完整性。尽管仍需要进一步的工艺优化和改进,但DES水溶液的温度和pH值都比目前所使用的碱溶液要温和,有希望用于聚木糖提取工艺的可替代溶剂。利用DES去除半纤维素时,其去除程度取决于DES种类和所需要的物理化学条件。Kumar等人[39]利用DES预处理稻草,在低pH值(pH值<2.0)、温度60℃条件下持续反应12 h,并未观察到半纤维素的水解;然而,在温度为120℃时,用强酸性DES(氯化胆碱/草酸)在4 h内水解了大部分的半纤维素[40]。此外,使用两个阶段的DES组合预处理被证明是提高某些DES利用率的有效方法,通过仔细选择DES种类和预处理两个阶段的前后顺序,从而实现半纤维素的高效分离[40]。
3 结 语
综合以上几种半纤维素分离方法的讨论发现,传统分离方法和新型溶剂体系分离方法都有各自的优缺点。微波、超声波、热处理以及新型溶剂体系分离方法可以改善碱溶液和有机溶剂分离方法的污染环境等问题,但在一定程度上限制了其大规模工业化生产。随着半纤维素分离方法的不断改进,一方面解决了某些分离方法的弊端,但也伴随着其他问题的出现。因此,利用各种分离方法优势相结合的形式进行半纤维素的分离,以实现最优的分离效果。综上,在未来半纤维分离方法的研究中应注重解决以下3个问题:①以低成本及低能耗获得半纤维素高得率;②提高半纤维素纯度及结构完整性;③实现绿色环保及大规模工业化生产的分离过程。
参 考 文 献
[1] Mood S H, Golfeshan A H, Tabatabaei M, et al. Lignocellulosic biomass to bioethanol, a comprehensive review with a focus on pretreatment[J]. Renewable and Sustainable Energy Reviews, 2013, 27: 77.
[2] Brandt A, Grsvik J, Hallett J P, et al. Deconstruction of lignocellulosic biomass with ionic liquids[J]. Green Chemistry, 2013, 15(3): 550.
[3] Peng F, Peng P, Xu F, et al. Fractional purification and bioconversion of hemicelluloses[J]. Biotechnology Advances, 2012, 30: 879.
[4] Sun R C, Sun X F. Fractional and structural characterization of hemicelluloses isolated by alkali and alkaline peroxide from barley straw[J]. Carbohydrate Polymers, 2002, 49: 415.
[5] Ruzene D S, Silva D P, Vicente A A, et al. An alternative application to the Portuguese agro industrial residue: wheat straw[J]. App lied Biochemistry Biotechnology, 2008, 147: 85.
[6] Peng P, Peng F, Bian J, et al. Isolation and structural characterization of hemicelluloses from the bamboo species Phyllostachys incarnata Wen[J]. Carbohydrate Polymers, 2011, 86(2): 883.
[7] Lawther J M, Sun R C, Banks W B. Effects of extraction conditions and alkali type on yield and composition of wheat straw hemicellulose[J]. Journal of Applied Polymer Science, 1996, 60: 1827.
[8] Xu F, Sun J X, Geng Z C, et al. Comparative study of water soluble and alkali soluble hemicelluloses from perennial ryegrass leaves(Lolium peree)[J]. Carbohydrate Polymers, 2007, 67: 56.
[9] Chen Q Q, Jiang H, Zhang Y, et al. Optimization of extraction and characterization of hemicelluloses from hybrid poplar residues[J]. Biomass Chemical Engineering, 2013, 47(3): 39.
陳清清, 江 华, 张 洋, 等. 速生杨半纤维素碱法提取工艺的优化和表征[J]. 生物质化学工程, 2013, 47(3): 39.
[10] Ebringerova A, Heinze T. Xylan and xylan derivatives biopolymers with valuable properties, 1 Naturally occurring xylans structures, isolation procedures and properties[J]. Macromolecular Rapid Communications, 2000, 21: 542.
[11] Geng Z C, Sun R C, Sun X F, et al. Comparative study of hemicelluloses released during two stage treatments with acidic organosolv and alkaline peroxide from Caligonum monogoliacum and Tamarix spp[J]. Polymer Degradation and Stability, 2003, 80: 315.
[12] Xu F, Liu C F, Geng Z C, et al. Characterisation of degraded organosolv hemicelluloses from wheat straw[J]. Polymer Degradation and Stability, 2006, 91: 1880.
[13] LI R, YANG G H, LV G J, et al. Separation and characterization of hemicelluloses of corn stalks[J]. Transactions of China Pulp and Paper, 2017, 32(3): 1.
李 蕊, 杨桂花, 吕高金, 等. 玉米秸秆半纤维素的逐级分离及其结构表征[J]. 中国造纸学报, 2017, 32(3): 1.
[14] Yue P P, Fu G Q, Hu Y J, et al. Changes of chemical composition and hemicelluloses structure in differently aged bamboo(Neosinocalamus affinis) culms[J]. Journal of Agricultural and Food Chemistry, 2018, 66: 9199.
[15] Li Y, Liu W, Hou Q X, et al. Release of acetic acid and its effect on the dissolution of carbohydrates in the autohydrolysis pretreatment of poplar prior to chemi thermomechanical pulping[J]. Industrial & Engineering Chemistry Research, 2014, 53: 8366.
[16] Yuan M T, Zhai H M, Feng N J, et al. Characterization of Hemicelluloses and Lignin Change of Wheat Straw in Autohydrolysis Process[J]. Journal of Cellulose Science and Technology, 2015, 23(2): 55.
袁梅婷, 翟華敏, 冯年捷, 等. 麦草自水解过程中半纤维素和木质素的变化特性[J]. 纤维素科学与技术, 2015, 23(2): 55.
[17] Svrd A, Brnnvall E, Edlund U. Rapeseed straw as a renewable source of hemicelluloses: Extraction, characterization and film formation[J]. Carbohydrate Polymers, 2015, 133: 179.
[18] Teng C, Yan Q J, Jiang Z Q, et al. Production of xylooligosaccharides from the steam explosion liquor of corncobs coupled with enzymatic hydrolysis using a thermostable xylanase[J]. Bioresource Technology, 2010, 101, 7679.
[19] Wang K, Jiang J X, Xu F, et al. Influence of steaming explosion time on the physicchemical properties of cellulose from Lespedeza stalks(Lespedeza crytobotrya)[J]. Bioresource Technology, 2009, 100: 5288.
[20] Wang K, Xu F, Sun R C, et al. Influence of incubation time on the physicochemical properties of the isolated hemicelluloses from steam exploded Lespedeza stalks[J]. Industrial & Engineering Chemistry Research, 2010, 49: 8797.
[21] Xiong J, Ye J, Liang W Z, et al. Influence of Microwave on the Ultrastructure of Cellulose I[J]. Journal of South China University of Technology(Natural Science Edition), 2000, 28(3): 84.
熊 键, 叶 君, 梁文正, 等. 微波对纤维素I超分子结构的影响[J]. 华南理工大学学报(自然科学版), 2000, 28(3): 84.
[22] Peng D, Zhou X S. Extraction of hemicellulose by acid or alkali with the assistance of microwave irradiation[J]. Paper Science & Technology, 2013, 32(6): 45.
彭 缔, 周雪松. 微波辅助下酸碱抽提半纤维素的研究[J]. 造纸科学与技术, 2013, 32(6): 45.
[23] Hou X F, Wang Z N, Sun J, et al. A microwave assisted aqueous ionic liquid pretreatment to enhance enzymatic hydrolysis of Eucalyptus and its mechanism[J]. Bioresource Technology, 2019, 272: 99.
[24] Li H L, Wang X H, Liu C Y, et al. An efficient pretreatment for the selectively hydrothermal conversion of corncob into furfural: The combined mixed ball milling and ultrasonic pretreatments[J]. Industrial Crops and Products, 2016, 94: 721.
[25] Sun R C, Tomkinson J. Characterization of hemicelluloses obtained by classical and ultrasonically assisted extractions from wheat straw[J]. Carbohydrate Polymers, 2002, 50(3): 263.
[26] MA Z Y, LV Y N. Study on Alkaline Extraction of Hemicelluloses from Bagasse Pith with Ultrasound Assisted[J]. China Pulp & Paper, 2018, 37(1): 19.
马志宇, 吕艳娜. 超声波辅助稀碱法提取蔗髓半纤维素的工艺探究[J]. 中国造纸, 2018, 37(1): 19.
[27] Miyafuji H, Miyata K, Saka S, et al. Reaction behavior of wood in an ionic liquid, 1 ethyl 3 methylimidazolium chloride[J]. Journal of Wood Science, 2009, 55(3): 215.
[28] Mohtar S S, Busu T N Z T M, Md Noor A M, et al. An ionic liquid treatment and fractionation of cellulose, hemicellulose and lignin from oil palm empty fruit bunch[J]. Carbohydrate Polymers, 2017, 166: 291.
[29] Mohtar S S, Tengku Malim Busu T N Z, Md Noor A M, et al. Extraction and characterization of lignin from oil palm biomass via ionic liquid dissolution and non toxic aluminium potassium sulfate dodecylhydrate precipitation processes[J]. Bioresource Technology, 2015, 192: 212.
[30] Raj T, Gaur R, Dixit P, et al. Ionic liquid pretreatment of biomass for sugars production: Driving factors with a plausible mechanism for higher enzymatic digestibility[J]. Carbohydrate Polymers, 2016, 149: 369.
[31] Lv B L. The studies on the solubility and dissolution mechanism of cellulose and xylan in ionic liquids[D]. Lanzhou: Lanzhou University, 2016.
呂本莲. 离子液体对纤维素和聚木糖的溶解性能及溶解机理研究[D]. 兰州: 兰州大学, 2016.
[32] Shuai L, Questell Santiago Y M, Luterbacher J S. A mild biomass pretreatment using γ valerolactone for concentrated sugar production[J]. Green Chemistry, 2016, 18: 937.
[33] Wu M, Yan Z Y, Zhang X M, et al. Integration of mild acid hydrolysis in γ valerolactone/water system for enhancement of enzymatic saccharification from cotton stalk[J]. Bioresource Technology, 2016, 200: 23.
[34] Alonso D M, Wettstein S G, Mellmer M A, et al. Integrated conversion of hemicellulose and cellulose from lignocellulosic biomass[J]. Energy & Environmental Science, 2013, 6: 76.
[35] Abbott A P, Capper G, Davies D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications, 2003, 1: 70.
[36] Satlewal A, Agrawal R, Bhagia Samarthya, et al. Natural deep eutectic solvents for lignocellulosic biomass pretreatment: Recent developments, challenges and novel opportunities[J]. Biotechnology Advances, 2018, 36: 2032.
[37] Soares B, Tavares D J P, Amaral J L, et al. Enhanced solubility of lignin monomeric model compounds and technical lignins in aqueous solutions of deep eutectic solvents[J]. ACS Sustainable Chemistry Engineering, 2017, 5: 4056.
[38] Morais E S, Mendonca P V, Coelho J F J, et al. Deep eutectic solvent aqueous solutions as efficient media for the solubilization of hardwood xylans[J]. Chem. Sus. Chem., 2018, 11: 753.
[39] Kumar A K, Pravakar M. Natural deep eutectic solvent mediated pretreatment of rice straw: bioanalytical characterization of lignin extract and enzymatic hydrolysis of pretreated biomass residue[J]. Environmental Science and Pollution Research, 2016, 23(10): 9265.
[40] Hou X D, Feng G J, Ye M, et al. Significantly enhanced enzymatic hydrolysis of rice straw via a high performance two stage deep eutectic solvents synergistic pretreatment[J]. Bioresource Technology, 2017, 238: 139.CPP
