好氧反硝化细菌LKX—1的分离、鉴定及初步应用研究
2016-12-17刘立立兰时乐杨友才
刘立立+兰时乐+杨友才
摘要:为筛选分离好氧反硝化细菌菌株用于农村生活污水处理,从水稻田中分离高效好氧反硝化细菌菌株,并进行鉴定及除氮效果分析。结果表明,通过菌体、菌落形态特征和生理生化指标并结合16S rDNA序列分析将该菌株鉴定为蒙氏假单胞菌(Pseudomonas monteilii);农村生活污水除氮条件初步研究结果表明,在葡萄糖添加量0.03%、接种量0.00015%、摇床转速120 r/min和发酵处理时间48 h条件下,总氮和亚硝酸盐氮去除率分别达到91.55%和96.33%。
关键词:好氧反硝化细菌;分离;农村生活污水;除氮率
中图分类号:S154.3 文献标识号:A 文章编号:1001-4942(2016)11-0076-05
Abstract A high efficient aerobic denitrifier was isolated from rice field to dispose the rural domestic sewage, then the strain was identified and its nitrogen removal effect was analyzed. The results showed that the strain was identified as Pseudomonas monteilii through analyzing the cell morphology, colony morphology, physiological and biochemical characteristics combined with 16S rDNA sequence. The preliminary study on nitrogen removal conditions of rural domestic sewage showed that with the glucose additive amount of 0.03%, inoculation amount of 0.00015%, rotation speed of 120 r/min and cultural time of 48 hours, the removal rate of TN and NO-2-N reached 91.55% and 96.33% respectively.
Keywords Aerobic denitrifier; Isolation; Rural domestic sewage; Nitrogen removal rate
随着我国农村生活水平的大幅度提高,农村生活污水中的COD、TN含量增加。据统计,我国农村生活污水每年的排放量为80~90亿吨[1]。由于农村生活污水具有面广分散、成分不稳定、排放不均匀、几乎不含有毒有害有机污染物、水量系数变化大等特点,加上我国大部分农村没有污水排放管网和污水处理系统,这些生活污水未经任何处理就直接排放到自然环境中,使得农村河道、地下水水体污染越来越严重,对生态环境造成了极大破坏。我国农村生活污水处理技术的研究起步较国外晚,目前国内较为成熟的处理技术主要有稳定塘处理技术[2]、人工湿地处理系统[3]、土地处理技术[4]和生物膜技术[5,6]等。尽管这些污水处理技术在实际应用中取得了一定效果,但也存在投资和处理成本较高、工艺复杂、占地面积大以及处理效果不稳定等缺点。因此,研究一种适合农村生活污水处理的技术,对解决农村污染问题具有迫切的现实意义。目前利用好氧反硝化菌来处理污水中氮素正得到广泛关注和研究。本研究试图通过筛选具有反硝化作用的目标菌,开展对农村生活污水的除氮研究,以期为好氧反硝化细菌在农村生活污水处理中的应用提供理论支持与实践指导。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 本试验反硝化菌株筛选所用土壤来自湖南农业大学周边水稻田,当天采集当天分离。
农村生活污水:取自长沙市某小区生活污水。
1.1.2 培养基 反硝化细菌富集、分离培养基:参照文献[7]配制。
斜面培养基:牛肉膏蛋白胨培养基。
液体种子培养基:葡萄糖3%,蛋白胨1%,牛肉膏0.5%,NH4NO3 0.5%,KH2PO4 0.2%,MgSO4·7H2O 0.1%,pH 7.0~7.5。
反硝化性能测定培养基(g/L):参照文献[7]配制。
发酵基础培养基:葡萄糖2%,蛋白胨1%,KH2PO4 0.2%,MgSO4·7H2O 0.1%,pH 7.0~7.5。
以上培养基均在121℃灭菌25 min。
1.1.3 主要试剂与设备 Na2HPO4·7H2O、KH2PO4 、NH4Cl、MgSO4·7H2O、HCl、KNO3、丁二酸钠、葡萄糖( 以上均为AR,国药集团),NaNO2 (AR,上海山浦化工有限公司)。
高压湿热灭菌锅(SS-325,TOMY.KOGYO.CO.LTD)、电热恒温干燥箱、单人单面超净工作台、可见光分光光度计(752型,上海光谱仪器有限公司)、恒温摇床、恒温培养箱。
1.2 试验方法
1.2.1 反硝化细菌的富集和初筛 称取1 g水稻田土壤接种到装有100 mL反硝化细菌富集培养基的250 mL三角瓶中,30℃、180 r/min条件下富集48 h。然后按10倍稀释法将富集液适当稀释,分别取不同浓度的稀释液0.1 mL接种到反硝化细菌分离固体培养基平板中央并涂布均匀,置于30℃恒温培养箱中培养至长出单菌落。挑取菌落形态特征不同的单菌落于分离培养基平板上划线纯化后进行斜面保存并编号。
1.2.2 反硝化细菌的复筛 将初筛菌株的斜面菌种接种于液体种子培养基中,30℃、180 r/min恒温振荡培养24 h。然后将液体种子分别按2%(V/V)接种量接种在装有100 mL灭菌反硝化性能测定培养基的250 mL锥形瓶中,30℃、180 r/min摇床恒温振荡培养48 h,按照文献[8]测定发酵前后培养液中NO-2-N和总氮含量,计算亚硝酸盐氮和总氮的去除率。
去除率(%)=(处理前污水含氮量-处理后污水含氮量)/处理前污水含氮量×100
1.2.3 筛选菌株的鉴定 ①形态及生理生化试验。将待测反硝化细菌接种于牛肉膏蛋白胨培养基平板上活化2~3代,根据《伯杰氏细菌鉴定手册》[8]进行形态学和生理生化特征鉴定。
②菌株16S rDNA序列分析。用Ezup柱式细菌基因组DNA抽提试剂盒提取待分析反硝化细菌的16S rDNA,用引物27F(5′-AGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增产物经纯化回收后,送上海生物工程技术服务有限公司进行测序,测序结果通过http://www.ncbi.nih.nlm.gov网站用BLAST与GenBank数据库中已有细菌的16S rDNA序列进行序列同源性比对,用MEGA 6.06的Neighbor-Joining法构建系统发育树,并进行1 000次Bootstraps检验。
1.2.4 筛选菌株对农村生活污水的除氮效果 ①葡萄糖添加量对除氮效果的影响。在250 mL三角瓶中加入150 mL农村生活污水,分别加入0、0.01%、0.02%、0.03%、0.04%和0.05%的葡萄糖,接种量为0.0002%(V/V),30℃、100 r/min恒温振荡培养箱中培养48 h,测定总氮和亚硝酸盐氮含量,并计算总氮和亚硝酸盐氮的去除率。每处理重复3次。
②接种量对除氮效果的影响。在农村生活污水中分别加入接种量为0.00005%、0.00010%、0.00015%、0.00020%和0.00025%(V/V)的液体种子,葡萄糖添加量按已优化值,其它条件不变,测定总氮和亚硝酸盐氮含量,并计算总氮和亚硝酸盐氮的去除率。
③摇床转速对除氮效果的影响。将装有农村生活污水的三角瓶分别置于60、80、100、120 r/min和140 r/min的恒温振荡培养箱中,葡萄糖添加量、接种量按已优化值,其它条件不变,测定总氮和亚硝酸盐氮含量,并计算总氮和亚硝酸盐氮的去除率。
④处理时间对除氮效果的影响。按前述优化条件处理,在处理24 h开始第一次取样,以后每隔12 h取样一次,直至培养72 h,测定总氮和亚硝酸盐氮含量,并计算总氮和亚硝酸盐氮的去除率。
2 结果与分析
2.1 好氧反硝化细菌菌株初筛结果
经富集分离,从水稻田土壤中分离到28株菌落形态特征差异明显且具有反硝化能力的细菌,进一步纯化后,保存于牛肉膏蛋白胨固体培养基斜面上,并分别编号LKX-1~LKX-28。
2.2 好氧反硝化细菌菌株除氮效果复筛结果
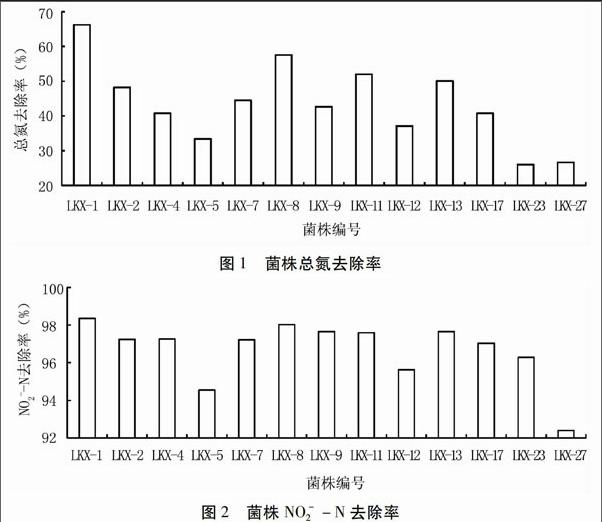
从筛选得到的28株菌株中选择生长速度快的13株细菌进行除氮效果复筛,其总氮和亚硝酸盐氮的去除率分别见图1、图2。可见,不同菌株对总氮和亚硝酸盐氮去除的效果不同,其中菌株LKX-1对总氮和亚硝酸盐氮去除率最高,分别达到66.22%和98.36%。因此选择LKX-1进行后续试验。
2.3 菌株LKX-1的鉴定结果
2.3.1 菌株形态及部分生理生化特征 菌株LKX-1的菌落形态特征为:乳白色,圆形,凸起,菌落表面湿润粘稠,不透明,菌落大小为0.1~0.3 mm;菌体形态特征为:短杆状,不产芽孢,具运动性,革兰氏染色阴性;生理生化特征为:V-P、吲哚和氧化酶接触试验阴性,淀粉水解阴性,明胶液化阳性,乳糖和蔗糖发酵不产酸不产气,葡萄糖发酵产酸不产气。根据菌株形态特征和部分生理生化的结果,初步鉴定菌株LKX-1为假单胞菌属。
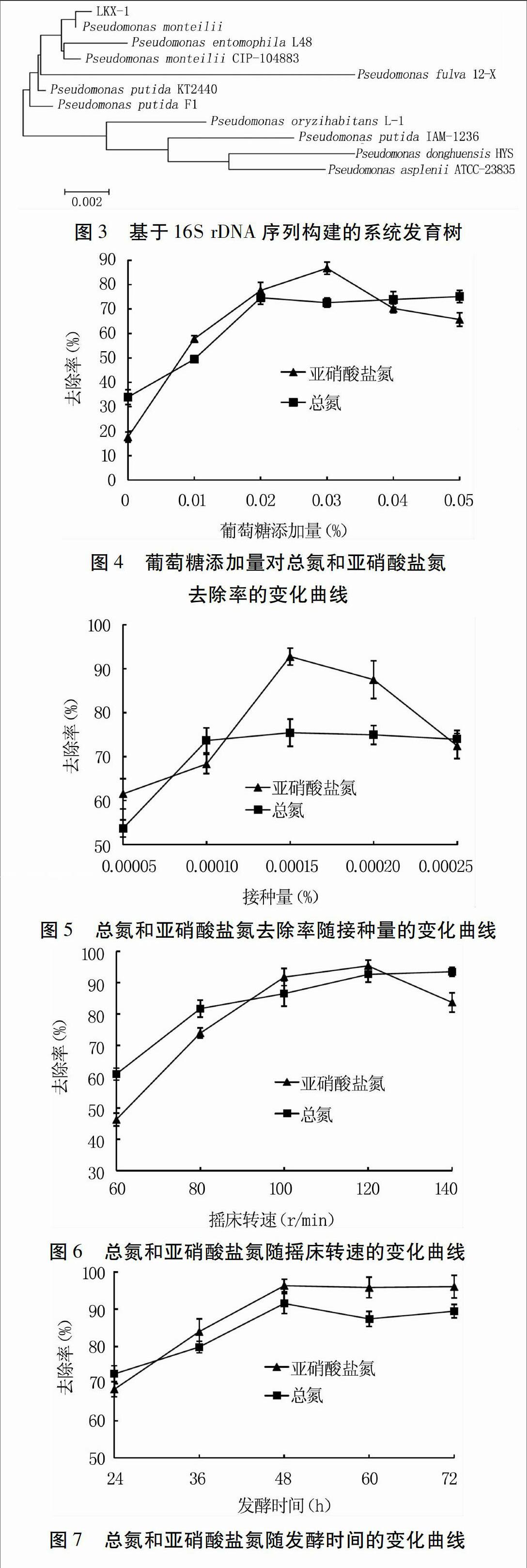
2.3.2 菌株LKX-1的16S rDNA序列分析 序列同源性比对结果显示,菌株LKX-1与Pseudomonas monteilii亲缘关系最近,同源性最高,达99%。结合菌株的形态特征、生理生化特征、16S rDNA测序结果的同源性相似度比对及系统发育树分析,确定该菌株为蒙氏假单胞菌(Pseudomonas monteilii)(图3)。
2.4 菌株LKX-1对农村生活污水的除氮效果
2.4.1 葡萄糖添加量对除氮效果的影响 由图4可以看出,不同葡萄糖添加量对总氮和亚硝酸盐氮的去除率影响较大。在一定范围内,总氮和亚硝酸盐氮的去除率随葡萄糖添加量的增加而提高。当葡萄糖添加量为0.03%时,亚硝酸盐氮去除率最高,达86.74%;而总氮去除率在葡萄糖添加量为0.02%时最大,且葡萄糖添加量超过0.02%,总氮去除率差异不显著。综合考虑对总氮和亚硝酸盐氮的去除效果,选择葡萄糖添加量为0.03%。
2.4.2 接种量对除氮效果的影响 由图5可见,总氮和亚硝酸盐氮去除率随接种量增加变化趋势不同。亚硝酸盐氮去除率随接种量的增加先上升后下降,当接种量为0.00015%时,去除率最大,达92.73%;而总氮去除率在接种量为0.00010%时迅速增加,后趋于稳定。因此选择菌种接种量为0.00015%(V/V)。
2.4.3 摇床转速对除氮效果的影响 氧气浓度也是影响微生物生长和代谢的主要因素之一。对于好氧菌来说,氧气浓度高,有利于微生物的生长和代谢。图6结果显示,在一定范围内,随摇床转速增加,总氮和亚硝酸盐氮去除率也随之增加。当摇床转速为120 r/min时,亚硝酸盐氮去除率最高,达95.42%,摇床转速超过120 r/min,亚硝酸盐氮去除率下降;而总氮去除率一直随摇床转速的增加而增加,但摇床转速在120~140 r/min之间,总氮去除率变化不显著。因此,摇床转速选择120 r/min。
2.4.4 处理时间对除氮效果的影响 由图7可以看出,总氮和亚硝酸盐氮的去除率随着发酵时间的延长而增加,当发酵时间为48 h时,总氮和亚硝酸盐氮的去除率均达最高,分别为91.55%和96.33%;发酵处理时间超过48 h,亚硝酸盐氮去除率略有下降,但差异不显著,总氮去除率先下降后略有上升。
3 讨论与结论
农村生活污水相对于城市生活污水而言,具有分散性和排放不集中等特点,难以采用城市生活污水的处理模式。好氧反硝化细菌包括泛养副球菌(Paracoccus pantotropha)、假单胞菌属(Pseudomonas spp.)的某一种、粪产碱菌(Alcaligenes faecalis)、Aquaspirillum、Thauera、生丝微菌属(Hyphomicrobium)[9-11]等。蔡亚君等[12]分离到一株具有好氧反硝化特性的铜绿假单胞菌NO62,该菌在对数生长期硝态氮迅速被还原成亚硝态氮,继续培养则亚硝态氮浓度也逐渐降低;吴美仙等[13]分离到一株具有较强反硝化作用能力的菌株(D),并对其发酵条件进行了研究;杨浩锋等[14]从处理城镇污水的移动床生物膜反应器中分离获得一株反硝化细菌D3,研究表明其反硝化速率最大为19.86 mg/(L·h)。
本研究从水稻田土壤中分离到一株具有反硝化作用的细菌,通过形态特征、生理生化特征并结合16S rDNA序列分析,确定该菌株为蒙氏假单胞菌(Pseudomonas monteilii)。初步探讨了好氧条件下该菌株对农村生活污水除氮效果,表明在葡萄糖添加量0.03%、接种量0.00015%、摇床转速120 r/min和发酵处理时间为48 h时,污水中的总氮和亚硝酸盐氮的去除率分别达到91.55%和96.33%,具有良好的应用前景。
参 考 文 献:
[1] 卢璟莉,肖运来.我国农村生活污水处理及利用分析[J].湖北农业科学,2009,48(9):2289-2291.
[2] Wang H,Appan A,Gulliver J S.Modeling of phosphorus dynamics in aquatic sediments: I-model development[J].Water Research,2003,37(16):3928-3938.
[3] 梁继东,周启星,孙铁晰.人工湿地污水处理系统研究及性能改进分析[J].生态学杂志,2003, 22(2): 49-55.
[4] 贾宏宇,孙铁晰,李培军,等.污水土地处理技术研究的最新进展[J].环境污染治理技术与设备,2001,2(1):62-65.
[5] 李玉华,吴迪,钱姗,等.一体化生物膜工艺处理滨海农村污水脱氮特性研究[J].环境工程,2013,31(5):1-4.
[6] 余晓敏.一体化生物膜技术处理农村生活污水试验分析[J].科技与创新,2015(15):87-88.
[7] 张凯,雷梦婕,胡国元,等.好氧反硝化菌WIT-1的分离鉴定及其脱氨氮特性研究[J].武汉工程大学学报,2011,33(11):14-16.
[8] 国家环保局《水和废水监测分析方法》编委会编.水和废水监测分析方法[M].北京:中国环境科学出版社,2002:211-281.
[9] 项慕飞.好氧反硝化菌的分离筛选和鉴别研究[D].北京:北京工商大学,2007.
[10]Thomsen T R,Kong Y,Nielsen P H. Ecophysiology of abundant denitrifying bacteria in activated sludge[J]. FEMS Microbiology Ecology,2007,60(3):370-382.
[11]Rehfuss M,Urban J. Alcaligenes faecalis subsp. phenolicus subsp. nov. a phenol-degrading, denitrifying bacterium isolated from a graywater bioprocessor[J]. Systematic and Applied Microbiology,2005,28(5):421-429.
[12]蔡亚君,桂震,李锋,等.好氧反硝化菌Pseudomonas aeruginosa NO62筛选分离与性质鉴定[J]. 长江大学学报(自然科学版),2011,8(1):240-243.
[13]吴美仙,张萍华,李莉,等.好氧反硝化细菌的筛选及培养条件的初步研究[J]. 浙江海洋学院学报(自然科学版),2008,27(4):406-409.
[14]杨浩锋,唐佳玛,胡安辉,等.一株反硝化细菌的分离鉴定及其反硝化特性[J].环境工程学报,2014,8(1):366-370.
