微波辅助酸处理桉木预水解液纯化制备低聚木糖
2019-09-10董吉冉杨桂花吉兴香徐丰陈嘉川
董吉冉 杨桂花 吉兴香 徐丰 陈嘉川





摘 要:为利用桉木预水解液制备低聚木糖,对经过Ca(OH)2和活性炭处理的二级处理预水解液进行微波辅助酸处理,探讨了处理过程中酸类型、酸用量、处理温度和处理时间对预水解液中木糖及聚合度为2~4低聚木糖(低聚木糖DP2~4)含量的影响,并对处理后预水解液中的低聚木糖进行了分析与表征。结果表明,微波辅助酸处理二级处理预水解液较优工艺条件为:硫酸用量1.4%、处理温度120℃、处理时间 20 min,在此条件下,经过微波辅助酸处理所制备的三级处理预水解液中低聚木糖DP2~4含量为9.25 g/L,与未经微波辅助酸处理二级处理预水解液相比,其低聚木糖DP2~4含量提高了38.1%,预水解液中低聚木糖DP2~4组分得到了进一步纯化。傅里叶变换红外光谱(FT IR)和热重分析(TGA)结果表明,微波辅助酸处理桉木预水解液纯化制备的低聚木糖含有部分阿拉伯糖及糖醛酸侧链,且该低聚木糖具有较高的热稳定性。
关键词:桉木;预水解液;低聚木糖;微波;酸水解
中图分类号:TS79
文献标识码:A
DOI:10.11980/j.issn.0254 508X.2019.06.002
Improvement of Xylo oligosaccharides Content of Eucalyptus Pre hydrolysis
Liquor with Microwave assisted Acid Treatment
DONG Jiran YANG Guihua* JI Xingxiang XU Feng CHEN Jiachuan*
(State Key Lab of Bio based Materials and Green Papermaking/Key Lab of Pulp & Paper Science and Technology of Education
Ministry of China,
Qilu University of Technology (Shandong Academy of Sciences), Jinan, Shandong Province, 250353)
(*E mail: ygh@qlu.edu.cn;chenjc@qlu.edu.cn)
Abstract:In this work,microwave assisted acid treatment was used to prepare xylo oligosaccharides(XOS) from the secondary Eucalyptus pre hydrolysis liquid(PHL) which had been treated by Ca(OH)2 and activated carbon successively. The effects of the kinds of acid, acid dosage, treatment temperature and treatment time on xylose and XOS DP2~4 contents were investigated and the prepared XOS DP2~4 were characterized. The results showed that the optimal treatment conditions were sulfuric dosage of 1.4%(based on the weight of secondary Eucalyptus PHL), 120℃ and 20 min, the content of XOS DP2~4 of the third PHL was 9.25 g/L, increased by 38.1% compared to the secondary PHL without microwave assisted acid treatment.Analyses of Fourier Transform infrared spectroscopy(FT IR) and Thermo gravimetric(TGA) showed that XOS from the microwave assisted sulfuric acid treatment process contained part of side chains of arabinose and uronic acid, and showed a high thermal stability.
Key words:Eucalyptus; pre hydrolysis liquid; xylo oligosaccharides; microwave; acid treatment
溶解漿作为一种高纯度精制浆,广泛应用于黏胶纤维、醋酸纤维、玻璃纸、纺织品等生产领域,其市场需求量不断提高[1]。在利用阔叶木生产硫酸盐法溶解浆的过程中,为降低木质纤维组分分离过程中的化学品消耗量,提高溶解浆质量,通常先对原料进行预水解溶出部分半纤维素,因此预水解过程会产生大量的预水解液[2]。预水解液中含有丰富的半纤维素糖类、少量木素、糠醛、乙酸等[3]。一些企业将预水解液与黑液混合燃烧产生热量,一定程度上造成了半纤维素资源的浪费。阔叶木预水解液中含有的半纤维素糖类主要是低聚合度木糖,因而预水解液成为生产低聚木糖的良好资源,具有较高的利用价值[4]。
低聚木糖(xylo oligosaccharides,XOS)又称木寡糖,是由2~7个木糖分子通过β 14糖苷键连接而成的功能性低聚糖,其主要有效成分为木二糖、木三糖和木四糖[5]。低聚木糖具有良好的理化性质,如可选择性增殖肠道益生菌、改善肠道功能、降低胆固醇、促进钙吸收及脂质代谢等。另外,由于低聚木糖不能被人体消化吸收,因而可满足肥胖症人及糖尿病人对甜度的需求[6 8]。因此近年来,低聚木糖产品广泛应用于医药、食品等领域。
目前,国内外制备低聚木糖的方法主要有热水抽提法、酶解法、酸解法及微波降解法[9]。热水抽提法操作简单、无污染,但是反应过程需要高温高压的环境,对设备要求较为苛刻,产物含量低且纯化工艺较为繁琐[10];酶解法反应条件温和,对设备无特殊要求,反应过程中产生的副产物较少,但是酶处理所需反应时间较长,且对酶的纯度要求较高,大大提高了生产成本,不利于工业化使用[11];酸解法过程简单,反应时间短,生产成本低,是目前较为常用的处理方法,但是传统酸水解是通过热对流或热传导进行加热,加热效率较低[12];微波降解法是一种绿色环保、方便简单的加热方式,具有加热速率快、可选择性加热、对热能消耗量少及反应副产物少、所得产物纯度高等优点[13],但是单一的微波处理大多限于实验室研究阶段。因此,将酸处理与微波处理相结合,既能弥补传统酸处理过程中加热效率低的不足,又能够在一定程度上实现工业化应用。
本研究以桉木预水解液为原料,基于预水解液中低聚木糖主要成分为木二糖、木三糖及木四糖,首先通过Ca(OH)2处理和活性炭吸附去除预水解液中木素、糠醛等杂质,得到二级处理预水解液,然后对二级处理预水解液进行微波辅助酸处理制备富含低聚木糖DP2~4(聚合度为2~4的低聚木糖)的三级处理预水解液。探讨了微波辅助酸处理过程中酸类型、酸用量、处理温度及处理时间对三级处理预水解液中低聚木糖DP2~4含量的影响,以优化工艺条件;并将酸处理后所制备的低聚木糖与目前市场上的低聚木糖产品进行了对比分析,为后续预水解液的高值化利用提供技术支持与理论指导。
1 实 验
1.1 原料及试剂
桉木预水解液,由山东太阳纸业有限公司提供;活性炭(磷酸活化、木质、过200目),购于广东海燕活性炭有限公司;Ca(OH)2、硫酸(H2SO4)、盐酸(HCl)及乙酸(CH3COOH),均为分析纯,购于天津恒兴试剂有限公司;H3PO4(色谱纯)、KBr(光谱纯),购于天津科密欧化学试剂有限公司;液体NaOH(色谱纯,纯度50%),由美国Thermo Fisher公司提供;标准品木糖、木二糖(X2)、木三糖(X3)及木四糖(X4),购于上海意果科技有限公司;透析袋(直径22 mm,压平宽度34 mm,长度5 m,相对分子质量200,购于美国迈姆生物科技有限公司;商品低聚木糖(食品级,XOS 95),购于山东龙力公司。
1.2 实验方法
1.2.1 桉木二级处理预水解液的制备
向桉木预水解液中加入1%(以预水解液质量计)的Ca(OH)2,处理10 min后离心,取上清液,称为一级处理预水解液;向一級处理预水解液中加入用量0.8%(以一级处理液质量计)的活性炭,吸附5 min后离心,取上层清液,称为二级处理预水解液。各级处理液中木素、木糖及乙酸的含量如表1所示。
由表1中数据可知,经过二级处理后,预水解液中木素及糠醛脱除率分别为80.1%和100%,总木糖损失率为8.8%,乙酸含量提高为原来的1.78倍。二级处理预水解液中木糖及低聚木糖DP2~4的含量如表2所示。
1.2.2 微波辅助酸处理制备三级处理预水解液
微波辅助酸处理制备三级处理预水解液(即富含低聚木糖DP2~4的预水解液)的反应在微波反应器(MicroSYNTH)中进行,该反应器是变功率可控温仪器,设定升温时间为2 min。固定反应条件二级处理预水解液用量20 g不变,探讨不同酸类型(乙酸、磷酸、盐酸、硫酸)、不同硫酸用量(1.0%、1.4%、1.8%、2.2%,基于二级处理预水解液质量计)、不同处理温度(100、110、120 、130℃)和不同处理时间(10、20、30 min)对三级处理预水解液中低聚木糖DP2~4含量的影响。反应完成后,将三级处理预水解液离心过滤,取上层清液用于木糖及低聚木糖DP2~4含量的检测。
1.2.3 低聚木糖的纯化
将在较优的微波辅助酸处理工艺条件下得到的三级处理预水解液置入透析袋中透析处理48 h,以除去其中剩余的小分子木素及酸根离子等杂质,透析完成后,将透析液进行旋转蒸发除去部分水分,然后将浓缩糖液进行冷冻干燥得到低聚木糖产品,用于后续红外光谱与热稳定性分析。
1.3 检测
1.3.1 预水解液中木糖、低聚木糖DP2~4及总木糖含量的检测
将预水解液稀释适宜倍数,采用离子色谱仪(ICS 5000型,美国Thermofisher公司)直接测定预水解液中木糖、低聚木糖DP2~4的浓度。测试过程的色谱条件[14]:分析柱为DionexCarboPacTM PA200(3 mm×250 mm),保护柱为CarboPacTM PA200(3 mm×50 mm);EC检测器;进样量为25 L;柱温 30℃;流动相为100 mmol/L NaOH与500 mmol/L NaOAc溶液。
总木糖含量测定:将经过酸水解之后的预水解液稀释适宜倍数,采用ICS 5000型离子色谱测定仪测定木糖含量,即为上清液中总木糖含量。
酸水解方法[15]:取5 mL上清液放入耐压瓶中,加入174 L、质量分数为72%的硫酸,将耐压瓶密封后放入油浴中,121℃下反应60 min。
1.3.2 预水解液中糠醛含量的检测
将预水解液稀释适宜倍数,采用高效液相色谱(LC 20AT,日本岛津公司)测定预水解液中糠醛的含量。检测条件:色谱柱为SUPELCOGEL C 610H(30 cm×7.8 mm),紫外检测器(SPD 20A),检测波长210 nm,柱温30℃;0.1%的磷酸淋洗,淋洗速度为0.7 mL/min。
1.3.3 红外光谱(FT IR)分析
取1 mg低聚木糖样品,与100 mg干燥KBr经玛瑙研钵研磨后压片,置于Vertex70傅里叶变换红外光谱分析仪(Vertex70型,德国布鲁克公司)中测试,扫描范围为250~4250 cm-1,扫描次数为16次。
1.3.4 热稳定性(TGA)分析
取5~10 mg低聚木糖样品置于坩埚中,在热重分析仪(Q50型,美国TA仪器公司)中进行测试。测试条件为:从室温开始,在氮气环境中以10℃/min的升温速率升温至600℃。
2 结果与讨论
2.1 不同类型酸处理对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响
酸处理过程中不同类型酸处理对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响见图1。由图1可以看出,在相同的处理条件下,经过乙酸处理所制备的低聚木糖DP2~4含量最高为9.67 g/L,木糖含量较低为5.96 g/L,且无糠醛等副产物产生(见图1(b)),表明在此条件下,仍有部分木糖以低聚木糖(聚合度>4)的形式存在。经过盐酸处理所制备的低聚木糖DP2~4含量为9.60 g/L,木糖含量高达8.70 g/L。另外图1显示,经过磷酸和硫酸处理所制备的低聚木糖DP2~4含量相似,但硫酸处理所得木糖含量高于磷酸处理。出现上述现象可能与酸自身的性质有关。乙酸、磷酸、盐酸和硫酸加入到二级处理预水解液中,分别被电解为CH3COO-、H2PO-4、Cl-及SO2-4,而不同的酸根离子具有不同的处理行为[16]。图1表明,乙酸是较为有效的酸处理剂。但是在本实验中,利用乙酸调节三级处理预水解液pH值至1.6,相当于乙酸用量为280%(基于二级处理预水解液质量计),而过高的乙酸用量会降低三级处理预水解液中低聚木糖DP2~4的含量,不利于低聚木糖DP2~4的纯化及乙酸的回收。另外,盐酸处理所得低聚木糖DP2~4含量略高于硫酸处理所得低聚木糖DP2~4含量,但盐酸易挥发,不利于工业化使用。因此,考虑到工业实际生产,硫酸是较为理想的酸处理剂,后续实验均以硫酸为处理剂进行。
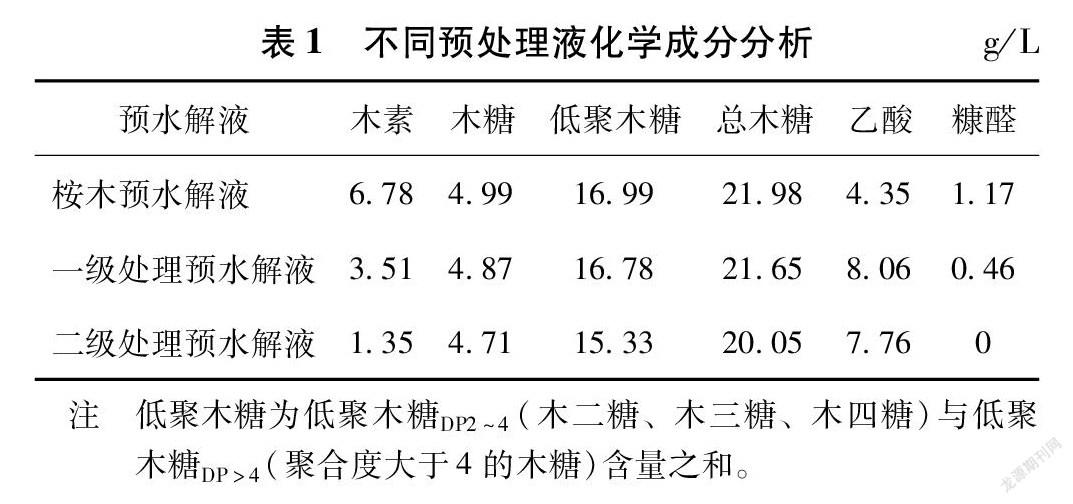
2.2 硫酸用量对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响
酸处理过程中硫酸用量对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响见图2。
由图2(a)可以看出,硫酸用量对三级处理预水解液中木糖及低聚木糖DP2~4含量的影响较大。当硫酸用量小于1.0%时,三级处理预水解液中木糖及低聚木糖DP2~4含量变化不明显;进一步提高硫酸用量至1.4%,低聚木糖DP2~4含量不断增加,且在硫酸用量为1.4%时达到最大值9.25 g/L,在此条件下,木糖、木二糖、木三糖及木四糖含量分别为8.38、4.23、2.85及2.17 g/L。原因可能是随着酸用量的增加,反应体系中酸性活性位点增多,使聚合度较高的低聚木糖降解为木糖、木二糖和木三糖等聚合度较低的低聚木糖。之后,进一步提高硫酸用量至2.2%,木二糖、木三糖及木四糖含量均开始减少,低聚木糖DP2~4含量快速降低,而木糖含量快速增加。在硫酸用量为2.2%时,木糖及低聚木糖DP2~4含量分别为16.30 g/L和0.42 g/L,低聚木糖DP2~4几乎完全降解。这是由于过量酸的加入,使溶液酸性过强,导致低聚木糖DP2~4进一步降解为木糖。另外,由图2(b)可知,随着硫酸用量的不断增加,三级处理预水解液中的糠醛含量呈现一直增加的趋势,原因可能是在较强的酸性环境下,木糖进一步被催化降解为糠醛等小分子产物[16]。然而即使在2.2%的硫酸用量下,糠醛含量仍然较低,仅为0.12 g/L。由上述分析可知,较优的硫酸用量为1.4%。
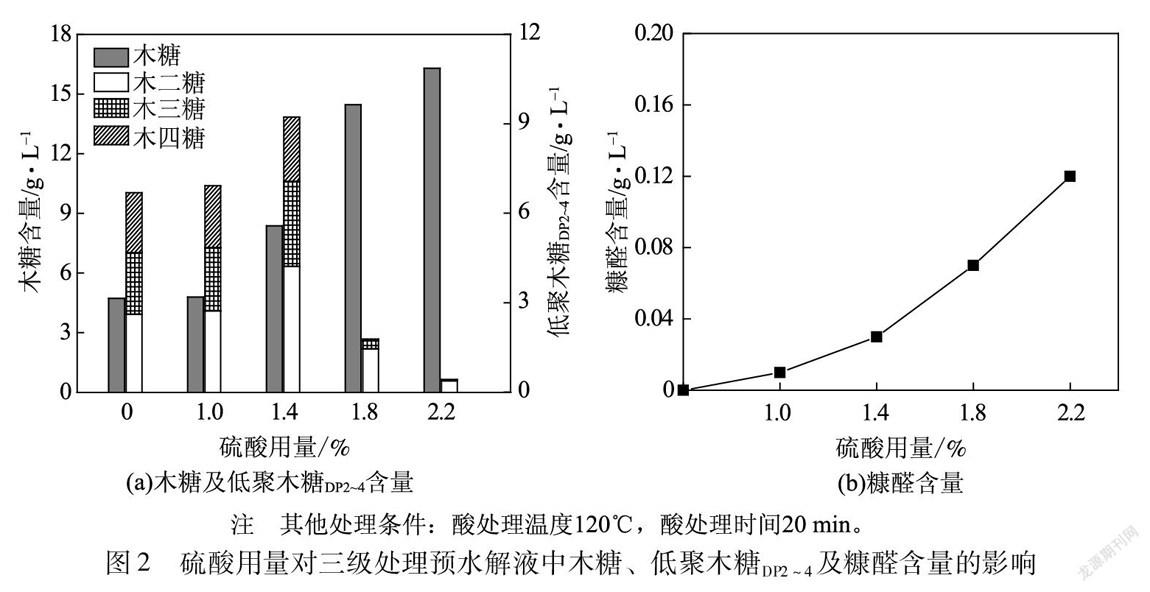
2.3 处理温度对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响
酸處理过程中处理温度对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响见图3。
由图3(a)可以看出,随着处理温度的不断提高,三级处理预水解液中低聚木糖DP2~4的含量呈现先增加后迅速降低的趋势,而木糖含量呈现持续增加的趋势。在处理温度低于110℃时,木糖及低聚木糖DP2~4含量提高不明显,这表明三级处理预水解液中(低)聚木糖的降解反应在相对较高的温度下才能进行。继续提高处理温度至120℃,低聚木糖DP2~4含量提高至9.25 g/L,木糖、木二糖及木三糖含量明显增加,而木四糖含量变化不明显,这说明高温有利于聚木糖降解为低聚木糖DP2~4。进一步提高处理温度至130℃,木糖含量达到13.79 g/L,木二糖、木三糖及木四糖含量均降低,低聚木糖DP2~4含量降低为4.03 g/L,这表明过高的处理温度会使低聚木糖DP2~4进一步降解为木糖。因此,酸水解制备低聚木糖DP2~4时温度不宜过高。另外,由图3(b)可知,随着处理温度的升高,糠醛含量不断增加,在温度为130℃时,糠醛含量仍较低,约为0.07 g/L,这说明该反应过程中产生的副产物较少。由上述分析可知,通过微波辅助酸处理桉木预水解液制备低聚木糖DP2~4的较优温度为120℃。
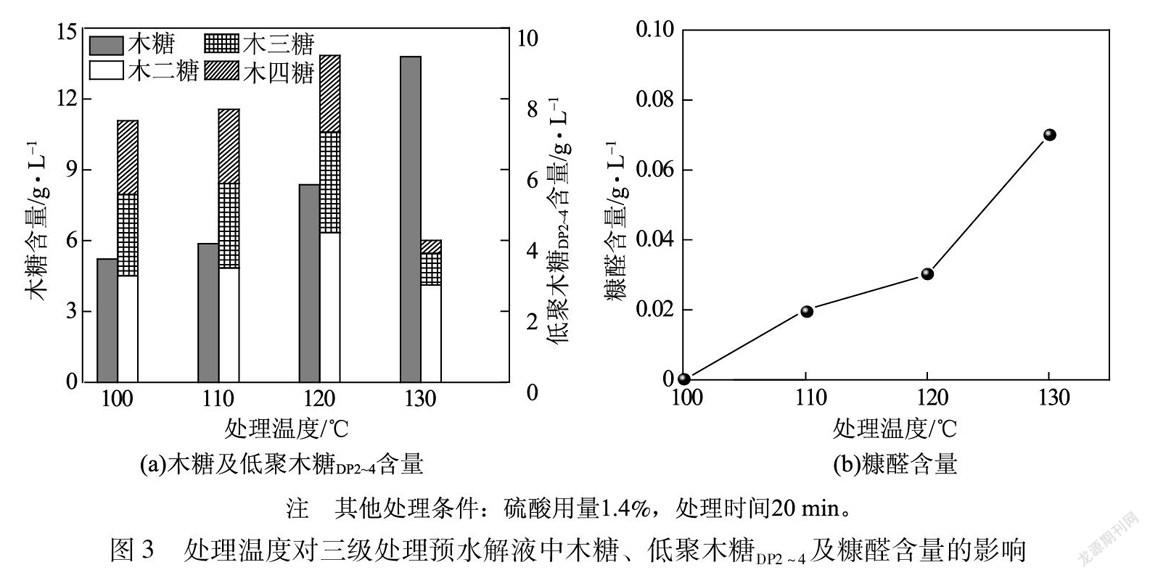
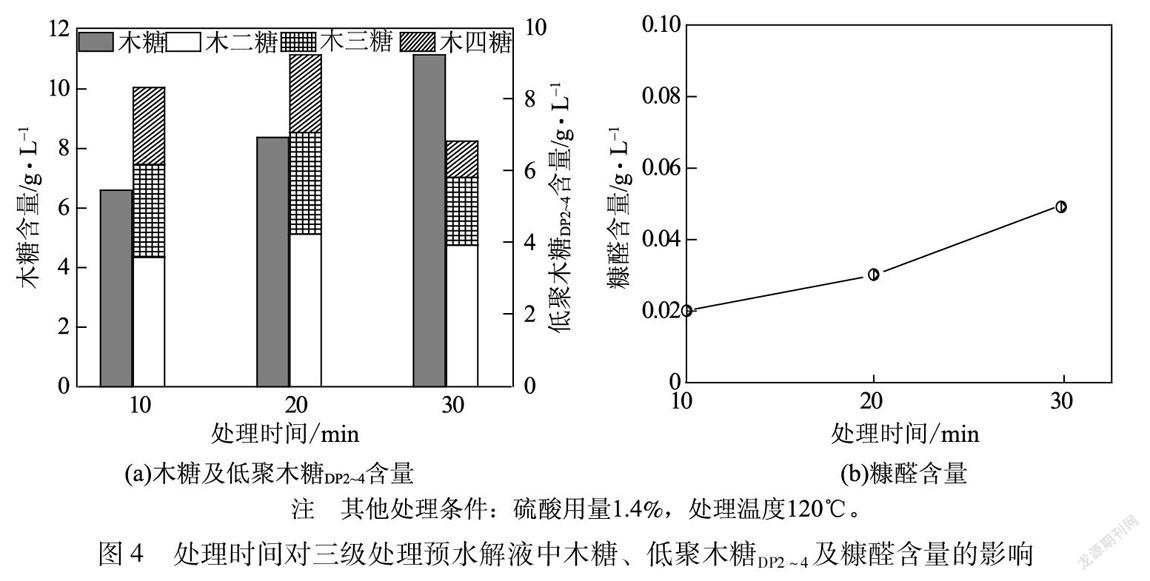
2.4 处理时间对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响
酸处理过程中处理时间对三级处理预水解液中木糖、低聚木糖DP2~4及糠醛含量的影响见图4。
由图4(a)可以看出,随着处理时间的不断增加,三级处理预水解液中低聚木糖DP2~4含量呈现先增加后下降的趋势,而木糖含量呈现一直增加的趋势。当处理时间增加至20 min时,低聚木糖DP2~4含量达到最大值9.25 g/L,木糖含量增加为8.38 g/L,木二糖和木三糖含量均有不同程度的增加,而木四糖含量没有明显变化。原因可能是聚合度>4的低聚木糖经过酸降解为木四糖的反应与木四糖降解转化为木糖、木二糖或木三糖的反应达到了动态平衡。继续增加反应时间至30 min,木糖含量增加为11.15 g/L,低聚木糖DP2~4含量降低为6.82 g/L。这表明在硫酸用量为1.4%、处理温度为120℃时,较短的反应时间(20 min)即可使低聚木糖DP2~4含量较高,而增加处理时间会使低聚木糖DP2~4进一步降解为木糖。因此,通过酸处理制备低聚木糖DP2~4时需要严格控制处理时间。另外,由图4(b)可知,处理时间对糠醛含量影响较小,在处理时间为30 min时,糠醛含量仍较低约为0.05 g/L。综上所述,酸处理过程中较优的处理时间为20 min。
2.5 较优处理工艺条件下木糖及低聚木糖DP2~4含量
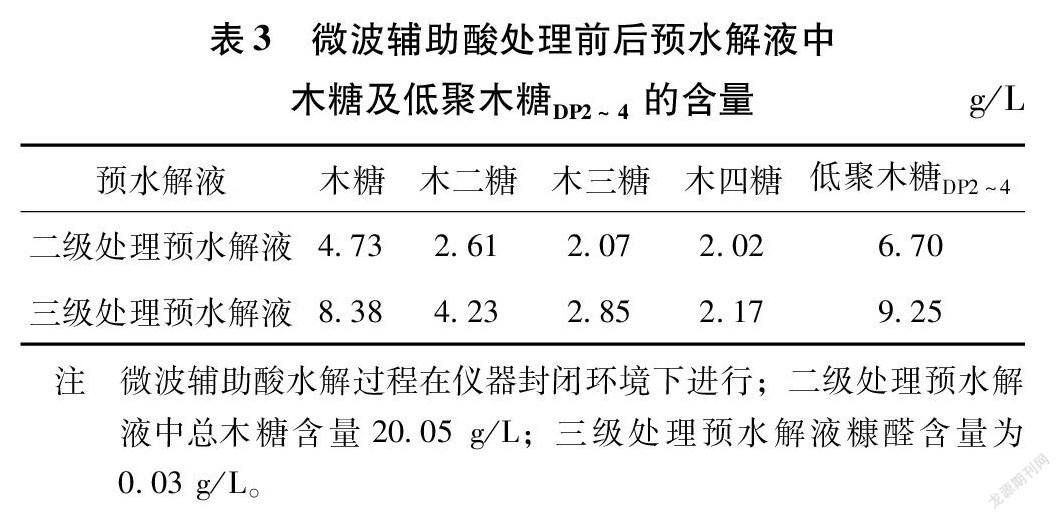
由2.1~2.4分析可知,微波辅助酸处理二级处理预水解液制备低聚木糖DP2~4的较优工艺条件为:硫酸用量1.4%、处理温度120℃和处理时间20 min。在此条件下,三级处理预水解液中木糖及低聚木糖DP2~4含量如表3所示。
由表3可知,与二级处理预水解液相比,经过微波辅助酸处理后所得三级处理预水解液中木糖、木二糖和木三糖含量分别提高了3.65、1.62和0.78 g/L,而木四糖含量无明显变化,低聚木糖DP2~4含量由原来6.70 g/L上升到9.25 g/L,提高了38.1%。
2.6 红外光谱(FT IR)分析
图5为由三级处理预水解液经过透析纯化处理后所制备的低聚木糖与商品低聚木糖的FT IR谱图。
由图5可以看出,三级处理预水解液经透析处理后所制备的低聚木糖与商品低聚木糖样品的FT IR谱图相似。两种低聚木糖均在1045 cm-1处出现较强的吸收峰,该处是由C—O的伸缩振动引起,是聚木糖主链的典型特征峰[17];在894 cm-1处出现的吸收峰是由糖单元间显性β 糖苷键的振动引起;987 cm-1处出现较弱的吸收峰主要是木糖残基C—3上的阿拉伯糖取代基,是阿拉伯聚木糖型低聚物的典型吸收峰[18];1635 cm-1处出现的吸收峰是由吸附水的弯曲振动引起[19];在1408 cm-1处出现的吸收峰是由—COO-的对称伸缩振动引起,为糖醛酸的特征吸收峰[20]。上述分析结果表明,经过硫酸处理桉木预水解液所制备的低聚木糖与商品低聚木糖所含官能团相似,均含有部分阿拉伯糖及糖醛酸侧链。另外图5显示,商品低聚木糖样品在1730 cm-1处出现较弱的吸收峰,该处是乙酰基的特征吸收峰,而经过硫酸处理预水解液所制备的低聚木糖样品在该处没有出现吸收峰,这表明在酸处理制备低聚木糖的过程中,连接在聚木糖侧链上的乙酰基脱落下来,这是由碱性条件下乙酰基脱落形成乙酸所导致的[21],与Ca(OH)2处理过程中乙酸含量的增加一致(见表1)。
2.7 热重(TGA)分析
图6为由三级处理预水解液经过透析处理后所制备的低聚木糖与商品低聚木糖的TGA曲线。
由图6(a)可知,经过硫酸处理所制备的低聚木糖与商品低聚木糖的热稳定性曲线相似。将温度升高至600℃,自制低聚木糖与商品低聚木糖质量分别损失了83%和78%。图6(b)显示,两种低聚木糖在150℃前均出现一个较小峰,这是由样品中水分蒸发所致。自制低聚木糖从200℃左右开始分解,同时在310℃左右出现最大峰,质量损失过程在600℃结束。与自制低聚木糖不同,商品低聚木糖在325℃左右出现最大峰,由此可知商品低聚木糖的热稳定性略高于自制低聚木糖。由上述分析可知,两种低聚木糖的热解过程主要分为4个阶段:25~150℃为第一个阶段,随着处理温度的不断升高,样品吸热使样品中的水分蒸发,这一阶段只发生物理变化;200~310℃(或325℃)为第二阶段,在此阶段内,自制(或商品)低聚木糖开始发生质量损失,生成不燃性气体如CO、CO2、甲酸和乙酸等[19];第三阶段为310(或325)~440℃,在此阶段内,不燃性气体生成为可燃性气体;第四阶段(>440℃)主要为炭化阶段,是由C—O和C—H键的进一步裂解造成的[22]。另外,图6显示,样品热重曲线温度范围较宽,原因可能是样品中所含低聚木糖的聚合度范围较宽,而不同聚合度的低聚木糖具有不同的热重行为。由上述分析可知,经过微波辅助酸处理桉木预水解液所制备的低聚木糖与商品低聚木糖的性质相近,均具有较高的热稳定性。
3 结 论
为利用桉木预水解液制备低聚木糖,对经过Ca(OH)2和活性炭处理的二级处理预水解液进行微波辅助酸处理,探讨了处理过程中酸类型、酸用量、处理温度和处理时间对预水解液中木糖及聚合度为2~4 低聚木糖(低聚木糖DP2~4)含量的影响,并对处理后预水解液中的低聚木糖进行了分析与表征。
3.1 酸类型、酸用量、处理温度及处理时间对低聚木糖的含量均有较大影响,其中硫酸是一种较优的酸处理剂;硫酸处理二级处理预水解液制备低聚木糖的较优工艺条件为:硫酸用量1.4%、处理温度120℃和处理时间20 min,在此条件下,经过酸处理后所得三级处理预水解液中低聚木糖DP2~4的含量为9.25 g/L,与二级处理预水解液相比,低聚木糖DP2~4含量提高了38.1%,預水解液中低聚木糖组分得到了进一步纯化。
3.2 傅里叶变换红外光谱(FT IR)分析和热重(TGA)分析结果表明,通过微波辅助酸处理预水解液所制备的低聚木糖与目前商品低聚木糖的性质相似,两者均含有部分阿拉伯糖及糖醛酸侧链,且均具有较高的热稳定性。
参 考 文 献
[1] TIAN Chao, HUANG Yan, YANG Xiaobo, et al. The Reactivity of Dissolving Pulp and Its Research Progress: A Review[J]. China Pulp & Paper, 2015, 34(1): 61.
田 超, 黄 雁, 杨小博, 等. 溶解浆的反应性能及相关研究进展[J]. 中国造纸, 2015, 34(1): 61.
[2] DONG Jiran, CHEN Jiachuan, JI Xingxiang, et al. Study on the Removal of Lignin from Eucalyptus Pre hydrolysis Liquid by Laccase Combined with Activated Carbon Treatment[J]. China Pulp & Paper, 2018, 37(9): 9.
董吉冉, 陈嘉川, 吉兴香, 等. 漆酶协同活性炭处理脱除桉木预水解液中木素的研究[J]. 中国造纸, 2018, 37(9): 9.
[3] CHEN Jia chuan, DONG Ji ;ran, YANG Gui hua, et al. A Process for Purifying Xylosugars of Pre hydrolysis Liquor from Kraft based Dissolving Pulp Production Process[J]. Biotechnology for Biofuels, 2018, 11(1): 337.
[4] XU Feng, YANG Guihua, JI Xingxiang, et al. Effect of P Factor on Dissolution of Poplar Hemicellulose During the Hydrothermal Pretreatment Process[J]. China Pulp & Paper, 2018, 37(8): 1.
徐 豐, 杨桂花, 吉兴香, 等. 热水预处理过程中P因子对杨木半纤维素溶出效果的影响[J]. 中国造纸, 2018, 37(8): 1.
[5] Caparros S, Garrote G, Ariza J, et al. Xylooligosaccharides Production from Arundo Donax[J]. J. Agric. Food Chem, 2007, 55(14): 5536.
[6] Chapla D, Pandit P, Shah A. Production of Xylooligosaccharides from Corncob Xylan by Fungal Xylanase and Their Utilization by Probiotics[J]. Bioresource Technology, 2012, 115(5): 215.
[7] Moniz P, Ailing H, Duarte L C, et al. Assessment of the Bifidogenic Effect of Substituted Xylo oligosaccharides Obtained from Corn Straw[J]. Carbohydrate Polymers, 2016, 136: 466.
[8] Yang Z Y, Wu D T, Chen C W, et al. Preparation of Xylooligosaccharides from Xylan by Controlled Acid Hydrolysis and Fast Protein Liquid Chromatography Coupled with Refractive Index Detection[J]. Separation & Purification Technology, 2016, 171: 151.
[9] YANG Dou, ZHANG Wei bo, ZHAO Qian yun, et al. Study on the Technology of Xylooligosaccharide Preparation[J]. Cereal and Food Industry, 2017, 24(1): 53.
杨 豆, 张卫波, 赵倩芸. 制备低聚木糖的工艺研究[J]. 粮食与食品工业, 2017, 24(1): 53.
[10] Yang B, Wang B B, Wang G H, et al. Integrated Forest Biorefinery: Value added Utilization of Dissolved Organics in the Prehydrolysis Liquor of Prehydrolysis Kraft (PHK) Dissolving Pulp Production Proces[J]. Paper and Biomaterials, 2018, 3(3):47.
[11] Samanta A K, Jayapal N, Kolte A P, et al. Enzymatic Production of Xylooligosaccharides from Alkali Solubilized Xylan of Natural Grass(Sehima Nervosum)[J]. Bioresource Technology, 2012, 112(3): 199.
[12] Warrand J, Janssen H G. Controlled Production of Oligosaccharides from Amylose by Acid hydrolysis Under Microwave Treatment: Comparison with Conventional Heating[J]. Carbohydrate Polymers, 2007, 69(2): 353.
[13] Delazar A, Nahar L, Hamedeyazdan S, et al. Microwave assisted Extraction in Natural Products Isolation[J]. Methods MolBiol, 2012, 864: 89.
[14] FAN Li, XU Yong, LIAN Zhi na, et al. Quantitative Determination of Xylo oligosaccharides in Xylo oligosaccharides Products with High Performance Anion exchange Chromatography Coupled with Pulsed Amperometric Detection[J]. Chinese Journal of Chromatography, 2011, 29(1): 75.
范 丽, 徐 勇, 连之娜, 等. 高效阴离子交换色谱 脉冲安培检测法定量测定低聚木糖样品中的低聚木糖[J]. 色谱, 2011, 29(1): 75.
[15] Yang Guihua, Sarwar Jahan M, Liu Haitang, et al. Acid Hydrolysis of Prehydrolysis Liquor Produced from the Kraft based Dissolving Pulp Production Process[J]. Industrial & Engineering Chemistry Research, 2012, 51(43): 13902.
[16] Yemis O, Mazza G, et al. Acid catalyzed Conversion of Xylose, Xylan and Straw into Furfural by Microwave assisted Reaction[J]. Bioresource Technology, 2011, 102: 7371.
[17] BIAN J, PENG P, PENG F, et al. Microwave assisted Acid Hydrolysis to Produce Xylooligosaccharides from Sugarcane Bagasse Hemicelluloses[J]. Food Chemistry, 2014, 156(156): 7.
[18] CHEN Qing qing, JIANG Hua, ZHANG Yang, et al. Optimization of Extraction and Characterization of Hemicelluloses from Hybrid Poplar Residues[J]. Biomass Chemical Engineering, 2013, 47(3): 39.
陳清清, 江 华, 张 洋, 等. 速生杨半纤维素碱法提取工艺的优化和表征[J]. 生物质化学工程, 2013, 47(3): 39.
[19] Peng F, Ren J L, XU F, et al. Comparative Study of Hemicelluloses Obtained by Graded Ethanol Precipitation from Sugarcane Bagasse[J]. Journal of Agricultural & Food Chemistry, 2009, 57(14): 6305.
[20] Patricia G, Maria J. Structural Features and Properties of Soluble Products Derived from Eucalyptus Globulus Hemicelluloses[J]. Food Chemistry, 2011, 127(4): 1798.
[21] Shen J, Fathei P, Soleiman P, et al. Lime Treatment of Prehydrolysis Liquor from the Kraft based Dissolving Pulp Production Process[J]. Industrial & Engineering Chemistry Research, 2012, 51(2): 662.
[22] Maschio G, Koufopanos C, Lucchesi A. Pyrolysis, A Promising Route for Biomass Utilization[J]. Bioresource Technology, 1992, 42(3): 219.CPP
