持续激活型CIPK9在花粉管生长过程中的生物学功能及亚细胞定位分析
2019-09-10周利明房玮
周利明 房玮
摘 要:植物的花粉管生長是一个多因素参与的生理学过程,需要多种信号传导系统来引导植物细胞完成。钙离子作为第二信使,可以通过钙传感器CBLs激活下游的蛋白激酶CIPKs参与调控细胞的极性发育过程。该研究中CIPK9被确定为候选基因,其C端与绿色荧光蛋白(GFP)相融合,通过基因枪技术在烟草花粉中进行瞬时表达,观察对应的亚细胞定位及花粉管中诱导的表型。结果表明:(1)GFP标记的CIPK9定位于花粉管中高速运动的颗粒状细胞器,并可随胞质环流进行规律的运动,为进一步探究CIPK9的生物学功能,还构建了持续激活型CIPK9(CACIPK9)。(2)与全长CIPK9相比较,CACIPK9缺少C末端的调控区域,并在激酶区域的激活环中进行了点突变,从而表现出不受调控的持续高活性。(3)缺少C端调控区的CACIPK9表现出非特异性的亚细胞定位,即与GFP对照相同的胞内弥散定位,说明CIPK9的C末端调控区对于其在花粉管中的正确定位发挥重要的调控作用。另外,CACIPK9过表达可以引起花粉管的去极化生长表型。这表明CIPK9作为钙信号下游家族的一员参与了花粉管极性生长的相关过程,并对花粉管的生长具有一定的调控作用。
关键词:花粉管, 钙离子, CBL互作蛋白激酶, 极性生长, 信号传导
中图分类号:Q945.6
文献标识码:A
文章编号:1000-3142(2019)06-0788-06
Abstract:Pollen tube growth is a physiological process in which multi-factors are involved. The entire growth process requires multiple signaling systems to regulate plant cell growth and orientation. Calcium, as the second messenger, is achieved by calcium sensors CBLs, and then activates downstream target CIPKs to participate in the regulation of cell polarity development. In this study, CIPK9 was identified as a candidate gene, and subsequently the PCR-amplified co-ding region of CIPK9 was cloned into pLAT52-GFP vector for transient expression in pollen tubes. The C-terminus of CIPK9 was fused to green fluorescent protein (GFP), and the resulting constructs were transiently expressed in tobacco pollen grains by gene-gun transform technology. CIPK9-GFP subcellular localization and biological function in pollen tube were studied by transient expression system (particle bombardment). The results were as follows:(1) GFP-labeled CIPK9 was localized in granular organelles with high-speed movement in pollen tubes, and shifted regularly with the cytoplasmic circulation. In order to further study the biological function of CIPK9, a constitutively active CIPK9 (CACIPK9) was constructed. (2) Compared with full-length CIPK9, CACIPK9 lacked the regulatory region at the C-terminal and had a Thr-178-to-Asp point mutation in the activation loop containing conserved Asp-Phe-Gly and Ala-Pro-Glu motifs. CACIPK9 thus had sustained high kinase activity without regulation. (3) While CACIPK9 lacking C-terminal regulatory region evenly distributed in the pollen tube cytoplasm, similar to that of GFP control, suggesting that the C-terminal of CIPK9 plays an important role in the correct subcellular localization of CIPK9 in pollen tube. In addition, overexpression of CACIPK9 could induce the depolarization of pollen tube growth. In conclusion, CIPK9, as a member of the downstream family of calcium signaling, participates in the process of pollen tube polarity growth and plays a certain role in pollen tube growth.
Key words:pollen tube, calcium ion, CBL-interactive protein kinase, polarized growth, signaling pathway
植物花粉萌发及生长是一个复杂的动力学过程:散落到柱头上的花粉经过相互识别之后,从萌发孔生长出花粉管,穿过花柱组织到达子房,最终将携带的精细胞释放到胚囊中完成受精过程。整个过程发生在雌雄配子之间,涉及多条信号调控途径,包括钙信号、小G蛋白、活性氧(ROS)和磷脂等(Kolukisaoglu et al., 2004)。细胞的生长模式主要分为弥散生长(diffuse growth)与顶端生长(tip growth)两种类型。弥散生长是整个细胞的均匀膨胀过程(缺少方向性),而顶端生长则主要集中在细胞的某一特定区域(花粉管顶端)。花粉管作为一类典型的顶端生长模式系统,被广泛用于研究植物细胞的极性发育(Yang, 2002; Fu et al., 2001)。花粉管的顶端生长有赖于细胞骨架的动态排布、囊泡的极性运输和胞吐作用等多方面,以此决定萌发起始的位点及极性生长的方向。目前已知多个信号分子如钙离子、小G蛋白、活性氧(ROS)和磷脂等在花粉管顶端生长过程中发挥重要作用(Rounds & Bezanilla, 2013)。其中,钙信号可被某类钙传感器识别,并引起一系列的下游级联反应(Kroeger & Geitmann, 2012; Rounds & Bezanilla, 2013)。类钙调神经磷酸酶B亚基(calcineurin B-like protein, CBL)作为一类典型的钙传感器家族,协同其下游互作蛋白激酶(CBL interacting protein kinase, CIPK),可以形成错综复杂的CBL-CIPK介导的钙信号网络(Luan, 2009; Hepler et al., 2011)。目前,CBL-CIPK相关研究主要集中在植物胁迫响应机制方面,如在盐胁迫下,CBL4-CIPK24复合物调节质膜上的Na+/K+逆向转运体SOS1以排除钠离子,而CBL10-CIPK24复合物可能参与液泡中钠离子的固定作用(Liu et al., 2000; Kim et al., 2007; Quan et al., 2007)。对于低钾胁迫,CBL1和CBL9与CIPK23相互作用,进而调节一个钾离子通道(Arabidopsis K+ transporter 1, AKT1),以介导根毛中钾离子的摄取(Xu et al., 2006)。
近年来,CBL-CIPK复合物在非生物胁迫(寒冷、干旱和盐害)耐受中的作用已被广泛研究,但对CBL-CIPK在花粉管极性生长中的作用研究却十分有限。本文主要研究钙信号下游家族中的CIPK9参与的花粉管极性生长过程。全长CIPK9及其持续激活型与绿色荧光蛋白(GFP)相融合,通过基因枪技术在烟草花粉中进行瞬时表达,观察其亚细胞定位及其在花粉管中诱导的表型,从而探究CIPK9在极性生长过程中发挥的作用。研究成果对深入揭示花粉管生长过程中的相关信号调控网络具有一定的理论指导意义。
1 材料与方法
1.1 植物材料及生长条件
目前用作研究的植物材料为拟南芥(Arabidopsis thaliana,Col-0)培育在22 ℃的温室中,光照16 h,黑暗8 h。烟草(Nicotiana tabacum)培育在28 ℃温室中,光周期为12 h/12 h。
1.2 瞬时表达载体构建
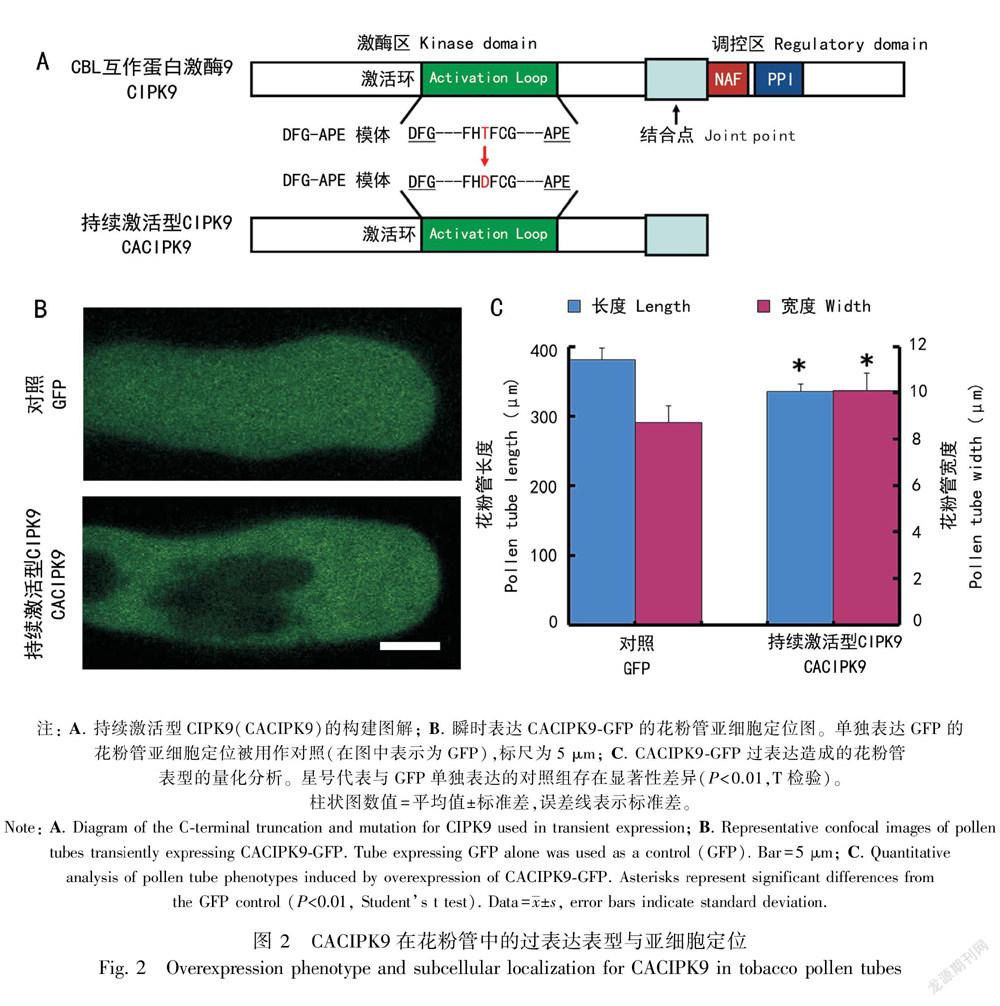
CIPK9全长cDNA(序列号为U15436 )购自ABRC(Arabidopsis Biological Resource Center),然后设计引物序列用于PCR扩增CIPK9基因片段。上游引物(TCTAGAATGAGTGGAAGCAGAAGGA)携带Xba I酶切位点,下游引物(GGATCCCTTGCTTTTGTTCTTCA)携带BamH I酶切位点,扩增所得CIPK9基因片段接入T载体(Promega公司),转化大肠杆菌 DH5α,选定阳性克隆并进行质粒提取,随后进行酶切鉴定及序列测序,序列检测正确的目的片段被接入pLAT52:GFP载体中(Wu et al., 2001)。对于CACIPK9的构建,CIPK9的C端调控区域(316~451位氨基酸)被切除,随后将保守DFG-APE模体(位于激酶结构域中的激活环,activation loop)中的178位的苏氨酸(THR)突变为天冬氨酸(ASP)(Guo et al., 2001; Albrecht et al., 2001),最后测序正确的目的片段被接入pLAT52:GFP载体中。
1.3 基因枪瞬时表达试验
收集新鲜的烟草花粉(8朵花的花粉/每批瞬时转化)备用,通过Plasmid Mini Kits试剂盒(QIAGEN, Germany)提取目的质粒DNA,随后紫外分光光度计测定具体浓度。按照以往的瞬时表达烟草花粉的实验步骤(Fu et al., 2001),每组转化实验使用0.8 μg的质粒DNA,转化后的烟草花粉粒在28 ℃中,避光培养3~4 h,然后利用荧光显微镜或者共聚焦扫描显微镜进行表型及亚细胞定位观察。
1.4 花粉管表型分析
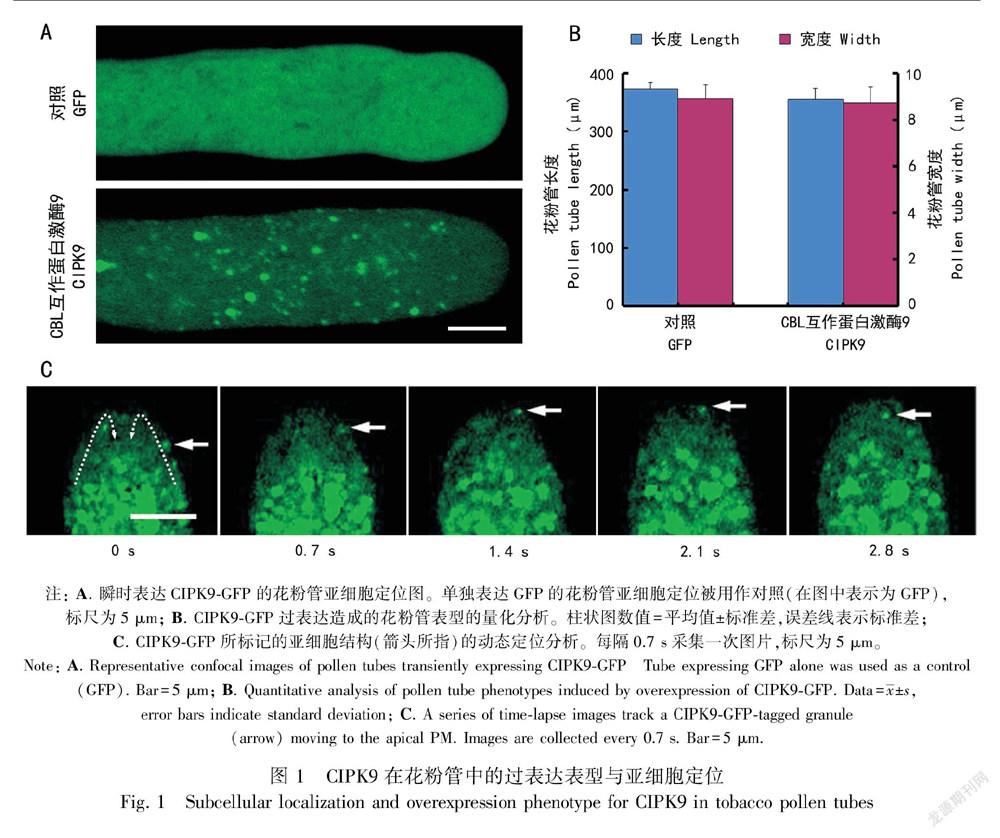
通过荧光倒置显微镜(BX51;OLYMPUS)觀察转化成功的花粉管,并以CCD摄像机(DP70型;OLYMPUS)拍摄相应照片。使用Zeiss LSM图像浏览器(3.2版)中的测量功能分析所获得的照片,分别测量花粉管的长度及花粉管顶端最宽处的直径。每种基因型分别进行3次独立的转化实验,一共收集80根左右的花粉管长度与宽度,以此作为判定花粉管是否具备去极化生长的表型特征。
1.5 亚细胞定位观察
利用共焦激光扫描显微镜(Model LSM 510 META; Zeiss, Germany)观察GFP标签化的CIPK9(或CACIPK9)在花粉管中的亚细胞定位情况(激发光为488 nm,发射光为505~530 nm),使用Zeiss LSM图像浏览器(3.2版)进行相应的图像分析。
2 结果与分析
2.1 CIPK9的亚细胞定位及过表达表型
类钙调神经磷酸酶B亚基(CBL)属于植物所特有的一类钙离子感受器,其下游存在一组互作的蛋白激酶(CBL-interactive protein kinase, CIPK)(Luan et al., 2002; Shi et al., 1999)。本研究挑选CIPK9作为候选基因,将其与绿色荧光蛋白(GFP)相融合,在花粉特异启动子LAT52的驱动下,利用基因枪技术在烟草花粉中进行瞬时表达,最终通过显微镜观察对应的表型及亚细胞定位。实验结果显示过量表达CIPK9并没有使花粉管极性生长发生显著的表型变化(图 1:B)。亚细胞定位结果显示GFP单独表达(对照实验)在花粉管中呈现弥散分布,而CIPK9-GFP则定位于花粉管中的颗粒状细胞器上(图 1:A),这些颗粒状细胞器可随胞质环流进行“反式喷泉式”的规律运动,即沿着花粉管两侧运动到质膜顶端,然后从花粉管中轴返回到基端(图 1:C)。
2.2 持续激活型CIPK9(CACIPK9)引起表型及定位异常
为进一步研究CIPK9在花粉管生长中的功能,我们构建了CIPK9的持续激活形式(constitutively active, CA)。如图 2:A所示,全长CIPK9包含2个重要的结构域,一个是激酶结构域(kinase domain),另一个是调控结构域(regulatory domain)。CIPK9的调控结构域位于序列的C末端,包含一个高度保守的NAF模体(NAF motif),由21个氨基酸组成,是一段与CBLs互作的区域(Kim et al., 2000)。除此之外,NAF模体可通过结合CIPKs的激酶结构域,对其激酶活性进行自抑制作用(Kolukisaoglu et al., 2004)。NAF模体旁边是一段PPI模体(protein phosphatase interaction motif),CIPKs与蛋白磷酸酶2C之间的相互作用可能通过这一结构区域得以实现(Ohta et al., 2003)。CACIPK9主要保留了激酶结构域,而去除了自身的调控结构域(包含自抑制区)。另外对激酶结构域中的激活环(activation loop)进行点突变(将178位的苏氨酸突变为天冬氨酸),进一步提高CIPK9的激酶活性。
构建成功的CACIPK9片段采取与全长CIPK9相似的策略,通过基因枪在烟草花粉中进行瞬时表达,进而研究CACIPK9-GFP的表型与定位。结果显示CACIPK9的瞬时表达可以引起花粉管的去极化生长,即花粉管长度有所缩短(从对照的381.67 μm减少到335.41 μm),而花粉管的宽度有所增加(从对照的8.74 μm增加到10.11 μm)。对于亚细胞定位研究,与CIPK9-GFP的颗粒状细胞器定位不同,CACIPK9-GFP表现出非特异性的亚细胞定位,即与GFP对照相同的花粉管中弥散定位。这一结构暗示CIPK9的正常定位与其结构的完整性密切相关。
3 讨论与结论
细胞极性是细胞发育的基本属性之一,主要体现为细胞结构与组成成分的不对称性(Yang, 2008)。植物细胞极性的确立与维持涉及多种信号调控因子,如钙离子、胞吞与胞吞及细胞骨架等,各信号因子需要维持在特定水平,已形成稳定的花粉管顶端生长(Kroeger & Geitmann, 2012)。
钙离子浓度对于调控花粉管的生长和导向,起着至关重要的作用。拟南芥基因组中包含4个主要的钙离子感受器家族,分别为钙调素(CaM)、类钙调素(CML)、类钙调神经磷酸酶B亚基(CBL)以及钙依赖蛋白激酶(CPK)(McCormack et al., 2005)。其中CBL是一类植物中特有的基因家族,在结构上与动物中的神经磷酸酶的B亚基类似。CBL的下游效应子是一类Ser/Thr的蛋白激酶(CIPK),CBL-CIPK体系共同作用,感知并传递钙信号的变化(Luan et al., 2002)。本研究中CIPK9-GFP定位于随胞质环流运动的颗粒状细胞器上,从运动方式上推测该结构可能是花粉管内膜系统的囊泡,实验结果暗示CIPK9可能通过调控花粉管中的囊泡系统影响细胞的极性生长。CIPK9的C末端含有一段自抑制区域(NAF motif),同時也是一段与其上游效应子(CBLs)结合的区域。CBLs结合到相应CIPKs上,解除其自抑制作用,从而激活CIPK的激酶活性(Luan et al., 2002; Kim et al., 2000)。本研究中构建的持续激活型CIPK9(CACIPK9)体现了相同的效果,并在此基础之上,通过突变激酶区域的保守结构进一步激活了CIPK9的激酶活性。实验结果显示CACIPK9在烟草花粉中的瞬时表达抑制了花粉管的纵向生长,促进了花粉管的横向生长,最终造成了细胞的去极化生长表型。另外,由于C端的缺失造成了CACIPK9-GFP的亚细胞定位呈现出非特异性的弥散定位,说明CIPK9的C端调控结构域是其在花粉管中正确定位的关键因素,同时亚细胞定位的异常也可以影响CIPK9在花粉管极性生长中功能的正常发挥。
前人(Quan et al., 2007; Cheong et al., 2007; Xu et al., 2006)关于CBL-CIPK网络的研究主要集中于胁迫信号途径。本研究为CIPK9在花粉管极性生长的作用做出了新的介绍,为CIPK9的生物学功能提供了新的认识,但CIPK9在花粉管中定位细胞器的具体性质(是否囊泡体系)和调控花粉管极性生长的具体作用机理,还有待于进一步的研究和探索。未来CIPK9下游靶蛋白的确定及其作用机制的阐明将进一步揭示CIPK信号网络在花粉管极性生长中所发挥的重要作用。
參考文献:
ALBRECHT V, RITZ O, LINDER S, et al., 2001. The NAF domain defines a novel protein-protein interaction module conserved in Ca2+-regulated kinases [J]. Embo J, 20(5):1051-1063.
CHEONG YH, PANDEY GK, GRANT JJ, et al., 2007. Two calcineurin B-like calcium sensors, interacting with protein kinase CIPK23, regulate leaf transpiration and root potassium uptake in Arabidopsis [J]. Plant J, 52(2):223-239.
FU Y, WU G, YANG Z, 2001. Rop GTPase-dependent dynamics of tip-localized F-actin controls tip growth in pollen tubes [J]. J Cell Biol, 152(5):1019-1032.
GUO Y, HALFTER U, ISHITANI M, et al., 2001. Molecular characterization of functional domains in the protein kinase SOS2 that is required for plant salt tolerance [J]. Plant Cell, 13(6):1383-1400.
HEPLER PK, KUNKEL JG, ROUNDS CM, et al., 2011. Calcium entry into pollen tubes [J]. Trends Plant Sci, 17(1):32-38.
KIM BG, WAADT R, CHEONG YH, et al., 2007. The calcium sensor CBL10 mediates salt tolerance by regulating ion homeostasis in Arabidopsis [J]. Plant J, 52(3):473-484.
KIM KN, CHEONG YH, GUPTA R, et al., 2000. Interaction specificity of Arabidopsis calcineurin B-like calcium sensors and their target kinases [J]. Plant Physiol, 124(4):1844-1853.
KOLUKISAOGLU U, WEINL S, BLAZEVIC D, et al., 2004. Calcium sensors and their interacting protein kinases:Genomics of the Arabidopsis and rice CBL-CIPK signaling networks [J]. Plant Physiol, 134(1):43-58.
KROEGER J, GEITMANN A, 2012. The pollen tube paradigm revisited [J]. Curr Opin Plant Biol, 15(6):618-624.
LIU J, ISHITANI M, HALFTER U, et al., 2000. The Arabidopsis thaliana SOS2 gene encodes a protein kinase that is required for salt tolerance [J]. PNAS, 97(7):3730-3734.
LUAN S, KUDLA J, RODRIGUEZ-CONCEPCION M, et al., 2002. Calmodulins and calcineurin B-like proteins:Calcium sensors for specific signal response coupling in plants [J]. Plant Cell, 14(Suppl.):389-400.
LUAN S, 2009. The CBL-CIPK network in plant calcium signaling [J]. Trends Plant Sci, 14(1):37-42.
MCCORMACK E, TSAI YC, BRAAM J, 2005. Handling calcium signaling:Arabidopsis CaMs and CMLs [J]. Trends Plant Sci, 10(8):383-389.
OHTA M, GUO Y, HALFTER U, et al., 2003. A novel domain in the protein kinase SOS2 mediates interaction with the protein phosphatase 2C ABI2 [J]. PNAS, 100(20):11771-11776.
QUAN R, LIN H, MENDOZA I, et al., 2007. SCABP8/CBL10, a putative calcium sensor, interacts with the protein kinase SOS2 to protect Arabidopsis shoots from salt stress [J]. Plant Cell, 19(4):1415-1431.
ROUNDS CM, BEZANILLA M, 2013. Growth mechanisms in tip-growing plant cells [J]. Ann Rev Plant Biol, 64:243-265.
SHI J, KIM KN, RITZ O, et al., 1999. Novel protein kinases associated with calcineurin B-like calcium sensors in Arabidopsis [J]. Plant Cell, 11(12):2393-2405.
WU G, GU Y, LI S, et al., 2001. A genome-wide analysis of Arabidopsis Rop-interactive CRIB motif-containing proteins that act as Rop GTPase targets [J]. Plant Cell, 13(12):2841-2856.
XU J, LI HD, CHEN LQ, et al., 2006. A protein kinase, interacting with two calcineurin B-like proteins, regulates K+ transporter AKT1 in Arabidopsis [J]. Cell, 125(7):1347-1360.
YANG Z, 2002. Small GTPases versatile signaling switches in plants [J]. Plant Cell, 14(Suppl. 1):375-388.
YANG Z, 2008. Cell polarity signaling in Arabidopsis [J]. Ann Rev Cell Dev Biol, 24:551-575.
