水深梯度对钝脊眼子菜生长和繁殖的影响
2019-09-10赫丁轩李肖夏郭友好
赫丁轩 李肖夏 郭友好

摘 要:水深是影響湿地植物生长和分布的一个重要限制性因子,该研究以具有典型异型叶性的钝脊眼子菜(Potamogeton octandrus)为对象,通过分析浅水处理(10 cm 和30 cm)和深水处理(50 cm和70 cm)4个水深梯度下幼苗生长、生物量及繁殖策略等,探讨钝脊眼子菜在不同水深条件下的适应机制和表型可塑性。结果表明,钝脊眼子菜植株到达水面后出现异型叶,相对生长率显著降低,且与水深梯度呈正相关。钝脊眼子菜的株高随着水深的增加呈现爆发式的增长,10 cm水深的总茎长显著低于其他水深处理。水深对节间数也有显著性影响,其中,30 cm组处理节间数最多;而深水处理组的节间长和生物量均显著高于浅水处理组。分蘖数在4组处理之间均表现出显著性差异,随着水深的增加呈现显著性递减。生物量和地上生物量分配则随着水深增加而明显增加。水深处理对有性生殖指标有显著性影响,水深的增加抑制其有性繁殖。其中,10 cm条件下无花序形成,50 cm水深下的花粉量、P/O比和花序数显著高于其他处理组,且深水处理的结实数和结实率均显著高于30 cm组。这表明钝脊眼子菜可通过调整形态可塑性和生物量分配,并采取不同的繁殖策略,以达到对水深的最佳适应,其中最适水深生长范围在50 cm左右。
关键词:钝脊眼子菜, 表型可塑性, 水深, 异型叶, 繁殖策略, 湿地生态
中图分类号:Q945.5
文献标识码:A
文章编号:1000-3142(2019)06-0794-08
Abstract:Water depth is an important limiting factor affecting the growth and distribution of wetland plants. In this study, Potamogeton octandrus with typical heterophylly was selected as the research object. To investigate the adaptive mechanism and phenotypic plasticity of P. octandrus under different water depth conditions, the seedling growth, biomass, and reproduction strategies under the four water depth gradients of shallow water treatments (10 cm and 30 cm) and deep water treatments (50 cm and 70 cm) were studied. The results showed that heterophyllous leaves appeared after the plants transferred from underwater to aerial condition, and the relative growth rate decreased significantly, which was also positively correlated with the water depth gradient. The shoot height showed an explosive growth with the increase of water depth, and the stem length in 10 cm water depth was significantly lower than those in other water depth treatments. The water depth also had a significant effect on the number of internodes, among which the number of internodes was the most in the 30 cm treatment, while the internode length and biomass in the deep water treatments were significantly higher than those in the shallow water treatments. The number of branch showed significant diffe-rences among the four treatments, and showed a significant decrease with the increase of water depth. While the biomass and aboveground biomass allocation increased significantly with the increase of water depth. Water depth treatment had a significant effect on sexual reproduction indexes, and the increase of water depth inhibited the sexual reproduction. No inflorescence was formed under 10 cm treatment. The pollen production, P/O ratio and the number of inflorescence in 50 cm water depth were significantly higher than those in other treatments, moreover, the seed number and seed set of the deep water treatments were significantly higher than those of the 30 cm group. Comprehensive stu-dies indicate that P. octandrus can be adapted to the water depth by adjusting the morphological plasticity and biomass allocation to adopt different reproduction strategies, and the optimum water depth range is about 50 cm.
Key words:Potamogeton octandrus, phenotypic plasticity, water depth, heterophylly, reproduction strategy, wetland ecology
同一基因型在不同环境下而产生不同表型的现象即表型可塑性,是生物有机体对环境变化的一种适应(Bradshaw,1965)。水深是影响水生植物生长和分布的一个重要环境因子,水深通过调节光照、基质、水体透明度等因素影响水生植物的生长,以无性繁殖为主的水生植物通过形态、生物量分配和繁殖的改变来适应水深的变化,从而减轻这种胁迫作用所带来的危害(Clevering & Hundscheid,1998;罗文泊等,2007)。植株大小、叶柄伸长、茎长、分蘖数和异型叶的分化等结构特征都具有形态可塑性。例如,菹草茎随水深的增加而延长,使光合作用器官升高到水面上并形成通气组织以减少对氧气的限制(何伟等,2009;陈正勇等,2011)。繁殖的变化主要包括改变花期、花序长度及繁殖器官的数量和质量。菰的基部根状茎分蘖数随水深加深而显著减少,完全淹没处理提前了其开花日期,且增加花序数(Wang et al.,2014)。辣蓼在水淹时选择减少根茎芽数和繁殖克隆生物量,在干旱水深时选择增加克隆繁殖的投入策略以适应干旱胁迫(李亚芳,2015)。随着水深的增加,湿地植物会分配更多的生物量到地上部分,以利于植物的快速伸长生长和有性繁殖。不同植物对水深变化的响应机制是植物提高自身对环境适应能力的表现,有利于植物克服异质性环境而最大限度的进行生长和繁殖以保持种群的稳定性和持续性(Philbrick & Les,1996;陈静蕊等,2011)。
沉水植物是一类与水环境关系密切的生态类群,其独特的进化历史、生活史特征以及水环境关系成为研究的热点问题(刘洋等,2017)。在一些沉水植物中存在异型叶这种独特的表型可塑性,尤其是处于不同水深会分化为不同的叶型(Minorsky,2003)。尽管目前对水深梯度条件下的水生植物的形态适应研究较多,但是关于具有典型异型叶沉水植物的研究相对较少。因此,本研究选取具有典型异型叶现象的钝脊眼子菜(Potamogeton octandrus)作为研究对象。眼子菜科眼子菜属的钝脊眼子菜是一种一年生沉水植物,生于池塘、缓流河沟中,具有适应性强的特点,在个体发育过程中叶片类型的发育因营养期和生殖期而不同。调查研究4个水深梯度对钝脊眼子菜的幼苗生长、生物量及植物繁殖等方面的作用,通过测定不同生长和繁殖的变化特点以探讨钝脊眼子菜处于不同水深条件下的适应机制和表型可塑性。
1 材料与方法
1.1 材料和试验设计
试验选在云南省大理市新华村黑龙潭附近的田地进行(100°10′37″ E,26°37′0″ N),海拔为2 100 m。试验地属亚热带高原气候,年均气温为13.5 ℃,全年日照时间为2 300.2 h,多年平均降水量为966.4 mm,且多集中在6—8月,占全年降水量在80%以上。
研究材料均为生长旺盛的钝脊眼子菜幼年植株,分成无性系单株种植。植株初始地上部分高度为(9.93±1.17) cm,初始根长(6.46±1.16) cm。分蘖种植植株于高93.5 mm,直径75 mm的塑料盆中。根据花盆上端开口距离水面的距离,设计了浅水处理(10、30 cm)和深水处理(50、70 cm)观察植株最适水深范围。2015年5月9日,将筛选的幼苗植株种入塑料盆中,每盆种1株,共120盆。随后,用石子将植株固定于试验容器中,将试验容器随机分成4组,每组30盆,放置于4个大塑料桶(高90 cm,直径50 cm)中,每个大塑料桶为一个区组。将植株定植后在10 cm水深的塑料桶中预培养5 d,待植株适应并恢复状态后,将其中一个大塑料桶中水深始终保持在10 cm,其余3个大塑料桶内的水深分别调至30、50和70 cm。试验期间,根据桶中水深变化人为添加水,使其与试验设计的水深误差小于2 cm。试验持续时间为两个月(2015年5月13日至7月17日),在6月11日换一次水,防止浮游植物和附着藻类过度生长对试验的干扰。
1.2 试验方法
2015年5月13日开始,每隔3 d于不同水深的花盆中取样测定株高,监测钝脊眼子菜不同水深处理梯度下的株高生长变化,以及异型叶的生长变化情况,共取样20次。并于试验第70天,采集不同水深条件下完整的30个植株,用清水将黏在根上的泥土沖洗干净,带回试验室,分别编号。先摘除所有植株花序,统计花序数和坐果花序结实数后,将花序与其余地上部分(茎、叶)在65 ℃烘箱中烘48 h后的总重作为地上生物量,并测定地下部分生物量(根、地下茎)、单株生物量、总茎长(主茎本身长度和所有侧枝的长度之和)、总节数(主茎本身节数和所有侧枝的节数之和)、地下茎上的分蘖数,并进一步计算每个处理的平均节间长和平均节间生物量。
在盛花期,从不同的植株随机收集未开放的新鲜花序,每个处理的30个植株各取1个花序,分别独立存放于EP管并用70%酒精溶液固定。在试验室内,每个花序随机取1朵花,将每朵花的柱头和花药用解剖针破碎后置于2 mL EP管,加蒸馏水至2 mL,并用胶头滴管吹打成均匀的浑浊液。用移液枪取50 μL花粉溶液置于载玻片上,在光学显微镜下数出液滴中全部的花粉数量,每朵花取3个样本计数,根据稀释倍数计算出每朵花的花粉产量。钝脊眼子菜为单胚珠心皮离生,其胚珠数即每朵花中的雌蕊数,单花花粉量除以单花胚珠数计算出每朵花的花粉-胚珠比(P/O)。
针对每个处理的30个植株,摘取所有已坐果的自然花序,记录整个花序的全部花朵的结实数,花序总结实数除以该花序总心皮数记为该花序的结实率。
1.3 数据处理
所有分析均使用统计学软件SPSS20.0,对单株钝脊眼子菜的株高、总茎长、平均节间长等测量指标进行单因素方差(One-way ANOVA)分析,以各项指标作为因变量,不同处理间的比较则以分组作为固定因子。平均节间生物量对数转换后符合方差齐性,采用单因素方差分析;单株生物量指标经过对数转换之后依然不符合方差齐性,因此采用非参数检验(Kruskal Wallis Test)。如果ANOVA差异显著,则使用Tukey多重比较法进行组间比较;如果是非参数检验的结果有显著性差异,则使用Mann-Whitney检验对处理之间进一步分析。经过对数转换的分蘖数以及节间数、花序数、花粉数和结实数等记数指标采用广义线性模型General linear model(GLM)进行分析,检验各组水深处理差异显著性。所有检验显著性水平为P<0.05。
2 结果与分析
2.1 不同水深条件下钝脊眼子菜的生长变化情况
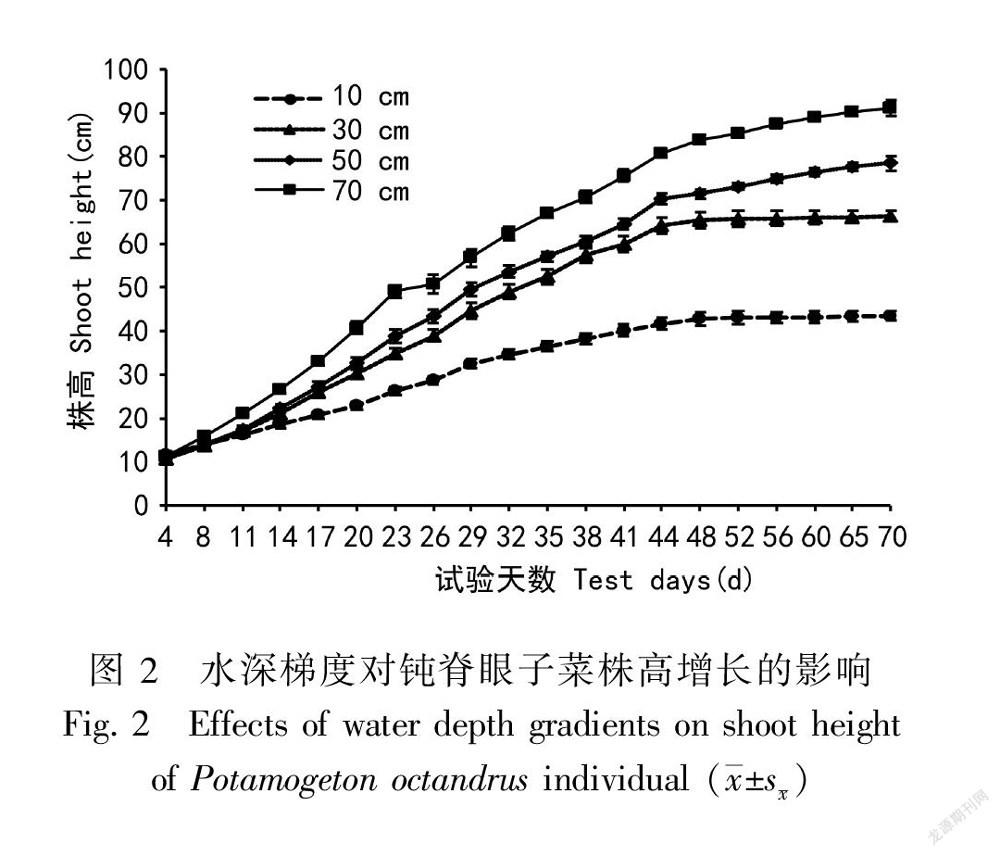
通过对不同水深处理下钝脊眼子菜的生长状况进行监测发现,不同水深处理对钝脊眼子菜的生长具有明显的影响。从图1可以看出,钝脊眼子菜生长分可为两个阶段:第1阶段内(试验第4天至第44天)和第2阶段(试验第44天至第70天)。在第1阶段,4种不同水深处钝脊眼子菜株高均表现为快速生长,植株处于营养时期且位于水下多产生线形或披针形的沉水叶,无柄,叶长(36.42±1.46) mm,宽(0.87±0.04)mm,叶片厚度(0.09±0.02) mm,全缘,先端渐尖(图1:A)。在第2阶段,4种不同水深处钝脊眼子菜的株高均已超过水深处理的高度,之后生长速率明显下降,此时植株向生殖期转变,植株的茎延伸至水面,其顶端分生组织形成椭圆形或矩圆形的浮水叶,叶片革质,长(11.37±0.40) mm,宽(8.15±0.30) mm,叶片厚度(0.26±0.02) mm,叶柄长(14.75±0.75)mm(图1:B)。由此可以看出,从营养期向生殖期过渡时,钝脊眼子菜异型叶的形态变化非常明显,浮水叶的长宽比(L/W)显著低于沉水叶,浮水叶的叶厚度和叶面积都大于沉水叶。
从图2可以看出,钝脊眼子菜在阶段1的相对生长速率明显高于阶段2。其中,在70 cm水深处理下钝脊眼子菜平均株高增加最明显,试验第4天钝脊眼子菜平均株高为(11.17±0.27) cm,第44天平均株高为(80.7±1.04)cm,第70天平均株高为(91.19±1.79) cm,因此,第1阶段钝脊眼子菜相对生长率平均为1.74 cm·d-1,第2阶段平均速率为0.4 cm·d-1。在10 cm水深处理下钝脊眼子菜平均株高生长变化最小,两个阶段的平均相对生长率分别为0.75 cm·d-1和0.07 cm·d-1。30 cm和50 cm水深处理组的平均株高生长变化介于70 cm和10 cm之间,第1阶段钝脊眼子菜平均相对生长率分别为1.34 cm·d-1和1.48 cm·d-1,第2阶段钝脊眼子菜的平均相对生长率分别为0.08 cm·d-1和0.31 cm·d-1。
2.2 水深对形态生长指标的影响
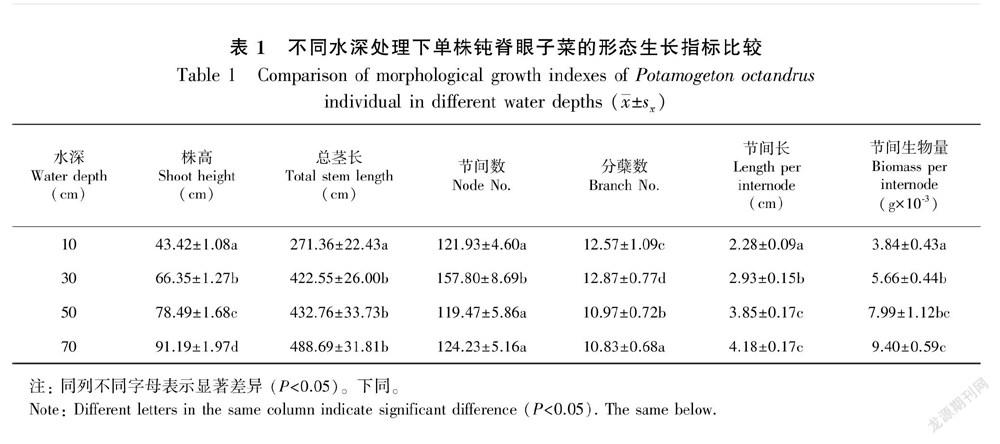
表1显示了6个形态生长指标在不同水深处理间的比较结果。钝脊眼子菜的株高在4个不同处理间均表现出显著差异性(F3,116=215.898,P<0.001),并呈现爆发式的增长。水深处理为10 cm的平均总茎长为271.36±22.43 cm,显著低于其他3组处理(F3,116=10.394,P<0.001),且其他3组处理间均无显著差异性。水深对单株钝脊眼子菜的节间数也有显著性影响(Wald χ2=23.808,P<0.001),30 cm组处理节间数最多,为157.8±8.69节,其他3组处理间并无显著差异。4组不同水深处理的分蘖数均存在显著差异性(Wald χ2=51.549,P<0.001),随着水深增加分蘖数表现出递减趋势。節间长和节间生物量在不同水深处理之间均表现出显著性差异(节间长为F3,116=37.611,P<0.001;节间生物量为F3,116=18.366,P<0.001),深水处理组的节间长和生物量均无显著性差异,且均显著高于浅水处理组。
2.3 水深对生物量及分配的影响
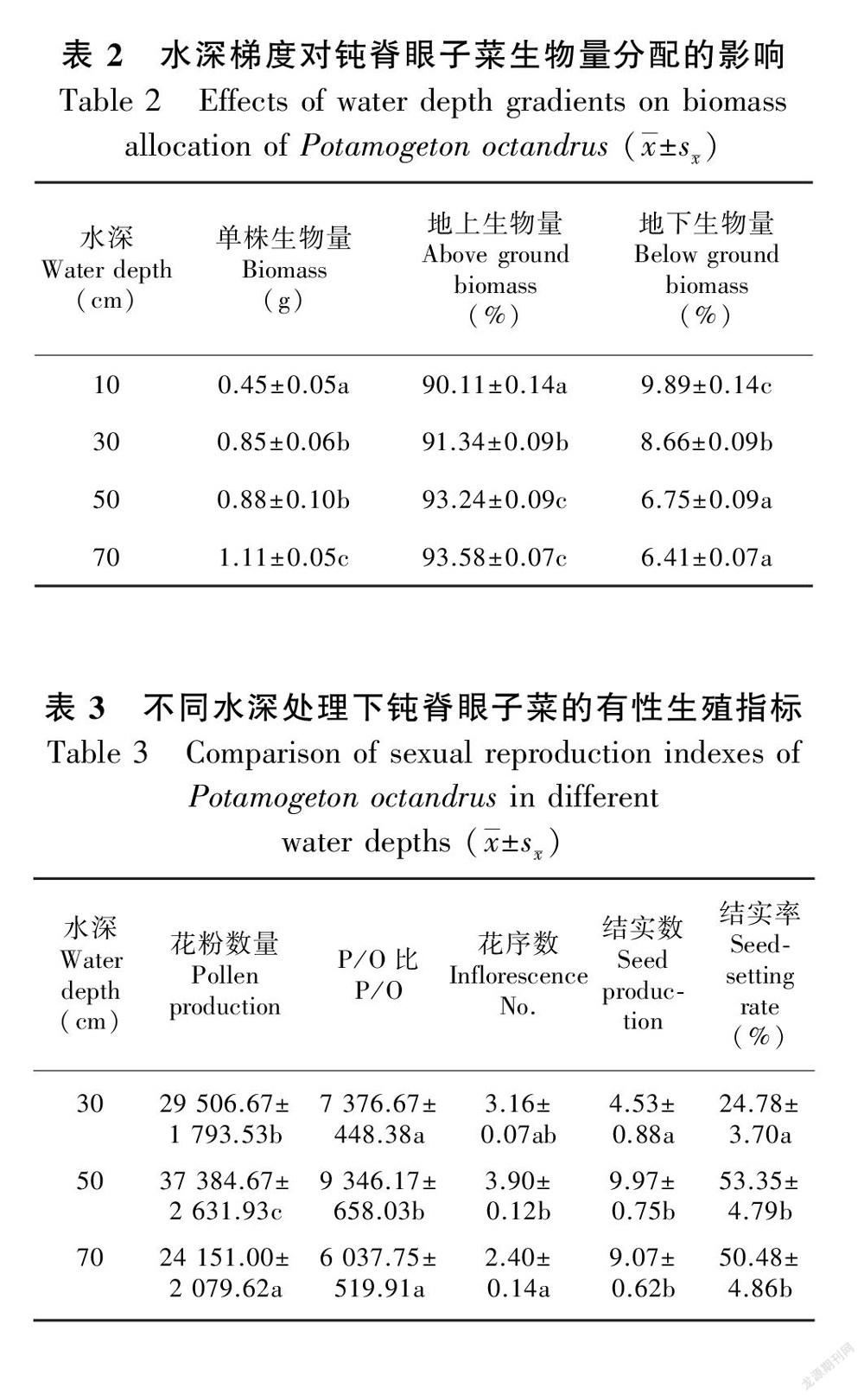
从不同水深梯度下生物量的变化(表2)可以看出,单株钝脊眼子菜的生物量随着水深的升高而显著增长(Kruskal Wallis χ2=42.948,P<0.001)。其中,在水深70 cm处,单株生物量为(1.11±0.05) g,显著高于其他水深处理;而在10 cm深度条件下的生物量为(0.45±0.05) g,显著低于其他处理。
水深处理显著影响钝脊眼子菜的地上生物量(茎、叶及花果序)(Kruskal Wallis χ2=100.071,P<0.001)和地下生物量(根、地下茎)(Kruskal Wallis χ2=100.071,P<0.001)(表2)。随着水深梯度的增加,钝脊眼子菜地上部分的生物量分配比例由90.11%增加到93.58%,分配到地下部分的生物量比例由9.89%减少到6.41%。
2.4 水深对有性生殖指标的影响
试验第70天,水深处理10 cm组植株仍未有花序形成,因此在统计花粉数和结实数时排除了这个处理。单花花粉量在组间显示出显著差异性(Wald χ2=8.934,P=0.011,表3),其中水深处理50 cm组最多,为37 384.67 ± 2 631.93,显著高于另两个处理组。P/O比在不同处理之间有极显著不同水深条件下,钝脊眼子菜的总花序数有显著差异(Wald χ2=143,P<0.001,表3),50 cm处理条件下的总花序数为3.9 ± 0.12,显著高于另两个处理组。此外,不同水深处理对花序的结实数和结实率均有显著性影响(结实数:Wald χ2=32.362,P<0.001;结实率:Kruskal Wallis χ2=19.975,P<0.001),深水处理组的结实数和结实率均显著高于30 cm组,且这两组间无显著性差异。
3 讨论
3.1 水深对钝脊眼子菜生长的影响
水深是影响湿地植物生长和分布的一个重要的限制性因子,以无性繁殖为主的水生植物通过生物量分配和形态可塑性,以适应水深的变化从而减轻这种胁迫作用所带来的危害 (Clevering& Hundscheid,1998;吴海英等,2017)。本研究发现,钝脊眼子菜在不同环境中通过快速的调整形态可塑性、生物量分配和采取不同的繁殖策略,以达到对局部环境的最佳适应。综合水深梯度对植株生长、生物量和繁殖的影响特点,钝脊眼子菜的最适水深生长范围在50 cm左右,水深的增加则抑制其有性繁殖。
不同水深条件下,虽然第1阶段内植株的相对生长率明显高于第2阶段,植株到达水面后相对生长率显著降低,说明植物形态可塑性的调整需要一定的时间(Edwards et al.,2003),并以此适应环境来获取光资源。且两个阶段内植株生长速率均与水深处理呈正相关,并在70 cm水深处理下达到最大。第1阶段达到1.74 cm·d-1,第2阶段只有0.4 cm·d-1,但是4组水深处理都是在第44天从第1阶段进入第2阶段,因此植株响应水深胁迫并能够适应环境的速度是一样的,即水深胁迫越强,响应的速度越快。第1阶段钝脊眼子菜位于水下只有沉水叶,第2阶段时植株由水下生长至水面,并在茎端生成浮水叶,这种同一植株长出不同叶型,即异型叶性也被认为是植物适应不同水环境的一种表型可塑(Wells & Pigliucci,2000)。有研究发现在眼子菜属的异型叶中,浮水叶比沉水叶单位面积具有更多的叶绿素(Chritensen & Jensen,1995),空气中浮水叶的光合作用效率是沉水叶的10倍,而在水下,沉水叶的光合作用效率提高两倍,浮水叶的光合作用降低四倍。所以不同的叶型在各自的生境中表现出最大的光合效率,且比相对的叶型更好地适应所在的生境。
随着水深的增加,钝脊眼子菜的株高和总茎长相应增加。在不同梯度下,钝脊眼子菜的株高都比其生长区水深较高,一般高出20~40 cm,新叶片的持续补充和主茎的伸长增加了光合组织的比例,促进了对光辐射的吸收,同时使茎伸长至水面附近确保浮水叶能将花序托出水面,以保证有性生殖的成功。在浅水情况下,钝脊眼子菜的分蘖数多而茎长较短,随着水深的增加,植株改变了形态结构,分蘖数减少而茎的长度增加。这种植物茎的快速生长反应可能是由细胞的分化和细胞的伸长生长引起的(Grace,1989;Kende et al.,1998;Vretare & Weisner,2000)。取样时发现在不同水深条件下,钝脊眼子菜的节间数和平均节间长也有差异,30 cm组节间数最多,深水组节间数相对较少,且随着水深的增加,茎中部的节间长度增加。由此可见,在深水弱光情况下,钝脊眼子菜是通过增加节间长度而不是增加节间数以适应深水环境的。许多水生植物都具有通过增加节间长度来适应淹水反应的共同特征(Voesenek & Blom,1989),植物组织中乙烯浓度的积累促进了细胞的伸长和细胞分裂(Slater,1999)。上述结果可以看出,钝脊眼子菜对水深梯度的适应性很强,具有明显的形态可塑性,已获得生长所需的氧气和光能。
3.2 水深梯度对植物生物量和繁殖的影响
水深的变化会影响水生植物的生物量累积(Mony et al.,2010),而生物量的分配作为植物形成生态策略的关键,反映出植物生长过程中资源分配的特点(Hills et al.,1994)。本研究结果表明,随着水深梯度的增加植物单株总生物量、地上生物量和地上分配比明显上升,钝脊眼子菜在深水条件下将光合碳物质的累计更多地投入到植物的茎和叶。
钝脊眼子菜的地下生物量和地下分配比随着水深梯度的增加而表现出下降趋势,说明浅水处理下植株对根系的资源分配较高,这是由于浅水处理时光照充足,钝脊眼子菜通过增加地下部分根系的大量生长,以获取更多的营养。深水处理时,钝脊眼子菜为获得更多的光照,植株增加更多的能量分配到地上部分的生长,同时增加与空气的接触面积,并相应减少地下部分根的扩展以减少呼吸消耗(闫道良等,2013)。10 cm组分蘖数显著高于其他组而花果期延迟,这直接影响到植株的有性繁殖能力。在适宜的环境下,植物生活时间较长,形成大量的无性克隆体进行营养生长并推迟开花,这种生殖时间和分配的可塑性保障了物种的种群扩张,最大限度提高其适应性(Galloway,1995)。当环境中养分或水分匮乏时,植物寿命短且开花早有利于繁殖的效率(Sultan,2000)。这说明在资源有限的环境下,植物向无性繁殖投入过多,会降低分配到有性繁殖的投入,反之亦然。
钝脊眼子菜通过地上与地下部分生物量、无性繁殖与有性繁殖等各个组织间的分配表现出明显的权衡关系(trade-off)。植物对于某一性状或行为投资分配的多,必然会减少其对于其他性状的投入,由于资源限制而导致的权衡关系被看作是生活史性状进化的普遍规律(Strand & Seb,2001;Drunen & Dorken,2012)。这种不同水深条件下植物资源分配样式的差异,可看作是有机体通过表型对环境可塑性的综合反应,以实现在其生境内必须资源的获取(Hutchings & Kroon,1994)。王海洋等(1999)在研究水深梯度影响湿地植物生长繁殖和生物量分配的研究中发现,不同植物间生物量分配样式和生长繁殖受水深影响的程度也有所不同,这种反应的差别不仅与水因子等生境有关,也与植物的生态策略有一定关系。遗传因子在植物繁殖策略的进化中也起到作用,因此表型受基因型、环境因素和发育过程共同作用的影响,值得从核酸和蛋白质水平对不同居群不同生境下植物的遗传分化程度进行研究。
参考文献:
BRADSHAW AD, 1965. Evolutionary significance of phenotypic plasticity in plants [M]. CASPARI EW, THOBAY JM. Advances in genetics. Salt Lake:Academic Press, 13(1):115-155.
CHEN JR, WANG QL, LI M, et al., 2011. Morphological responses of Carex argyi to water fluctuation in Swan Islet wetland [J]. Plant Sci J, 29(4):474-479. [陳静蕊, 王秋林, 黎明, 等, 2011. 红穗苔草对天鹅洲湿地淹水时间变化的形态学响应 [J]. 植物科学学报, 29(4):474-479.]
CHEN ZY, WANG GX, WU XD, et al., 2011. Ecological adaptability of Potamogeton crispus under different water depths [J]. J Lake Sci, 23(6):942-948. [陈正勇, 王国祥, 吴晓东, 等, 2011. 不同水深条件下菹草(Potamogeton crispus) 的适应对策 [J]. 湖泊科学, 23(6):942-948.]
CHRITENSEN HF, JENSEN KS, 1995. Comparative kinetics of photosynthesis in floating and submerged Potamogeton leaves [J]. Aquat Bot, 51(1):121-134.
CLEVERING OA, HUNDSCHEID M, 1998. Plastic and non-plastic variation in growth of newly established clones of Scirpus maritimus L. (Bolboschoenus) grown at different water depths [J]. Aquat Bot, 62(1):1-17.
EEWARDS AL, LEE DW, RICHARDS JH, 2003. Responses to a fluctuating environment:Effects of water depth on growth and biomass allocation in Eleocharis cellulosa Torr. (Cyperaceae) [J]. Can J Bot, 81(9):964-975.
GALLOWAY LF, 1995. Response to natural environmental heterogeneity:Maternal effects and selection on life-history characters and plasticities in Mimulus guttatus [J]. Evolution, 49(6):1095-1107.
GRACE JB, 1989. Effects of water depth on Typha latifolia and Typha domingensis [J]. Am J Bot, 76(5):762-768.
HE W, WANG GX, YANG WB, et al., 2009. Growth response of Potamogeton crispus to water depth gradient [J]. Chin J Ecol, 28(7):1224-1228. [何偉, 王国祥, 杨文斌, 等, 2009. 水深梯度对菹草生长的影响 [J]. 生态学杂志, 28(7):1224-1228.]
HILLS JM, MURPHY KJ, PULFORD ID, et al., 1994. A method for classifying European riverine wetland ecosystems using functional vegetation groups [J]. Funct Ecol, 8(2):242-252.
HUTCHINGS MJ, KROON HD, 1994. Forging in plants-the role of morphological plasticity in resource acquisition [J]. Advan Ecol Res, 25:159-238.
KENDE H, VAN KE, CHO HT, 1998. Deepwater Rice:A model plant to study stem elongation [J]. Plant Physiol, 118(4):1105-1110.
LI YF, 2015. Effects of water levels on the growth and reproductive characteristics of dominant plants in the Dongting Lake wetlands [D]. Changsha:Central South University of Forestry and Technology. [李亚芳, 2015. 洞庭湖湿地克隆植物繁殖分配对水位的响应 [D]. 长沙:中南林业科技大学.]
LIU Y, FU WL,CAO Y, et al., 2017. Study on the functional traits of submerged macrophytes [J]. Plant Sci J, 35(3):444-451. [刘洋, 付文龙, 操瑜, 等, 2017. 沉水植物功能性状研究的思考 [J]. 植物科学学报, 35(3):444-451.]
LUO WB, XIE YH, SONG FB, 2007. Survival strategies of wetland plants in flooding environments [J]. Chin J Ecol, 26(9):1478-1485. [罗文泊, 谢永宏, 宋凤斌, 2007. 洪水条件下湿地植物的生存策略 [J]. 生态学杂志, 26(9):1478-1485.]
MINORSKY PV, 2003. Heterophylly in aquatic plants [J]. Plant Physiol, 133:1671-1672.
MONY C, MERCIER E, BONIS A, et al., 2010. Reproductive strategies may explain plant tolerance to inundation:A mesocosm experiment using six marsh species [J]. Aquat Bot, 92(2):99-104.
PHILBRICK CT, LES DH, 1996. Evolution of aquatic angiosperm reproductive systems [J]. Bioscience, 46(11):813-826.
SLATER J, 1999. Growth and resource allocation in response to flooding in the emergent sedge Bolboschoenus medianus [J]. Aquat Bot, 63(2):145-160.
STRAND JA, SEB W, 2001. Morphological plastic responses to water depth and wave exposure in an aquatic plant (Myriophyllum spicatum) [J]. J Ecol, 89(2):166-175.
SULTAN SE, 2000. Phenotypic plasticity for plant development, function and life history [J]. Trends Plant Sci, 5(12):537-542.
VAN DRUNEN WE, DORKEN ME, 2012. Trade-offs between clonal and sexual reproduction in Sagittaria latifolia (Alismataceae) scale up to affect the fitness of entire clones [J]. New Phytol, 196(2):606-616.
VOESENEK LACJ, BLOM CWPM, 1989. Growth responses of Rumex species in relation to submergence and ethylene [J]. Plant Cell Environ, 12(4):433-439.
VRETARE V, WEISNER SEB, 2000. Influence of pressurized ventilation on performance of an emergent macrophyte (Phragmites australis) [J]. J Ecol, 88(6):978-987.
WANG HY, CHEN JK, ZHOU J, 1999. Influence of water level gradient on plant growth, reproduction and biomass allocation of wetland plant species [J]. Acta Phytoecol Sin, 23(3):78-83. [王海洋, 陳家宽, 周进, 1999. 水位梯度对湿地植物生长繁殖和生物量分配的影响 [J]. 植物生态学报, 23(3):78-83.]
WANG QL, CHEN JR, LIU F, et al.,2014. Morphological changes and resource allocation of Zizania latifolia (Griseb.) Stapf in response to different submergence depth and duration [J]. Flora, 209 (5-6):279-284.
WELLS CL, PIGLIUCCI M, 2000. Adaptive phenotypic plasti-city:The case of heterophylly in aquatic plants [J]. Perspect Plant Ecol Evol Syst, 3(1):1-18.
WU HY, CAO Y, GUO ZC, et al., 2017. Effects of waterlogging stress on growth and physiological characteristics of Phalaris arundinacea seedlings [J]. Guihaia, 37(9):1161-1167. [吴海英, 曹昀, 国志昌, 等, 2017. 淹水胁迫对虉草幼苗生长和生理的影响[J]. 广西植物, 37(9):1161-1167.]
YAN DL, JIN SH, XIA GH, et al., 2013. Response of clonal growth and biomass allocation of 3 aquatic plant species to different inundation levels [J]. J SW For Coll, 33(2):10-14. [闫道良, 金水虎, 夏国华, 等, 2013. 3种湿地植物克隆生长及其生物量对不同水淹的响应 [J]. 西南林业大学学报, 33(2):10-14.]
