生防菌XP1对香蕉枯萎病防效及土壤细菌群落多样性的影响
2019-09-10马凤娟孙杰徐培智解开治李夏顾文杰卢钰升徐如玉
马凤娟 孙杰 徐培智 解开治 李夏 顾文杰 卢钰升 徐如玉

摘要:【目的】研究生防菌解淀粉芽孢種菌XP1对香蕉根际土壤细菌群落多样性的影响,揭示生防菌防治香蕉枯萎病的土壤微生物学机制,为利用生防菌防控香蕉枯萎病提供理论参考。【方法】试验设3个处理:CK,健康蕉园+每株0.5 L灭菌PDA培养基灌根+每株0.5 L灭菌LB培养基灌根;DI,健康蕉园+香蕉枯萎病菌(菌液浓度1×109个/mL,接种量0.5 L/株)+每株0.5 L灭菌LB培养基;TR,健康蕉园+香蕉枯萎病菌(菌液浓度1×109个/mL,接种量0.5 L/株)+生防菌(菌液浓度1×109个/mL,接种量0.5 L/株)。利用Illumina Hiseq 2500高通量测序平台,对3个处理香蕉植株的根际土壤分别提取总DNA并构建16S rDNA基因文库,进而对微生物群落多样性进行分析。【结果】生防菌XP1对香蕉枯萎病的防效试验结果显示,CK处理香蕉植株无发病现象;DI处理在接种香蕉枯萎病菌后蕉园的发病率达95.0%,病情指数为68.3;TR处理接种生防菌后蕉园的发病率为13.3%,病情指数降低至10.8,防治效果达84.2%。共测序获得886890个有效序列,在97%的相似水平下聚类后获得61660个OTUs,归属于40个细菌门。3个处理的OTUs数量表现为CK>DI>TR。变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、OD1、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)是3个处理共有的菌门,其中变形菌门是CK、DI和TR处理的优势菌门,分别占各自相对丰度≥1%物种的32.21%、28.94%和53.78%。TR处理的Shannon指数和Simpson指数均显著低于CK和DI处理(P<0.05,下同),Dominance指数显著大于CK和DI处理,Chao1指数和Observed species指数大于DI处理、小于CK处理;接种生防菌后,TR处理的Chao1指数和Observed species指数较DI处理分别提高7.3%和0.7%。【结论】接种生防菌XP1能有效防控大田香蕉枯萎病的发生,提高香蕉根际土壤细菌物种丰富度和有益菌比例,促进根际土壤细菌群落结构特征向健康土壤细菌群落结构特征的方向演替,具有一定的应用潜力。
关键词: 香蕉枯萎病;根际土壤;生防菌;高通量测序;微生物多样性
中国分类号: S436.681;S476 文献标志码: A 文章编号:2095-1191(2019)09-1981-09
Abstract:【Objective】The study was conducted to reveal the effects of Bacillus amyloliquefaciens XP1 on the diversity of bacterial communities in rhizosphere soil of banana tree, show the soil microbiological mechanism of biocontrol agents and provide theoretical basis for biological control of banana fusarium wilt. 【Method】Three treatments were set up in this study:CK, healthy banana orchard+0.5 L sterilized PDA medium irrigating root per plant+0.5 L sterilized LB me-dium irrigating root per plant;DI, healthy banana orchard+banana fusarium wilt strain(bacterial solution concentration was 1×109/mL, inoculation amount was 0.5 L/plant)+0.5 L per plant sterilized LB medium;TR, healthy banana orchard+banana fusarium wilt strain(bacterial solution concentration was 1×109 /mL, inoculation amount was 0.5 L/plant) and biocontrol agent(bacterial solution concentration was 1×109 /mL, inoculation amount was 0.5 L/plant). Using Illumina Hiseq 2500 high-throughput sequencing platform, total DNA was extracted from the rhizosphere soil of three banana plants treatments and 16S rDNA gene library was constructed to analyze the diversity of microbial communities. 【Result】The control test of XP1 on banana fusarium wilt indicated that there was no diseased banana plants in CK treatment, the incidence of banana orchard in DI treatment after inoculation of banana fusarium wilt fungus was 95.0% with disease index of 68.3. The incidence of banana orchard in TR treatment was 13.3% with disease index of 10.8, and the control effect was 84.2%. A total of 886890 valid sequences were obtained by sequencing, and 61660 OTUs(operational taxonomic unit) belonging to 40 phyla were obtained by clustering at 97% similarity level. The number of OTUs of the three treatments were in the following order:CK>DI>TR. Among them, Proteobacteria, Acidobacteria, Planctomycetes, Chloroflexi, Gemmatimonadetes, OD1, Nitrospirae, Firmicutes, Bacteroidetes, Actinobacteria and Verrucomrobia were the shared bacteria in three treatments. Among them, the dominant bacteria in CK, DI and TR were Proteobacteria, accounting for 32.21%, 28.94% and 53.78% of the species with relative abundance irrigating root per plant 1%. The Shannon index and Simpson index of TR treatment were significantly lower than those of CK and DI treatments(P<0.05, the same below), dominance index was significantly higher than that of CK and DI treatment, Chao1 index and Observed species index of TR treatment were larger than those of DI treatment and less than those of CK treatment. After biocontrol agent inoculation, the Chao 1 index and the Observed species index of TR treatment increased by 7.3% and 0.7%, respectively compared with DI treatment. 【Conclusion】The inoculation of XP1 can effectively prevent the occurrence of banana fusarium wilt in the field, improve the bacterial species richness in rhizosphere soil and proportion of beneficial bacteria, and promote the rhizosphere soil bacterial community succession towards direction of that in healthy soil. Therefore, it has potential in application.
Key words: banana fusarium wilt; rhizosphere soil; biocontrol agent; high-throughput sequencing; microbial diversity
0 引言
【研究意义】香蕉作为热带和亚热带水果在人们的日常生活中扮演着重要角色。近年来,随着香蕉枯萎病的不断加剧和蔓延,已给我国乃至全球香蕉产业带来了重创(肖爱萍和游春平,2005)。香蕉枯萎病是一种极具破坏性的土传病害,其发病过程为尖孢镰刀菌侵染香蕉维管束,维管束腐烂坏死,香蕉枯萎死亡(聂燕芳等,2017)。香蕉枯萎病于1967年首次出现在我国台湾省,随后从广东蔓延至福建,并迅速扩展到海南、广西、云南等其他香蕉种植区(邓铁军等,2015;周维等,2017),严重威胁我国香蕉种植业的发展。目前应对香蕉枯萎病的主要措施有化学防治、物理防治、培育抗病品种、生物防治及田间综合管理等,其中,生物防治措施凭借其对环境污染小、安全程度高、能提高香蕉产量和品质等优点而越来越受到研究者们的重视(丁文娟等,2014;赖朝圆等,2018)。研究发现,土壤细菌的群落结构与香蕉发病率和产量显著相关(Garbeva et al.,2004;Raaijmakers et al.,2009; Zhang et al.,2011;Phili-ppot et al.,2013;Wang et al.,2016),因此,研究土壤细菌群落的多样性对维持土壤健康和抑制植物病害具有重要意义。【前人研究进展】黄珍等(2010)对海南省福山香蕉园香蕉枯萎病发生地和正常种植园的土壤样品进行研究,发现正常香蕉种植区土壤样品的细菌多样性较丰富,其中变形菌门、厚壁菌门和酸杆菌门为主要细菌类群,而香蕉枯萎病发生地土壤以放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)为主要细菌类群。付琳等(2012)研究发现,通过生物有机肥处理后微生物群落结构变得更加优化,可提高香蕉抵抗病原菌的能力。邓晓等(2015)在对香蕉健康植株和患病植株根际细菌群落多样性的比较中发现,患病植株根际的细菌多样性小于健康植株根际的细菌多样性。钟书堂等(2015)发现连续两年施用生物有机肥可明显降低尖孢镰刀菌数量,使蕉园土壤可培养微生物群落结构更加均衡,实现对香蕉枯萎病的防效提升和产量及果实品质的提高。Shen等(2015)通过连续两年施用微生物肥料发现,土壤细菌多样性和微生物群落结构得到优化,从而降低了香蕉枯萎病的发病率。【本研究切入点】目前,针对香蕉枯萎病的研究主要集中在患病蕉园和健康蕉园土壤微生物群落多样性的差异上,对在患病蕉园施入生防菌剂后土壤细菌群落的变化特征研究甚少。【拟解决的关键问题】采用大田区组试验,利用Illumina Hiseq 2500高通量测序平台,研究生防菌XP1接种土壤后对香蕉根际土壤细菌群落多样性的影响,探索生防菌防治香蕉枯萎病的土壤微生物学机制,以期为利用生防菌剂防控香蕉枯萎病提供理论参考。
1 材料与方法
1. 1 试验地概况
试验地位于广东省湛江市徐闻县迈陈镇那种基地(东经110°10′17.90″,北纬20°19′39.90″),气候类型为热带季风气候,年平均气温23.5 ℃,年平均降水量1364 mm。试验区为连续8年种植韭菜的平整地块,土壤类型为砖红壤,土壤理化性质为有机质14.4 g/kg、碱解氮62.3 mg/kg、有效磷(P2O5)38.0 mg/kg、速效钾(K2O)108.6 mg/kg、pH 5.6。
1. 2 试验材料
供试香蕉品种:巴西蕉(Cavendish,cv. Brazilium AAA,香蕉枯萎病感病品种)组培苗。供试病原菌:带有标记绿色荧光蛋白的香蕉枯萎病菌4号生理小种(简写GFP-FOC4),由广东省农业科学院果树研究所李春雨博士馈赠,致病性与野生型菌株一致。供试生防菌:解淀粉芽孢杆菌(Bacillus amyloliquefaciens)XP1,由广东省农业科学院农业资源与环境研究所提供。XP1培养条件:利用PDA和LB混合培养基在28 ℃的培养箱中连续培养5 d,抑菌圈直径为62.5 mm(孙杰,2018);PDA和LB混合培养基配方:马铃薯200 g、葡萄糖(C6H12O6·H2O)20 g、胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、蒸馏水1000 mL。
主要试剂:MOBIO PowerSoil® DNA Isolation Kit试剂盒(货号12888-100)购自北京宝杰罗生物科技有限公司(MOBIO);Premix Taq(E×Taq Version 2.0 Plus)(货号RR902A)、DL15000 DNA Marker(货号3582A)、100 bp DNA Ladder(货号3422A)和DL2000 DNA Marker(货号3247A)购自宝日医生物技术(北京)有限公司(TaKaRa);Primer(订购合成)和Quant-iTTM Broad-Range DNA Assay(货号Q32853)购自美国英杰生命技术有限公司(Invitrogen);琼脂糖(货号111860)购自广州浩玛生物科技有限公司。主要仪器:PCR扩增仪(型号 ABI9600,美国)和Daek reader(型号DR-46B)购自Clare Chemical Research;QubitTM Fluorometer(型号Qubit® 2.0 Fluorometer)購自Invitrogen公司;微型离心机(型号Baygene BG-Qspin#8482)购自Baygene;涡旋混合器(型号QL-901)购自其林贝尔仪器制造有限公司;凝胶成像仪(型号Tanon 4100)购自上海天能科技有限公司。
1. 3 试验方法
1. 3. 1 试验设计 试验设3个处理,每处理3次重复,随机区组排列,共9个小区,小区面积223 m2。其中,CK:健康蕉园+每株0.5 L灭菌PDA培养基灌根+每株0.5 L灭菌LB培养基灌根;DI:健康蕉园+香蕉枯萎病菌(菌液浓度1×109个/mL,接种量0.5 L/株)+每株0.5 L灭菌LB培养基;TR:健康蕉园+香蕉枯萎病菌(菌液浓度1×109个/mL,接种量0.5 L/株)+生防菌(菌液浓度1×109个/mL,接种量0.5 L/株)。
香蕉枯萎病菌采用灌根法在香蕉7~8片叶、株高40~50 cm时接种。TR处理生防菌剂是在香蕉枯萎病菌接种后24 h灌根。香蕉种植密度为60株/223 m2,起垄种植,株行距1.5 m×2.5 m。
1. 3. 2 根际土壤采集方法 土壤样品于DI处理小区95%香蕉植株出现发病症状时进行采集(约移栽后100 d)。参照Zhao等(2016)的根际土壤采集方法,在每小区按发病重度、中度、轻度各采取4株完整植株根际土壤。将采集的根际土壤混合均匀,分成两份,一份约2000 g室温保存,用于土壤理化性质测定;一份约500 g放入无菌密封袋装入冰盒,带回实验室-80 ℃保存,用于细菌群落多样性分析。
1. 3. 3 理化性质测定方法 土壤pH采用pH计、全磷采用钼锑抗比色法、全氮采用半微量凯氏定氮法、碱解氮采用碱解扩散法进行测定(鲍士旦,1999);土壤速效磷和速效钾分别采用碳酸氢钠浸提钼锑抗比色法和乙酸铵浸提火焰光度法进行测定(张甘霖和龚子同,2012);硝态氮和铵态氮采用流动注射分析法进行测定。
1. 3. 4 防效调查 参照张志红等(2008)的方法将香蕉枯萎病发病情况分为5个等级:0级,植株无枯黄症状;1级,植株下部叶片出现轻微的枯黄症状,嫩叶完好,少部分根系轻微褐变,茎部出现水渍状褐变;2级,植株下部叶片出现明显的枯黄症状,但嫩叶完好,根系出现褐变,茎部和假茎部出现水渍状褐变;3级,整株植株出现枯黄症状,根系褐变腐烂,茎部和假茎部褐变连片,少数叶柄出现红褐;4级,植株出现枯萎死亡症状,根系严重褐变腐烂。收获期调查香蕉枯萎病发病率和病情指数,参考Xu等(2004)的方法统计香蕉发病率、病情指数和防治效果。
发病率(%)=发病的植株数/处理植株总数×100
病情指数=∑各级发病数×该级代表数/总数×最高级代表值×100
防病效果(%) =(对照病情指数-处理病情指数)/对照病情指数×100
1. 3. 5 土壤总DNA提取 采用土壤DNA提取试剂盒(MOBIO PowerSoil® DNA Isolation Kit)对土壤样品进行总DNA提取,每个土样设置3个重复,最后把提取的所有DNA混合成一个样品。用1%琼脂糖凝胶电泳检测DNA的纯度和浓度。
1. 3. 6 扩增及产物电泳检测 采用通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACNVGGGTWTCTAA-3')对细菌16S rDNA高变区V4区进行目标片段扩增。PCR反应体系50 μL:2×PCR Mix 25 μL,20 ng/μL DNA模板3 μL,10 mmol/L正、反向引物各1 μL,ddH2O 20 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共进行30个循环;72 ℃延伸 10 min,4 ℃保存。每个样品3个重复,扩增完成后将同一样本的PCR产物进行混合。PCR产物电泳检测:用1%琼脂糖凝胶电泳检测PCR产物的片段长度和浓度,筛选出主带长度在正常范围内(16S V4:290~310 bp)的样品。
1. 3. 7 Pooling及切胶纯化 按照等质量原则,利用GeneTools Analysis Software(Version 4.03.05.0,SynGene)计算各样品PCR产物所需体积后进行混合,并使用EZNA Gel Extraction Kit(OMEGA,USA)凝胶回收试剂盒回收目标片段。
1. 3. 8 建库及测序 按照NEBNext® UltraTM DNA Library Prep Kit for Illumina®(New England Biolabs,USA)标准操作流程进行建库,并对研究构建的扩增子文库采用 Illumina Hiseq 2500平台进行PE250测序。
1. 3. 9 数据处理 分别利用Mothur(Schloss et al.,2009)、Flash(Magoč and Salzberg,2011)和Trimmomatic(Bolger et al.,2014)对测序数据进行质量控制及过滤,得到有效的拼接片段(Clean Tags)。
1. 3. 10 序列处理与分析 利用Usearch以97%的默认相似性将序列聚类成为一个OTU(Operational taxonomic units),再与NCBI数据库进行比对及物种注释。
(1)菌群丰富度(Species richness)指数计算方法(只考虑物种数量):
a. Chao1-the Chao1 estimator:用Chao1算法估计样本中所含OTU数目的指数(Liu et al.,2014)。
Schao1=Sobs+[n1(n1+1)2(n2+1)]
其中,Schao1:估计的OTU数目;Sobs:实际观测到的OTU数目;n1:只含有一條序列的OTU数目(singletons);n2:只含有两条序列的OTU数目(doubletons),以此类推。
b. Observed species:指样本中实际测定得到的OTU数目,可间接反映样品中物种的丰富程度(Chaparro et al.,2014)。
(2)菌群多样性(Species diversity)指数计算方法:
a. Dominance指数:表示随机取两条序列,来自同一个物种的概率。
Ddominance=[p2i]
其中,pi代表OTU(i)在全部OTU中的比例。Dominance 也可定义为1-Simpson’s index。其值在0~1之间。
b. Shannon指数:香农—维纳指数(Shannon-Wiener index)(Yates et al.,2012),用来估算样本中微生物多样性指数之一,值越大说明群落多样性越高。
Hshannon=[-i=1SobsniNlnniN]
其中,Sobs:实际测量出的OTU数目;ni:含有i条序列的OTU数目;N:所有序列数。
c. Simpson指数:辛普森指数(Simpson’s diversity index)(Liu et al.,2014)用来估算样品中微生物的多样性指数之一,Simpson 指数值越大,说明群落多样性越高。
Dsimpson=1-[i=1Sobsnini-1NN-1]
其中,Sobs:实际观测到的OTU数目;ni:含有i条序列的OTU数目;N:所有序列数。
1. 4 统计分析
试验数据采用 Excel 2016进行整理并制图,采用IBM SPAS Statistics 22.0进行统计分析。使用R软件进行Venn图绘制和Alpha多样性指数组间差异分析;基于OTU相对丰度,利用QIIME软件包中的Alpha-rarefaction脚本进行Observed-species指数稀释曲线数据计算,然后利用R软件绘制稀释曲线;基于3种Beta多样性距离矩阵,使用qiime2和ggplot2软件包进行PCoA分析并绘图。基于均一化的OTU丰度,使用R软件vegan包的anosim函数进行Anosim分析。
2 结果与分析
2. 1 生防菌XP1对香蕉枯萎病的防治效果
由表1可知,CK处理香蕉植株无发病现象;DI处理在接种香蕉枯萎病菌GFP-FOC4后蕉园的发病率高达95.0%,病情指数为68.3;TR处理接种生防菌XP1后蕉园的发病率为13.3%,与DI处理相比差异达极显著水平(P<0.01,下同),病情指数降低至10.8,防治效果显著,达84.2%。TR处理香蕉枯萎病发病率较DI处理降低81.7%(绝对值),说明生防菌对香蕉枯萎病菌具有较强的拮抗作用。
2. 2 Observed species指数分析结果
共测序获得886890个序列,在97%的相似水平下聚类后获得61660个OTUs。测序结果显示,3个样品的所有优质序列经聚类注释后归属于40个菌门。从图1可看出,当测序深度达80000个序列时,各处理的Observed species指数曲线趋向平缓,上升速度减缓,说明测序深度已基本覆盖样品中绝大部分物种;在同等测序深度上,无发病现象的CK处理实际观测到的物种数最多,当测序深度达70000个序列时,接种致病菌的DI处理实际观察到的物种数低于CK处理、高于TR处理,随测序深度的加大,接种生防菌的TR处理其实际观测到的物种数略高于DI处理、低于CK处理。
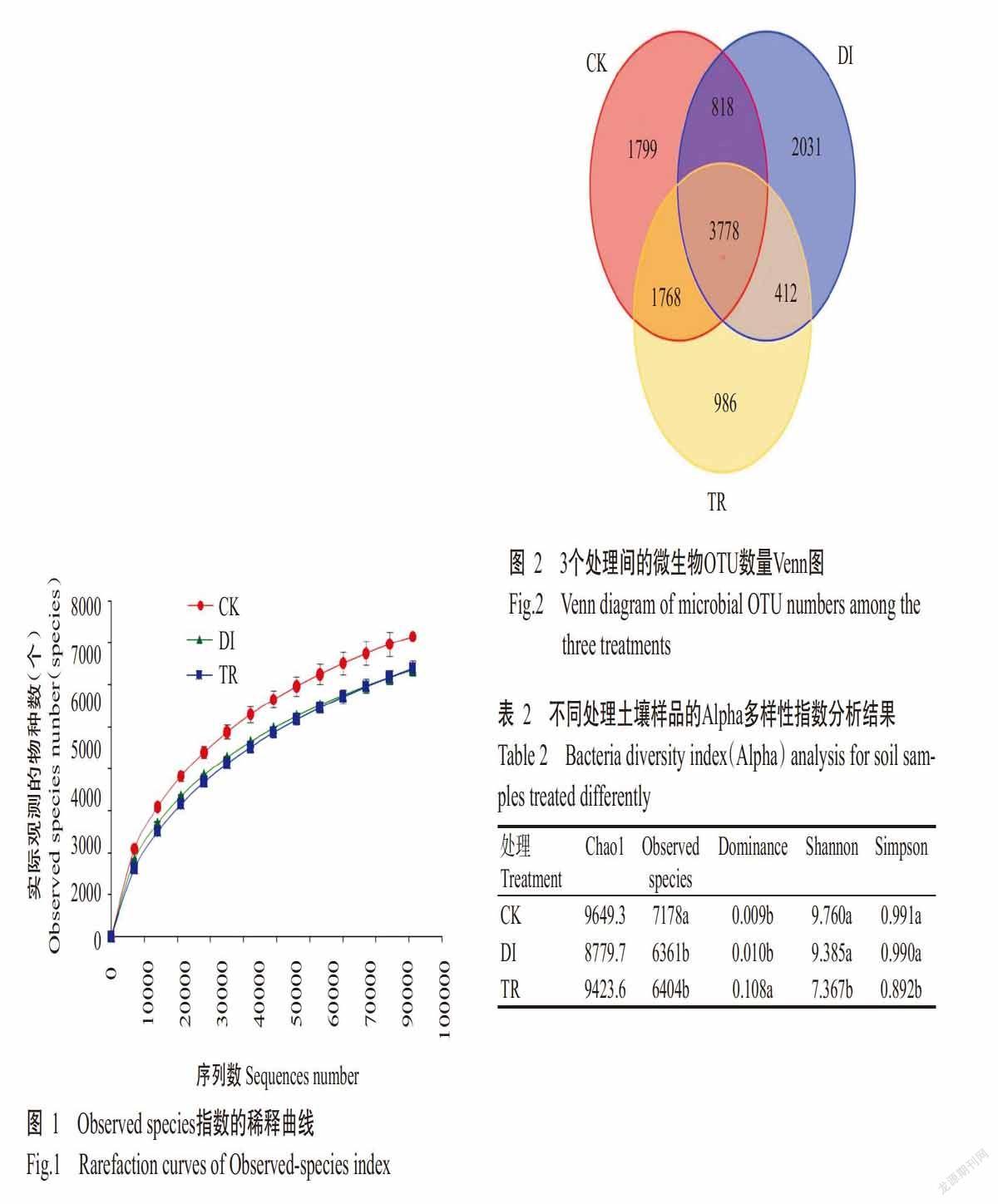
2. 3 OTU聚类分析结果
由图2可看出,CK、DI和TR处理分别有8163、7039和6944个OTUs,其中,CK与DI处理共有4596个OTUs,CK与TR处理共有5546个OTUs,DI与TR处理共有4190个OTUs。三者的OTUs数量表现为CK>DI>TR,说明CK处理中的微生物种类最丰富,DI次之,TR处理中的微生物种类最少。由各处理间共有的OTUs数量可知,CK与TR处理的共有物种种类较多,DI与TR处理共有的物种种类最少,说明TR处理经过生防菌作用后细菌群落内部的物种种类与无发病状况的健康土壤物种种类更接近。
2. 4 Alpha多样性指数分析结果
为保证各处理在同一测序深度,所有序列进行均一化处理后所得的Alpha多样性参数如下表2所示。由表2可知,DI处理除Dominance指数略大于CK处理外,Chao1指数、Observed species指数、Simpson指数和Shannon指数分别比CK小869.6、817、0.001和0.375,表明GFP-FOC4在根际定殖后降低了土壤细菌群落的多样性和丰度。TR处理的Dominance指数显著大于DI和CK处理,说明TR处理细菌物种的分布较DI和CK处理更集中;TR处理的Shannon指数和Simpson指数均显著低于CK和DI处理,说明TR处理的细菌群落多样性和群落均匀性小于CK和DI处理;TR处理的Chao1指数和Observed species指数大于DI处理、小于CK处理,说明TR处理中实际观察到的细菌物种数量大于DI处理、小于CK处理。接种生防菌后,TR处理的Chao1指数和Observed species指数与DI处理相比分别提高7.3%和0.7%,香蕉根际土壤中的细菌物种丰度得到有效提高。
2. 5 门水平上细菌群落结构组成分析结果
各样品相对丰度≥1%的菌门组成情况见图3。由图3可知,变形菌门(Proteobacteria)是CK、DI和TR处理的优势菌门,分别占各自相对丰度≥1%物种的32.21%、28.94%和53.78%,且TR与CK和DI处理间达显著差异水平(P<0.05,下同);酸杆菌门(Acidobacteria)在CK、DI和TR处理中的比重有依次减少的趋势;拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)在DI处理中的比重最大,在TR处理中的比重最小;硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和OD1等在CK处理中的比重均略大于其他两个处理。综上,蕉园发病后降低了硝化螺旋菌门、变形菌门、芽单胞菌门、绿弯菌门、酸杆菌门、OD1和浮霉菌門的丰度,接种生防菌后变形菌门、绿弯菌门、OD1和硝化螺旋菌门的相对丰度有回升趋势;发病后增加了厚壁菌门、拟杆菌门、放线菌门和疣微菌门的丰度,生防菌剂处理后上述菌门的相对丰度均有所下降;变形菌门、厚壁菌门、酸杆菌门、浮霉菌门、放线菌门、绿弯菌门、芽单胞菌门、拟杆菌门、OD1、硝化螺旋菌门和疣微菌门是3个处理共有的菌门种类。
2. 6 细菌群落结构与根际土壤环境因子的冗余分析(RDA)结果
利用细菌群落特征和土壤因子数据矩阵进行冗余分析可综合反映土壤因子与细菌群落间的关系及相关程度。图4中轴1和轴2分别解释了细菌群落构成与环境变量间关系的84.23%和14.33%,两轴共解释了98.56%,较好地解释了细菌群落特征与根际土壤理化性质间的关系。从图4可看出,变形菌门与pH间呈正相关,与其他理化指标间呈负相关;酸杆菌门、芽单胞菌门、绿弯菌门、OD1、浮霉菌门、硝化螺旋菌门、疣微菌门与全磷(Total phosphorus)含量、速效磷(Available phosphorus)含量、速效钾(Avai-lable potassium)含量、全氮(Total nitrogen)含量、碱解氮(Alkaline nitrogen)含量间呈正相关,与pH、铵态氮(Ammonium nitrogen)含量、硝态氮(Nitrate nitrogen)含量间呈负相关;厚壁菌门、拟杆菌门、放线菌门与铵态氮含量、硝态氮含量间呈正相关,与其他理化指标间呈负相关。
2. 7 样品组间主坐标分析结果
从基于加权的主坐标分析结果(图5)可看出,第一主成分(PC1)和第二主成分(PC2)是造成3组样品差异的两个最大特征,贡献率分别为67.02%和27.05%,两者共解释了细菌群落结构差异的94.07%。CK与DI处理在PC2轴上相距较远,说明致病菌FOC4-GFP施入土壤后改变了土壤细菌群落结构;DI与TR处理在PC1轴上相距较远,说明接入致病菌FOC4-GFP再施入生防菌XP1后,改变了土壤细菌群落结构;CK与TR处理在PC1和PC2轴上均有一定距离,说明TR与CK处理间细菌群落构成差异明显。各处理重复间相距较近,处理间距离较远,说明各处理内部間群落结构相似性较高,各处理间群落结构差异明显。
2. 8 组间群落结构差异显著性分析结果
从Anosim相似性分析结果(表3)可知,3个处理间的R为1,说明CK、DI和TR处理组间差异大于组内差异,与PCoA分析结果一致,且统计分析的可信度P为0.003,小于0.05,表明统计具有较高的可信度。
3 讨论
近年来,由于连作、施肥不当和线虫危害等导致的土传病害越来越普遍,给农业生产带来重大经济损失。研究发现,土传病害的发生主要与土壤微生物群落结构失衡、生态环境恶化等有关(van Bruggen and Semenov,2000)。生物防治是目前用于防控香蕉枯萎病最受欢迎的一种绿色安全措施,其原理是利用生防菌来抑制病原菌的繁殖和增长,从而使土壤微生物生态系统维持均衡。
本研究的试验地是8年连作韭菜地,韭菜残留物含有的2-甲基-2-戊烯醛、2-甲基-3-硫醚和2-丙基-3-硫醚等成分可有效抑制田间香蕉枯萎病的发生(王彤,2018)。本研究发现未接种病原菌GFP-FOC4和生防菌XP1的CK处理大田无香蕉植株发病现象;接入病原菌后,香蕉枯萎病的发病率高达95.0%,说明尖孢镰刀菌已入侵到香蕉植株体内,导致香蕉维管束坏死;接种生防菌解淀粉芽孢杆菌后,香蕉枯萎病发病率由95.0%下降到13.3%,防效极显著。究其原因:一是解淀粉芽孢杆菌作为一种生防菌,在其生长过程中能产生多种抑菌物质,具有广泛抑制真菌的功能(Yuan et al.,2013);二是一些土传植物病原菌通常是从宿主根部的伤口或在初生根和次生根的交界处开始入侵,而生防菌对这些根际重要生态位点的占领可有效防止病原菌对植物根系的侵袭(Compant et al.,2005;Timmusk et al.,2005;Zhou et al.,2018)。
已有大量研究报道土传病害会引起作物根际土壤中微生物多样性和均匀性降低。Gorissen等(2004)在对马铃薯青枯病的研究中发现,马铃薯患病后其植株根际土壤细菌多样性明显小于健康植株根际土壤。邓晓等(2015)比较了香蕉健康植株与患病植株根际细菌群落的多样性,发现患病植株根际细菌多样性小于健康植株根际的细菌多样性。肖蓉等(2017)通过高通量测序比较患炭疽病草莓与健康草莓根际土壤细菌群落多样性,发现发病草莓根际土壤的细菌群落丰富度和多样性均小于健康植株根际土壤。本研究中,DI处理的Chao1指数、Observed species指数、Shannon指数和Simpson指数均小于CK处理,说明植株发病后其根际土壤细菌多样性和丰富度均较健康植株根际土壤有所减少;健康植株根际土壤(CK)有更丰富的微生物群落构成,且微生物多样性和丰富度均较高;在接种病原菌的基础上接入生防菌的TR处理,其Chao1指数和Observed species指数较DI处理均有所提高,说明接入生防菌后可增加土壤中细菌的丰富度,很大程度上能阻控物种丰富度不断减小的趋势。
本研究对细菌群落组成的分析发现,变形菌门、厚壁菌门、酸杆菌门、浮霉菌门、放线菌门、绿弯菌门、芽单胞菌门、拟杆菌门、OD1、硝化螺旋菌门和疣微菌门是3个处理共有的11个菌门,变形菌门、酸杆菌门和厚壁菌门是3个处理共有的优势菌门,其中变形菌门在TR处理中所占的比重最高,为53.78%。也有研究表明,变形菌门中有很多对植物生长有益的细菌,其存在与增殖对土壤能量平衡起重要作用(翟婉璐等,2017)。因此,本研究中尽管接种生防菌的TR处理Simpson指数和Shannon指数并未提高,但细菌群落结构变得更加优化。李冬丽等(2011)对海南省临宝县南宝镇健康土样和香蕉枯萎病发病程度高达80%的土样进行分析,发现两种土样均以厚壁菌门、酸杆菌门、变形菌门、黄杆菌门、绿湾菌门和螺旋菌门为主要类群。邓晓等(2015)通过对海南香蕉枯萎病患病植株根际和健康植株根际土壤微生物群落特征进行分析,发现健康植株和发病植株根际土壤的优势菌门均为厚壁菌门,分别高达64%和75%。本研究结果与李冬丽等(2011)、邓晓等(2015)的研究结果基本一致,但本研究识别的菌门种类更多、分类更详细,且优势菌门种群与李冬丽等(2011)、邓晓等(2015)的研究结果有所不同,推测是土壤样品来源和自然环境不同所致。
PCoA分析结果表明,CK和TR处理的细菌群落结构相似性大于DI和TR处理,说明患病蕉园施用解淀粉芽孢杆菌XP1后,细菌群落结构逐渐向健康土壤的方向演替,其原因是生防菌改善了微生物菌群间的相互关系。Saravanan等(2004)研究发现,在香蕉根际接种荧光假单孢菌后,荧光假单孢菌大量定殖,进而取代了病原真菌的生态位,成为根际优势菌群,联合根际拮抗菌代谢物质共同抑制病原菌的生长。冗余分析结果显示,轴1和轴2共解释了98.56%的群落差异性,说明所选理化指标能较好地分析微生物群落结构与环境因子间的相关性。牛世全等(2017)研究发现,pH与拟杆菌门、厚壁菌门和变形菌门呈正相关;速效钾含量与绿弯菌门、芽单胞菌门、浮霉菌门、酸杆菌门和疣微菌门成正相关。本研究结果与之大致相同,不同的是铵态氮和硝态氮含量分别与拟杆菌门和厚壁菌门呈正相关。本研究中,酸杆菌门与土壤全氮和碱解氮含量呈正相关,与Magill和Aber(2000)对森林土壤研究得出的土壤中氮含量的增加会使酸杆菌门的多样性增加相符合。
4 结论
患病蕉园接种生防菌XP1后,XP1能在香蕉根际土壤中定殖和增殖,并通过改善香蕉根际土壤细菌群落结构特征,提升细菌群落物种丰富度和有益菌比例,有效阻控病原菌在香蕉根际的定殖和增殖,使香蕉枯萎病发病率显著降低,具有一定的应用潜力。
参考文献:
鲍士旦. 1999. 土壤农化分析[M]. 北京:中国农业出版社:30-33. [Bao S D. 1999. Soil and agricultrual chemistry analysis[M]. Beijing:China Agriculture Press:30-33.]
邓铁军,李菁,梁旻雯. 2015. 香蕉枯萎病疫情發生防控实践和可持续治理思考[J]. 植物检疫,29(4): 60-63. [Deng T J,Li J,Liang M W. 2015. Study on the control and sustainable management of banana Fusarium wilt[J]. Plant Quarantine,29(4): 60-63.]
邓晓,李勤奋,武春媛,李怡,刘景坤. 2015. 健康香蕉(Musa paradisiaca)植株与枯萎病患病植株根区土壤细菌多样性的比较研究[J]. 生态环境学报,24(3): 402-408. [Deng X,Li Q F,Wu C Y,Li Y,Liu J K. 2015. Comparison of soil bacterial genetic diversity in root zone of banana(Musa paradisiaca) infected with fusarium wilt and non-infected plants[J]. Ecology and Environmental Sciences,24(3): 402-408.]
丁文娟,曹群,赵兰凤,刘小峰,柳影,杨盼盼,李兴华. 2014. 生物有机肥施用期对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报,33(8): 1575-1582. [Ding W J,Cao Q,Zhao L F,Liu X F,Liu Y,Yang P P,Li X H. 2014. Effects of biological fertilizer applications on banana wilt disease and soil microorganisms[J]. Journal of Agro-Environment Science,33(8): 1575-1582.]
付琳,阮云泽,沈宗专,李荣,杨兴明,沈其荣. 2012. 生物有机肥对连作香蕉根际土壤可培养细菌区系的影响[J]. 南京农业大学学报,35(6): 82-88. [Fu L,Ruan Y Z,Shen Z Z,Li R,Yang X M,Shen Q R. 2012. Effects of bio-organic fertilizer on the community structure of culturable bacteria in the rhizosphere soil of a continuous-cropping banana filed[J]. Journal of Nanjing Agricultural University,35(6): 82-88.]
黄珍,谭志琼,阮云泽. 2010 . 香蕉园土壤16S rDNA文库分析[J]. 热带作物学报,31(6): 989-993. [Huang Z,Tan Z Q,Ruan Y Z. 2010. Phylogenetic diversity of bacteria in banana soils determined with 16S rDNA library analysis[J]. Chinese Journal of Tropical Crops,31(6): 989-993.]
赖朝圆,杨越,陶成圆,王一鸣,郭继阳,王蓓蓓,阮云泽,赵艳. 2018. 不同作物—香蕉轮作对香蕉生产及土壤肥力质量的影响[J]. 江苏农业学报,34(2):299-306. [Lai C Y,Yang Y,Tao C Y,Wang Y M,Guo J Y,Wang B B,Ruan Y Z,Zhao Y. 2018. Effects of replanted banana after rotation of different crops on banana production and soil fertility quality[J]. Jiangsu Journal of Agricultural Sciences,34(2):299-306.]
李冬丽,许乐,阮小蕾,李华平. 2011. 香蕉枯萎病田间不同类型土壤中微生物主要类群的分析[C]//中国植物病理学会2011年学术年会论文集. 北京:中国农业科学技术出版社:576. [Li D L,Xu L,Ruan X L,Li H P. 2011. Ana-lysis of main microbial groups in different soils of banana fusarium wilt[C]//Proceedings of the 2011 Annual Mee-ting of Chinese Society of Plant Pathology. Beijing:China Agricultural Science and Technology Press:576.
聂燕芳,黄嘉瑶,周玲菀,涂晓欢,陈慧妍,王振中,李云锋. 2017. 香蕉枯萎病菌热带4号小种基因组规模分泌蛋白的预测与分析[J]. 江苏农业学报,33(2):288-294. [Nie Y F,Huang J Y,Zhou L W,Tu X H,Chen H Y,Wang Z Z,Li Y Feng. 2017. Genome-scale prediction and analysis of the secretory proteins of Fusarium oxysporum f. sp. cubense tropical race 4[J]. Jiangsu Journal of Agricultural Sciences,33(2):288-294.]
牛世全,龙洋,李海云,达文燕,胡山,李渭娟,朱学泰,孔维宝. 2017. 应用Illumina MiSeq高通量測序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报,44(9): 2067-2078. [Niu S Q,Long Y,Li H Y,Da W Y,Hu S,Li W J,Zhu X T,Kong W B. 2017. Microbial diversity in saline alkali soil from Hexi Corridor analyzed by Illumina MiSeq high-throughput sequencing system[J]. Microbiology China,44(9):2067-2078.]
孙杰. 2018. 生防菌剂对香蕉枯萎病的防控效应及作用机制研究[D]. 武汉:华中农业大学. [Sun J. 2018. Study on Control effect and mechanism of biocontrol agents on fusarium wilt of banana[D]. Wuhan:Huazhong Agruicultu-ral University.]
王彤. 2018. 六种韭菜品种抑菌物质分析及其对香蕉枯萎病的抑制效果评价[D]. 福州:福建农林大学. [Wang T. 2018. Analysis of the chemical substances in six diffe-rent Chinese chive(Allium Tuberosum Rottler) cultivars and evaluation of their inhibitory effect to panama disease of banana[D]. Fuzhou:Fujian Agriculture and Forestry University.]
肖爱萍,游春平. 2005. 香蕉枯萎病防治进展[J]. 江西植保,28(2): 67-69. [Xiao A P,You C P. 2005. Advances on control of banana vascular wilt[J]. Jiangxi Plant Protection,28(2): 67-69.]
肖蓉,曹秋芬,聂园军,张春芬,邓舒,孙海峰,李倩. 2017. 基于高通量测序患炭疽病草莓根际与健康草莓根际细菌群落的比较研究[J]. 中国农学通报,33(11): 14-20. [Xiao R,Cao Q F,Nie Y J,Zhang C F,Deng S,Sun H F,Li Q. 2017. A comparative study on rhizosphere soil bacterial communities of healthy strawberry and infected strawberry with anthracnose by high-throughput sequen-cing[J]. Chinese Agricultural Science Bulletin,33(11): 14-20.]
翟婉璐,钟哲科,高贵宾,杨慧敏. 2017. 覆盖经营对雷竹林土壤细菌群落结构演变及多样性的影响[J]. 林业科学,53(9): 133-142. [Zhai W L,Zhong Z K,Gao G B,Yang H M. 2017. Influence of mulching management on soil bacterial structure and diversity in Phyllostachys praecox stands[J]. Scientia Silvae Sinicae,53(9): 133-142.]
张甘霖,龚子同. 2012. 土壤调查实验室分析方法[M]. 北京: 科学出版社:38-80. [Zhang G L,Gong Z T. 2012. Soil survey laboratory analysis methods[M]. Beijing:Scien-ce Press:38-80.]
张志红,李华兴,韦翔华,刘序,彭桂香. 2008. 生物肥料对香蕉枯萎病及土壤微生物的影响[J]. 生态环境,17(6):2421-2425. [Zhang Z H,Li H X,Wei X H,Liu X,Peng G X. 2008. Infulence of biological fertilizers on banana wilt disease and microorganisms in soil[J]. Ecological Environment,17(6):2421-2425.]
钟书堂,沈宗专,孙逸飞,吕娜娜,阮云泽,李荣,沈其荣. 2015. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报,26(2): 481-489. [Zhong S T,Shen Z Z,Sun Y F,Lü N N,Ruan Y Z,Li R,Shen Q R. 2015. Effects of continuous application of bio-organic fertilizer on banana production and cultural microflora of bulk soil in orchard with serious disease incidence[J]. Chinese Journal of Applied Ecology,26(2): 481-489.]
周維,田丹丹,覃柳燕,李朝生,韦绍龙,龙盛风,黄素梅,李小泉. 2017. 台湾香蕉产业现状、栽培技术及抗枯萎病品种选育[J]. 中国南方果树,46(3): 157-159. [Zhou W,Tian D D,Qin L Y,Li C S,Wei S L,Long S F,Huang S M,Li X Q. 2017. Current status,cultivation techniques and breeding of fusarium wilt resistance in Taiwan banana industry[J]. South China Fruits,46(3): 157-159.]
Bolger A M,Lohse M,Usadel B. 2014. Trimmomatic: A flexi-ble trimmer for Illumina sequence data[J]. Bioinforma-tics,30(15): 2114-2120.
Chaparro J M,Badri D V,Vivanco J M. 2014. Rhizosphere microbiome assemblage is affected by plant development[J]. ISME Journal,8(4): 790-803.
Compant S,Duffy B,Nowak J,Clément C,Barka E A. 2005. Use of plant growth-promoting bacteria for biocontrol of plant diseases: Principles,mechanisms of action,and future prospects[J]. Applied and Environmental Microbio-logy,71(9): 4951-4959.
Garbeva P,van Veen J A,Van Elsas J D. 2004. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology,42(1):243-270.
Gorissen A,van Overbeek L S,van Elsas J D. 2004. Pig slurry reduces the survival of Ralstonia solanacearum biovar 2 in soil[J]. Canadian Journal of Microbiology,50(8): 587-593.
Liu L,Li T Y,Wei X H,Jiang B K,Fang P. 2014. Effects of a nutrient additive on the density of functional bacteria and the microbial community structure of bioorganic fertilizer[J]. Bioresource Technology,172: 328-334.
Magill A H,Aber J D. 2000. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biology & Biochemistry,32(5): 597-601.
Magoč T,Salzberg S L. 2011. FLASH: Fast length adjustment of short reads to improve genome ssemblies[J]. Bioinformatics,27(21): 2957-2963.
Philippot L,Raaijmakers J M,Lemanceau P,Putten W H. 2013. Going back to the roots: The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology,11(11): 789-799.
Raaijmakers J M,Paulitz T C,Steinberg C,Alabouvette C,Loccoz Y M. 2009. The rhizosphere: A playground and battlefield for soilborne pathogens and beneficial microorganisms[J]. Plant and Soil,321(1-2):341-361.
Saravanan T,Muthusamy M,Marimuthu T. 2004. Effect of Pseudomonas fluorescens on Fusarium wilt pathogen in banana rhizosphere[J]. Journal of Biological Sciences,4:(2):192-198.
Schloss P D,Westcot S L,Ryabin T,Hall J R,Hartmann M,Hollister E B,Leaniewski R A,Oakley B B,Parks D H,Robinson C J,Sahl J W,Stres B,Thallinger G G,Van Horn D J,Weber C F. 2009. Introducing mothur: Open-source,platform-independent,community-supported software for describing and comparing microbial communities[J]. Applied & Environmental Microbiology,75(23): 7537-7541.
Shen Z Z,Ruan Y Z,Chao X,Zhang J,Li R,Shen Q R. 2015. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression[J]. Biology & Fertility of Soils,51(5): 553-562.
Timmusk S,Grantcharova N,Wagner E G H. 2005. Paenibacillus polymyxa invades plant roots and forms biofilm[J]. Applied and Environmental Microbiology,71(11): 7292-7300.
van Bruggen A H C V,Semenov A M. 2000. In search of biological indicators for soil health and disease suppression[J]. Applied Soil Ecology,15(1): 13-24.
Wang B B,Shen Z Z,Zhang F G,Raza W,Yuan J,Huang R,Ruan Y Z,Li R,Shen Q R. 2016. Bacillus amyloliquefaciens strain W19 can promote growth and yield and su-ppress Fusarium wilt in banana under greenhouse and ?eld conditions[J]. Pedosphere,26(5): 733-744.
Xu W Y,Wu X H,Yang J H. 2004. Pathological responses of banana pseudostem cells to different races of Fusarium oxysporum and its crude toxin[J]. Acta Phytopathologica Sinica,34(5): 425-430.
Yates M D,Kiely P D,Call D F,Rismani-Yazdi H,Bibby K,Peccia J,Regan J M,Logan B E. 2012. Convergent development of anodic bacterial communities in microbial fuel cells[J]. ISME Journal,6(11): 2002-2013.
Yuan J,Ruan Y Z,Wang B B,Zhang J,Waseem R Z,Huang Q W,Shen Q R. 2013. Plant growth-promoting rhizobacteria strain Bacillus amyloliquefaciens NJN-6-enriched bio-organic fertilizer suppressed Fusarium wilt and promoted the growth of banana plants[J]. Journal of Agricultural and Food Chemistry,61(16): 3774-3780.
Zhang N,Wu K,He X,Li S Q,Zhang Z H,Shen B,Yang X M,Zhang R F,Huang Q W,Shen Q R. 2011. A new bioorganic fertilizer can effectively control banana wilt by strong colonization with Bacillus subtilis N11[J]. Plant and Soil,344(1-2): 87-97.
Zhao Y P,Lin S,Chu L X,Gao J T,Azeem S,Lin W X. 2016. Insight into structure dynamics of soil microbiota mediated by the richness of replanted Pseudostellaria he-terophylla[J]. Scientific Reports,6: 26175.
Zhou X G,Shen Y H,Fu X P,Wu F Z. 2018. Application of sodium silicate enhances cucumber resistance to Fusarium wilt and alters soil microbial communities[J]. Frontiers in Plant Science,9: 624.
(责任编辑 麻小燕)
