不同进口白霉奶酪中优势霉菌分离鉴定及其凝乳酶酶学特性研究
2019-09-10沈阳农业大学食品学院沈阳110866沈阳市农业综合行政执法支队沈阳110031
(1.沈阳农业大学食品学院,沈阳110866;2.沈阳市农业综合行政执法支队,沈阳110031)
0 引言
奶酪富含多种对人体健康有益的营养物质[1,2],钙含量突出[3-4],是全球重要的乳制品之一[5]。但我国奶酪产品主要依赖进口,普遍存在口味单一和品质同质化问题[6]。已有众多研究选用不同霉菌制作奶酪,以丰富奶酪口味[7-10]。白霉奶酪典型特征为奶酪表面有一层白色霉菌,营养价值极高[11-13]。白地霉在食品、酿造、饲料等行业已有长期研究[14],其在牛奶、奶酪等乳制品中自然存在[15],对奶酪质构、风味、香气等贡献明显[11,16-17]。近年来,有关奶酪风味[18]、作用机理[19]、分子鉴定[20]等研究较为突出,微生物源凝乳酶酶学特性研究日益广泛[21-24]。基于此,本研究从进口白霉奶酪中筛选优势霉菌进行鉴定,并研究该凝乳酶的酶学性质,以期为白地霉在霉菌奶酪生产中的应用提供基础资料。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
白霉奶酪,生产商Nordex Food;Danish Brie cheese白霉奶酪,生产商Arla Foods amba Troldhede Dairy Y;Danish Camembert cheese白霉奶酪,生产商北京申囤贸易有限公司。
1.1.2 培养基
麦芽汁琼脂培养基:麦芽膏20 g,蛋白胨1.0 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 m L。麦芽汁液体培养基:10~15°P新鲜麦芽汁1 000 mL,自然pH值,1×105Pa灭菌20 min。5°P麦汁培养基:5度麦芽汁,2%琼脂,1×105Pa灭菌20 min。马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15-20 g,蒸馏水1 000 mL。制法:将马铃薯去皮切块,加1 000 mL蒸馏水,煮沸10-20 min。用纱布过滤,补加蒸馏水至1 000 mL。加入葡萄糖和琼脂,加热溶化,自然p H值,1×105Pa灭菌20 min。
1.2 仪器与设备
Nikon TS100型倒置荧光显微镜,AYU-12O型分析天平,HCB-1300V型垂直层流洁净工作台,电子天平,LDZF-30KB型立式压力蒸汽灭菌器,上海一恒THZ-98A型恒温振荡器,上海精宏SHP-250型生化培养箱,DK-8D型电热恒温水槽,3-30K型低温高速离心机。
1.3 实验方法
1.3.1 优势霉菌筛选分离
(1)采样。在垂直层流洁净工作台打开奶酪外包装,用灭菌切割刀将整块奶酪不同部分切割成小片,平铺放置于加有抗生素的PDA培养基中,28°C培养24 h,定期观察菌种培养过程并记录,选择发霉量大,生长旺盛的培养基平板进行后续实验。
(2)增殖培养。无菌操作条件下,接种环挑取上述菌种物置于麦芽汁液体培养基,28°C恒温箱中培养24 h。
(3)平板分离。无菌操作将增殖培养后的菌种稀释为10-1浓度菌液,再依次稀释为10-2,10-3,10-4,10-5,10-6浓度梯度菌液。分别吸取0.1 mL各浓度梯度菌液至麦芽汁琼脂平板中涂布,置于28°C恒温培养箱中培养定期观察菌落形态特征并记录。
(4)初筛。将培养好的平皿选取单个分散菌落,在无菌条件下,进行第一次、第二次平板分离,接种针挑取第二次平板分离的菌株,进行麦芽汁琼脂培养基划线培养,每株菌株划线三个平板,记录并观察菌株生长情况及菌落形态特征,选取生长能力较强菌株。
(5)复筛。将初筛后得到的菌株接种于添加抗生素、无外源污染物的麦芽汁琼脂培养基,于28°C培养5 d后,观察菌株生长能力,保留生长能力较强菌株。
1.3.2 优势霉菌菌种鉴定与保藏
(1)常规鉴定。对筛选得到的生长能力较强、菌落旺盛菌株进行形态学和理化特性分析。形态学包括显微形态和培养特征,显微镜观察根据筛分菌种的菌丝有隔或无隔;菌丝体透明或暗黑,有色或无色;是否产生有性孢子,孢子的类型;无性孢子的类型等对霉菌进行初步鉴定。初步鉴定菌株通过碳源同化试验、氮源同化试验、水解蛋白、分解杨梅苷测定及分解脂肪试验进行理化特性分析鉴定,并参照《真菌鉴定手册》进行鉴定[25]。
(2)分子生物学鉴定。a.菌种培养:取4°C低温冷藏菌种,连续2次在PDA培养基活化,转接到5°P麦芽汁固体平板上,30°C过夜培养,挑取一环菌种,加入25 mL、5°P麦芽汁培养基,于28°C、150 r/min条件下培养48 h。b.基因组提取:筛分菌株基因组DNA提取CTAB法,使用0.8%琼脂糖凝胶电泳检验DNA纯度和完整性。c.26SrDNA D1/D2区序列扩增:以菌株基因组DNA为模板,用引物5′-GGTGACGCAG-3′进行PCR扩增。反应体系:10×PCR Buffer5μL,MgCl2(25 mmol/L)4μL,d NTPs(2.5 mol/L)4μL,随机引物(5μmol/L)2μL,模板DNA2μL,Taq酶(5 U/μL)0.6μL,用ddH2O补至50μL;采用分段PCR扩增程序:94°C 5 min,(94°C 3 min,35°C 1.5 min,72°C 2 min)×5个循环,(94°C 30 s,35°C 1 min,72°C 1.5 min)×30个循环,72°C 5 min。扩增产物用1.5%琼脂糖凝胶电泳检测,并拍照记录结果。d.序列测定与比对分析:将图谱结果与模式菌株DNA进行同源性比较,获得菌株相似度。
(3)鉴定菌种保藏。菌种短期保藏采用斜面保藏法,分离得到纯菌株移接到麦芽汁斜面,放置于28°C恒温箱中培养24 h后置于冰箱4°C存放。菌种长期保藏采用甘油超低温保藏,分离得到纯菌株摇瓶培养后获得菌悬液,取菌悬液与60%甘油各500μL于保菌管中混合均匀,置于-80°C超低温冰箱存放。
1.3.3 优势霉菌凝乳酶活性及酶学特性测定
(1)保藏菌种活化。将冷冻保藏优势霉菌接种于PDA斜面培养基进行活化培养,28°C培养3~4 d,待培养基中长满菌丝后备用。
(2)孢子悬浮液制备。
用10 mL无菌生理盐水冲刷生长良好的试管斜面种子,将冲刷液移入装有生理盐水和玻璃珠的三角瓶中,在摇床上振荡打散,并用带有脱脂棉的漏斗进行过滤。
(3)凝乳酶分离与提取
将1 mL优势霉菌孢子悬浮液接种于发酵培养基,28°C培养3~4 d,培养完成后,加入100 mL蒸馏水,在20°C、180 r/min振荡浸提1 h,浸提液用4层纱布过滤,滤液在10 000 r/min条件下离心30 min。在4°C向所得上清液中加入预冷的无水乙醇,使无水乙醇体积分数分别为20%、30%、40%、50%、60%、70%和80%,静置24 h后离心30 min,用5 mmol/L磷酸盐缓冲液溶解沉淀,分别测定凝乳酶活性,选取凝乳酶活力最高时无水乙醇的体积分数进行凝乳酶提取。
(4)凝乳酶活性及酶学特性测定
参照Arima[26]方法,用0.01 mol/L的CaCl2溶液将脱脂乳溶解,配制成10%的脱脂乳溶液,室温下静置30 min后,各量取5 mL分装到小试管中,35°C恒温水浴5 min,在35°C下取待测酶液0.5 mL加入到5 mL装有10%脱脂乳溶液的试管中,立即摇匀,开始计时,出现絮状沉淀停止计时,并计算凝乳酶活性。
凝乳酶最适反应温度:配置浓度为10%的脱脂乳溶液,取同量的酶液,分别在30°C、35°C、40°C、45°C、50°C、55°C、60°C、65°C、70°C保温10 min,测定凝乳酶活性,确定凝乳酶最适反应温度。
凝乳酶最适反应pH:用浓度为0.1 ml/L的氢氧化钠溶液和0.1 ml/L盐酸溶液将酶液的pH分别调整为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0,在最适反应温度下保持10 min,测定凝乳酶活性,确定凝乳酶最适反应pH。
凝乳酶稳定性:取同量的酶液,在最适反应温度和pH下反应3、5、7、10、15、20和30 min,测定凝乳酶活性,考察凝乳酶稳定性。
金属离子对凝乳酶活性影响:配置不同浓度的金属离子溶液,按照一定比例加入到脱脂乳溶液中,使得脱脂乳中金属离子浓度为0.001 mol/L,所选择的金属离子包括Fe2+、Cu2+、Mg2+、Co2+、Zn2+、Al3+、Ca2+、Fe3+、Mn2+金属离子,在最适温度、p H条件下催化反应,测定凝乳酶活性,考察金属离子对凝乳酶影响。
1.4 数据处理
用Excel软件整理数据和绘图,使用SPSS 22.0软件对数据进行方差分析和相关性分析,方差分析选取Duncan检验,在p<0.05检验水平上对数据进行统计学分析。
2 结果
2.1 菌种筛选分离及鉴定
2.1.1 菌种筛选分离
筛分培养期间观察得到4个奶酪平板具有较强的生霉能力,分别在奶酪表面长有白色绒毛状兼粉状菌丝,菌丝紧贴奶酪表面,平坦且分布均匀,菌丝丛细密度相接近。培养开始第二天有菌丝出现,在第三天到第四天菌丝生长旺盛,形成大面积菌落,菌丝丛大多呈圆形,颜色主要为白色,部分略带微黄色。筛分得到的菌株其菌落形态特征如图1。
优势菌株的菌落形态如图1所示,菌株在麦芽汁琼脂培养基中28°C培养3 d,菌落正面观看呈圆形,较薄,正面颜色白色,平坦,边缘不整齐,中心略微凸起,呈放射状,略有微绒状,菌丝质地粉状,背面观看呈圆形,黄白色,边缘不整齐,边缘色浅,呈放射状。
从筛选获得45个菌落选取1个单菌落进行优势菌株制片进行细胞形态观察,结果如图2。
图1 菌落形态
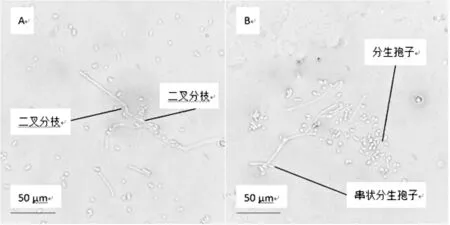
图2 菌株显微形态
由图2可以观察到,分离所得菌株细胞形态,菌体产生真菌丝,菌丝匍匐,有橫隔,菌丝以二叉分枝形式生长,菌丝无色。孢子梗顶端生有长串状的分生孢子,分生孢子5.4μm×4μm,呈圆筒状或长筒形,近乎长方形,两端多圆形,少数平切,无色透明,单孢,有时连接成孢子链。
2.1.2 菌种理化鉴定
菌株对于试验选用7种不同唯一碳源培养基表现出不同的利用结果。碳源同化试验测定结果如表1所示,菌株能够在D-核糖、蔗糖、麦芽糖、乳糖、核糖醇作为唯一碳源培养基中正常生长,但在不同碳源化合物周围的霉菌菌落数目存在差异,说明菌株对D-核糖、蔗糖、麦芽糖、乳糖、核糖醇的利用程度存在一定差异,对碳源种类有一定要求。而在纤维二糖、木糖醇作为唯一碳源培养基中不能生长,说明菌种对碳源的利用具有选择性。

表1 碳源同化结果
氮源同化试验测定结果如表2所示,菌株在蛋白胨、尿素、硫酸铵作为唯一氮源培养基中正常生长,但在蛋白胨作为培养基中唯一氮源时,菌体生长迅速,菌丝浓密,菌落特征明显。而在硝酸钾作为唯一氮源培养基中不能生长,菌株对有机氮源的利用效果优于无机氮源。

表2 氮源同化结果
水解蛋白质、分解杨梅苷、脂肪试验测定结果如表3所示,菌株不能分解杨梅苷,能分解脂肪和蛋白质。霉菌菌株中包含多种酶系,其中蛋白酶和脂肪酶表现出对蛋白质和脂肪较强的分解能力,其挥发性产物对奶酪风味形成具有重要作用。

表3 其他生理实验结果汇总表
2.1.3 菌种分子生物学鉴定
菌株进行基因分子水平鉴定,将其26S rDNA D1/D 2区序列同NCBI库中序列进行比对,其结果显示测定菌株与Geotrichum sp.(白地霉属)同源性高达99%以上,与其他物种序列相比得分最高,具有明显物种差异。本序列测定使用该菌株的脂肪酸脱饱和酶基因作为特征序列,其GenBank编号为MH 198047。
2.2 凝乳酶酶学特性
2.2.1 温度对凝乳酶活性影响
温度主要影响凝乳酶对酪蛋白作用的第二步即影响酪蛋白胶束的聚集作用。在反应温度分别为30°C、35°C、40°C、45°C、50°C、55°C、60°C、65°C和70°C条件下测定了其活性。从图3结果中可以看出白地霉凝乳酶的活性随着温度的升高逐渐提高,在反应温度为45°C时其活性达到(0.495±0.067)IMCU。而后随温度的升高凝乳酶活性有下降的趋势,在45°C~65°C时,凝乳酶活性缓慢下降,在70°C凝乳酶活性比45°C降低了45.4%。反应温度在30°C~40°C和55°C~70°C之间,温度对凝乳酶活性影响不存在显著性差异。在45°C~50°C范围内凝乳酶活性未见明显损失,说明白地霉凝乳酶在45°C~50°C内具有较强的稳定性和凝乳效果。
白地霉凝乳酶最适反应温度为45°C,此结果与Rajesh Kumari Narwal等[27]所报告的Bacillus subtilis MTCC 10422凝乳酶最适温度一致。Lmdaki等[28]研究结果表明,提取自Pediococcus acidilactici SH菌株的凝乳酶最高活性在50°C时不受抑制,而在60°C时没有活性。我们的结果表明凝乳酶在70°C活性依然存在,这可以解释Ahmed and Helmy[29]发现最大的地衣芽孢杆菌5A5凝乳酶最高活性在75°C的可能性,体现了白地霉凝乳酶作用温度范围的广泛。温度作为影响酶活性的重要条件,在温度过低时酶活性受到抑制,温度过高时凝乳酶三维空间结构易被破坏而发生变性,导致在低温和高温条件下凝乳酶活性相对较低。白地霉凝乳酶最适温度为45°C,说明在此温度下凝乳酶与底物结合最佳,酶的空间构象未被改变,凝乳酶表现出相对较高的活性。
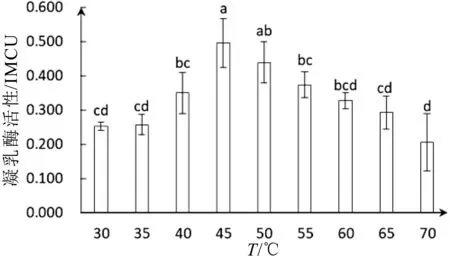
图3 温度对凝乳酶活性影响
2.2.2 p H值对凝乳酶活性影响
在最适反应温度45°C条件下,pH值对凝乳酶活性影响如图4所示。从图中可以看出,白地霉凝乳酶在pH 6.0时活性最高,达到(0.613±0.043)IMCU。而后随着p H值的增加白地霉凝乳酶活性呈下降趋势,当p H值为8.5时凝乳酶活性仅为p H=6.0时的27.0%。pH在4.5-5.0、6.5-7.5和8.5-10.0之间,凝乳酶活性没有显著性差异,在pH为9.0和10.0时凝乳酶活性比p H=6.0时分别降低71.5%和67.2%。从图中还可以看出,白地霉凝乳酶在酸性条件活性高于碱性条件,这与凝乳酶是酸性蛋白酶相吻合。在pH 4.0-6.0之间凝乳酶活性上升平缓,说明白地霉凝乳酶对酸耐受性较好,在酸性条件具有相对较高的稳定性;而在p H 7.0-8.5范围内,凝乳酶活性有下降的趋势,波动较明显。
白地霉凝乳酶最适反应pH值为6.0,此结果与Poza M等[30]所报告的Myxococcus xanthus strain 422凝乳酶最适p H 6.0一致。p H值对酶活性的影响主要为破坏酶的空间结构,影响酶活性部位催化基团的解离状态和影响底物解离状态。在过酸或过碱条件下凝乳酶的空间构象将被破坏,影响酶分子构象的稳定性,导致酶活性降低。而在p H 6.0时,凝乳酶分子上的极性基团受到低酸性环境的影响,处于较为稳定的解离状态,此时凝乳酶与底物结合表现出较高的活性。
2.2.3 反应时间对凝乳酶活性影响
凝乳酶稳定性对奶酪生产加工具有现实意义,在奶酪的加工成熟过程中凝乳酶起着极其重要的作用,凝乳酶的稳定性将会影响奶酪的质构和风味。在反应温度为45°C、pH=6.0的条件下,将白地霉的凝乳酶分别保温3、5、7、10、15、20和30 min后,测定了其活性。结果如图5所示,凝乳酶活性随作用时间增加缓慢降低。在3 min时具有最高活性(0.613±0.043)IMCU,5~7 min凝乳酶活性略有降低,分别为(0.549±0.048)IMCU、(0.536±0.031)IMCU,其活性分别保留了89.6%和87.4%。而在20-30 min其活性显著下降,分别为(0.347±0.041)IMCU、(0.251±0.057)IMCU,其活性分别保留了56.6%和40.9%。白地霉凝乳酶在实际应用中,应保持反应时间在3~7 min内,才能够发挥凝乳酶最佳凝乳作用,保持相对较高的稳定性[31]。因此,该凝乳酶具备较好的凝乳稳定性。
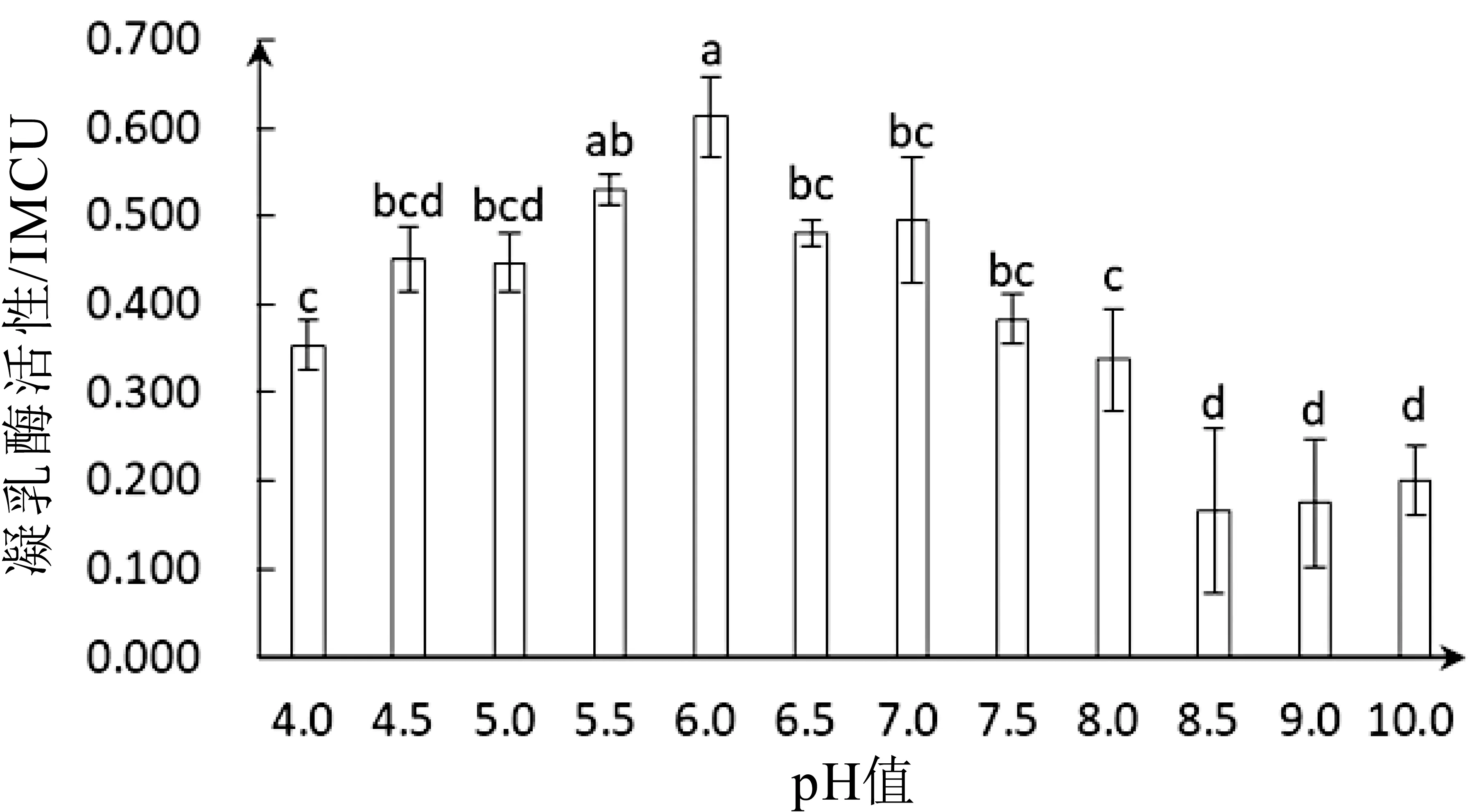
图4 pH值对凝乳酶活性影响
白地霉凝乳酶在3~7 min相对稳定,酶活性变化不显著,凝乳酶在短时间内受到温度和pH影响不明显,凝乳酶对环境具有一定耐受性,酶分子的空间结构、解离状态、催化活性都较为稳定,能够保持较高的活性。但长时间处于恒定温度和p H环境下,凝乳酶活性也会有所下降,稳定性发生波动。7~10 min为酶活性显著下降阶段,此时温度和pH对凝乳酶活性影响累积作用达到临界点,酶活性发生突变,10~20 min凝乳酶作用环境不足以使酶分子解离状态发生较大变化,活性下降较为平缓,直至30 min环境累积作用进一步加强,凝乳酶解离状态大大增加,酶活性波动较大,下降明显。
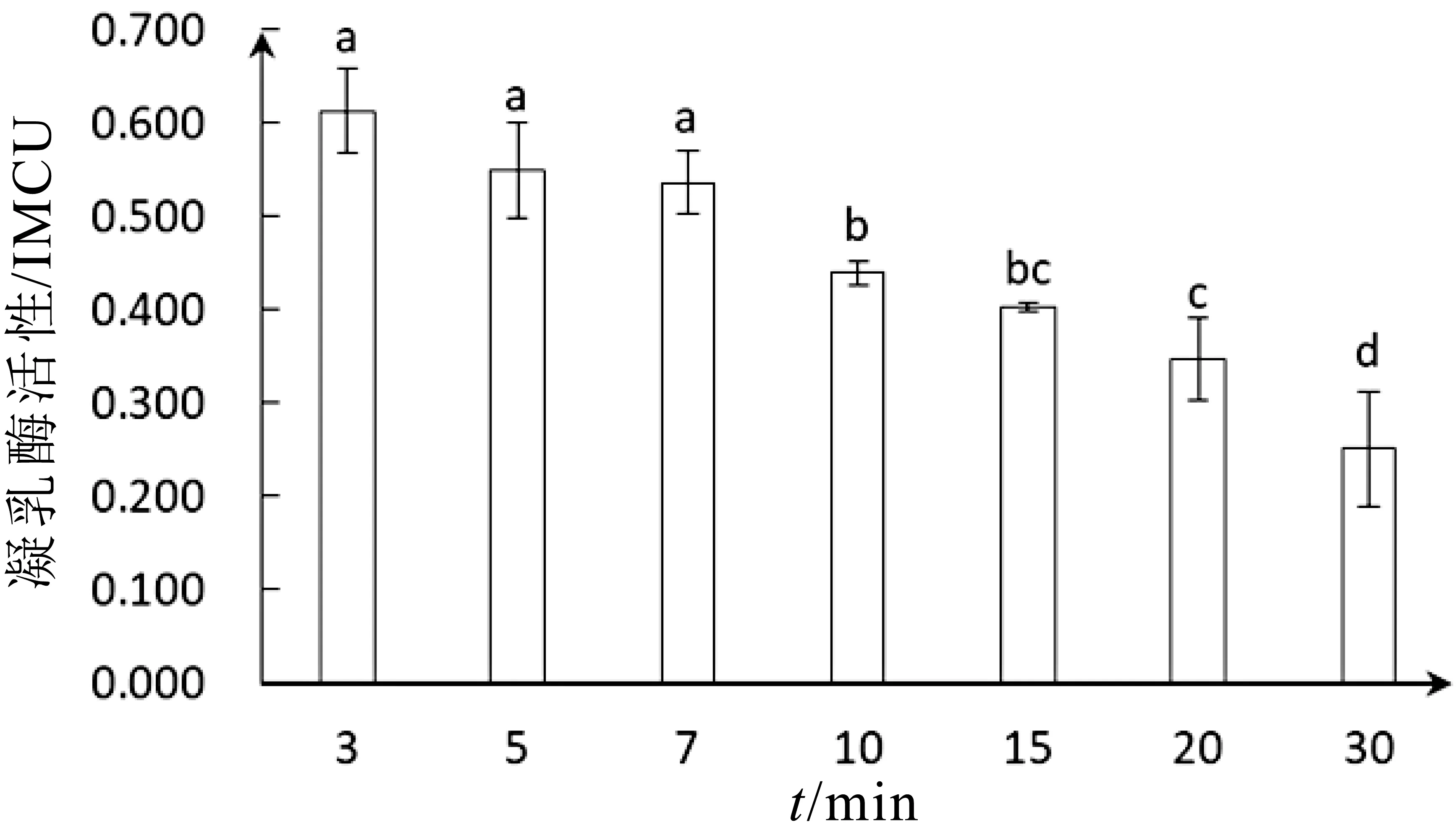
图5 反应时间对凝乳酶活性影响
2.2.4 金属离子对凝乳酶活性影响
在反应温度为45°C、pH=6.0、作用时间3 min条件下,不同金属离子对凝乳酶活性影响如图6所示。由结果可知,不同金属离子对白地霉凝乳酶活性具有较大影响。Fe2+、Ca2+、Fe3+、Mn2+能够降低凝乳酶活性,Fe3+对凝乳酶活性有极大抑制作用,其活性降低至(0.175±0.070)IMCU仅为原来的19.9%。Mn2+对凝乳酶活性抑制作用较小,其活性降低至(0.594±0.061)IMCU。Cu2+、Mg2+、Zn2+、Al2+能够提升凝乳酶活性,其活性分别达到(0.812±0.055)IMCU、(0.880±0.092)IMCU、(0.639±0.034)IMCU和(0.664±0.024)IMCU,与对照组相比分别提高32.5%、43.6%、4.2%和8.3%。由此可知,Mg2+和Cu2+对提高白地霉凝乳酶活性有显著影响。
白地霉凝乳酶在不同金属离子存在时,酶活性变化较大。凝乳酶和底物因均带负电荷而相互排斥,不同金属离子因所带正电荷数量不同将会对它们之间的排斥作用产生不同程度的影响,引起酶活性变化。不同金属离子可以作为辅基,通过与酶分子结合影响酶活性,Mg2+和Cu2+与酶的结合更加牢固,凝乳酶表现出较高的活性,而Fe3+常作为血红蛋白的辅基离子,不易与凝乳酶结合,体现出较低的酶活性。同时,有报道表明凝乳酶对酪蛋白的Phe105-106键呈高度专一性,Fe3+将会影响к酪蛋白的构象[32],导致凝乳酶活性降低。

图6 金属离子对凝乳酶活性影响
3 结论
本研究从进口奶酪中分离筛选得到优势霉菌,并鉴定该优势霉菌为白地霉。考查了白地霉凝乳酶在不同温度、不同pH值、作用时间以及不同金属离子条件下的酶活性,确定其最佳反应温度为45°C,最适pH 6.0,最适反应时间3 min,最优结合金属离子为Mg2+和Cu2+。本研究为提高白霉奶酪品质和生产应用提供数据基础。
