射流空化对大豆蛋白美拉德反应及产物乳化特性的影响
2019-09-10郭增旺王中江
李 良 周 艳 滕 飞 郭增旺 田 甜 王中江
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
大豆分离蛋白(Soy protein isolate, SPI)具有乳化性、起泡性和凝胶性等功能特性[1]。其功能特性在酸性和碱性条件、高温及有机溶剂等逆环境中易遭受破坏,限制了在食品工业中的应用[2]。美拉德反应是一种非酶、天然、无毒的蛋白质或多糖修饰方法,被认为是改善蛋白质或氨基酸乳化和抗氧化性能的优异方法[3],但也存在效率低、时间长、能耗高、反应过程难以控制等缺陷。故探索如何提高美拉德反应效率以及控制反应进程成为近年来国内外的研究热点。
射流空化作为一种新型强化手段,具有空化场均匀、操作简便、效率高等特点,基于液体中的空化泡溃灭时产生的极端热、高压、强烈的冲击波以及高时速的微射流将产生机械效应、自由基效应和热效应[4]。文献[5]发现,动态高压微射流(Dynamic high pressure microfluidization, DHPM)与糖基化结合导致β-乳球蛋白解折叠和聚集,增加了变性温度;文献[6]认为,DHPM预处理诱导牛血清白蛋白(Bovine serum albumin, BSA)结构去折叠,可提高BSA美拉德反应程度;文献[7]发现,DHPM改变了α-乳白蛋白的三级结构,促进了美拉德反应,提高了美拉德反应产物的乳化性能和抗氧化活性。但目前有关射流空化对美拉德反应进程及产物功能特性影响的研究较少。
本文研究射流空化处理对SPI-葡聚糖美拉德反应进程的影响,以及压力对产物结构和功能特性的影响,为改善蛋白质功能特性提供理论支持。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(纯度90.21%以上,灰分质量分数5.7%,脂肪质量分数0.95%,粗纤维质量分数0.87%),山东禹王实业(集团)有限公司;葡聚糖(分子量70 ku),分析纯,上海源叶生物科技有限公司;非转基因大豆色拉油,食用级,九三粮油工业集团有限公司;邻苯二甲醛(OPA),北京索莱宝科技有限公司;其他所需试剂均为分析纯。
1.2 仪器与设备
M-700型微射流均质机,美国Microfluidics公司;UV-2600型紫外-可见分光光度计,日本岛津公司;JJ-1型恒温磁力搅拌器,常州国华电器有限公司;电子分析天平(精度0.000 1 g),北京赛多利斯仪器系统有限公司;RF-5301PC型荧光分光光度计,日本Hitachi公司;PHSJ-4A 型实验室pH计,上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1SPI射流空化处理
将SPI样品溶于0.2 mol/L、pH值7.0的磷酸盐缓冲液,室温(20℃)下磁力搅拌2.5 h,调节大豆分离蛋白质量分数至4%。取500 mL SPI溶液室温下进行射流空化处理,处理压力分别为0、0.5、1.0、1.5、2.0 MPa,每次10 min,均质处理3次,处理后样品于4℃保存备用。
1.3.2SPI-葡聚糖结合物制备
处理后的SPI溶液与1%葡聚糖(70 ku)溶液(由0.2 mol/L、pH值8.0磷酸盐缓冲溶液配置),按照体积比1∶1的比例混合,在室温磁力搅拌2 h,确保完全水合蛋白和葡聚糖,水合溶液放入冰箱中预冻,然后经真空冷冻干燥机进行冷冻干燥[8]。在一定的相对湿度(79%)、温度(60℃)条件下,密闭容器中干法美拉德反应48 h得SPI-葡聚糖样品,研磨粉碎后储存在-20℃备用[9]。
1.3.3褐变程度
SPI-葡聚糖样品溶于0.2 mol/L、pH值7.0磷酸盐缓冲液,样品溶液质量浓度10 mg/mL,磁力搅拌20 min,以0.2 mol/L、pH值7.0磷酸盐缓冲液作空白,紫外分光光度计420 nm测定其吸光度A420,数值越小,表示褐变指数越小[10]。
1.3.4中间产物
SPI-葡聚糖样品溶于0.2 mol/L、pH值7.0磷酸盐缓冲液,样品溶液质量浓度5 mg/mL,磁力搅拌20 min,紫外分光光度计测定294 nm下吸光度A294。数值越大,表示反应生成的中间产物含量越多[11]。
1.3.5接枝度
按照上述方法配置2 mg/mL SPI-葡聚糖样品溶液,加入4 mL邻苯二甲醛(OPA)试剂,充分混匀后,35℃水浴加热2 min,紫外分光光度计测量其340 nm处的吸光度。以200 μL(0.2 mol/L、pH值7.0)磷酸盐缓冲液作空白。将80 mg OPA(溶解在2.0 mL 95%乙醇中),50 mL 0.1 mol/L四硼酸钠缓冲液(pH值9.5),5.0 mL 20%SDS(十二烷基硫酸钠)溶液和0.2 mL 2-巯基乙醇混合、定容至100 mL配制OPA试剂[12]。接枝度计算公式为
(1)
式中At——糖化蛋白溶液340 nm处吸光度
A0——蛋白溶液在相同反应条件340 nm处吸光度
1.3.6聚丙烯酰胺凝胶电泳
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)测定SPI蛋白和SPI-葡聚糖美拉德反应产物的分子质量。电泳用分离胶和浓缩胶的条件是:分离胶质量分数10%,浓缩胶质量分数5%,样品质量浓度5 mg/mL,上样量体积10 μL,电泳电压分三段式(50、80、120 V,每隔30 min切换一次电压),当染料前沿距橡胶框底边约1 cm时,停止电泳。考马斯亮蓝R-250染色30~60 min,脱色。
1.3.7样品荧光性
SPI-葡聚糖样品2.5 mg/mL(0.2 mol/L磷酸盐、pH值7.0),室温下溶解,避光保存。激发波长为290 nm,激发和发射的狭缝为5 nm,并且发射光谱在200~500 nm记录荧光光谱,具有240 nm/min的恒定扫描速度[13]。
1.3.8紫外光谱
以磷酸盐缓冲溶液(0.2 mol/L、pH值7.0)作空白对照,SPI-葡聚糖溶液的蛋白质量浓度为1 mg/mL(0.2 mol/L磷酸盐、pH值7.0),在紫外分光光度计中测定样品200~400 nm范围紫外吸收图谱[14]。
1.3.9表面疏水性
取4 mL SPI-葡聚糖样品溶液(2.5 mg/mL)加入20 μL ANS(8-苯胺萘磺-1-1酸盐) 储备溶液(8.0 mmol/L),用0.01 mol/L、pH值7.4的Tris-HCl缓冲液将蛋白质质量浓度稀释至0.05、0.1、0.2、0.4、0.8 mg/mL。当λex=390 nm (2.5 nm狭缝宽度)时,测量470 nm处荧光值F。对蛋白质量浓度线性拟合,初始斜率H0表示表面疏水性指数[15]。
1.3.10乳化活性和乳化稳定性
将SPI-葡聚糖样品溶于0.2 mol/L、pH值7.0磷酸盐缓冲液中,使其质量浓度为0.001 g/mL,取30 mL糖化蛋白样品中加入10 mL的大豆油配制混合溶液,高速分散机以10 000 r/min将混合溶液高速剪切2 min,重复3次。从新鲜制备的乳液样品的底部取出50 μL并立即分散到5 mL 0.1%SDS 溶液中,混合均匀。分别在0 min和10 min时测定其在500 nm处吸光度A00和A10,以0.1% SDS 溶液作对照[16]。乳化活性指数(EAI)和乳化稳定性指数(ESI)计算公式为
(2)
(3)
式中EAI——乳化活性指数,m2/g
ESI——乳化稳定性指数,min
c——乳液形成前溶液中蛋白质质量浓度,g/mL
θ——乳状液中油相体积分数,取0.25
V——稀释倍数
1.4 数据处理
本试验均重复3次,测定值为平均值±标准偏差,所得试验数据采用SPSS 18.0软件的One Way ANOVA进行显著性分析(P<0.05),Origin 9.0软件制图。
2 结果与讨论
2.1 褐变程度及中间产物
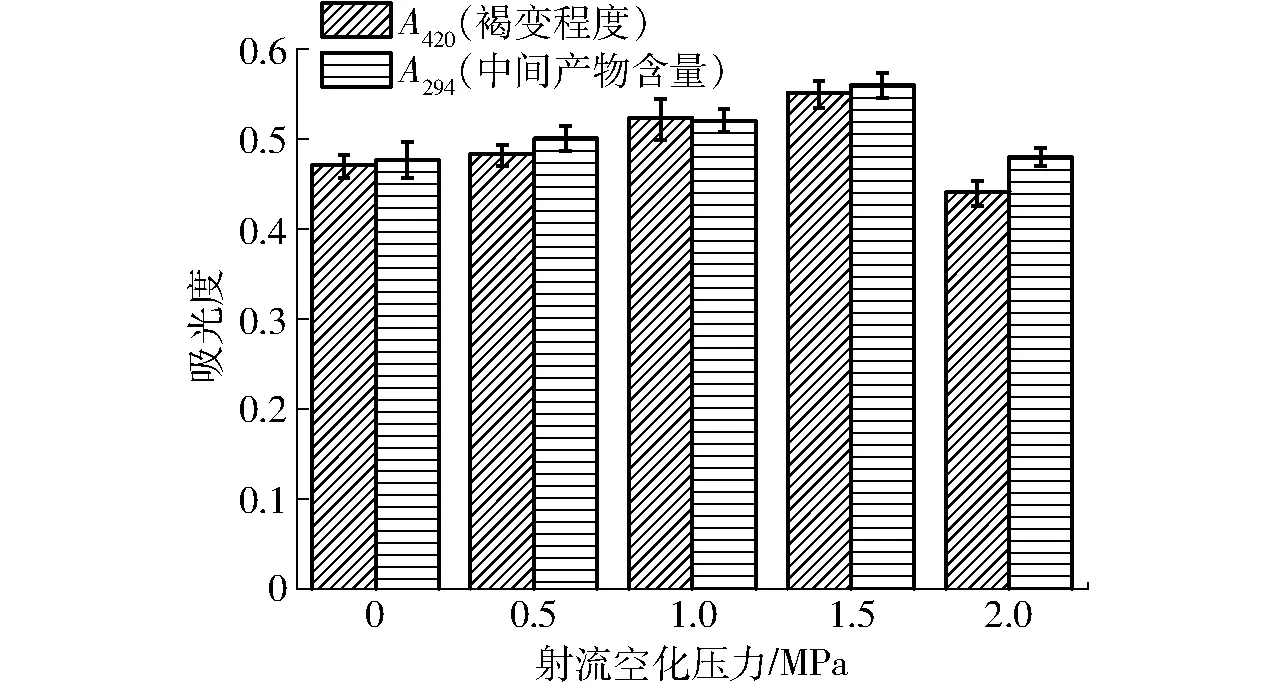
图1 射流空化压力对褐变程度及中间产物含量的影响Fig.1 Effect of jet cavitation powers on browning intensity and A294
美拉德反应可分为初级、中级和高级3个阶段,反应过程通常伴随褐变现象,同时高级反应阶段产生一类统称为类黑精的含氮棕色聚合物。随美拉德反应的持续进行,反应体系的颜色变得越来越深,因此蛋白质的美拉德反应进程可通过测定反应体系在420 nm下的吸光度变化反映出来,从而得知美拉德反应体系的褐变程度[17]。一般吸光度越大,反应越快,中间产物越多。射流空化压力对褐变程度及中间产物含量的影响如图1所示,随射流空化压力逐渐增大,反应体系的褐变程度表现出先增大后降低的趋势。当射流空化压力为1.5 MPa时,A420达到0.55,与对照样品(0.47)相比提高了17.02%,表明射流空化处理能显著提高美拉德反应的速率,增加中间产物的含量(P<0.05)。射流空化处理时空化泡溃灭产生的机械效应及较高的冲击波和微射流可能会导致SPI分子结构伸展,暴露出更多的反应位点,有助于提高蛋白的活性,从而加快美拉德反应[18]。当射流空化压力继续增大到2.0 MPa时,A420下降到0.44。射流空化压力过大会导致伸展的蛋白分子连接、聚集,不利于美拉德反应的进行[17]。综合褐变程度和中间产物的结果可知,当射流空化压力1.5 MPa时美拉德反应速率较快,中间产物含量多,反应停留在中间阶段,有利于产物乳化性等功能性质提高。
2.2 接枝度
美拉德反应主要是蛋白游离氨基和多糖羧基之间的反应,游离氨基数目越少,说明参与反应的氨基越多,反应进行程度也就越高,因此可通过利用邻苯二甲醛(OPA)法游离氨基数目计算接枝度表示反应进行程度。由图2可知,射流空化处理可显著提高美拉德反应速率,这可能是由于液体中的空化泡溃灭时产生的空穴及机械效应,增加了气泡周围的压强,导致蛋白分子结构伸展,肽键断裂,蛋白溶出率增加,增加了反应体系中可用游离氨基的含量,增大了其与糖碰撞的可能性,从而促进SPI与葡聚糖发生美拉德反应[19]。文献[20]研究发现高强度声波产生的机械效应及热效应能够改变蛋白质分子的空间构象及结构,使得包埋在结构内部的亲水性氨基酸残基暴露出来。在射流空化时间一定的条件下,SPI-葡聚糖样品的接枝度随着射流空化压力呈先增加后减小的趋势,当压力为1.5 MPa时,接枝度从32.54%增加到了57.89%。但随着射流空化压力继续增大到2.0 MPa时,接枝度下降到42.68%,过大的空化压力导致蛋白变性严重,发生自身聚集,阻碍了美拉德反应的进程。

图2 射流空化压力对接枝度的影响Fig.2 Effect of jet cavitation powers on degree of grafting
2.3 聚丙烯酰胺凝胶电泳
为研究蛋白的成分变化,射流空化处理SPI-葡聚糖产物的SDS-PAGE图谱如图3(条带M表示标准蛋白分子;条带1~5表示不同射流空化压力(0、0.5、1.0、1.5、2.0 MPa))所示,与未射流空化处理的SPI-葡聚糖产物(条带1)相比,随射流空化压力(0.5~1.5 MPa)增加,低分子量(20~25 ku附近)条带逐渐变浅,表明射流空化促进SPI与葡聚糖的接枝反应生成了其他物质。根据SDS-PAGE迁移机制,推断SPI-葡聚糖产物可能通过共价键结合[21]。射流空化处理的空穴和机械效应使SPI分子解折叠,暴露出更多的活性基团,有利于蛋白和多糖之间的结合,促进SPI-葡聚糖美拉德反应进程[19]。射流空化压力继续增加至2.0 MPa时,射流空化抑制了SPI与葡聚糖的美拉德反应。这主要是由于射流空化产生的极端热和高压作用导致蛋白质发生变性聚集,结构折叠,阻碍了美拉德反应进程。

图3 不同射流空化压力对SPI-葡聚糖美拉德反应产物分子量的影响Fig.3 Effect of different jet cavitation powers on molecular weight of Maillard reaction products (SPI-dextran)
2.4 样品荧光性分析
荧光光谱分析是研究蛋白及肽空间结构(三级结构)的有力手段,也可以用来研究美拉德反应产物的结构。荧光化合物形成与美拉德反应有关,Amadori化合物与蛋白质或游离氨基产生交联,美拉德反应后期阶段产生荧光聚合物,其荧光性可作为美拉德反应的标志[22]。美拉德反应过程中生成的具有荧光特性的产物典型光谱特征是:激发波长是340~370 nm,发射波长是420~440 nm。图4为不同射流空化压力对SPI-葡聚糖样品荧光性的影响。与天然SPI相比,经射流空化处理后,SPI的荧光强度升高。这可能是因为射流空化的冲击波及高时速的微射流产生的机械效应破坏了SPI的空间结构,导致分子内部的Trp更多地暴露在极性环境中,增加了SPI的荧光强度[23]。随空化压力增加,当压力超过1.5 MPa时SPI的荧光强度降低。当空化压力过大时,射流空化产生的高压和热效应导致蛋白分子变性严重,蛋白发生折叠,疏水性被残基包埋,引起荧光猝灭[17]。文献[24]提出空化可能通过破坏蛋白质的四级和三级结构促进蛋白质变性。经葡聚糖美拉德反应后,SPI-葡聚糖反应产物的荧光强度显著降低,可能是由于SPI与葡聚糖的结合对部分色氨酸起到了屏蔽作用[25],且随空化压力的增大,荧光强度先增后减,1.5 MPa时SPI-葡聚糖的荧光强度达最低,可能是当空化压力为1.5 MPa时SPI-葡聚糖反应体系的美拉德反应程度最大,结合的葡聚糖含量最多,具有更强的屏蔽效应。

图4 射流空化压力对SPI-葡聚糖样品荧光扫描光谱的影响Fig.4 Effect of jet cavitation powers on fluorescence spectra of SPI and SPI-dextran
2.5 紫外光谱分析
蛋白质产生紫外吸收主要是由于蛋白的发色基团对紫外光的吸收作用,发色基团包括色氨酸和酪氨酸残基侧链基团,根据对紫外光谱吸收的不同,可以推断蛋白质分子构象的变化[26]。不同射流空化压力对SPI-葡聚糖产物的紫外吸收光谱如图5所示,紫外吸收峰的最大值随空化压力的增加而增加。这说明SPI分子中的氨基酸残基因空化处理暴露在蛋白分子的表面,发色基团所处的环境由非极性向极性变化,促使蛋白多肽链局部展开[27]。在射流空化压力为1.5 MPa时紫外光谱的吸收峰取得最大值,之后呈现减小的趋势,这与2.4节荧光光谱的变化趋势一致。与对照SPI-葡聚糖反应产物相比,射流空化处理的SPI与葡聚糖美拉德反应产物的紫外吸收峰显著降低,可能是由于射流空化处理加快了SPI与葡聚糖的美拉德反应进程,蛋白质发生折叠自身聚集,使得蛋白分子中更多的疏水性残基再次埋到分子结构内部[28]。

图5 射流空化压力对SPI及SPI-葡聚糖样品紫外光谱的影响Fig.5 Effect of jet cavitation powers on UV-Vis spectra of SPI and SPI-dextran
2.6 表面疏水性分析
图6为SPI的表面疏水性指数,与天然SPI相比,经射流空化处理后SPI的H0显著增大(P<0.05)。这可能是由于空化处理的高压力改变了SPI构象,导致内部疏水性基团部分暴露,H0增大。但当射流空化压力超过1.5 MPa处理后H0有所下降,当疏水基团暴露较多时,其会通过疏水作用重新聚合[7]。空化处理的SPI发生美拉德反应后,较单独空化处理的SPI,SPI-葡聚糖反应产物的H0显著降低(P<0.05),且随空化压力逐渐增加H0呈现出先降低后增加的趋势(P<0.05)。当空化压力达到1.5 MPa,SPI-葡聚糖反应产物的H0达到最小值(17.29),与未进行射流空化处理的SPI-葡聚糖反应产物的H0相比减小了41.29%。这可能是空化处理使蛋白质分子结构伸展,促进SPI与葡聚糖发生美拉德反应时,使更多的葡聚糖结合到SPI分子上,导致亲水基团增多[29]。随射流空化压力继续增大SPI-葡聚糖反应产物的H0增大,这与过大的空化压力使蛋白分子聚集,减小了美拉德反应速率有关。

图6 射流空化压力对SPI及SPI-葡聚糖样品表面疏水性的影响Fig.6 Effect of jet cavitation powers on surface hydrophobicity of SPI and SPI-dextran
2.7 乳化特性分析

图7 射流空化压力对SPI及SPI-葡聚糖样品乳化活性和乳化稳定性的影响Fig.7 Effect of jet cavitation powers on EAI and ESI of SPI and SPI-dextran
乳化活性指能够参与并形成乳浊液的能力;乳化稳定性指在一定时间里,蛋白质能够维持乳化状态一直不变,既没有出现油相与水相分层的变化,也没有发生絮凝现象的能力,即能显著地降低油、水或空气、水的界面张力[30]。射流空化压力对SPI及SPI-葡聚糖反应产物的乳化活性和乳化稳定性的影响如图7所示,射流空化处理可显著增加SPI及SPI-葡聚糖反应产物的乳化特性,且与单独射流空化处理相比,射流空化协同美拉德反应显著增加了SPI的乳化活性和乳化稳定性(P<0.05)。与对照相比,当射流空化压力为1.5 MPa时,SPI的乳化活性和乳化稳定性分别增加了26.42%和30.13%。这可能是由于射流空化处理时,液体中空化泡溃灭时产生的强烈的冲击波及高时速的微射流产生空穴和机械效应改变了蛋白质的空间结构,使得极性侧链的水合作用增强,同时使包埋在分子内部的疏水性基团暴露出来,提高了其亲水性和亲油性,两者达到较好的平衡,乳化性增强[29]。当射流空化处理压力为1.5 MPa时,SPI与葡聚糖美拉德反应产物的乳化活性和乳化稳定性与对照(未射流空化处理SPI与葡聚糖美拉德反应产物)相比分别提高了40.61%和48.46%。美拉德反应的理想产物应该是蛋白的一部分疏水基团与多糖发生共价结合增加了复合物的亲水性,同时保留足够的疏水基团来维持产物的表面活性。射流空化处理使SPI分子结构伸展,有利于更多的葡聚糖结合到SPI分子侧链,其较强的亲水性使得SPI的亲水基团增多,亲水性增大,同时多糖链带来的空间位阻抑制了油相的聚集,因此含有许多支链基团的大分子SPI-葡聚糖美拉德反应产物更容易在油/水界面上分散排列,使得蛋白界面不会轻易聚集到一起,从而提高了两相界面之间的蛋白膜稳定性,使得油滴之间不易聚合,形成紧密的稳定层,改善了其乳化活性和乳化稳定性[31]。但当射流空化压力超过1.5 MPa时,SPI及SPI-葡聚糖反应产物的乳化活性和乳化稳定性呈现出下降的趋势。这主要是由于伸展的SPI分子通过氢键和二硫键等作用力重新聚合到一起,表面疏水性及水-油界面平衡力减弱,同时蛋白分子聚集导致美拉德反应速率降低,使得乳化活性和乳化稳定性下降[17]。这与2.2节中SPI-葡聚糖反应产物的接枝度变化趋势相一致。
3 结束语
以大豆分离蛋白和葡聚糖为原料,研究了射流空化压力对SPI的美拉德反应进程的影响,并进一步研究了射流空化压力对结合物结构及乳化特性的影响。研究显示:射流空化压力可增加美拉德反应的褐变程度、中间产物含量及接枝度,且当空化压力为1.5 MPa时,SPI与葡聚糖美拉德反应速度最快;射流空化处理可显著改善SPI的空间结构,蛋白分子伸展,使得包埋在分子内部的疏水性基团暴露出来,促进了美拉德反应进程;射流空化处理SPI-葡聚糖美拉德反应产物乳化特性优于单一的美拉德反应改性。本研究可为射流空化提高美拉德反应效率以及控制反应进程提供理论指导。
