高效液相色谱法同时测定防己药材中粉防己碱和防己诺林碱含量
2019-09-10杨帆吴梦丽高慧闫国跃何秋梅谢阳姣
杨帆 吴梦丽 高慧 闫国跃 何秋梅 谢阳姣


摘要:【目的】建立同時测定防己药材中粉防己碱和防己诺林碱含量的高效液相色谱方法(HPLC),为防己药材质量检测提供有效方法。【方法】用2%盐酸甲醇常温超声30 min提取粉防己碱和防己诺林碱,采用HPLC对江西、安徽、浙江、湖南、福建和广东等不同产地防己药材进行测定。色谱条件:色谱柱Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 μm),流动相为乙腈-0.08%三乙胺(75∶25),等度洗脱,进样量8 μL,流速1.0 mL/min,柱温25 ℃,检测波长282 nm,运行时间20 min。【结果】粉防己碱和防己诺林碱的线性范围分别为0~6000 μg/mL(R2=1.0000)和0~3000 μg/mL(R2=0.9999),平均回收率分别为104.99%和90.13%,相对标准偏差(RSD)分别为1.75%和2.70%;粉防己碱和防己诺林碱的稳定性RSD分别为1.06%和0.62%、精密度RSD分别为1.57%和0.06%、重复性RSD分别为1.04%和1.45%。不同产地防己药材中粉防己碱的含量变化范围为0.836%~5.999%,最高的是江西金桥乡株系3,最低的是浙江苏庄株系4;防己诺林碱的含量变化范围为0.507%~2.993%,最高的是广东天子地株系4,最低的是湖南贯塘株系1,RSD均小于5%。【结论】建立的HPLC测定方法简单、稳定性好、精密度高且运行时间短,可同时测定防己药材中粉防己碱和防己诺林碱含量,可考虑作为防己药材质量检测的方法。
关键词: 防己;粉防己碱;防己诺林碱;含量;高效液相色谱法(HPLC)
中图分类号: S567.9 文献标志码: A 文章编号:2095-1191(2019)11-2545-07
Simultaneous determination of tetrandrine and fangchindine
contents in Stephania tetradra S. Moore by high efficiency
liquid chromatography
YANG Fan, WU Meng-li, GAO Hui, YAN Guo-yue, HE Qiu-mei, XIE Yang-jiao*
(Guangxi University of Chinese Medicine, Nanning 530001, China)
Abstract:【Objective】A high efficiency liquid chromatography(HPLC) method for the simultaneous determination of tetrandrine and fangchinoline in Stephania tetrandra S. Moore was established to provide effective method to detect the quality of S. tetrandra. 【Method】Tetrandrine and fangchinoline were extracted by 2% hydrochloric acid and methanol at room temperature and ultrasonic for 30 min. S. tetrandra produced from Jiangxi, Anhui, Zhejiang, Hunan, Fujian and Guangdong were determined by HPLC. Chromatographic conditions:column Agilent Zorbax Extend-c18(4.6 mm×250 mm, 5 μm), the mobile phase acetonitrile-0.08% triethylamine water(75∶25), isoelution, injection volume of 8 μL, flow rate of 1.0 mL/min, column temperature of 25 ℃, detection wavelength of 282 nm, operation time of 20 min. 【Result】The linear ranges of tetrandrine and tetrandrine were 0-6000 μg/mL(R2=1.0000) and 0-3000 μg/mL(R2=0.9999), the average recoveries were 104.99% and 90.13%, the relative standard deviations(RSD) were 1.75% and 2.70%, the stability RSD of tetrandrine and tetrandrine were 1.06% and 0.62%, the precision RSD were 1.57% and 0.06%, the repeatability RSD were respectively 1.04% and 1.45%. The content of tetrandrine in different habitats ranged from 0.836% to 5.999%, the highest was strain 3 in Jinqiao, Jiangxi, the lowest was Strain 4 in Suzhuang, Zhejiang. The content of fangchinoline in different habitats ranged from 0.507% to 2.993%, and the highest was strain 4 in Tianzidi, Guangdong, the lowest was Strain 1 in Guantang, Hunan, with RSD less than 5%. 【Conclusion】The established HPLC method is simple, stable, precise and short in operation. It can be used for the simultaneous determination of tetrandrine and tetrandrine in Radix stephaniae, and can be considered as a method for the quality detection of S. tetradra.
Key words: Stephania tetradra S. Moore; tetrandrine; fangchinoline; content; high performance liquid chromatography(HPLC)
0 引言
【研究意义】防己为防己科植物粉防己(Stephania tetrandra S. Moore)的干燥根,具有利水消肿、祛风止痛的功效(国家药典委员会,2015)。粉防己碱和防己诺林碱为防己药材的主要化学成分,其含量是衡量防己药材质量的重要指标。研究表明,粉防己碱具有抗尘肺、抗癌及抗类风湿性关节炎等多种药理作用(刘畅和赵宝祥,2015;宋占帅等,2017;张艳辉等,2017;陈宁姿和楼红侃,2018;王宏等,2018);防己诺林碱在抗肿瘤(Ncube et al.,2012;Shi et al.,2017;Wang et al.,2017)、抗癌(于有江等,2017)和抑制增生性瘢痕(宋英莉等,2018)等方面有显著的生物活性。若能建立高效、简便测定粉防己碱和防己诺林碱含量的方法,可为防己药材质量检测提供有效手段。【前人研究进展】2015版《中国药典》(国家药典委员会,2015)已记载防己药材中粉防己碱和防己诺林碱含量的测定方法,但该法流动相需添加十二烷基磺酸钠,起泡多,消除泡沫时间长,且溶解温度要求严格,操作复杂。流动相混合可有效减少消除泡沫的时间,但混合流动相适合单通道进样,对于新的多通道进样液相色谱仪,该操作方法已不具优势。至今,已有不少研究者对流动相进行了改进。和健等(2006)采用甲醇—乙腈-0.003 mol/L磷酸二氢钾—二乙胺(55∶25∶20∶0.06)为流动相、杨学猛等(2007)采用甲醇—乙腈—水—二乙胺(60∶20∶20∶0.08)为流动相、白雪媛等(2017)采用甲醇—乙腈—水—二乙胺(52∶20∶28∶0.08)为流动相分别对迪可颗粒、舒肝饮丸和利心丸中粉防己碱和防己诺林碱含量进行测定,在这些色谱条件下样品中防己诺林碱和粉防己碱均分离效果良好。刘永刚等(2010)采用甲醇—乙腈—水—三乙胺(55∶25∶20∶0.05)为流动相测定防己药材中粉防己碱和防己诺林碱含量,结果表明该方法可有效测定这两种成分含量。以上几种改进的流动相,相对于药典法易配制,但流动相组分较多,仍具有改进空间。饶毅等(2006)测定防己药材中防己诺林碱和粉防己碱用的流动相为乙腈-0.2%磷酸(63∶37),流动相组分相对减少,但需用三乙胺调节pH,操作复杂且费时,对于大批量试验,流动相pH的差异会成为新的误差来源。蔡瑾瑾和韩海(2017)采用乙腈-0.2%三乙胺梯度洗脱测定复方防己注射液中延胡索乙素、粉防己碱和防己诺林碱含量,结果表明,该方法准确,且流动相较简单。【本研究切入点】目前,关于防己的研究主要集中在药理药效方面(朱祖成,2013;邢志博等,2016),虽然粉防己碱和防己诺林碱含量测定方法已有一定研究,但采用的流动相均较复杂(于士婷等,2017;关皎等,2018)。本研究基于2015版《中国药典》方法存在的缺陷及相关文献(朱鹤云等,2017)报道其流动相的复杂性,拟研究获得流动相组分较少、配制简单,同时测定粉防己碱和防己诺林碱含量的高效液相色谱法(HPLC)。【拟解决的关键问题】采用超生法提取防己中粉防己碱和防己诺林碱化学成分,利用HPLC对该成分进行含量测定,通过减少流动相数量,简化配置程序,以期解决流动相数量多、配置程序复杂的问题,为防己药材中粉防己碱和防己诺林碱含量的同时测定提供高效、低耗、简便的方法。
1 材料与方法
1. 1 试验材料
试验材料于2017年10月采自防己分布区江西、安徽、浙江、福建、湖南和广东等地,经广西中医药大学瑶医药学院谢阳姣研究员鉴定防己药材为正品。粉防己碱对照品(批号110711-201609,含量99.2%)购自中国食品药品检定研究院,防己诺林碱对照品(批号170301-005,含量98%)购自北京中兴嘉仁生物技术有限公司,乙腈为色谱纯,水為超纯水,其他试剂均为分析纯。主要仪器设备:Agilent 1260 Inifinal II高效液相色谱仪(包括G7111A四元泵、G7116A柱温箱、G7129A自动进样器、G7114AVWD检测器和Control panel化学工作站)(安捷伦科技有限公司);Sartorious BP211D十万分之一电子天平[赛多利斯科学仪器(北京)有限公司];超声波清洁机(宁波芝新科技有限责任公司)。
1. 2 试验方法
1. 2. 1 溶液配制
1. 2. 1. 1 混合对照品溶液配制 取粉防己碱对照品和防己诺林碱对照品适量,精密称定,加甲醇分别制成每l mL含粉防己碱0.3 mg、防己诺林碱0.15 mg的混合溶液。
1. 2. 1. 2 供试品溶液配制 取防己药材粉末约0.5 g,精密称定,按2015版《中国药典》中供试品溶液的制备方法,精密加入2%盐酸甲醇溶液25 mL,称定重量,常温超声30 min,取出,放冷,再称定重量,用2%盐酸甲醇溶液补足减失的重量,摇匀,过滤,精密量取续滤液5 mL置于10 mL容量瓶中,加流动相至刻度,摇匀,即得供试品溶液。
1. 2. 2 色谱条件 色谱柱Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 μm),流动相为乙腈-0.08%三乙胺(75∶25),等度洗脱,流速1.0 mL/min,紫外检测282 nm,柱温25 ℃,进样量8 μL,运行时间20 min。上述色谱条件的色谱图见图1。
1. 3 方法学考察
随机采用量多的江西省浮梁县勒功乡暗屋里2号药材进行试验。
1. 3. 1 线性关系考察 取混合对照品溶液,设仪器自动进样0、2、4、6、8、10、12、14、16、18和20 μL,以对照品的进样量为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得到回归方程,规定R2大于0.9999的浓度范围为线性范围。
1. 3. 2 精密度考察 取供试品溶液,连续进样6次,根据粉防己碱和防己诺林碱的峰面积分别计算相对标准偏差(RSD),检验HPLC的精密度。
1. 3. 3 稳定性考察 取供试品溶液,分别于0、2、4、6、8、10、12和24 h进样测定,根据粉防己碱和防己诺林碱的峰面积分别计算RSD,检验HPLC的稳定性。
1. 3. 4 重复性考察 制备供试品溶液6份,进样测定,以样品峰面积的平均值计算RSD,检验HPLC的重复性。
1. 3. 5 加样回收率考察 精密称取已测含量的防己样品6份,每份约0.5 g,按样品所含粉防己碱和防己诺林碱质量1∶1的比例加入对照品,精密加入2%盐酸甲醇50 mL,再按1.2.1.2的方法制备供试品溶液,进样测定,记录峰面积,计算加样回收率。
1. 4 单因素考察
1. 4. 1 提取溶剂考察 分别采用2%盐酸甲醇、50%甲醇、70%甲醇、100%甲醇和70%乙醇为提取溶剂,每种提取溶剂设3个重复,按1.2.2色谱条件进样分析,记录峰面积,筛选最佳提取溶剂。
1. 4. 2 提取方法考察 采用1.2.1.2供试品溶液提取方法,对比分析加热回流30 min和常温超声30 min,考察较佳提取方法。
1. 5 样品含量测定
取江西金桥乡、安徽老家谭、浙江苏庄镇、福建洋坊、湖南贯塘和广东天子地6个产地各3个不同株系的药材,按1.2.1.2的方法制备供试品溶液,采用1.2.2色谱条件测定,记录色谱峰面积,采用标准曲线法计算各样品含量。
1. 6 统计分析
采用Excel 2019和SPSS 13.0对试验数据进行统计分析,Duncans新复极差法进行单因素方差分析。
2 结果与分析
2. 1 方法学考察结果
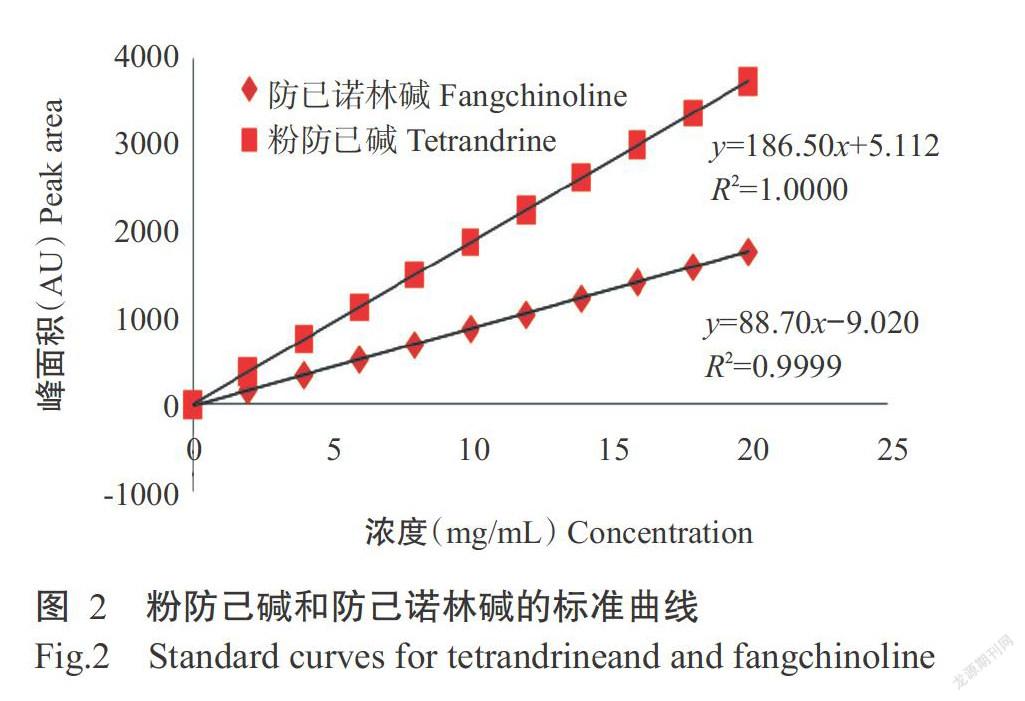
2. 1. 1 线性关系考察结果 由图2可知,防己诺林碱的回归方程为y=88.70x-9.020(R2=0.9999),粉防己碱的回归方程为y=186.50x+5.112(R2=1.0000),表明防己诺林碱和粉防己碱分别在0~3000 μg/mL和0~6000 μg/mL范围内与峰面积呈良好的线性关系。
2. 1. 2 精密度考察结果 结果显示,防己诺林碱峰面积RSD为0.06%,粉防己碱峰面积RSD为1.57%,均小于2.00%,表明建立的HPLC精密度良好。
2. 1. 3 稳定性考察结果 结果显示,防己诺林碱峰面积RSD为0.62%,粉防己碱峰面积RSD为1.06%,均小于2.00%,表明该供试品溶液在24 h内化学性质稳定。
2. 1. 4 重复性考察结果 结果显示,防己诺林碱的RSD为1.45%,粉防己碱的RSD为1.04%,均小于2.00%,表明建立的HPLC重复性良好。
2. 1. 5 加样回收率考察结果 由表1可知,防己诺林碱回收率为90.13%,粉防己碱回收率为104.99%,对应的RSD分别为2.70%和1.75%,均小于3.00%。表明建立的HPLC回收率试验符合要求。
2. 2 单因素考察结果
2. 2. 1 提取溶剂的选择 对各提取溶剂峰面积进行单因素方差分析,結果见表2。由表2可知,2%盐酸甲醇作为提取溶剂时,防己诺林碱和粉防己碱的峰面积均极显著大于其他溶剂(P<0.01,下同),其次为70%乙醇和70%甲醇,两者间无显著差异(P>0.05),但均极显著大于50%甲醇和100%甲醇的峰面积。粉防己碱各提取溶剂的分离度均较好;防己诺林碱的70%和50%甲醇不能有效分离,100%甲醇的分离度低于1.50,2%盐酸甲醇和70%乙醇具有有效的分离度。综合峰面积和分离度,选择2%盐酸甲醇作为最终提取溶剂。
2. 2. 2 提取方法的选择 对常温超声提取和加热回流提取两种方法的峰面积进行独立样本T 检验,结果见表3。由表3可知,两种提取方法的防己诺林碱含量差异未达95%的显著水平(Sig.=0.08),但粉防己碱的常温超声提取法显著高于加热回流法(Sig.=0.03)。根据实际操作提取用时少,并考虑超声提取方法简单、方便、经济,且可大批量操作,确定超声提取法为粉防己碱和防己诺林碱含量测定的前处理方法。
2. 3 含量测定结果
由表4可知,6个产地不同株系测定结果RSD均较小,表明建立的HPLC普遍适用于不同产地、不同防己药材的粉防己碱和防己诺林碱含量测定。6个不同产地防己药材的两种有效成分含量均符合药典规定的总含量不少于1.6%的最低要求,且不同产地和同一产地不同株系间防己药材含量存在差异。不同产地中防己诺林碱的含量变化范围为0.507%~2.993%,以广东天子地株系4的含量最高,湖南贯塘株系1的含量最低;粉防己碱的含量变化范围为0.836%~5.999%,最高的是江西金桥乡株系3,最低的是浙江苏庄株系4,其中,广东和江西防己药材的两种成分含量普遍高于湖南、福建、浙江和安徽。
3 讨论
3. 1 色谱柱的选择
采用Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 ?m)色谱柱(pH适用范围2~8)进行预试验,适用流动相条件为乙腈-0.03%三乙胺(75∶25),pH接近7,流速1.0 mL/min,进样量10 ?L,柱温25 ℃,波长282 nm,运行时间25 min,在该条件下,防己诺林碱峰形有轻微拖尾、对称因子较低,但总体基线平稳。本研究采用的色谱柱为Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 ?m),其pH适用范围2.0~11.5,该色谱柱采用前述条件,出现杂峰多、主要成分不出峰、基线不平稳。调整三乙胺浓度为0.08%,流动相比例仍为75∶25,pH接近9.0、进样量降至8 ?L时,防己诺林碱峰形拖尾问题得到解决,对称因子高,运行时间降为15 min,但测定结果相对于Agilent ZORBAX SB-C18测定的含量较低。此外,两根色谱柱的峰形分离度均较好,但第一根色谱柱由于pH耐碱范围窄,出现硅胶基质溶解、柱子进样压力波动大,伴随填料塌陷、柱效快速下降、峰形越来越差且有肩峰出现等现象。液相色谱测定法,因色谱柱的差异,测定条件和测定结果会有差异,粉防己碱类物质作为碱性较强的物质,需考虑耐碱范围更宽的柱子,综合考虑色谱柱耐用性和峰形对称性,粉防己碱类物质的测定宜采用pH适用范围较宽的Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 ?m)色谱柱。
3. 2 流动相考察
本研究所测物质为生物碱,碱性物质色谱峰拖尾是一个较难解决的问题,一般解决原则为酸性化合物拖尾加酸,碱性化合物拖尾加碱,故本研究采用添加碱性物质三乙胺以解决拖尾问题。试验仅以乙腈和三乙胺为流动相,通过调整流动相比例(90∶10、85∶15、80∶20和75∶25)和三乙胺浓度(0.03%、0.05%、0.06%、0.08%和0.10%),并比较不同流速(0.5、0.8和1.0 mL/min)和不同柱温(25、30、35和40 ℃)下各待测成分的分离度,发现在流动相比例75∶25、三乙胺浓度0.08%、流速1.0 mL/min、25 ℃下能获得较好的分离效果。在色谱条件摸索过程中发现,三乙胺用量是一个较敏感的因素,用量过小则分离度不好,用量过大会使流动相pH偏高,致使色谱柱硅胶基质发生溶解,从而影响色谱柱的使用寿命,且色谱峰峰形对流动相pH的变化较敏感,与侯丽丽等(2013)的研究结果一致;柱温对分离度影响不明显;在有缓冲盐的情况下不宜选择低流速。由于三乙胺的比例和浓度是影响试验结果的敏感因素,若参照本研究方法但采用不同色谱柱时,建议重点考察三乙胺的比例和浓度。
3. 3 检测波长的选择
采用沃特世2695检测器在200~400 nm进行波长的考察,发现在波长210~280 nm会发生基线下移,出现负峰,波长达280 nm时负峰消失,与宋俊蓉等(2018)的研究结果存在差异。究其原因可能是波长不合适或使用的流动相具有高吸收系数,也有可能进样注射器进入了空气或色谱柱柱效下降等。
3. 4 提取注意事项
生物碱属于大极性成分,对样品前处理要求较高,若处理不当,会出现峰形分离不理想,直接影响客观判断,也容易污染柱头降低色谱柱使用寿命。因此,在提取过程中,应注意使用器皿等的清洗、称量纸的勤换、溶液的均匀度等细节问题。
3. 5 与前人已有成果的对比分析
本研究最初选择药典法,但由于流动相需添加表面活性剂,起泡性强,前处理较耗时,经查阅相关文献(和健等,2006;杨学猛等,2007;刘永刚等,2010;白雪媛等,2017),发现各研究对药典法流动相的改进均取得了较好的效果,但仍存在试验复杂和操作繁琐的问题。本研究在前人研究的基础上,对流动相进行简化,获得与其他研究(杨学猛等,2007;刘永刚等,2010;于士婷等,2017;关皎等,2018)相同的测定结果,且具有更快速、高效、低耗和简便的优点。
3. 6 不同产地防己药材防已诺林碱和粉防已碱含量差异分析
本研究结果表明,不同产地及同一产地不同株系防己药材中防己诺林碱和粉防己碱含量均存在差异,与赖晓莲等(2015)的研究结果一致。药材的有效成分主要为植物次生代谢物质,次生代谢物质的合成和积累由种质因素决定,同时受环境因素影响,是植物与环境长期进化结果的产物(阎秀峰等,2007)。在药用植物的生长发育过程中,药用植物次生代谢产物的类型、含量和比例均可能受到一系列环境因素的影响(Ncube et al.,2012),進而影响其药物内在含量。从本研究结果来看,不同产地防己中防己诺林碱和粉防己碱含量的差异可能受种质差异和环境的双重影响,而同一产地不同防己株系间药材有效成分含量的差异,更多的来自于种质间的差异。同一产地防己种质存在多样性,可为防己优良种质选育提供大量种质资源。
不同产地防己药材防己诺林碱和粉防己碱的含量测定结果也表明,本研究建立同时测定防己诺林碱和粉防己碱含量的方法,其重复性和稳定性等均可达到HPLC测定药材药效成分含量的要求,可用于不同产地、不同批次防己药材中防己诺林碱和粉防己碱含量的测定。
4 结论
建立同时测定防己药材中防己诺林碱和粉防己碱含量的HPLC线性关系好,精密度、稳定性、重复性及加样加收率均符合相关要求,且运行时间短,可节约测试时间,可用于不同产地、不同批次防己药材防己诺林碱和粉防己碱含量的测定,可考虑作为防己药材质量检测的方法。
参考文献:
白雪媛,尹翌秋,王彤,张巍,王佳雯,赵雨,赵大庆. 2017. HPLC法同时测定利心丸中粉防己碱和防己诺林碱含量[J]. 中华中医药杂志,32(7):3235-3238. [Bai X Y,Yin Y Q,Wang T,Zhang W,Wang J W,Zhao Y,Zhao D Q. 2017. Simultaneous determination of tetrandrine and fangchinoline in Lixin Pill by HPLC[J]. China Journal of Traditional Chinese Medicine and Pharmacy,32(7):3235-3238.]
蔡瑾瑾,韩海. 2017. HPLC同时测定复方防己注射液中延胡索乙素、粉防己碱和防己诺林的含量[J]. 成都中医药大学学报,40(2):34-37. [Cai J J,Han H. 2017. Determination of tetrahydropalmatine,tetrandrine and fangchinoline in compound tetrandrine injection by HPLC[J]. Journal of Chengdu University of Traditional Chinese Medicine,40(2):34-37.]
陈宁姿,楼红侃. 2018. 汉防己甲素治疗类风湿性关节炎合并骨质疏松症效果观察[J]. 中国乡村医药,25(5):26-27. [Chen N Z,Lou H K. 2018. Observation of the effect of tetrandrine on rheumatoid arthritis with osteoporosis[J]. Chinese Journal of Rural Medicine and Pharmacy,25(5):26-27.]
关皎,张颖,费雪,孙宇慧,王黎明,郝乘仪,冯波,朱鹤云. 2018. 反相高效液相色谱法测定防己黄芪汤中6种活性成分的含量[J]. 吉林医药学院学报,39(5):321-325. [Guan J,Zhang Y,Fei X,Sun Y H,Wang L M,Hao C Y,Feng B,Zhu H Y. 2018. Determination of six active components in Fangji Huangqi Decoction by RP-HPLC[J]. Journal of Jilin Medical University,39(5): 321-325.]
国家药典委员会. 2015. 中华人民共和国药典[M]. 北京:中国医药科技出版社. [Chinese Pharmacopoeia Commi-ssion. 2015. Pharmacopoeia of the Peoples Republic of China[M]. Beijing:China Medical Science Press.]
和健,穆丽华,王建国,刘刚叁. 2006. RP-HPLC法同时测定迪可颗粒中粉防己碱和防己诺林碱的含量[J]. 药物分析杂志,26(l):107-109. [He J,Mu L H,Wang J G,Liu G S. 2006. RP-HPLC determination of tetrandrine and fangchi-noline in Dike granules[J]. Chinese Journal of Pharmaceutical Analysis,26(l):107-109.]
侯丽丽,晏永新,张丽. 2013. HPLC法测定复方防己口服液中粉防己碱和防己诺林碱的含量[J]. 中国兽药杂志,47(2):24-26. [Hou L L,Yan Y X,Zhang L. 2013. Determination of tetrandrine and fangchinoline in compound Fangji oral solution by HPLC[J]. Chinese Journal of Veterinary Drug,47(2):24-26.]
赖晓莲,郭圣茂,彭仁,陈兰兰,廖兴国. 2015. 江西省不同产地粉防己主要药效成分含量分析[J]. 福建林业科技,42(1):84-86. [Lai X L,Guo S M,Peng R,Chen L L,Liao X G. 2015. Determination of tetrandrine and fangchindine in Stephania tetrandra from different areas in Jiangxi Province[J]. Journal of Fujian Forestry Science and Technology,42(1):84-86.]
刘畅,赵宝祥. 2015. 汉防己甲素对小鼠血管内皮瘤细胞的影响及其分子机制研究[J]. 中国生化药物杂志,35(3):54-57. [Liu C,Zhao B X. 2015. Effects of tetrandrine on murine hemangioendothelioma cell and its molecular mechanisms[J]. Chinese Journal of Biochemical Pharmaceutics,35(3):54-57.]
劉永刚,刘勇,何瑞杰,赵保胜,韩静,马群. 2010. HPLC测定防己中防己诺林碱和粉防己碱的含量[J]. 中国实验方剂学杂志,16(9):49-51. [Liu Y G,Liu Y,He R J,Zhao B S,Han J,Ma Q. 2010. Determination of tetrandrine and fangchinoline in Stephania tetradra S. Moore by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae,16(9):49-51.]
饶毅,黎莉,刘隆洪,袁华生,魏惠珍,黄周华,杨世林. 2006. HPLC法同时测定防己药材中防己诺林碱和粉防己碱[J]. 中草药,37(4):612-613. [Rao Y,Li L,Liu L H,Yuan H S,Wei H Z,Huang Z H,Yang S L. 2006. Simultaneous determination of tetrandrine and tetrandrine in Radix Stephaniae Tetrandrae by HPLC[J]. Chinese Traditional and Herbal Drugs,37(4):612-613.]
宋俊蓉,娄华勇,方友来,蓝俊杰,何敏,马小攀,潘卫东. 2018. HPLC法同时测定粉防己中汉防己甲素和汉防己乙素的含量[J]. 山地农业生物学报,37(3):79-83. [Song J R,Lou H Y,Fang Y L,Lan J J,He M,Ma X P,Pan W D. 2018. Simultaneous determination of tetrandrine and fangchinoline from Stephania tetrandra by HPLC[J]. Journal of Mountain Agriculture and Biology,37(3):79-83.]
宋英莉,王洪一,马书丹,徐志山,陶凯. 2018. 防己诺林碱对增生性瘢痕的抑制作用[J]. 中国美容整形外科杂志,29(5):297-299. [Song Y L,Wang H Y,Ma S D,Xu Z S,Tao K. 2018. The inhibitory effect of fangchinoline on hypertrophic scars[J]. Chinese Journal of Aesthetic and Plastic Surgery,29(5):297-299.]
宋占帅,张娟,张蓉,沈秀娟. 2017. 补阳还五汤联合汉防己甲素片改善矽肺肺纤维化效果观察[J]. 山东医药,57(42):51-53. [Song Z S,Zhang J,Zhang R,Shen X J. 2017. Effect of Buyang Huanwu decoction combined with tetrandrine tablets on silicosis fibrosis[J]. Shandong Medical Journal,57(42):51-53.]
王宏,郭晓远,吴国建,陈陆馗. 2018. 汉防己甲素联合紫杉醇逆转脑胶质瘤C6/MDR细胞耐药及其机制研究[J]. 中草药,49(11):2584-2590. [Wang H,Guo X Y,Wu G J,Chen L K. 2018. Combination of tetrandrine and paclitaxel overcomes multidrug resistance on C6/MDR glioma cells[J]. Chinese Traditional and Herbal Drugs,49(11):2584-2590.]
邢志博,王凤梅,王翠平,慕强,王启堂. 2016. 粉防己有效成分的药理活性研究进展[J]. 中国实验方剂学杂志,20(9):241-246. [Xing Z B,Wang F M,Wang C P,Mu Q,Wang Q T. 2016. Advance on study of chemical components,pharmacological effect of Stephania tetrandra[J]. Chinese Journal of Experimental Traditional Medical Formulae,20(9):241-246.]
阎秀峰,王洋,李一蒙. 2007. 植物次生代谢及其与环境的关系[J]. 生态学报,27(6):2554-2562. [Yan X F,Wang Y,Li Y M. 2007. Plant secondary metabolism and its response to environment[J]. Acta Ecologica Sinica,27(6):2554-2562.]
杨学猛,徐凤梅,魏景文,罗桂萍. 2007. RP-HPLC测定舒肝饮丸中粉防己碱和防己诺林碱的含量[J]. 天津医药,35(4):289-290. [Yang X M,Xu F M,Wei J W,Luo G P. 2007. Determination of tetrandrine and tetrandrine in Shuganyin pills by RP-HPLC[J]. Tianjin Medical Journal,35(4):289-290.]
于士婷,赵大庆,尹翌秋,白雪媛. 2017. 利心丸中粉防己碱 HPLC检测方法的建立及其评价[J]. 长春中医药大学学报,33(4):537-540. [Yu S T,Zhao D Q,Yin Y Q,Bai X Y. 2017. Simultaneous determination of tetrandrine in Lixin pills by HPLC[J]. Journal of Changchun University of Traditional Chinese Medicine,33(4):537-540.]
于有江,罗雪,叶记林,苏兰娣,彭建明. 2017. 汉防己乙素对人肺癌95D细胞凋亡的诱导作用及机制[J]. 山东医药,57(38):5-7. [Yu Y J,Luo X,Ye J L,Su L D,Peng J M. 2017. Effect of fangchinoline on proliferation of human lung cancer 95D cells[J]. Shandong Medical Journal,57(38):5-7.]
張艳辉,郝翠,王炳高,邢志博,王凤梅. 2017. 防己诺林碱诱导人乳腺癌细胞MDA-MB-231凋亡的作用机制[J]. 癌症进展,15(3):250-282. [Zhang Y H,Hao C,Wang B G,Xing Z B,Wang F M. 2017. The mechanism of fangchi-noline in inducing the apoptosis of MDA-MB-231 human breast cancer cells[J]. Oncology Progress,15(3):250-282.]
朱鹤云,费雪,孙宇慧,王黎明,郝乘仪,冯波,关皎. 2017. UFLC法同时测定防己中粉防己碱和防己诺林碱的含量[J]. 中国兽医杂志,53(8):91-93. [Zhu H Y,Fei X,Sun Y H,Wang L M,Hao C Y,Feng B,Guan J. 2017. Simultaneous determination of tetrandrine and fangchinoline in Stephania tetrandra S. Moore by UFLC[J]. Chinese Journal of Veterinary Medicine,53(8):91-93.]
朱祖成. 2013. 粉防己碱对肾性高血压大鼠血压及抗氧化作用影响研究[J]. 辽宁中医药大学学报,15(4):44-46. [Zhu Z C. 2013. Effects of tetrandrine on blood pressure and serum antioxidant ability in renovascular hypertensive rats[J]. Journal of Liaoning University of Traditio-nal Chinese Medicine,15(4):44-46.]
Ncube B,Finnie J F,van Staden J. 2012.Quality from the field:The impact of environmental factors as quality determinants in medicinal plants[J]. South African Journal of Botany,82:11-20.
Shi J,Guo B Y,Hui Q,Chang P,Tao K. 2017. Fangchinoline suppresses growth and metastasis of melanoma cells by inhibiting the phosphorylation of FAK[J]. Oncology Reports,38(1):63-70.
Wang B G,Xing Z B,Wang F M, Yuan X Y, Zhang Y H. 2017. Fangchinoline inhibits migration and causes apoptosis of human breast cancer MDA-MB-231cells[J]. Oncology letters,14(5):5307-5312.
(责任编辑 罗 丽)
