鱼鸭混养池塘罗非鱼无乳链球菌病的病原分离鉴定及其防治
2019-09-10陈福艳黎建斌欧阳贤华杨学明黄彩林李大列雷爱莹梁万文
陈福艳 黎建斌 欧阳贤华 杨学明 黄彩林 李大列 雷爱莹 梁万文


摘要:【目的】查明罗非鱼与鸭混养模式下引起罗非鱼发病的主要病原,并探索微生物与中药综合防治的有效方法,为建立安全、高效的鱼鸭混养模式提供科学依据。【方法】从广西南宁市隆安县那桐镇某罗非鱼与鸭混养池塘的发病罗非鱼中取样进行病原菌分离纯化,对获得的纯化分离菌株进行16S rRNA序列测序及人工感染试验和药敏试验,并在药敏试验的基础上采用内服结合外用消毒的方式进行治疗,且在罗非鱼痊愈后使用微生物制剂(成分为芽孢杆菌、乳酸菌、酵母菌和光合菌等)调节池塘水质,同时给罗非鱼投喂微生物制剂和中药(三黄散、肝胆利康散和黄芪多糖)。【结果】引起罗非鱼与鸭混养池塘中罗非鱼发病的病原菌为无乳链球菌(Streptococcus agalactiae),其对罗非鱼的半数致死浓度(LD50)为4.7×106 CFU/mL,对罗红霉素、青霉素、氯霉素、磺胺异恶唑、阿莫西林、利福平、头孢克洛、呋喃唑酮、氟本尼考、头孢氨苄和头孢派酮等抗菌药物高度敏感,对诺氟沙星、庆大霉素和卡那霉素不敏感(耐药)。通过内服氟苯尼考、三黄散、维生素K3和黄芪多糖并全塘泼洒戊二酫与苯扎溴铵混合液及过硫酸氢钾,连续用药14 d后罗非鱼病情基本得到控制。定期泼洒微生物制剂,结合罗非鱼内服微生物制剂和中药的效果良好,即使在高温季节也未出现水质恶化和鱼类发病现象。【结论】引起鱼鸭混养池塘罗非鱼发病的病原菌为无乳链球菌,可采取氟本尼考与三黄散、维生素K3和黄芪多糖联合用药的方法进行治疗。生产上,在鱼鴨混养池塘泼洒微生物制剂及罗非鱼内服微生物制剂和中药,对改善池塘水质及预防疾病发生具有积极作用,能有效降低鱼鸭混养模式下鱼类的发病率。
关键词: 罗非鱼;鱼鸭混养模式;无乳链球菌;微生物制剂;中药
中图分类号: S943.125.42 文献标志码: A 文章编号:2095-1191(2019)11-2583-09
Isolation, identification and prevention of the pathogen of Streptococcus agalactiae disease in tilapia of fish-duck polyculture pond
CHEN Fu-yan1, LI Jian-bin1, OUYANG Xian-hua2, YANG Xue-ming1, HUANG Cai-lin3, LI Da-lie1, LEI Ai-ying1, LIANG Wan-wen1*
(1Guangxi Academy of Fisheries Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture, Nanning 530021, China; 2Guangxi Fangcao Angui Biotechnology Co., Ltd., Nanning
530001, China; 3Guangxi Aquatic Products Breeding Center, Nanning 530031, China)
Abstract:【Objective】To identify the pathogens of tilapia diseases in a tilapia-duck polyculture pond, explore the ways to comprehensively control diseases by microorganisms and Chinese herbal medicines, and provide scientific basis for establishing a safe and efficient fish-duck polyculture model. 【Method】The pathogen of tilapia fish disease in a tilapia-duck polyculture pond in Natong, Longan, Nanning were isolated and identified, and 16S rRNA sequencing, artificial infection test and drug sensitivity test on the purified isolate were performed. Then oral administration combined with external disinfection was used for treatment based on the drug sensitivity test. After the tilapia were cured, the microbial preparations(the ingredients were bacillus, lactobacillus, yeast and photosynthetic bacteria, etc.) were used to control the water quality of the pond, and tilapia were fed with microbial preparations and traditional Chinese medicines(Sanhuangsan, Gandanlikangsan and Astragalus polysaccharides). 【Result】The pathogen of the tilapia disease in this pond was identified as Streptococcus agalactiae, and its medium lethal concentration(LD50) for tilapia was 4.7×106 CFU/mL. It was highly sensitive to roxithromycin, penicillin, chloromycetin, sulfanisoxazole, amoxicillin, rifampicin, cefaclor, furazolidone, flubenicol, cefalexin and cefoperazone, and resistant to norfloxacin, gentamicin and kanamycin. After continuous oral administration of flufenicol, Sanhuangsan, vitamin K3, astragalus polysaccharides, and the whole pond sprayed with a concentrated glutaridine/benzamium bromide solution and potassium persulfate for 14 d, tilapia disease was basically controlled. The spray of microbial preparations regularly combined with oral administration of microbial preparations and Chinese herbal medicines had sound effects on water quality, no deterioration of water quality and disease occurred even in hot seasons. 【Conclusion】The pathogen causing tilapia in fish-duck polyculture ponds was S. agalactiae, which can be treated with the combination of flubenico, Sanhuangsan, vitamin K3 and astragalus polysaccharide. In production, spraying microbial preparations and oral administration of microbial preparations and Chinese herbal medicines on fish-duck polyculture ponds has a positive effect on improving water quality and preventing disease occurrence, and can effectively reduce the disease incidence of fish in polyculture modes.
Key words: tilapia; fish-duck polyculture; Streptococcus agalactiae; microbial preparation; Chinese herbal medicine
0 引言
【研究意义】罗非鱼作为我国广西、广东、海南、福建和云南等地经济鱼类的主要养殖品种之一(骆乐和何韬,2006),其养殖模式多种多样,包括单养、混养和立体养殖等(刘雪兵等,2013)。无论采取哪种养殖模式,罗非鱼均表现出生长速度快和抗病力强的优点(吕业坚和黄玉玲,2011)。罗非鱼与鸭混养是一种常见的立体养殖模式,养殖者利用周边开阔的水岸养殖鱼和鸭,实现鱼鸭双丰收(李继业,1997;黄邦星,2007),但在该养殖模式下的水质极易恶化,进而导致鱼病频发(梅文涛和齐同俊,2008;袁媛等,2013),其主要原因是鸭粪直接排入池塘堆积在底泥中,糞泥经厌氧菌分解产生大量的有机酸、氨氮化合物、硫化物和亚硝酸盐,造成水质恶化及水体pH降低,促使各种病菌快速繁殖(张千云,1999)。近年来,鱼鸭混养模式在我国得到广泛推广应用,特别是在南方地区罗非鱼与鸭混养模式最常见,但也存在病害频发、药物治疗效果不佳而造成罗非鱼病期长和持续性死亡的现象,给养殖者带来巨大经济损失(崔小华等,2014;吕小丽等,2017)。因此,明确罗非鱼与鸭混养模式下引起罗非鱼发病的主要病原,并探索药物防治结合微生物制剂调控水质的综合防治措施,对促进鱼鸭混养模式健康发展具有重要意义。【前人研究进展】目前,已有大量关于罗非鱼病原菌鉴定的研究报道。谭健民和陈信廉(2010)对广东发病罗非鱼的肝脏等器官进行细菌分离鉴定,明确引起罗非鱼发病的病原体为海豚链球菌(Streptococcus iniae);黄钧等(2012)对患竖鳞病的罗非鱼进行病原分离和鉴定,结果显示该病是由嗜水气单胞菌(Aeromonas hydrophila)与温和气单胞菌(A. sobria)共同感染引起;黄艳华等(2014)从濒死罗非鱼脑部分离并鉴定出罗非鱼无乳链球菌(S. agalactiae);吕小丽等(2016)从大批死亡的罗非鱼腹水、肝脏和心脏组织中分离出类志贺邻单胞菌(Plesiomonas shigelloides),并进行药敏试验,为该病的防治提供了参考。在罗非鱼病害防治方面,胡大胜等(2012)对比了12种药物对罗非鱼无乳链球菌的抑菌效果,结果发现青霉素G、盐酸沙拉沙星、氨苄青霉素和氟苯尼考对罗非鱼无乳链球菌的抑菌效果最佳;黄钧等(2012)研究发现复达欣、菌必治、氟哌酸、恩诺沙星、环丙沙星、先锋必、特治星、氟苯尼考、盐酸沙拉沙星和复方磺胺嘧啶等20种药物可有效抑制罗非鱼嗜水气单胞菌和温和气单胞菌;此外,张彬等(2010)研究发现黄连、金银花、黄芩、大黄、连翘和黄柏等中药水提物对罗非鱼海豚链球菌有抑菌作用;高桂生等(2016)研究发现五倍子、乌梅、沙棘和苏木4种中药水提物对罗非鱼温和气单胞菌有明显抑菌作用,将其两两组合后发现五倍子+乌梅组合的抑菌效果最强;梁志凌等(2016)采用82种中药对罗非鱼无乳链球菌进行体外抑菌试验,结果显示黄连、五倍子和红藤等20种中药的水提物可显著抑制罗非鱼无乳链球菌。【本研究切入点】近年来,关于鱼鸭混养模式的研究报道主要集中在养殖经济效益分析方面(黄秋标等,2015;张恒和庞涛,2017),而对于在罗非鱼与鸭混养模式下鱼病病原菌的鉴定鲜见报道,且利用化学药物、微生物或中药针对该养殖模式下发生的鱼病进行防治也尚无报道。【拟解决的关键问题】查明罗非鱼与鸭混养池塘内引起罗非鱼发病的主要病原,并探索微生物与中药综合防治的有效方法,为建立安全、高效的鱼鸭混养模式提供科学依据。
1 材料与方法
1. 1 试验材料
细菌基因组DNA提取试剂盒、2×Taq PCR MasterMix和DNA胶回收试剂盒购自天根生化科技(北京)有限公司;奥可丹水质测试盒购自无锡奥可丹生物科技有限公司;药敏纸片(罗红霉素、青霉素、氯霉素、磺胺异恶唑、阿莫西林、利福平、头孢克洛、呋喃唑酮、氟本尼考、头孢氨苄、头孢派酮、恩诺沙星、诺氟沙星、庆大霉素和卡那霉素15种药片)购自杭州天和微生物试剂有限公司;优酸菌和碳源购自南宁欧海生物科技有限公司;氟苯尼考、恩诺沙星、维生素K3、肝胆利康散和三黄散购自北京鑫洋水产高新技术有限公司;戊二酫(20%)购自广西南宁诺惠动物药业有限公司;黄芪多糖购自成都芳水生物科技有限公司;过硫酸氢钾购自上海泰缘生物科技股份有限公司。
1. 2 水域条件
发病罗非鱼池塘位于广西南宁市隆安县那桐镇,水源丰富、无污染,水域面积7 ha,水深2.5~3.0 m;排灌方便,周边通风向阳,无高大树木等障碍物;池塘东南面有低矮的小灌木坡,鸭舍搭建在池塘北面平缓坡岸,管理人员居住用房建造在池塘西面。
1. 3 池塘清整与鱼种放养
2018年3月中旬,当水温上升至18 ℃以上时开始清整池塘和清除周边杂草和树木,注入新水至水深达1.0~1.5 m;3月25日使用生石灰清塘,用量为2250 kg/ha。池塘水体毒性消失且水温在20 ℃以上时开始投苗。共投放罗非鱼种19.0万尾,其中,4.0万尾规格为100~150 g/尾,15.0万尾规格为8~10 g/尾;且陆续投入其他配养品种:鲤鱼种15.0万尾、草鱼种5.0万尾、链鱼种0.8万尾、鳙鱼种0.5万尾及鲶鱼种0.3万尾。
1. 4 池塘日常管理
1. 4. 1 饲料投喂 主要投喂罗非鱼饲料,根据罗非鱼规格不断调整饲料颗粒大小及蛋白含量。饲料为广西百跃牌罗非鱼颗粒饲料,蛋白含量为28%~32%。坚持“定时、定点、定质和定量”的科学投喂方法,并结合天气及鱼群情况适当调整。每天投喂2次,分别在上午8:00—9:00和下午16:00—17:00。投喂时先喂大鱼后喂小鱼,时间控制在40~60 min。
1. 4. 2 水质管理 池塘适时加注新水。早期(4—6月)每半个月用生石灰调节水质,用量为195~225 kg/ha。罗非鱼发病后除正常使用生石灰调节水质外,还添加微生物制剂调控水质。
1. 4. 3 日常管理 增氧机每天中午开机1~2 h,凌晨开机3~5 h,主要坚持“三开三不开”原则(晴天中午开机,阴天次日清晨开机,连续阴雨半夜开机;傍晚不开机,阴雨天中午不開机,早上日出后不开机)。同时视具体情况适当调整,以鱼群不缺氧为宜。每日早中晚巡查池塘,观察鱼群的活动、进食及水质变化等情况,发现问题及时处理。
1. 5 水质与病害监测
池塘pH、氨氮、亚硝酸盐及溶解氧等水质指标采用奥可丹水质测试盒进行测量,每周测量1次,测量时间为上午9:00—11:00。通过日常观察鱼群的活动、进食及水质指标等情况,初步判断其健康状况;如发现鱼出现浮头、食量减少或不食及鱼打转等异常症状,则参考SC/T 7014—2006《水生动物检疫实验技术规范》(夏艳洁等,2007),采集病鱼样本进行细菌分离鉴定。
1. 6 细菌分离与鉴定
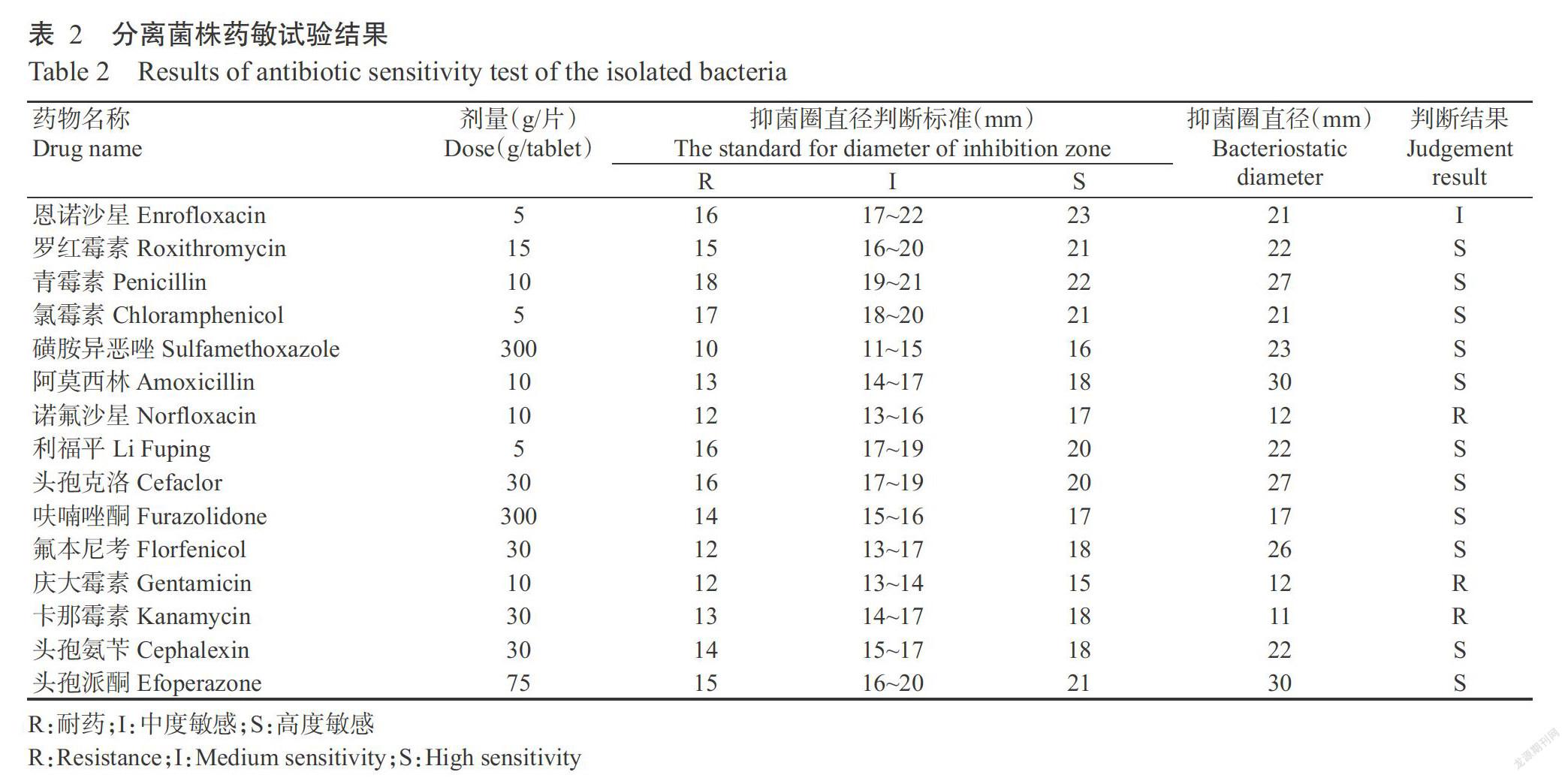
参照何力等(2007)的方法,对表现出浮头、打转、突眼及体表红肿充血等典型症状的濒死罗非鱼(10尾)进行细菌分离。无菌条件下剖取病鱼的脑组织、肝脏和肾脏等,取样接种于血琼脂培养基上,37 ℃培养24 h后观察菌落的生长情况。挑取血琼脂培养基上生长的单一菌落进行纯化培养,并进行革兰氏染色和显微观察。采用细菌基因组DNA提取试剂盒对纯化后的细菌进行DNA提取,然后用于PCR扩增。分离菌株16S rRNA的PCR扩增引物为16S-F(5'-AGAGTTTGATCMTGGCTCAG-3')和16S-R(5'-TACGGYTACCTTGTTACGACTT-3'),目的片段大小约1450 bp。PCR反应体系20.0 μL:细菌基因组DNA 1.0 μL,2×Taq PCR MasterMix 10.0 μL,上、下游引物(10 pmol/μL)各0.8 μL,以超纯水补足至20.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,进行30个循环;72 ℃延伸5 min。PCR扩增产物经琼脂糖凝胶电泳后,使用DNA胶回收试剂盒对阳性PCR扩增产物进行回收纯化,然后送至上海基康生物技术有限公司测序,将测序结果输入NCBI(http://blast.st-va.ncbi.nlm.nih.gov)核酸数据库进行同源性比对分析,以确定细菌种类。
1. 7 回归感染试验
挑取纯化后的分离菌株进行人工感染试验,用于人工感染试验的罗非鱼共200尾,规格150.0±10.0 g/尾,暂养期间健康无病。将罗非鱼随机均分为5组,每组2个平行,每个平行20尾鱼,分别养殖在0.8 m3的塑料桶内,每桶配充气石1个。第1组为空白对照组,注射生理盐水(0.2 mL/尾),其余4组分别注射1.5×105、1.5×106、1.5×107和1.5×108 CFU/mL的菌悬液。菌悬液用灭菌生理盐水进行梯度稀释。人工感染后连续观察14 d,重点观察和记录罗非鱼的活动及死亡情况,并测量水温、pH和氨氮等指标。采用Reed-Muench氏法计算细菌的半数致死浓度(LD50)。
1. 8 药敏试验及临床治疗
采用纸片扩散法(K-B)对分离菌株进行药敏试验,药敏试验结果判断标准参照美国临床实验室标准化委员会(CLSI)公布的标准进行判断,个别药物判断标准参照其说明书。分离菌株经纯化培养后,使用灭菌生理盐水进行洗脱稀释制备菌悬液(1.5×107 CFU/mL);在无菌条件下取300 μL菌悬液涂布于胰蛋白胨大豆(TSB)培养皿(直径11.5 cm)上,待培养基稍凉干后将药敏纸片贴上,用摄子轻压纸片;每个平皿贴6片,每种药物3个平衡;37 ℃培养箱培养24 h后测量抑菌圈。根据药敏试验结果选择合适药物,并结合临床经验对患病罗非鱼进行治疗。
1. 9 微生物调控水质及中药预防病害措施
病害治愈后,定期使用微生物制剂调节池塘水质,并定期灌服微生物制剂和中药以提高其免疫力。微生物制剂发酵制备:按照复合微生物干粉(含芽孢杆菌、乳酸菌、酵母菌和光合菌等复合物)1 kg∶碳源5 kg∶暴气自来水100 kg的比例进行均匀搅拌,将搅拌物密封于发酵罐,置于阴凉处,或在25~35 ℃的气温条件下发酵2~3 d即可使用,发酵液在养护和使用过程中要注意防止污染。微生物制剂使用分为环境外泼和拌料内服两种方式。使用微生物制剂前,需提前12 h以过硫酸氢钾进行池塘改底。微生物制剂外泼用量为45~75 kg/ha,每隔7~10 d泼洒1次,直至罗非鱼上市;在鸭子活动区用量加倍,一般选择在晴天上午泼洒,并提前1~2 h开增氧机。微生物制剂拌料用量为饲料量的3%~4%,每隔5~7 d用药1次,每次2~3 d,尤其在7—9月病害高发期坚持内服直至罗非鱼上市,同时坚持每周停料1 d。中药添加方法:将2 kg三黄散、2 kg肝胆利康散和2 kg黄芪多糖添加到1 t饲料中,混匀,制成颗粒饲料,定期投喂,每隔20 d投喂1次,每次3~5 d,直至罗非鱼上市前1个月。
2 结果与分析
2. 1 病害暴发情况
2018年6月15日池塘内有少量罗非鱼死亡,内服用药[恩诺沙星(5 g/kg)和维生素K3(3 g/kg)拌料]3 d后病情有所好转,暂停喂药;6月18日台风来临前夕,天气闷热,此时水温27~29 ℃、pH 7.5~7.7、溶解氧2.3~6.0 mL/L、氨氮5.80~7.21 mg/L、亚硝酸盐0.042~0.065 mg/L;罗非鱼出现浮头、反应迟缓和游边等异常情况。采取解救措施:加注新水、增设增氧机、施放降氨灵及应急解毒安,虽然池塘水质有所好转,但罗非鱼病情并未得到有效改善,死亡数由6月18日的200尾增加到6月22日的800多尾,6月15—30日累计损失罗非鱼约2500 kg。
2. 2 患病鱼临床症状
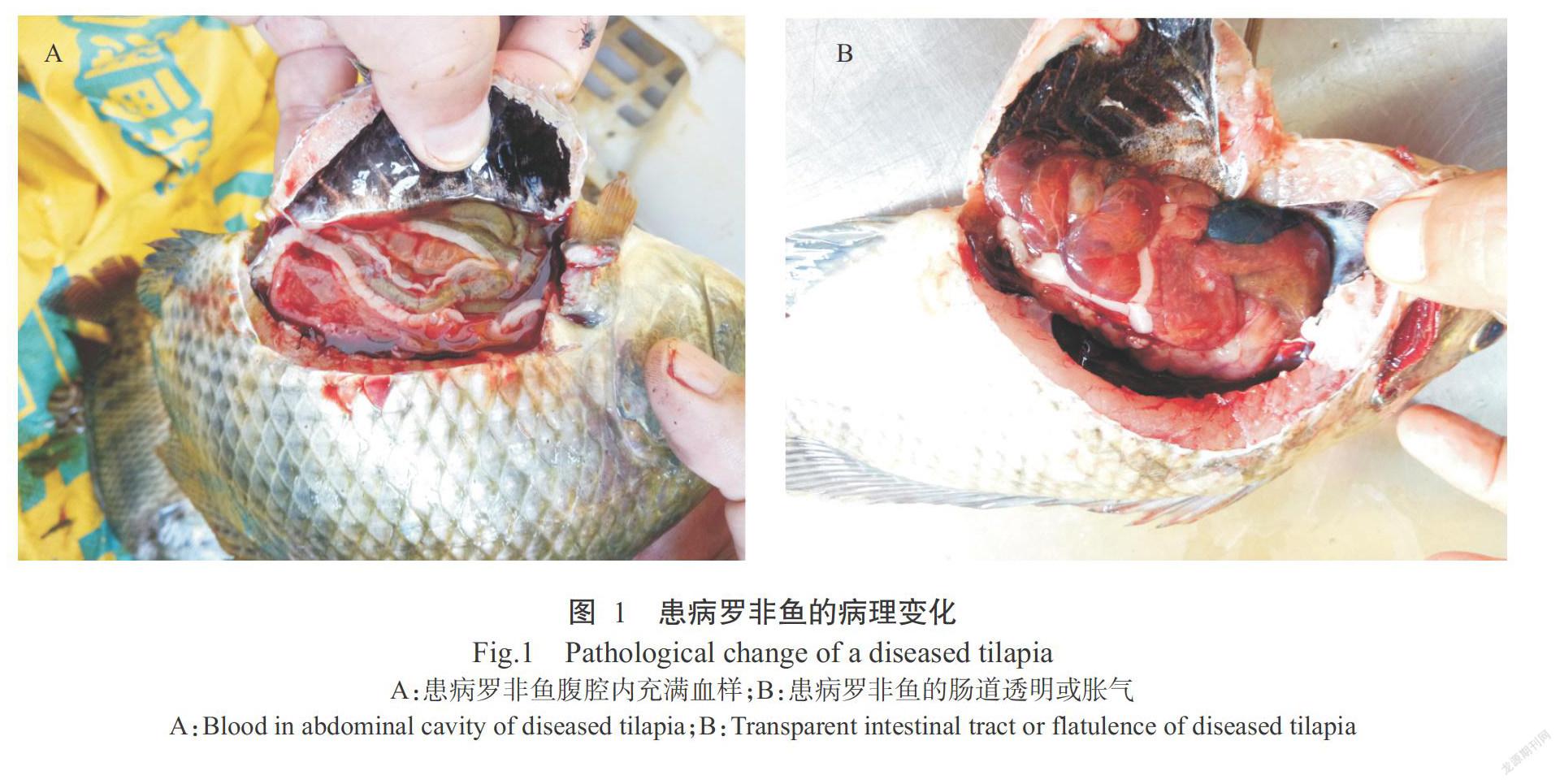
6月15日患病罗非鱼出现体色发黑、游动缓慢、离群独游、打转、不进食或食量减少等症状;肉眼可观察到大部分患病罗非鱼突眼,体表充血,鳃丝红肿充血;剖解发现腹腔内充满血样(图1-A),肝脏、脾脏和肾脏红肿、充血和出血;肠道食物较少,肠壁红肿充血,有些肠道呈透明或半透明状,严重者一触碰肠道即破裂,有黄色水样流出;有的肠道胀气(图1-B)。
2. 3 病原菌分离鉴定结果
从濒死罗非鱼脑组织、肝脏和肾脏分离获得的菌株在血琼脂培养基上均能生长出乳白色的菌落,其形态一致,但大小不一(图2-A);革兰氏染色及显微观察显示,分离菌株为革兰氏阳性菌(菌体紫色),菌体呈球形,排列成链状,符合无乳链球菌的形态特征(图2-B);分离菌株经再次纯化培养获得1株纯化菌株(编号为NT0623)。
采用16S rRNA引物对分离菌株的基因组DNA进行PCR扩增,结果扩增获得大小约1450 bp的目的条带(图3),与预期结果相符。PCR扩增产物经纯化后测序,测序结果(登录号MK409988)与GenBank数据库中的参考序列进行同源性比对分析,结果发现其与无乳链球菌(S. aqalactiae)16S rRNA序列的同源性超过99%,即确定分离菌株是无乳链球菌。
2. 4 人工感染试验结果
在27~29 ℃的水温条件下,对分离菌株进行人工感染试验,连续观察14 d,发现4个感染组的罗非鱼均出现游动缓慢、打转或挣扎等症状,其体表充血,感染后期死亡的罗非鱼突眼现象十分明显。剖检发现罗非鱼体内急性败血,腹腔内的肝脏、脾脏、肾脏及肠道等器官红肿充血,感染组罗非鱼的剖检病变及临床症状与池塘中自然发病的罗非鱼相似。各组罗非鱼的累计死亡情况如表1所示,其中,对照组罗非鱼的存活率为100%;其余4组罗非鱼的累计死亡率为10%~100%,不同组间的死亡率差异明显,注射菌悬液的浓度越高,罗非鱼的死亡率越高。采用Reed-Muench氏法计算得到分离菌株对罗非鱼的LD50为4.7×106 CFU/mL,说明该分离菌株是罗非鱼自然发病的致病菌,且毒性较强。
2. 5 药敏试验结果及其治疗效果
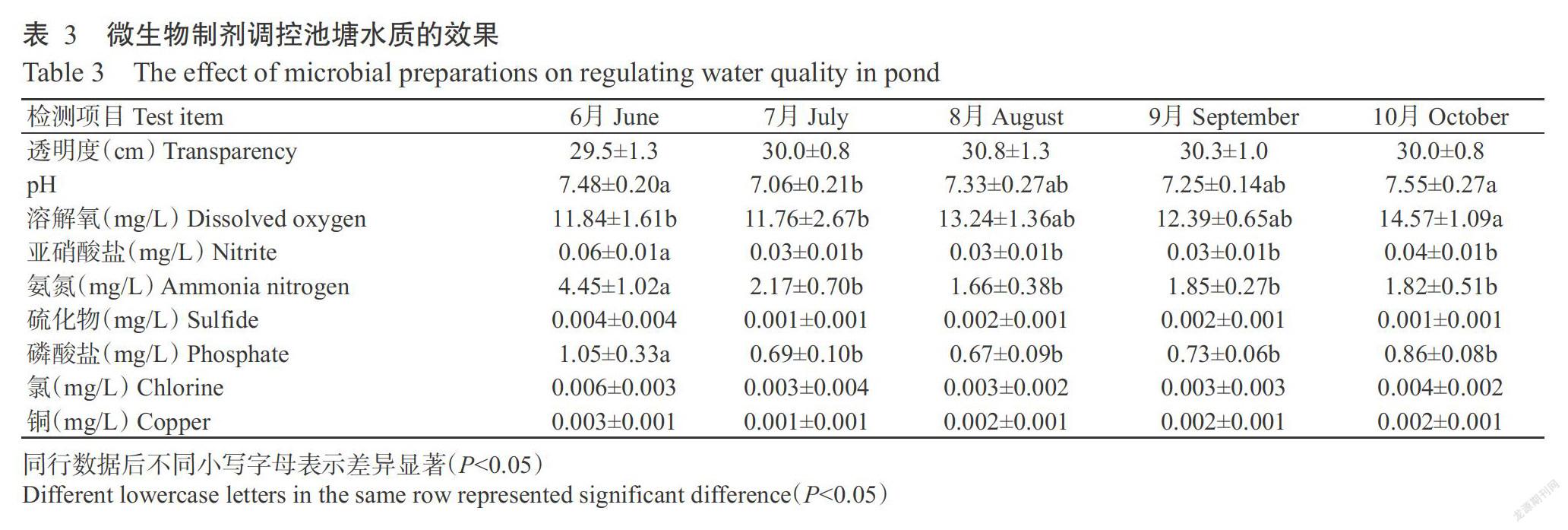
由表2可知,分离菌株对罗红霉素、青霉素、氯霉素、磺胺异恶唑、阿莫西林、利福平、头孢克洛、呋喃唑酮、氟本尼考、头孢氨苄和头孢派酮等药物高度敏感,对恩诺沙星中度敏感,对诺氟沙星、庆大霉素和卡那霉素不敏感(耐药)。
结合药敏试验结果及临床用药经验,采用内服与外用消毒的方式进行治疗。内服用药:以氟苯尼考3 g/kg、三黄散10 g/kg、维生素K3 5 g/kg和黄芪多糖2 g/kg拌料;外用消毒:以20%戊二酫与苯扎溴铵混合液(3.75 L/ha)及过硫酸氢钾(3.75 kg/ha)进行池塘泼洒消毒。连续用药3 d后病情好转,但养殖户盲目停药,导致2 d后罗非鱼又出现死亡,且死亡数量加剧;恢复用药3 d后病情再度好转,连续用药14 d后病情基本得到控制,罗非鱼停止死亡,并恢复正常摄食。
2. 6 微生物调控水质及中草药预防病害的效果
病情得到控制后,从7月起池塘定期泼洒微生物制剂以调控水质,同时让罗非鱼内服微生物制剂和中药。通过监测池塘水色和水质指标发现,池塘水色由原来的暗绿色(6月)逐渐转变成黄绿色(7月)至鲜亮黄绿色(8—10月);透明度也得到一定程度的改善(表3);7—9月的池塘水体pH低于6月,其中7月显著低于6月(P<0.05,下同);溶解氧含量整体上呈上升趋势,至10月达14.57±1.09 mg/L,显著高于6月;7—10月的亚硝酸盐、氨氮和磷酸盐含量均显著低于6月,硫化物、氯和铜含量也低于6月,但差异不显著(P>0.05),说明定期泼洒微生物制剂后池塘水质得到明显改善。罗非鱼病害监测结果显示,7—10月罗非鱼链球菌病无复发现象,且健康状况良好,剖检罗非鱼腹部发现其肝胆健康,色泽红润,肠道肌肉结实,脂肪沉积少,说明内服微生物制剂和中药的效果良好。综上所述,池塘泼洒微生物制剂及罗非鱼内服微生物制剂和中药对改善池塘水质和预防疾病发生具有积极作用。
3 讨论
罗非鱼与鸭混养是我国南方地区常见的生态养殖模式,能有效降低养殖成本,提高经济效益,但该养殖模式下罗非鱼病害频发,尤其是暴发性细菌性鱼病。为明确罗非鱼与鸭混养池塘暴发鱼病的原因,本研究在广西南宁市隆安县那桐镇某罗非鱼与鸭混养池塘采集患病罗非鱼样本,经细菌分离纯化、形态观察、16S rRNA测序分析及人工感染试验,确定病原为无乳链球菌。无乳链球菌是罗非鱼的主要致病菌之一,暴发性强,死亡率高,对罗非鱼养殖业的危害极大(黎娅等,2014)。罗非鱼无乳链球菌病的主要临床症状是病鱼打转游动,且多数眼球突出,因此又被称为突眼病(张德锋等,2015)。本研究也发现患病罗非鱼出现打转游动与眼球突出的典型症状,且动物回归试验中人工感染的罗非鱼也出现相同症状,与张德锋等(2015)的研究结果一致。此外,对罗非鱼的发病情况进行调查得知,发病期间天气突变,高温闷热,水质恶化,出现溶氧量低、氨氮增高的情况,进一步验证无乳链球菌是条件性致病菌。鱼病发生是鱼体生理状态、病原体及水质环境相互作用的结果(黄锦炉,2012)。水体环境既是链球菌传播感染的媒介,也是重要的致病因素,环境恶劣导致鱼产生应激反应,而应激反应是鱼病暴发的重要要素。因此,在罗非鱼养殖过程中要加强水质、鱼病和微生态环境的监测及预警,发现问题及时处理,避免引起病害暴发。
近年来,随着抗菌药物在罗非鱼病害防治上的大量使用,病原菌耐药性、食品安全及环境污染等问题日益突出。本研究通过定期使用中药及微生物制剂预防罗非鱼无乳链球菌病,取得良好效果,及时控制了病害的发展。中药与微生物制劑联合应用,对提高动物机体免疫机能、抗病能力及促进其生长均具有一定的协同增效作用,可能与中药中含有某些活性组分,如有机酸、多糖及双歧生长因子等有关,因为这些活性组分可促进有益微生物的生长与繁殖(刘明杰等,2001;邢跃楠和赵文,2007;邓恒为,2013;丘金珠,2015);同时,有益微生物在鱼类肠道中能产生多种消化酶促进中药的发酵、分解和转化过程,使其在鱼体内更好地被吸收利用而发挥药效(王祥红等,1998)。可见,中药与微生物制剂联合应用将是动物病害综合防预的新路径。
魚鸭混养池塘的水质相对更容易恶化,因此控制水质环境是保障养殖成功的关键。养殖水体环境是一个由多种微生物组成的动态平衡系统,有益微生物和有害微生物共同存在。人为定期向养殖水体中泼酒适量复合微生物制剂,使各种微生物的生长特性及代谢产物具有多样性,而有利于形成共生增殖关系,在新的环境里能快速形成复杂而稳定的微生态系统,有益微生物通常能增殖成为优势种群(李卓佳等,1999)。养殖水体中有益微生物组成的优势种群能抑制有害微生物的生长与繁殖,在一定程度上能减少鱼类病害的发生。此外,有益微生物通过分解或转化水体中的粪便和残饵等有害物质,能为浮游动植物的生长与繁殖提供营养物质,或扩散到空气中,有效去除水体中的氨氮、亚硝酸盐和有机质等有害物质,降低生物耗氧量(BOD)和化学耗氧量(COD),提高溶氧量,调节水质pH,同时促进底泥氮磷释放及浮游动植物生长,进而提高水体的生产能力(张进凤等,2009)。本研究向鱼鸭混养池塘定期泼洒复合微生物制剂,有效避免养鸭对池塘造成的污染,即使在高温季节也未出现水质恶化和鱼类发病现象。
4 结论
引起鱼鸭混养池塘罗非鱼发病的病原菌为无乳链球菌,可采取氟本尼考与三黄散、维生素K3和黄芪多糖联合用药的方法进行治疗。生产上,在鱼鸭混养池塘泼洒微生物制剂及罗非鱼内服微生物制剂和中药,对改善池塘水质及预防疾病发生具有积极作用,能有效降低鱼鸭混养模式下鱼类的发病率。
参考文献:
崔小华,刘兴隆,孙苑娜,廖佛生. 2014. 罗非鱼链球菌病综合防控措施[J]. 海洋与渔业,(10):64-65. [Cui X H,Liu X L,Sun Y N,Liao F S. 2014. Comprehensive prevention and control measures for tilapia Streptococcosis[J]. Ocean and Fishery,(10):64-65.]
邓恒为. 2013. 海南罗非鱼链球菌病病原菌分离鉴定及防治中草药筛选[D]. 海口:海南大学. [Deng H W. 2013. Isolation and identification of the pathogen of streptoco-cci and screening of its controlling Chinese herbal medicines for tilapia cultured in Hainan[D]. Haikou:Hainan Univeristy.]
高桂生,张艳英,高光平,史秋梅,李星灿,韩红升,黄晓媛,缴宝丰,宋青春. 2016. 罗非鱼腐皮病病原菌分离鉴定及其对中草药敏感性试验[J]. 河南农业科学,45(5):148-151. [Gao G S,Zhang Y Y,Gao G P,Shi Q M,Li X C,Han H S,Huang X Y,Jiao B F,Song Q C. 2016. Isolation,identification of pathogenic bacteria of rotten skin disease in tilapia mossambica and sensitivity test to Chinese herbal medicine[J]. Journal of Henan Agricultural Sciences,45(5):148-151.]
何力,邹为民,徐忠法,姜兰,周瑞琼,罗晓松. 2007. SC/T 7201.1—2006 鱼类细菌病检疫技术规程 第一部分:通用技术[S]. 中华人民共和国农业部. 20070201. [He L,Zhou W M,Xu Z F,Jiang L,Zhou R Q,Luo X S. 2007. SC/T 7201.1—2006 Rules for quarantining bacterial di-seases of fish Part 1: General technique[S]. Ministry of Agriculture of the People’s Republic of China. 20070201.]
胡大胜,黄钧,黄艳华,温华成,施金谷,刘坚红,彭民毅. 2012. 12种药物对罗非鱼无乳链球菌的抑菌试验[J]. 中国水产,(8):60-63. [Hu D S,Huang J,Huang Y H,Wen H C,Shi J G,Liu J H,Peng M Y. 2012. Bacteriostatic test of 12 drugs against tilapia Streptococci[J]. China Fisheries,(8):60-63.]
黄邦星. 2007. 山塘水库鱼禽立体高产高效养殖技术[J]. 水产养殖,28(1):25-26. [Huang B X. 2007. Three-dimensional high-yield and high-efficiency culture technology for fish and poultry[J]. Journal of Aquaculture,28(1):25-26.]
黄锦炉. 2012. 罗非鱼无乳链球菌病病原学、病理学及cpsE基因的原核表达研究[D]. 雅安:四川农业大学. [Huang J L. 2012. Study on etiology,pathology of tilapias Streptococcus agalactiae disease and on the function of cpsE gene[D]. Yaʼan:Sichuan Agricultural University.]
黄钧,施金谷,黄艳华,温华成,陈武仕,秦纪璇,覃丽芬,滕忠作. 2012. 罗非鱼竖鳞病病原菌的分离鉴定及药敏试验[J]. 南方农业学报,43(8):1230-1234. [Huang J,Shi J G,Huang Y H,Wen H C,Chen W S,Qin J X,Qin L F,Teng Z Z. 2012. Isolation and identification of lepidorthosis pathogenic bacteria in tilapia and its drug sensitivity test[J]. Journal of Southern Agriculture,43(8):1230-1234.]
黃秋标,李庆勇,姚振锋. 2015. 惠州地区鱼鸭混养模式经济效益分析[J]. 中国渔业经济,33(4):109-112. [Huang Q B,Li Q Y,Yao Z F. 2015. Analysis of economic benefit of fish-duck polyculture in Huizhou[J]. Chinese Fishe-ries Economics,33(4):109-112.]
黄艳华,彭亚,刘杰,彭民毅,黄钧,胡大胜,陈明,马旦梅,曾桂忠. 2014. 罗非鱼致病性无乳链球菌的分离鉴定及药敏试验[J]. 南方农业学报,45(3):498-504. [Huang Y H,Peng Y,Liu J,Peng M Y,Huang J,Hu D S,Chen M,Ma D M,Zeng G Z. 2014. Isolation, identification and drug susceptibility test of tilapia pathogen Streptococcus agalactiae[J]. Journal of Southern Agriculture,45(3):498-504.]
李继业. 1997. 池塘鱼鸭混养高产高效技术经济效益分析[J]. 农业技术经济,(2):61-62. [Li J Y. 1997. Analysis on the economic benefit of high yield and high efficiency of pond fish and duck polyculture[J]. Agricultural Technology Eco-nomy,(2):61-62.]
黎娅,罗福广,左跃,易弋,伍时华,杨军. 2014. 罗非鱼源γ溶血性无乳链球菌的分离鉴定[J]. 淡水渔业,44(4):63-76. [Li Y,Luo F G,Zuo Y,Yi Y,Wu S H,Yang J. 2014. Isolation and identification of γ-hemolytic Streptococcus agalactiae from tilapia[J]. Freshwater Fisheries,44(4):63-76.]
李卓佳,张庆,陈康德. 1999. 复合微生物在水产池塘养殖中的应用[J]. 饲料研究,(1):5-8. [Li Z J,Zhang Q,Chen K D. 1999. Application of compound microorganisms in aquaculture pond culture[J]. Feed Research,(1):5-8.]
梁志凌,马艳平,马江耀,郝乐,刘振兴,柯浩. 2016. 82种中草药对罗非鱼无乳链球菌的抑菌活性研究[J]. 广东农业科学,43(10):128-133. [Liang Z L,Ma Y P,Ma J Y,Hao L,Liu Z X,Ke H. 2016. Antimicrobial activities of 82 kinds of Chinese herbal medicines against the pathogen of Streptococcus from tilapia in vitro[J]. Guangdong Agricultural Sciences,43(10):128-133.]
刘明杰,林琳,王钊. 2001. 肠道细菌对天然药物代谢的研究进展Ⅰ[J]. 中国现代应用药学,18(2):90-91. [Liu M J,Lin L,Wang Z. 2001. Metabolism of natural products by intestinal bacteria[J]. Chinese Journal of Modern Applied Pharmacy,18(2):90-91.]
刘雪兵,张璐,米海峰,陈效儒,文远红. 2013. 广西罗非鱼养殖模式概述[J]. 海洋与渔业,(12):109-111. [Liu X B,Zhang L,Mi H F,Chen X R,Wen Y H. 2013. Overview of Guangxi tilapia culture model[J]. Ocean and Fishery,(12):109-111.]
骆乐,何韬. 2006. 中国罗非鱼产业的国际地位及对外贸易评价[J]. 渔业经济研究,(3):27-30. [Luo L,He T. 2006. Evaluation on international status of Chinese tilapia industry and foreign trade[J]. Fisheries Economy Research,(3):27-30.]
吕小丽,邓小红,牛志伟,范华龙,龙苏,梁静真,黄钧. 2016. 养殖型吉富罗非鱼暴发性死亡的病原菌分离鉴定及药敏测定[J]. 广西畜牧兽医,32(5):230-233. [Lü X L,Deng X H,Niu Z W,Fan H L,Long S,Liang J Z,Huang J. 2016. Isolation,identification and drug sensitivity determination of pathogenic bacteria outbreak of cultured tilapia gifford[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,32(5):230-233.]
吕小丽,黎姗梅,彭民毅,韩书煜,蒙兰丽,韦慕兰,黄维,黄钧. 2017. 广西罗非鱼主养区致病性链球菌及其耐药性调查[J]. 广西畜牧兽医,33(3):143-148. [Lü X L,Li S M,Peng M Y,Han S Y,Meng L L,Wei M L,Huang W,Huang J. 2017. Investigation on pathogenic Streptococci and their drug resistance in the main culture area of tilapia in Guangxi[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,33(3):143-148.]
吕业坚,黄玉玲. 2011. 广西罗非鱼产业发展战略研究[J]. 广西农学报,26(2):46-50. [Lü Y J,Huang Y L. 2011. Study on the development strategy of Guangxi tilapia industry[J]. Journal of Guangxi Agriculture,26(2):46-50.]
梅文涛,齐同俊. 2008. 广州市江高镇罗非鱼养殖之我见[J]. 内陆水产,33(10):39-40. [Mei W T,Qi T J. 2008. My opinion on tilapia culture in Jianggao Town,Guangzhou City[J]. Inland Fisheries,33(10):39-40.]
丘金珠. 2015. 中草药微生态制剂的研制及其在罗非鱼养殖中的应用[D]. 湛江:广东海洋大学. [Qiu J Z. 2015. Research and development of probiotics combined with Chinese herbal medicine and its application in tilapia[D]. Zhanjiang:Guangdong Ocean University.]
谭健民,陈信廉. 2010. 罗非鱼链球菌病病原鉴定及中草药药敏试验[J]. 海洋与渔业,(5):46-47. [Tan J M,Chen X L. 2010. Identification of the pathogen of tilapia Streptococci and the sensitivity test of Chinese herbal medicine[J]. Ocean and Fishery,(5):46-47.]
王祥红,李军,纪伟尚,徐怀恕. 1998. 有益微生物在水产养殖中的应用[J]. 海洋湖沼通報,(1):33-39. [Wang X H,Li J,Ji W S,Xu H S. 1998. Application of probiotics to aquaculture[J]. Transaction of Oceanology and Limnology,(1):33-39.]
夏艳洁,孙喜模,江育林,钱爱东,陈爱平,陈辉,张雅斌. 2007. SC/T 7014—2006 水生动物检疫实验技术规范[S]. 中华人民共和国农业部. 20070201. [Xia Y J,Sun X M,Jiang Y L,Qian A D,Chen A P,Chen H,Zhang Y B. 2007. SC/T 7014—2006 Technical specification for aquatic animal quarantine experiment[S]. Ministry of A-griculture of the People’s Republic of China. 20070201.]
邢跃楠,赵文. 2007. 中草药在水产养殖中应用的研究进展[J]. 中国水产,(4):64-65. [Xing Y N,Zhao W. 2007. Advances in research on application of Chinese herbal medicine in aquaculture[J]. China Fisheries,(4):64-65.]
袁媛,袁永明,贺艳辉,代云云,龚赟翀,张红燕,王红卫,陆建飞. 2013. 罗非鱼不同池塘养殖模式生产成本及经济效益分析[J]. 江苏农业科学,41(8):217-219. [Yuan Y,Yuan Y M,He Y H,Dai Y Y,Gong Y C,Zhang H Y,Wang H W,Lu J F. 2013. Analysis on production cost and economic benefit of tilapia in different pond culture modes[J]. Jiangsu Agricultural Sciences,41(8):217-219.]
张彬,黄婷,陈福艳,梁万文,余晓丽,雷爱莹,陈明. 2010. 罗非鱼致病性海豚链球菌药敏及中草药提取液体外抑菌试验[J]. 广东农业科学,37(9):162-165. [Zhang B,Huang T,Chen F Y,Liang W W,Yu X L,Lei A Y,Chen M. 2010. Studies on antibacterial effects of antibiotic drugs and Chinese medicinal herbs to the pathogen of Streptococcus iniae disease from tilapia in vitro[J]. Guangdong Agricultural Sciences,37(9):162-165.]
张德锋,刘礼辉,任燕,李宁求,林强,潘厚军,石存斌,吴淑勤. 2015. 我国罗非鱼源新型无乳链球菌的分离、鉴定及其分子特征[J]. 中国水产科学,22(5):1044-1054. [Zhang D F,Liu L H,Ren Y,Li N Q,Lin Q,Pan H J,Shi C B,Wu S Q. 2015. Isolation,identification,and molecular characteristics of a new geno-type of Streptococcus agalactiae from cultured tilapia in China[J]. Journal of Fishery Sciences of China,22(5):1044-1054.]
张恒,庞涛. 2017. 兵家必争的粤西罗非混养市场,粤海如何设立攻防占据6成天下[J]. 当代水产,42(5):56-57. [Zhang H,Pang T. 2017. How did Yuehai accounted for 60% share of market in the competitive tilapia polyculture market in western Guangdong[J]. Current Fisheries,42(5):56-57.]
张进凤,李瑞伟,刘杰凤,王辉,巩育军. 2009. 淡水养殖水体氨氮积累危害及生物控制的研究现状[J]. 河北渔业,(6):41-44. [Zhang J F,Li R W,Liu J F,Wang H,Gong Y J. 2009. Accumulation of ammonia nitrogen in fresh aquaculture:Harm and biological control[J]. Hebei Fishe-ries, (6):41-44.]
张千云. 1999. 鱼鸭混养池塘暴发性鱼病多发原因及对策[J]. 渔业致富指南,(20):32. [Zhang Q Y. 1999. Causes and countermeasures of fulminant fish disease in fish and duck culture ponds[J]. Fishery Guide to be Rich,(20):32.]
(责任编辑 兰宗宝)
