氮补充对氮饥饿铜绿微囊藻生长的影响
2019-09-10张达娟张树林王泽斌李鹏英
张达娟 张树林 王泽斌 李鹏英











摘要:【目的】探讨氮缺乏及氮补充对铜绿微囊藻细胞密度、光合色素和叶绿素荧光参数的影响,为揭示水华暴发机制及其影响因素提供参考依据。【方法】使用BG-11全培养基(对照组)和无氮BG-11培养基(处理组)分别培养铜绿微囊藻7 d后,再转移至BG-11全培养基中继续培养,于不同培养时期测定铜绿微囊藻密度、光合色素含量及叶绿素荧光参数等指标,观察其变化规律。【结果】氮饥饿处理铜绿微囊藻7 d后,处理组藻密度(2.10×107 cell/mL)极显著低于对照组(3.11×107 cell/mL)(P<0.01,下同),氮补充144 h后,处理组的藻细胞密度为3.35×107 cell/mL,仍极显著低于对照组(4.32×107 cell/mL);氮缺乏会极显著或显著(P<0.05)抑制铜绿微囊藻叶绿素a、类胡萝卜素和藻胆蛋白的合成,但抑制作用随氮补充时间的延长而降低;氮饥饿处理后,处理组铜绿微囊藻可溶性蛋白含量较对照组减少64.50 μg/L,氮补充144 h后二者相差44.10 μg/L,但差异不显著(P>0.05);氮饥饿处理后再恢复氮补充对铜绿微囊藻光合作用速率有明显促进作用,尤其是Fv/Fm在氮补充12 h后开始逐渐提高,至144 h后极显著高于对照组。【结论】氮缺乏会抑制铜绿微囊藻的分裂增殖及正常代谢过程,但这种抑制作用随着氮补充时间的延长而减弱;在氮补充后,铜绿微囊藻叶绿素a、类胡萝卜素和藻胆蛋白的含量虽然呈升高趋势,但很难恢复至正常水平。Fv/Fm等叶绿素荧光参数对氮营养盐缺乏后再补充具有良好的响应作用,可作为营养盐监测的指示指标。
关键词: 铜绿微囊藻;氮饥饿;氮补充;光合色素;可溶性蛋白;叶绿素荧光参数
中图分类号: S663.4 文獻标志码: A 文章编号:2095-1191(2019)11-2592-07
Effects of nitrogen recovery on the growth of nitrogen
starved Microcystis aeruginosa
ZHANG Da-juan, ZHANG Shu-lin*, WANG Ze-bin, LI Peng-ying
(Tianjin Key Laboratory of Aqua-Ecology and Aquaculture/College of Fisheries, Tianjin Agricultural University,
Tianjin 300384, China)
Abstract:【Objective】In the present study, effects of nitrogen recovery on cell density, photosynthetic pigments content and chlorophyll fluorescence parameters of Microcystis aeruginosa after nitrogen starved were studied to provide reference for the mechanism of Microcysis blooms outbreaks and its influencing factors. 【Method】Using BG-11 medium(control group) and nitrogen-free BG-11 medium(treatment group) cultured M. aeruginosa for 7 d, then transferred to BG-11 medium, measured the cell density, photosynthetic pigments content and chlorophyll fluorescence parameters in different times. 【Result】After nitrogen starved 7 d, the cell density of M. aeruginosa in the treatment group(2.10×107 cell/mL) was extremely lower than that in the control group(3.11×107 cell/mL)(P<0.01,the same below), after nitrogen recovered 144 h, its cell density of treatment groups was 3.35×107 cell/mL, still extremely lower than the control groups(4.32×107 cell/mL). Nitrogen starvation could inhibit the synthetize of chl-a, carotenoid and phycobiliprotein, the difference reduced with the time of nitrogen recovery. The soluble protein content was 64.50 μg/L lower than that in the control groups because of nitrogen starvation, it was still 44.10 μg/L lower than that after recovery,but the difference was not significant(P>0.05). The recovery of nitrogen could accelerate the photosynthesis rate of M. aeruginosa significantly, especially the Fv/Fm responded to nitrogen recovery in 12 h obviously, and was extremely higher than control group after 144 h. 【Conclusion】Nitrogen starved can inhibit the cleavage, proliferation and metabolize, however, the inhibition reduces with the nitrogen recovery time. After nitrogen recovery, the contents of chl-a, carotenoid and phycobiliprotein increase, but cannot reach the normal levels. Fv/Fm respond to the nutrient deficiency and recovery sensitively, soit can be used as indicator of the nutrient monitors.
Key words: Microcystis aeruginosa; nitrogen starvation; nitrogen recovery; pigment; soluble protein; chlorophyll fluorescence parameters
0 引言
【研究意义】随着社会经济的快速发展及工业化进程的飞速前进,大量氮、磷等营养性污染物质的排放致使我国江河、湖泊及沿海海域水体中的氮、磷营养盐含量不断升高,富营养化程度不断加重。淡水生态环境的格局由草型转变为藻型,而藻的种类组成由硅藻为主转变为蓝藻为主,水华频发(顾岗,1996),且发生的时间和范围不断扩大,已引起社会各界的普遍关注(孔繁翔和高光,2005;Schindler,2006)。在蓝藻水华中以铜绿微囊藻(Microcystis aeruginosa)最常见,其隶属于蓝藻门(Cyanophyta)色球藻科(Chroococcaceae)微囊藻属(Microcystis)。铜绿微囊藻外有一层胶被,不能被养殖对象消化吸收,同时蛋白含量较高,藻体死亡后可分解产生羟胺和硫化氢等物质,进而影响水质及养殖对象(姜小玉等,2019)。微囊藻大量繁殖时水体pH急剧升高,致使养殖对象体内硫胺酶活性增加,导致神经系统失调或痉挛,尤其大量暴发时可造成水体变色、散发异味并产生有害气体及释放藻毒素,严重威胁养殖对象及其他水生生态功能的正常发挥,甚至影响人类健康(Codd,2000)。因此,研究微囊藻水华发生与环境因子间的关系,对深入了解微囊藻暴发机制及进行有效防控具有重要意义。【前人研究进展】微囊藻水华发生不仅与氮、磷营养鹽初始浓度有关,还与其缺失和补充有关。已有研究结果表明,在较高的总氮/总磷比条件下,水体会形成蓝藻水华;较低的总氮/总磷比不是蓝藻水华形成的条件,而是水华产生的结果(Xie et al.,2003)。孔繁翔等(2010)研究认为,伴随着水体的富营养化,尤其是磷浓度的增加,通常会导致水体中浮游植物的群落组成向可形成水华的蓝藻演替,且当水体中总氮/总磷比小于29时,水华蓝藻会占优势,为水华的暴发提供条件。在自然水体中,因废水排放、降雨及底泥营养物质的释放等,氮、磷营养盐在水体中的含量时刻都在发生变化。微囊藻水华的发生受化学、物理和生物因素等的综合影响。孔繁翔等(2010)提出在四季分明、扰动剧烈的富营养化水体中,蓝藻的生长与水华的形成分休眠、复苏、生物量增长、上浮及聚集4个阶段,每个阶段中蓝藻的生理特性及主导环境因子均有所不同。在冬季,水华蓝藻的休眠主要受低温及光照强度影响;春季的复苏过程主要受水底表面温度和溶解氧控制,而光合作用和细胞分裂所需要的物质与能量决定了水华蓝藻在春季和夏季的生长状况,一旦有合适的气象与水文条件水华蓝藻即大量暴发(陈卫民等,2010;孔繁翔等,2010)。室内研究表明,氮、磷起始浓度与微囊藻生长速率和生物量间呈显著正相关,但当氮或磷单一营养盐处于富营养化状态,另一种营养盐浓度降低,微囊藻仍能保持较高的生长速率,且明显高于绿藻的生长速率(孙凯峰等,2017);当氮、磷维持在一定浓度范围内时,蓝藻生长速率随氮/磷比的降低而升高(周健等,2014;雷鹏和孙成渤,2015)。【本研究切入点】上述学者大多将研究重点集中在微囊藻水华的形成机制和不同氮磷浓度及比例对微囊藻生长特性的影响,而有关短期营养盐限制解除后藻类响应方面的研究鲜有报道。李杰等(2008)研究表明,氮磷饥饿可以显著影响铜绿微囊藻的生长,主要表现为叶绿素a含量显著下降,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性显著上升。在营养盐得到补充后,微囊藻能快速生长,氮饥饿的藻细胞生长周期变短,磷饥饿的藻细胞营养盐补充后固碳能力和光合作用相关基因的表达会有所提升,但难以恢复至未经饥饿的藻细胞水平,且关于铜绿微囊藻在经受氮磷饥饿后其光合作用水平、叶绿素含量及可溶性蛋白等恢复情况尚未得到深入研究。【拟解决的关键问题】以铜绿微囊藻为研究对象,在实验室条件下模拟氮缺乏后大量补充对其生长和主要代谢产物的影响,为揭示水华暴发机制及其影响因素提供参考依据。
1 材料与方法
1. 1 试验材料
铜绿微囊藻(M. aerμginosa 905)由中科院水生生物研究所淡水藻种库提供,采用BG-11培养基进行培养,温度27 ℃,光暗比12 h∶12 h,光照强度38 μmol/(m²·s)。
1. 2 试验设计
本研究设1个对照组和1个处理组,对照组使用BG-11全培养基,处理组使用不含氮的BG-11培养基,每组设3个平行。开始培养时,铜绿微囊藻的初始浓度均为2.00×107 cell/mL,氮饥饿处理7 d后,将对照组和处理组中的铜绿微囊藻分别转接至正常的BG-11全培养基中,分别于转接后的第0、12、24、48、72、96、120和144 h取样,测定相应指标。
1. 3 测定项目及方法
1. 3. 1 铜绿微囊藻密度测定 用血球计数板对铜绿微囊藻进行细胞计数,每个平行样品均重复计数3次,取其平均值。
1. 3. 2 叶绿素a和类胡萝卜素含量测定 参照王曼(2013)、戴立洲等(2015)的方法:取10.0 mL藻液4500 r/min离心10 min,弃上清液,向藻泥中加入等体积95%乙醇,混匀后4 ℃下提取8 h,4500 r/min离心10 min,取上清液,分别在665、649和470 nm处测定吸光值并记录。
Chla=13.7×OD665-5.76×OD649
A=(1000×OD470-2.05×Chla)/245
式中,Chla为叶绿素a浓度(μg/mL),A为类胡萝卜素浓度(μg/mL)。
1. 3. 3 藻胆蛋白含量测定 参照李小路等(2008)的方法:取5.0 mL藻液4500 r/min离心10 min,弃上清液,向藻泥中加入5.0 mL磷酸缓冲液(0.05 moL/L,pH 7.0),混匀后用锡纸将样品包好,避光放入超低温冰箱(-80 ℃),8 h后取出室温解冻,反复冻溶4次,4500 r/min离心10 min;取上清液,分别在650、620和565 nm处测定吸光值并记录。
根据以下公式计算藻蓝蛋白(PC)、别藻蓝蛋白(APC)和藻红蛋白(PE)的含量(mg/L)及相对含量:
PC=(OD620-0.7×OD650)/7.38
APC=(OD650-0.19×OD620)/5.65
PE=(OD565-2.8×PC-1.34×APC)/1.27
1. 3. 4 可溶性蛋白测定
1. 3. 4. 1 蛋白标准曲线的制作 准确称取100.0 mg牛血清蛋白溶于少量无菌水中,并定容至100.0 mL容量瓶中,配制成1000 μg/mL的母液,再稀释制成不同浓度的蛋白标准溶液,分别吸取不同浓度的蛋白标准溶液0.5 mL于20.0 mL的比色管中,加入5.0 mL考马斯亮蓝G-250蛋白试剂,涡旋混匀,反应2 min后在1 cm光径、595 nm波长处测定溶液吸光值,然后以蛋白含量为横坐标、吸光值为纵坐标绘制蛋白标准曲线(图1)。
1. 3. 4. 2 可溶性蛋白提取与测定 参考孙颖颖等(2010)、谷兵等(2017)的方法:取10.0 mL藻液,4500 r/min离心10 min,弃上清液,将藻泥分别用无菌水和磷酸盐缓冲液(10 mmol/L、pH 6.8)冲洗藻泥1次,再用400 μL磷酸缓冲液将藻泥转入2.0 mL离心管并放入冰盒,以匀浆仪破碎藻细胞(4.0 M/S,MP:24×2,TIME 10,破碎10 s停顿5 min,重复4次),破碎液4500 r/min离心10 min,收集的上清液即为可溶性蛋白粗提取物。吸取0.5 mL蛋白粗提取物置于20.0 mL比色管中,加入5.0 mL考马斯亮蓝G-250蛋白试剂,涡旋混匀,反应2 min后在1 cm光径、595 nm波长处测定溶液的吸光值并记录,然后根据可溶性蛋白标准曲线计算铜绿微囊藻的可溶性蛋白含量。
1. 3. 5 叶绿素荧光参数测定 参考张媛媛等(2015)的方法,检测所得的指标根据叶绿素荧光基础参数(Fo、Fm、Fs和Fm')可得到最大电子传递速率(ETRmax),并计算最大光能转化效率(Fv/Fm)、实际光能转化效率(ΦPSⅡ)及有效光能转化效率(Yield')。计算公式:
Fv/Fm=(Fm-Fo)/Fm
ΦPSⅡ=(Fm'-Fs)/Fm'
F'v=Fm'-Fo'
Yield'=Fv'/Fm'
Fo'=1/(1/Fo-1/Fm+1/Fm')
1. 4 统计分析
采用SPSS 19.0中的独立样本T检验对试验结果进行统计分析。
2 结果与分析
2. 1 氮补充对氮饥饿铜绿微囊藻生长的影响
氮补充后铜绿微囊藻的生长趋势与对照组基本一致(图2),氮饥饿7 d后,铜绿微囊藻的平均密度为2.10×107 cell/mL,极显著低于对照组(3.11×107 cell/mL)(P<0.01,下同);随着氮的补充,两组藻细胞密度明显升高,至144 h时,对照组的平均密度为4.32×107 cell/mL,处理组的平均密度为3.35×107 cell/mL,两组间依然存在极显著差异,经饥饿处理的微囊藻生长很难恢复至未处理前的水平。
2. 2 氮补充对氮饥饿铜绿微囊藻色素含量的影响
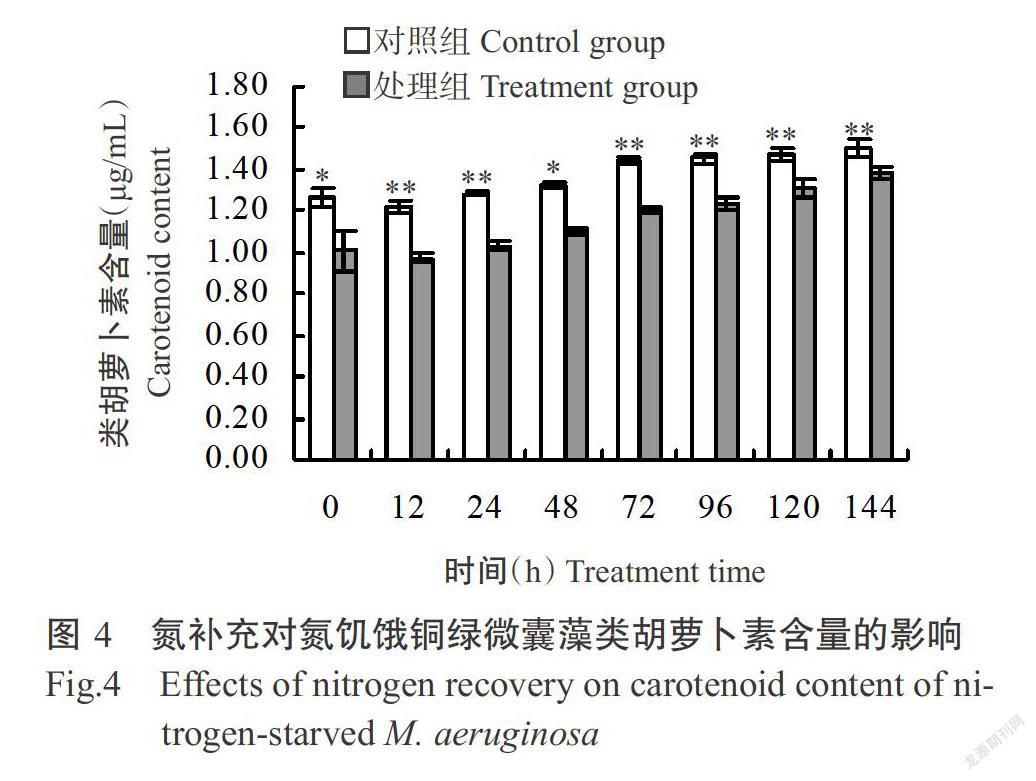
2. 2. 1 氮补充对氮饥饿铜绿微囊藻叶绿素a和类胡萝卜素含量的影响 铜绿微囊藻叶绿素a含量的变化情况见图3。氮饥饿7 d后,对照组铜绿微囊藻叶绿素a含量(5.41 μg/mL)极显著高于处理组(3.29 μg/mL),且這种极显著差异一直持续至培养结束。经氮饥饿后,对照组与处理组间的铜绿微囊藻类胡萝卜素含量存在显著差异(P<0.05,下同);随着氮的补充,二者间的类胡萝卜素含量差距逐渐缩小,但至培养结束时二者间仍存在极显著差异(图4)。
2. 2. 2 氮补充对氮饥饿铜绿微囊藻藻胆蛋白含量的影响 氮补充后铜绿微囊PC、APC和PE的含量变化趋势基本一致(图5~图7)。氮饥饿7 d后,处理组铜绿微囊藻PC、APC和PE的含量均显著或极显著低于对照组;随着氮的补充,处理组3种藻胆蛋白的含量均有所提高,至培养结束时PC和PE含量显著低于未经氮饥饿的对照组,而APC含量与对照组无显著差异(P>0.05,下同)。
2. 3 氮补充对氮饥饿铜绿微囊藻可溶性蛋白的影响
氮饥饿7 d后,对照组铜绿微囊藻可溶性蛋白的平均含量为146.39 μg/L,处理组为81.89 μg/L,二者间存在极显著差异(图8);随着氮的补充,处理组铜绿微囊藻可溶性蛋白含量明显增加,至培养结束时,对照组铜绿微囊藻可溶性蛋白平均含量为206.49 μg/L,处理组为162.39 μg/L,二者间差异不显著。
2. 4 氮补充对氮饥饿铜绿微囊藻叶绿素荧光参数的影响
氮饥饿7 d后,处理组铜绿微囊藻的Fv/Fm为0.1999,极显著低于对照组(图9);在氮补充12 h后,对照组Fv/Fm处于一个相对稳定的变化趋势,处理组则开始逐渐提高,至培养结束时,处理组Fv/Fm提升至0.4328,极显著高于对照组(0.3618)。
铜绿微囊藻在经过氮饥饿7 d后,其ΦPSⅡ为0.3500(图10),极显著低于对照组;随着氮补充时间的延长,从培养48 h至结束时,处理组铜绿微囊藻的ΦPSⅡ逐渐升高至0.4367,高于对照组(0.4067)但差异不显著。
铜绿微囊藻Yield'的变化趋势如图11所示。氮补充后,对照组铜绿微囊藻的Yield'处于稳定状态,处理组的Yield'随补充时间的延长而上升后趋于稳定,至培养结束时铜绿微囊藻Yield'为0.4623,极显著高于对照组。
氮补充后,对照组铜绿微囊藻的ETRmax变化不明显,处理组的ETRmax则呈逐渐上升趋势,至培养结束时上升至30,与对照组(28)间无显著差异(图12)。
3 讨论
水华蓝藻对氮、磷等营养盐缺乏的耐受能力对其种群的生长与繁殖具有重要意义,耐受能力较强的种类能在复杂的营养条件下维持一定规模,且可在适宜的环境条件下迅速发展成优势种类。氮缺乏对铜绿微囊藻的生长具有一定抑制作用,氮饥饿处理7 d后,对照组藻细胞密度是处理组的1.5倍,说明氮缺乏能有效抑制铜绿微囊藻的生长。氮缺乏时,铜绿微囊藻蛋白合成停止,使得微藻细胞分裂减缓,导致生长速率下降甚至停止细胞分裂(曾玲等,2011)。不同藻类对氮、磷的耐受能力具有高度种类特异性,铜绿微囊藻对氮缺乏的耐受力远低于斜生栅藻(S. obliquus),但对磷的耐受力较高(许海等,2014),也是其易形成水华的原因之一。一般认为,微藻生长适宜的氮/磷比为16∶1,超过或低于该比值,被认为存在磷或氮限制。当存在磷限制时,因铜绿微囊藻耐受力强而具有更高的竞争力。Smith(1986)研究认为当蓝藻水华发生时,氮/磷比不会超过29∶1,即蓝藻成为优势种的临界值,但随着更多学者的深入研究,发现当氮/磷比高于29∶1时,微囊藻仍能维持优势地位(Xie et al.,2003;Amano et al.,2010)。
氮营养盐缺乏后再供给,可使微囊藻生长有一定恢复,但与对照组相比仍有差异。在相同的磷浓度下,按比例降低氮浓度,水华微囊藻(M. flosa-quae)1028藻种群体大小、比例及生长速率均呈明显的降低趋势,但随氮浓度的增加其生长速率呈线性增长趋势(许慧萍,2014)。王璐瑶等(2012)研究表明,氮限制与氮饥饿严重影响了金色奥杜藻(Odontella aurita)的色素合成,致使叶绿素合成受到抑制。在本研究中,铜绿微囊藻色素也受到氮缺乏的显著抑制,但随着氮的补充而得到缓解,合成量明显提高。究其原因主要是在氮限制条件下,类囊体膜上捕光色素蛋白复合物和反应中心复合体受到一定损伤或部分降解,导致其转能效率降低(梁英等,2006)。
叶绿素荧光参数是用于描述植物光合作用机理和光合生理状况的变量或常数值,也是研究光合作用的有效探针,其中,Fv/Fm可反映植物体进行光化学反应的最大潜力,对营养盐变化十分敏感。Kolber等(1988)研究认为,营养盐充足时,Fv/Fm最大值为0.65,与微藻种类无关。一般认为,在实验室条件下培养,浮游植物的Fv/Fm很难达到该水平。在本研究中,氮补充后处理组铜绿微囊藻各叶绿素荧光参数均高于对照组,表明其光合速率较高。王昭玉(2013)在缺氮条件下培养7种微藻,8 d后发现Fv/Fm均呈下降趋势,补充氮源后,不同微藻的Fv/Fm迅速上升,并在一定时间后恢复到营养盐充足时的水平,本研究也得出相似结论。大量研究表明,氮限制时,随氮浓度的降低,Fv/Fm下降幅度逐渐增大,重新添补氮源后,Fv/Fm开始恢复,24 h后可恢复至原来水平(Steglich et al.,2001;Young and Beardall,2003;尹翠玲,2006)。这主要是因为氮元素是蛋白质、叶绿素与光合作用有关的酶的必要组成成分,当氮缺乏时,光系统Ⅱ(PSⅡ)吸收的光能大于需求光能,致使PSⅡ的活性反应中心部分损坏,光能转化效率和电子传递效率降低,从而导致Fv/Fm下降(Steglich et al.,2001;Geider et al.,2010)。ΦPSⅡ是光照条件下光合反应中心的实际光化学量子产量,可用来衡量藻类的实际光合效率,添加营养盐后ΦPSⅡ的升高表明光能转化效率升高,可为暗反应的光合碳同化积累更多能量,促进碳同化的高效运转和有机物积累(尹翠玲,2006),与Fv/Fm的变化规律相吻合。
4 结论
氮缺乏会抑制铜绿微囊藻的分裂增殖及其正常代谢过程,但这种抑制作用随着氮补充时间的延长而減弱;在氮补充后,铜绿微囊藻叶绿素a、类胡萝卜素和藻胆蛋白的含量虽然呈升高趋势,但很难恢复至正常水平。Fv/Fm等叶绿素荧光参数对氮营养盐缺乏后再补充具有良好的响应作用,可作为营养盐监测的指示指标。
参考文献:
陈卫民,戴树桂,张清敏. 2010. 铜绿微囊藻竞争机制的探讨[J]. 安全与环境学报,19(5):73-77. [Chen W M,Dai S G,Zhang Q M. 2010. Tracing the competition mechanism of Microcystis aeruginosa[J]. Journal of Safety and Environment,19(5):73-77.]
戴立洲,成小英,俞珊,雍佳君,李婉璐,张清春,慕亚南. 2015. 豆瓣菜有机提取物对铜绿微囊藻的抑制及成分初步分离[J]. 环境科学学报,35(12):4159-4168. [Dai L Z,Cheng X Y,Yu S,Yong J J,Li W L,Zhang Q C,Mu Y N. 2015. Inhibitory effects of organic solvent extract from Nasturtium officinale on Microcystis aeruginosa associated with isolation of the allelochemical ingredients[J]. Acta Scientiae Circumstantiae,35(12): 4159-4168.]
谷兵,张达娟,王沂,包志明,王雪莹,余海军. 2017. 铁对紫球藻生长及可溶性蛋白和胞外多糖含量的影响[J]. 江苏农业科学,45(1):159-162. [Gu B,Zhang D J,Wang Y,Bao Z M,Wang X Y,Yu H J. 2017. Effects of Fe on the growth,soluble protein and extracellular polysaccharose content of Porphyridium cruentum[J]. Jiangsu Agricultu-ral Sciences,45(1):159-162.]
顾岗. 1996. 太湖蓝藻暴发成因及其富营养化控制[J]. 环境监测管理与技术,8(6):17-19. [Gu G. 1996. Reason and control on bluegreen algae fast growth of eutrophication in Taihu Lake[J]. The Administration and Technique of Environmental Monitoring,8(6):17-19.]
姜小玉,赵闪闪,褚一凡,陈艳,李杲光,靳同霞,马建敏. 2019. 氮浓度对铜绿微囊藻、大型溞和金鱼藻三者相互作用的影响[J]. 水生生物学报,43(2):439-447. [Jiang X Y,Zhao S S,Chu Y F,Chen Y,Li G G,Jin T X,Ma J M. 2019. Impacts of nitrogen concentration on the intera-ctions among Microcystis aeruginosa,Daphnia magna and Ceratophyllum demersum[J]. Acta Hydrobiologica Sinica,43(2):439-447.]
孔繁翔,曹焕生,谭啸. 2010. 水华蓝藻复苏的研究进展与水华预测[J]. 环境监控与预警,2(1):1-4. [Kong F X,Cao H S,Tan X. 2010. Development of research on recruitment of bloom-forming cyanobacteria and blooms forecast[J].Environmental Monitoring and Forewarning,2(1):1-4.]
孔繁翔,高光. 2005. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报,25(3):589-595. [Kong F X,Gao G. 2005. Hypothesis on cycanbacteria bloom-forming mechanism in large shallow eutraophic lakes[J]. Acta Ecologica Sinica,25(3):589-595.]
雷鹏,孙成渤. 2015. 不同氮磷比对水华微囊藻生长特性的影响[J]. 环境科学与技术,38(12):27-31. [Lei P,Sun C B. 2015. The Influence for growth characteristics of Miscrocystis flosaquae in different N/P ratios[J]. Environmental Science & Technology,38(12):27-31.]
李杰,欧丹云,宋立荣. 2008. 微囊藻衰亡过程研究——四种模拟胁迫条件下微囊藻的衰亡生力[J]. 湖泊科学,20(5):549-555. [Li J,Ou D Y,Song L R. 2008. Decline of Microcystis aeruginosa FACHB-905 under four stress conditions[J]. Journal of Lake Sciences,20(5):549-555.]
李小路,潘慧云,徐洁,鲜啟鸣,高士祥,尹大强,邹慧仙. 2008. 金鱼藻与铜绿微囊藻共生情况下的化感作用[J].环境科学学报,28(11):2243-2249. [Li X L,Pan H Y,Xu J,Xian Q M,Gao S X,Yin D Q,Zou H X. 2008. Allelopathic effects of Ceratophyllum demersum and Microcystis aeruginosa in co-cultivation[J]. Acta Scientiae Circumstantiae,28(11):2243-2249].
梁英,馮力霞,田传远,尹翠玲. 2006. 盐胁迫对塔胞藻生长及叶绿素荧光动力学的影响[J]. 中国海洋大学学报,36(5):726-732. [Liang Y,Feng L X,Tian C Y,Yin C L. 2006. Effects of salt stress on the growth and chlorophyll fluorescence of Pyramidomonas sp.[J]. Periodical of Ocean University of China,36(5):726-732.]
孙凯峰,肖爱风,刘伟杰,何宁,段舜山. 2017. 氮磷浓度对惠氏微囊藻和斜生栅藻生长的影响[J]. 南方水产科学,13(2):69-76. [Sun K F,Xiao A F,Liu W J,He N,Duan S S. 2017. Effect of nitrate and phosphate concentration on growth of Microcystis wesenbergii and Scenedesmus obliquus[J]. South China Fisheries Science,13(2):69-76.]
孙颖颖,王长海,刘筱潇. 2010. 浒苔提取物对4种赤潮微藻生长的抑制作用[J]. 环境科学,31(6):1662-1669. [Sun Y Y,Wang C H,Liu X X. 2010. Growth inhibition of the four species of red tide microalgae by extracts from Enteromorpha prolifera extracted with the five solvents[J]. Environmental Science,31(6):1662-1669.]
王璐瑶,桑敏,李爱芬,张成武. 2012. 不同缺氮营养水平对金色奥杜藻生长及光合生理的影响[J]. 中国生物工程杂志,32(6):48-56. [Wang L Y,Sang M,Li A F,Zhang C W. 2012. Effects of different nitrogen nutrition level on the growth and photosynthetic physiology of Odontella aurita[J].China Biotechnology,32(6):48-56.]
王曼. 2013. 浮游植物叶绿素a 4种提取方法的比较[J]. 中国实用医药,8(22):263-264. [Wang M. 2013. Comparison on the 4 extraction method for chlorophyll a in phytoplankton[J]. China Practical Medicine,8(22):263-264.]
王昭玉. 2013. 叶绿素荧光参数对氮、磷限制的响应及其在赤潮生消过程中的变化特征研究[D]. 青岛:中国海洋大学. [Wang Z Y. 2013. Responses of chlorophyll a flurescence parameter to nitrogen or phosphorus limition and variation of chlorophyll a fluprescence parameter during the process of algal blooms[D]. Qingdao: Ocean University of China.]
许海,吴雅丽,杨桂军,朱广伟,秦伯强. 2014. 铜绿微囊藻、斜生栅藻对氮磷饥饿的耐受能力研究[J]. 生态科学,33(5):879-884. [Xu H,Wu Y L,Yang G J,Zhu G W,Qin B Q. 2014. Tolerance of Microcystis aeruginosa and Scendesmus obliquus to nitrogen and phosphorus deficiency[J]. Ecological Science,33(5):879-884.]
许慧萍. 2014. 氮磷营养盐对水华微囊藻群体的影响研究[D]. 无锡:江南大学. [Xu H P. 2014. Study of effect of nitrogen and phosphorous on colony of Microcystis[J]. Wuxi: Jiangnan University.]
尹翠玲. 2006. 營养盐限制对6株微藻叶绿素荧光特性的影响[D]. 青岛:中国海洋大学. [Yin C L. 2006. Effects of nutrient limition on the chlorophyll fluorescence of 6 microalgal strains[D]. Qingdao: Ocean University of China.]
曾玲,文菁,徐春曼. 2011. 氮、磷对微藻生长和产毒的影响[J]. 湛江师范学院学报,32(6):103-108. [Zeng L,Wen J,Xu C M. 2011. Effects of nitrogen and phosphorus on the growth and toxin production of microalgae[J]. Journal of Zhanjiang Normal College,32(6):103-108.]
张媛媛,戴伟,张树林,毕相东,张达娟. 2015. 光照历史对小檗碱化感抑藻效应的影响[J]. 水生态学杂志,36(1):88-93. [Zhang Y Y,Dai W,Zhang S L,Bi X D,Zhang D J. 2015. Effects of light acclimation on allelopathic inhibition of Microcystis aeruginosa by berberine[J]. Journal of Hydroecology,36(1):88-93.]
周健,杨桂军,秦伯强,张光生,许慧萍. 2014. 氮磷对铜绿微囊藻群体形态的影响[J]. 环境科学研究,27(11):1251-1257. [Zhou J,Yang G J,Qin B Q,Zhang G S,Xu H P. 2014. Effects of nitrogen and phosphorous on colony formation of Microcystis aeruginosa[J]. Research of Environmental Sciences,27(11):1251-1257.]
Amano Y,Sakai Y,Sekiya T,Takeya K. 2010. Effect of phosphorus fluctuation caused by river water dilution in eutrophic lake on competition between blue-green alga Microcystis aeruginosa and diatom Cyclotella sp.[J]. Journal of Environmental Sciences,22(11):1666-1673.
Codd G A. 2000. Cyanobacterial toxins,the perception of water quality,and the prioritisation of eutrophication control[J]. Ecological Engineering,16(1):51-60.
Geider R J,Roche J L,Greene R M,Olaizola M. 2010. Response of the photosynthetic apparatus of Phaeodactylum tricornutum(Bacillariophyceae) to nitrate,phosphate,or iron starvation[J]. Journal of Phycology,29(6):755-766.
Kolber Z,Zehr J,Falkowski P. 1988. Effects of growth irra-diance and nitrogen limitation on photosynthetic energy conversion in photosystemⅡ[J]. Plant Physiology,88(3): 923-929.
Schindler D W. 2006. Recent advances in the understanding and management of eutrophication[J]. Limnology and Oceanography,51(1): 356-363.
Smith V H. 1986. Light and nutrient effects on the relative biomass of blue-green algae in lake phytoplankton[J]. Canadian Journal of Fisheries and Aquatic Sciences,43:148-153.
Steglich C,Behrenfeld M,Koblizek M,Claustre H,Penno S,Prasil O,Partensky F,Hess W R. 2001. Nitrogen deprivation strongly affects Photosystem II but not phycoerythrin level in the divinyl-chlorophyll b-containing cyanobacterium Prochlorococcus marinus[J]. Biochimica et Biophysica Acta,1503(3):341-349.
Xie L,Xie P,Li T H,Liu H. 2003. The low TN∶TP ratio,a cause or a result of Microcystis blooms?[J]. Water Research,37(9): 2073-2080.
Young E B,Beardall J. 2003. Photosynthetic function in Dunaliella tertiolecta(Chlorophyta) during a nitrogen starvation and recovery cycle[J]. Journal of Phycology,39(5): 897-905.
(責任编辑 兰宗宝)
