核桃低聚肽对亚健康疲劳大鼠的影响
2019-09-10刘睿郝云涛乌兰刘欣然毛瑞雪侯超刘思奇麻慧娟李勇
刘睿 郝云涛 乌兰 刘欣然 毛瑞雪 侯超 刘思奇 麻慧娟 李勇




摘 要:目的:研究核桃低聚肽(walnut oligopeptides,WOPs)抗亚健康疲劳的作用及其可能机制。方法:50只健康雄性SD大鼠随机分成5组:正常对照组、模型对照组和3个WOPs干预组(剂量分别为220、440、880 mg/kg·BW),每日经口灌胃给予受试样品。模型对照组和3个WOPs剂量组大鼠连续睡眠剥夺5d后,进行负重力竭游泳实验,记录力竭游泳时间,并测定大鼠血常规、血乳酸、肝糖原和肌糖原的变化。结果:与模型对照组相比,WOPs组大鼠力竭游泳时间明显延长,白细胞异常增高和红细胞及血红蛋白降低得到了明显改善,全血中乳酸含量显著下降,大鼠肝糖原和肌糖原的储备增高。结论:WOPs可以有效增强亚健康疲劳大鼠体力和运动耐力,起到防治亚健康疲劳的效果。
关键词:核桃低聚肽;亚健康;疲劳;睡眠剥夺;力竭游泳
亚健康状态,常以一多三少(一多指疲劳多;三少即三种减退:活力减退、反应能力减退和适应能力减退)为主要表现[1-3]。疲劳不仅是亚健康的重要症状之一,也是导致亚健康发生发展的重要原因[4]。“中国适度劳动研究”的调查发现,我国有30%的劳动力处于“过劳死”边缘,60%长期处于过劳状态[5]。但目前临床上尚缺乏有效的治疗方法,哌甲酯、利他林等药品可以达到较好的缓解疲劳的效果,但因具有一定的副作用与成瘾性,不宜长期服用[6]。因此,研究亚健康疲劳的发生发展机制及寻找安全有效的方法来预防和缓解亚健康状态极为重要。
现代研究表明,外源性生物活性肽具有免疫调节、抗氧化、抗菌、抗病毒、调节激素与酶抑制等多种生理功能。由于外源性活性肽原料广泛且进入机体后可发挥与内源性活性肽相似的生理作用,极具研究应用价值,是当前最热门的研究方向之一[7-8]。近年来研究发现,低聚肽比单个氨基酸的吸收更有效,并能直接参与蛋白质的合成,有效提高了蛋白质的吸收利用率[9-10]。核桃低聚肽(walnut oligopeptides,WOPs)是利用生物酶解技术从核桃蛋白中提取的小分子生物活性肽,研究发现,WOPs具有提高记忆力[11]、抗辐射[12]、抗氧化[13]、润肠通便[14]、提高性功能[15]等多种生物活性。研究报道,核桃多肽可以延长实验动物力竭游泳时间,加速乳酸消除,有效促进疲劳的恢复[16-18]。但尚未见WOPs用于治疗亚健康疲劳状态的相关报道,因此,本研究通过采用复合造模法即睡眠剥夺(中枢疲劳)与负重力竭游泳(外周疲劳)相结合来制备建立亚健康疲劳大鼠模型[19-22],根据大鼠力竭游泳时间、血常规、血乳酸、肝糖原来评价WOPs对亚健康疲劳大鼠的作用,为研究WOPs干预亚健康疲劳的治疗机理奠定前期基础。
1 材料与方法
1.1 样品
WOPs,外观为淡黄色固体粉末,由北京天肽生物科技有限公司提供。通过高效液相色谱法分析其分子量及氨基酸组成发现分子量小于1 000Da的小分子低聚肽占86.5%,小于2 000Da的肽类总量高达96.5%,其水解氨基酸含量为53.15g/100g,游离氨基酸含量为2.98g/100g,其中谷氨酸、精氨酸、天冬氨酸、亮氨酸含量较多。
1.2 主要试剂和仪器
全血乳酸测试试剂盒,货号A019-1,南京建成;肝/肌糖原检测试剂盒,货号A043,南京建成。大鼠游泳箱(80cm×18cm);Nihon Kohden Celltac 2全自动血球计数仪,日本光电工业株式会社;低温高速离心机,德国Eppendorf公司;电热恒温水浴锅,北京天林恒泰科技有限公司;BMG FLUOstar Omega多功能酶标仪,德国 BMG LABTECH公司。
1.3 实验动物
健康SPF级雄性SD大鼠50只,体重(250±20)g,由北京大学医学部实验动物中心提供(实验动物许可证号:SYXK(京)2016-0041;实验动物生产许可证号:SCXK(京)2016-0010)。动物饲养在北京大学医学部实验动物科学部,饲养环境为屏障环境,温度为(22±2)℃,相对湿度为50%~60%,昼:夜明暗交替时间为12h∶12h。实验动物单笼饲养,自由饮食、饮水,适应性喂养1周。
1.4 实验方法
1.4.1 实验动物分组 动物适应性喂养结束后,第1周行适应性游泳训练,将大鼠放入水深50cm,水温维持在(30±1)℃的游泳桶中进行游泳训练,每次训练10min,每天1次,连续3d。适应性游泳结束后,将50只大鼠随机分为5组,每组10只:正常对照组,模型对照组,核桃低聚肽低、中、高剂量组(剂量分别为220、440、880 mg/kg·BW,分别对应WOPs 1、WOPs 2、WOPs 3组)。临床上尚没有针对亚健康疲劳状态的上市药物,因此本研究中未设阳性对照组[23]。实验期间,大鼠单笼饲养,自由饮水、进食。
1.4.2 亚健康疲劳大鼠模型的建立 分组结束后,参照文献,采用睡眠剥夺+5%负重游泳的复合方式制备亚健康疲劳大鼠模型[19-22]。具體方法为:空白对照组大鼠正常饲养,其余4组大鼠放入装有2.2cm水高的大鼠饲养盒中,每笼1只,连续5d,期间自由饮水进食,水的温度与室温相近,维持(23±1)℃,每日早晚各换水1次。造模期间,每日经口灌胃给予受试样品1次,空白对照组和模型对照组给予蒸馏水,WOPs组给予相应浓度受试物,灌胃量为1mL/100g。每日观察各组大鼠的一般情况,包括毛色、精神状态、摄食及日常活动情况等。睡眠剥夺5d后,对各组大鼠行5%负重游泳实验,造成亚健康疲劳大鼠模型。
1.4.3 负重游泳实验 睡眠剥夺5d后,取各组大鼠于末次给予受试样品1h后[24],在鼠尾根部负荷5%体重的铅皮,将大鼠置于游泳箱中游泳[水深50cm,水温(30±1)℃],记录大鼠自游泳开始至力竭的时间,作为大鼠负重游泳时间,游泳运动期间对动物的运动能力及活动状态进行观察记录。采用力竭判断标准为:大鼠游泳协调性显著性下降、身体下沉、水淹没鼻尖至再次浮出水面超过10s[25-26]。负重游泳结束后,采用乙醚麻醉处死大鼠,股动脉收集血液,并快速分离肝脏和腓肠肌。采用全自动血球计数仪及根据试剂盒说明书进行血常规、血乳酸、肝糖原和肌糖原的检测。
1.5 统计方法
用SPSS 24.0软件对数据进行分析。连续变量数据用均数±标准差(±s)表示,行单因素方差分析,采用LSD法进行组间的统计检验;变量转换后仍未达到正态或方差齐的数据,采用Kruskal-Wallis检验进行统计分析。P<0.05具有统计学意义。
2 结果与分析
2.1 实验动物一般状况观察
正常对照组大鼠精神状态正常、活泼好动、反应灵敏、皮毛光洁整齐、体重增加。模型对照组大鼠精神状态明显欠佳、倦怠、烦躁、易激惹,毛色欠光泽,个别遗留有灰暗污渍,反应能力降低,消瘦,体重降低。WOPs各组大鼠精神状态及行为异常情况较模型对照组有所改善,且随着WOPs干预剂量的增高表现情况越为好转。
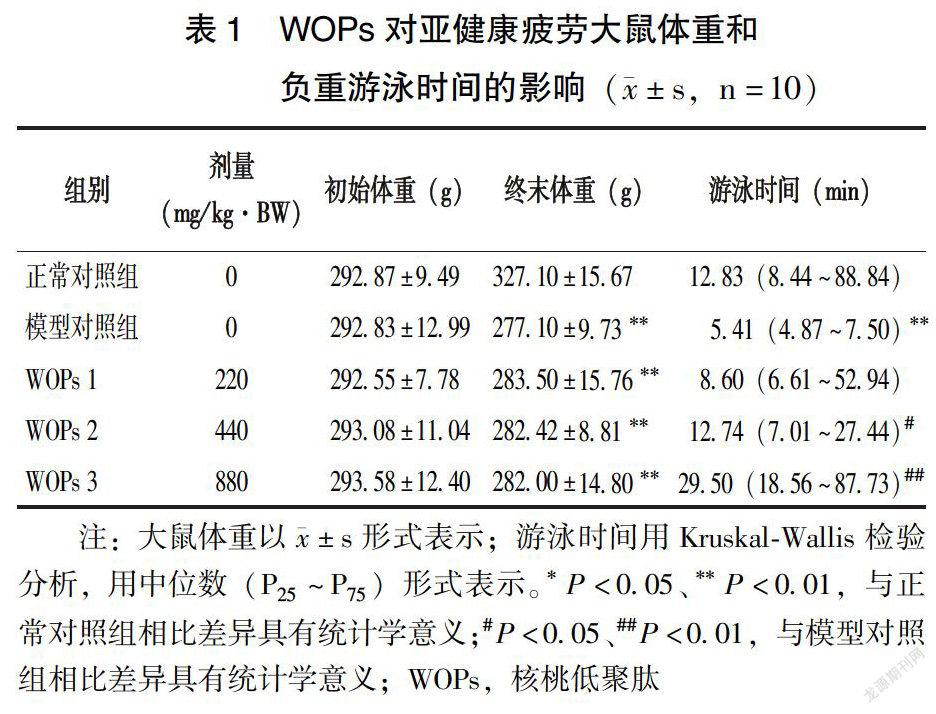
2.2 WOPs对亚健康疲劳大鼠体重和负重游泳时间的影响
如表1所示,大鼠初始体重各组间无显著性差异(P>0.05)。实验造模5d后,与空白对照组相比,模型对照组和3个WOPs干预组大鼠终末体重明显减轻,差异具有统计学意义(P<0.01)。在负重力竭游泳测试中,模型对照组大鼠游泳時间低于正常对照组,差异具有统计学意义(P<0.05)。WOPs组大鼠游泳时间长于模型对照组,其中核桃低聚肽中、高剂量组WOPs 2、WOPs 3组与模型对照组相比差异具有显著性(P<0.05、P<0.01)。
2.3 WOPs对亚健康疲劳大鼠血常规的影响
2.3.1 WOPs对亚健康疲劳大鼠白细胞的影响 与正常对照组相比,模型对照组白细胞计数、单核细胞计数、淋巴细胞计数均显著升高(P<0.05或P<0.01)。WOPs 1、WOPs 2、WOPs 3组低、中、高剂量干预组白细胞计数、单核细胞计数和淋巴细胞计数均低于模型对照组,其中WOPs 1组白细胞计数与模型对照组相比差异具有显著性(P<0.05);WOPs 3组白细胞计数、单核细胞计数及淋巴细胞计数与模型对照组相比差异均有统计学意义(P<0.05或P<0.01)(表2)。
2.3.2 WOPs对亚健康疲劳大鼠红细胞的影响 与空白对照组相比,模型对照组红细胞数和红细胞压积明显降低,差异具有统计学意义(P<0.05)。与模型对照组相比,3个WOPs干预组红细胞数和红细胞压积明显增高(P<0.05或P<0.01)。WOPs干预组红细胞体积分布宽度均低于模型对照组,其中WOPs 1组与模型对照组相比差异具有显著性(P<0.05)。平均红细胞体积在各组间均无显著性差异(P>0.05)(表3)。
2.3.3 WOPs对亚健康疲劳大鼠血红蛋白的影响 如表4所示,模型对照组大鼠血红蛋白含量、平均血红蛋白量和平均血红蛋白浓度均低于正常对照组,其中血红蛋白含量与正常对照组相比差异具有统计学意义(P<0.05)。与模型对照组相比,3个WOPs干预组血红蛋白含量均明显升高(P<0.05或P<0.01),其中WOPs 1组平均血红蛋白含量与模型对照组相比差异具有显著性(P<0.05);WOPs 2、WOPs 3组平均血红蛋白浓度明显高于模型对照组,差异具有统计学意义(P<0.05或P<0.01)。
2.4 WOPs对亚健康疲劳大鼠全血中乳酸含量的影响
如附图所示,模型对照组血乳酸含量明显高于空白对照组(P<0.05)。WOPs干预组血乳酸含量与模型对照组相比有降低的趋势,其中WOPs 2、WOPs 3组与模型对照组相比差异具有统计学意义(P<0.05、P<0.01)。
2.5 WOPs对亚健康疲劳大鼠肝糖原的影响
如表5所示,与空白对照组相比,模型对照组大鼠肝糖原和肌糖原含量均有降低的趋势,但无统计学差异(P>0.05)。3个WOPs干预组肝糖原和肌糖原含量均高于模型对照组,其中WOPs 1、WOPs 3组肝糖原含量明显高于模型对照组(P<0.05、P<0.01);WOPs 1、WOPs 2组肌糖原含量显著高于模型对照组(P<0.05)。
3 讨论
现有关亚健康疲劳的实验研究主要以大鼠和小鼠为研究对象,多以跑台或游泳作为单一训练手段来制备实验疲劳动物模型。但现今社会亚健康疲劳多是由于精神压力和体力活动叠加共同引起的,单一因素亚健康疲劳动物模型的重复性、可靠性、相似性较差,不能准确反映亚健康疲劳引起的机体损伤模式[2,27]。因此,本研究采用睡眠剥夺(中枢疲劳)与负重力竭游泳(外周疲劳)复合造模法,在运动疲劳的基础上添加精神上的影响,来制备亚健康疲劳大鼠模型,将大鼠放入盛有2.2cm水深的动物笼中,迫使大鼠保持站立的姿态不能睡眠,从而导致其中枢疲劳;游泳时大鼠本能的一种运动方式,在进行游泳运动时不会表现出强烈的抵触行为,不容易产生其他的应激源[19,22,24]。实验中模型对照组大鼠体重明显下降、精神状态差、易激惹、易疲劳,而WOPs干预则在一定程度上减缓了大鼠体重的下降,改善了大鼠的精神状态。大鼠游泳疲劳模型是目前国内外比较公认的实验动物疲劳模型,本实验采用5%负重力竭游泳模型,力竭是疲劳长期积累而引起机体功能紊乱的病理状态,负重力竭游泳时间的长短可以反映动物疲劳的程度,是评价实验动物抗疲劳能力的有效指标[25,28]。本研究中,模型对照组负重力竭游泳时间与正常对照组相比下降明显(P<0.05)。WOPs各剂量组大鼠负重游泳时间的持续时间均高于模型对照组,其中WOPs 2、WOPs 3组大鼠负重游泳时间相比模型对照组显著延长(P<0.05、P<0.01),表明WOPs有效增强了亚健康疲劳大鼠体力和运动耐力,起到了防治亚健康疲劳的效果。
白细胞、红细胞及血红蛋白等相关指标是血常规检测的核心内容[29]。白细胞在疲劳相关的肌肉损伤引起的炎症反应中起着重要的作用[30-31]。在本实验中,模型对照组白细胞计数、单核细胞计数、淋巴细胞计数与正常对照组相比均显著升高,说明亚健康疲劳刺激激发了大鼠体内白细胞的大量产生;WOPs干预组白细胞计数、单核细胞计数和淋巴细胞计数均低于模型对照组,其中WOPs 1、WOPs 3组白细胞计数与模型对照组相比差异具有显著性(P<0.05),WOPs 3组单核细胞计数及淋巴细胞计数与模型对照组相比差异均有统计学意义(P<0.05、P<0.01),提示WOPs在维持机体白细胞水平时可以起到有效的作用。本实验中,模型对照组红细胞数和红细胞压积与空白对照组相比明显降低,差异具有统计学意义(P<0.05),说明大鼠力竭运动后,红细胞数量有所减少;WOPs干预组红细胞数和红细胞压积与模型对照组相比则明显增高(P<0.05或P<0.01),提示WOPs干预可适当提高红细胞的含量。血红蛋白含量是运动员身体机能检测中极为重要的一项。本研究结果显示,模型对照组大鼠血红蛋白含量与正常对照组相比显著降低(P<0.05),说明睡眠剥夺加力竭游泳运动降低了大鼠血红蛋白的含量;WOPs干预组血红蛋白含量与模型对照组相比明显升高(P<0.05),表明WOPs有益于疲劳的恢复。
研究发现,血乳酸水平可以有效反映机体有氧代谢能力、疲劳的产生和消除速度[32]。本研究中,WOPs干预组全血中乳酸含量与模型对照组相比有不同程度的下降,且WOPs 2、WOPs 3组与模型对照组相比差异具有显著性(P<0.05、P<0.01),表明WOPs可有效促进乳酸的代谢与排除,降低大鼠体内血乳酸堆积,延长运动时间,延缓疲劳的产生或加速疲劳的消除。此外,糖原储备可作为评价机体抗疲劳能力的重要指标[28]。正常运动时机体的能量提供主要来自于糖原的分解,其中肌糖原是维持肌肉运动的重要能源,肝糖原分解是血糖维持稳定的重要保障[33]。研究发现,肌糖原消耗增加时,机体將分解肝糖原产生葡萄糖进入血液,以维持血糖水平;当肝糖原储备耗竭时,机体不能维持正常的血糖水平,将会导致大脑供能不足,从而影响机体健康引起疲劳[34]。本研究中,WOPs干预组肝糖原和肌糖原含量均高于模型对照组,其中WOPs 1、WOPs 3组肝糖原含量显著高于模型对照组(P<0.05、P<0.01);WOPs 1、WOPs 2组肌糖原含量与模型对照组相比差异具有显著性(P<0.05),表明WOPs可以增强大鼠肝糖原和肌糖原的储备,提高运动耐力,延缓疲劳。
综上所述,本研究通过模拟亚健康疲劳相关发生发展因素,使大鼠站立于水盒中连续5d,并结合负重力竭游泳,成功制备出亚健康疲劳大鼠模型。WOPs干预则可明显改善亚健康疲劳大鼠精神状态,显著提高大鼠力竭游泳时间,改善亚健康疲劳状态引起的血常规异常,降低全血中乳酸的堆积和提高机体肝糖原与肌糖原含量,促进了机体疲劳的恢复,缩短了亚健康康复时间,从而为研制开发新型健康的生物活性肽类抗亚健康疲劳功能食品提供实验基础。
参考文献
[1]林沅锜,许军,李文源,等.亚健康状态影响因素的研究进展[J].中国医药导报,2017,14(33):35-39.
[2]黄建华.疲劳型亚健康小鼠模型的创建及维康颗粒对其血清皮质酮的影响[D].广州:南方医科大学,2010.
[3]中华中医药学会.亚健康中医临床指南[M].北京:中国中医药出版社,2006.
[4]孙淑英,孟青芳,张青霞.疏肝健脾膏对躯体性亚健康人群疲乏及睡眠质量的影响[J].解放军预防医学杂志,2018,36(10):1340-1343.
[5]孙传玲.我国“过劳死”工伤认定问题研究[D].南宁:广西大学,2017.
[6]囤秀秀.蓝莓浓缩汁对小鼠疲劳型亚健康的改善作用[D].大连:大连理工大学,2017.
[7]陈彩霞,苏秀兰,韩瑞兰.生物活性肽调节免疫功能的研究现状[J].现代预防医学,2016,43(15):2798-2801.
[8]He L X,Ren J W,Liu R,et al.Ginseng (Panax ginseng Meyer)oligopeptides regulate innate and adaptive immune responses in mice via increased macrophage phagocytosis capacity,NK cell activity and Th cells secretion[J].Food Funct,2017,8(10):3523-3532.
[9]李勇.肽营养学[M].北京:北京大学医学出版社,2007.
[10]Bao L,Cai X,Wang J,et al.Anti-fatigue effects of small molecule oligopeptides isolated from panax ginseng C.A.meyer in mice[J].Nutrients,2016,8(12):807.
[11]杜倩,乌兰,刘睿,等.核桃肽对幼年小鼠学习记忆能力的影响[J].中国生育健康杂志,2017,28(6):538-543.
[12]珠娜,张亭,刘睿,等.核桃低聚肽辐射防护作用探讨[J].中国公共卫生,2018:1-3.
[13]珠娜,郝云涛,张亭,等.核桃低聚肽对60Coγ射线照射小鼠氧化损伤保护作用的实验研究[J].中国预防医学杂志,2019(3):212-216.
[14]张亭,珠娜,刘睿,等.核桃低聚肽的润肠通便功能作用[J].中国公共卫生,2019,35(9):1225-1228.
[15]张亭,李迪,乌兰,等.牡蛎低聚肽配伍核桃低聚肽和山药多糖对雄性小鼠性功能的影响[J].现代预防医学,2018,45(12):2141-2144、2153.
[16]贾靖霖,蒲云峰,李虎,等.核桃多肽抗疲劳作用的研究[J].食品工业科技,2014,35(7):340-342.
[17]段心妍.核桃肽对雄性大鼠抗疲劳作用的研究[D].太原:太原理工大学,2014.
[18]Kim D I,Kim K S.Walnut extract exhibits anti-fatigue action via improvement of exercise tolerance in mice[J].Laboratory Animal Research,2013,29(4):190-195.
[19]Tanaka M,et al.Establishment and assessment of a rat model of fatigue[J].Neurosci Lett,2003,352(3):159-162.
[20]Machado R B,et al. Sleep deprivation induced by the modified multiple platform technique:quantification of sleep loss and recovery[J].Brain Research,2004,1004(1-2):45-51.
[21]邹赢锌,刘玉香,周意,等.冬虫夏草口服液对亚健康疲劳的影响[J].现代预防医学,2015,42(7):1199-1201.
[22]李晓勇,靳文,孙晓敏,等.构建复合因素致慢性疲劳大鼠模型及血生化动态变化[J].中国组织工程研究与临床康复,2008(24):4701-4704.
[23]刘艳艳,陈淑娟,余洁英,等.维康颗粒对亚健康疲劳小鼠不同组织氧化应激损伤的干预作用[J].暨南大学学报(自然科学与医学版),2017,38(1):20-24、45.
[24]Moriura T,Matsuda H,Kubo M.Pharmacological study on Agkistrodon blomhoffii blomhoffii BOIE.V.anti-fatigue effect of the 50% ethanol extract in acute weight-loaded forced swimming-treated rats[J].Biological & Pharmaceutical Bulletin,1996,19(1):62-66.
[25]郭庆军.大鼠游泳运动疲劳模型力竭标准的研究[D].西安:第四军医大学,2011.
[26]Rogero M M,et al.Effect of alanyl-glutamine supplementation on plasma and tissue glutamine concentrations in rats submitted to exhaustive exercise[J].Nutrition (Burbank,Los Angeles County,Calif),2006,22(5):564-571.
[27]杨道宁,李丽.运动性疲劳动物模型制备的研究进展[J].沈阳体育学院学报,2011(3):80-85、89.
[28]鲍雷,王军波,蔡夏夏,等.吉林人参低聚肽抗疲劳作用[J].科技导报,2015,33(13):56-60.
[29]程华初,程婉红,王芳婷,等.降脂理肝汤对高脂饮食诱导的非酒精性脂肪肝大鼠血常规的影响[J].湖南中医杂志,2018,34(10):164-167.
[30]黄超.金针菇多糖对运动疲劳大鼠T淋巴细胞转录因子T-bet、GATA-3基因及蛋白表达的影响[D].济南:山东体育学院,2014.
[31]李扬.不同运动方式对反映肌肉微损伤指标影响的比较研究[D].北京:北京体育大学,2004.
[32]Ma G D,Chiu C H,Hsu Y J,et al.Changbai mountain ginseng (Panax ginseng C.A.Mey)extract supplementation improves exercise performance and energy utilization and decreases fatigue-associated parameters in mice[J].Molecules (Basel,Switzerland),2017,22(2):237.
[33]Kent J A,et al.No Muscle is an island:integrative perspectives on muscle fatigue[J].Medicine and Science in Sports and Exercise,2016,48(11):2281-2293.
[34]Osman W N W,Mohamed S.Standardized morinda citrifolia L.and Morinda elliptica L.leaf extracts alleviated fatigue by improving glycogen storage and lipid/carbohydrate metabolism[J].Phytotherapy Research,2018,32(10):2078-2085.
[35]烏兰,刘睿,杜倩,等.核桃肽对小鼠的抗疲劳作用研究[J].中国食物与营养,2018,24(12):50-52.
Abstract:Objective To evaluate effects of walnut oligopeptides (WOPs)in fatigue-type sub-health rats and explore the possible underlying mechanism.Method Totally 50 male SD rats were randomly divided into five experimental groups including normal control group,model control group,and three WOPs intervention groups.The normal control group and model control group were administered distilled water,and the three intervention groups administered WOPs by orally gavage at a dose of 220,440,and 880 mg/kg of body weight,respectively.After the rats in model control group and WOPs groups were sleep deprivation for five consecutive days,the exhausted swimming time of rats in all groups were observed,the change of routine blood,lactic acid and liver glycogen storage were measured.Result It was observed that WOPs could significantly prolong the swimming time,improve the abnormal increase in white blood cells and reduction in red blood cells and hemoglobin,decrease the accumulation of blood lactic acid,and enhance the glycogen storage of liver.Conclusion WOPs have beneficial effects of anti-fatigue-type sub-health,which may be a novel anti-fatigue-type sub-health natural substance.
Keywords:walnut oligopeptides(WOPs);sub-health;fatigue;sleep deprivation;exhaustive swimming test
(责任编辑 李婷婷)
