采用UPLC-MS/MS法研究树豆酮酸A在不同种属肝微粒体中的代谢差异
2019-09-10张丽蔡进班玉娟朱高峰陈瑞王建塔汤磊黄静
张丽 蔡进 班玉娟 朱高峰 陈瑞 王建塔 汤磊 黄静

摘 要 建立測定肝微粒体孵育体系中树豆酮酸A(CAA)质量浓度的方法,并比较其在不同种属肝微粒体中的代谢特征。方法:分别将CAA溶解于由还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)启动的大鼠、比格犬、人肝微粒体孵育体系中,置于37 ℃水浴中进行孵育,分别于孵育的0、5、10、15、30、45、60 min时用乙腈终止反应,以染料木素为内标,采用超高效液相色谱-串联质谱法(UPLC-MS/MS)检测各孵育体系中CAA的质量浓度。色谱柱为Waters BEH C18,流动相为水(含0.1%甲酸)-乙腈(含0.1%甲酸)(45 ∶ 55,V/V),流速为0.25 mL/min,柱温为30 ℃,进样量为2 μL;采用电喷雾离子源,以选择反应监测模式进行负离子扫描,用于定量分析的离子对分别为m/z 353.14→309.11(CAA)、m/z 269.86→224.11(内标)。以孵育0 min时CAA的质量浓度为参照,计算其在不同孵育体系中的剩余百分比和酶动力学参数。结果:CAA检测质量浓度的线性范围为0.05~20 μg/mL,定量下限为0.05 μg/mL,最低检测限为0.01 μg/mL;日内、日间RSD均小于10%,相对误差为-4.83%~8.94%,提取方法和基质效应均不影响待测物的测定。孵育60 min时,CAA在大鼠、比格犬、人肝微粒体中的剩余百分比分别为(62.79±9.99)%、(64.07±11.59)%、(96.66±5.71)%;在大鼠、比格犬肝微粒体中的半衰期(72.19、68.61 min)均显著短于人肝微粒体(364.74 min),清除率[0.019 2、0.020 2 mL/(min·mg)]均显著高于人肝微粒体[0.003 8 mL/(min·mg)](P<0.05)。结论:本研究建立的UPLC-MS/MS法简便、快速、专属性强、灵敏度高,可用于肝微粒体孵育体系中CAA质量浓度的测定及体外代谢稳定性的研究。CAA在大鼠、比格犬肝微粒体中的代谢稳定性均差于人肝微粒体。
关键词 树豆酮酸A;超高效液相色谱-串联质谱法;肝微粒体;不同种属;体外代谢稳定性
ABSTRACT OBJECTIVE: To establish a determination method for the concentration of cajanonic acid A (CAA) in liver microsome incubation system, and to compare the metabolism characteristics of it in different species of liver microsomes. METHODS: CAA was dissolved in liver microsome incubation system of rat, Beagle dog and human initiated by reduced nicotinamide adenine dinucleotide phosphate (NADPH), and was incubated in water at 37 ℃. The reaction was terminated with acetonitrile at 0, 5, 10, 15, 30, 45 and 60 min, respectively. Using genistein as internal standard, the concentration of CAA in different incubation systems was determined by UPLC-MS/MS. The determination was performed on Waters BEH C18 column with mobile phase consisted of water (containing 0.1% formic acid)-acetonitrile (containing 0.1% formic acid) (45 ∶ 55, V/V) at the flow rate of 0.25 mL/min. The column temperature was 30 ℃, and the sample size was 2 μL. The electrospray ionization source was used to the select reaction monitoring mode for negative ion scanning. The ion pairs for quantitative analysis were m/z 353.14→309.11 (CAA), m/z 269.86→224.11 (internal standard) respectively. The residual percentage and enzymatic kinetic parameters of CAA in different incubation systems were calculated according to the mass concentration of CAA at 0 min. RESULTS: The linear range of CAA was 0.05-20 μg/mL; the limit of quanti- tation was 0.05 μg/mL, and the lowest detection limit was 0.01 μg/mL. RSDs of intra-day and inter-day were lower than 10%; relative errors ranged -4.83%-8.94%; extraction method and matrix effect did not affect the determination of the substance to be measured. At 60 min of incubation, residual percentages of CAA in rat, Beagle dog and human liver microsomes were(62.79±9.99)%,(64.07±11.59)%,(96.66±5.71)%, respectively. The half-life period (72.19, 68.61 min) of CAA in rat and Beagle dog liver microsomes were significantly shorter than human liver microsome (364.74 min). The clearance rates [0.019 2, 0.020 2 mL/(min·mg)] were significantly higher than human liver microsome [0.003 8 mL/(min·mg)] (P<0.05). CONCLUSIONS: Established UPLC-MS/MS method is simple, rapid, specific and sensitive, and can be used for the determination of CAA concentration in liver microsome incubation system and the study of metabolism stability in vitro. The stability of CAA metabolism in rat and Beagle dog liver microsomes are poorer than human liver microsome.
KEYWORDS Cajanonic acid A; UPLC-MS/MS; Liver microsomes; Different species; Metabolism stability in vitro
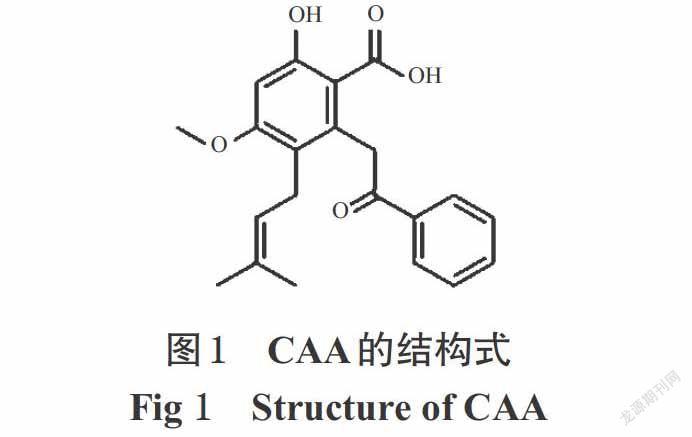
樹豆酮酸A(Cajanonic acid A,CAA;结构式见图1)是从豆科植物树豆[Cajanus cajan (Linn.) Millsp.]叶中分离出的一种新的菧类化合物[1-2]。已有体内外研究证实,CAA作为肥胖症特异性靶点蛋白酪氨酸磷酸酶1B(PTP1B)抑制剂,可明显提高胰岛素抵抗脂肪细胞对葡萄糖的吸收量,并可降低先天肥胖型小鼠的体质量和空腹血糖水平、提高其葡萄糖耐受量,具有开发成糖尿病治疗药物的潜力和价值[3-4]。
细胞色素P450(CYP)酶是药物Ⅰ相代谢的重要酶系,主要存在于肝微粒体中,在药物生物转化过程中发挥着至关重要的作用[5-6]。在新药研发的早期阶段,研究者可通过表征药物在体外不同种属肝微粒体中的代谢稳定性和代谢转化行为来分析其代谢差异[7-8]。鉴于此,本研究建立了测定肝微粒体中CAA质量浓度的超高效液相色谱-串联质谱法(UPLC-MS/MS),计算并比较了该化合物在大鼠、比格犬和人肝微粒体中的酶动力学参数[消除半衰期(t1/2)、体外清除率(CLint)],旨在为CAA的体内代谢研究提供参考,为其后续药效学及临床研究奠定基础。
1 材料
1.1 仪器
UltiMate 3000型UPLC-TSQ Endura型三重四极杆串联质谱仪,配有电喷雾离子源(ESI)和Xcalibur v2.2数据处理系统(美国Thermo Finnigan公司);JN300-2型氮气吹扫仪(苏州吉米诺仪器有限公司);X1型高速离心机(香港基因有限公司);KH-600E型超声波清洗器(昆山禾创超声仪器有限公司);FA805N型十万分之一电子天平(上海菁海仪器有限公司);DW-86L486型超低温保存箱(青岛海尔股份有限公司)。
1.2 药品与试剂
CAA对照品(贵州医科大学药物化学重点实验室制备,批号:20180521,纯度:>98%);染料木素对照品(内标,批号:528C021,纯度:>98%)、烟酰胺腺嘌呤二核苷酸磷酸二钠(NADP-Na2,批号:718B0225)、葡萄糖-6-磷酸-二钠(G-6-P-Na2,批号:116B039)、葡萄糖-6-磷酸脱氢酶(G-6-P-DH,批号:20160725)均购自北京索莱宝科技有限公司;雄性SD大鼠肝微粒体(批号:M10017. 2017002)、雄性比格犬肝微粒体(批号:M10007. 2017002)、人肝微粒体(男性健康蒙古利亚人种,批号:M10001.2017003)均购自武汉普莱特生物医药技术有限公司,质量浓度均为20 g/L(以蛋白计);甲酸、甲醇、乙腈均为色谱纯,氯化镁、柠檬酸钠等其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 溶液的制备
2.1.1 CAA和内标溶液 精密称取CAA对照品适量,用甲醇溶解并定容,制得质量浓度为1 mg/L的CAA贮备液;同法制得质量浓度为1 mg/L的内标贮备液;上述贮备液均置于4 ℃保存,备用。临用前,将CAA贮备液与适量甲醇、0.1 mol/L磷酸盐缓冲液(PBS,pH 7.4;下同)、肝微粒体、辅酶溶液等混合,制备孵育体系;将内标贮备液用甲醇稀释,制得质量浓度为2 μg/mL的内标溶液。
2.1.2 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅酶溶液 A液:依次加入NADP-Na2、G-6-P-Na2、氯化镁200、200、133 mg,用水定容至10 mL。B液:依次加入柠檬酸钠、G-6-P-DH 44 mg、1 000 U,用水定容至25 mL。将A、B液均置于-20 ℃保存,备用。临用前,将A、B液按体积比5 ∶ 1混合,制得浓度为1 mmol/L(按反应产物NADPH计)的辅酶溶液[9]。
2.2 样品孵育与处理
2.2.1 孵育体系的建立 取大鼠、比格犬、人肝微粒体各适量,用PBS稀释至0.5 g/L,随后加入“2.1.1”项下CAA贮备液适量,使CAA最终质量浓度为5 μg/mL,同时确保孵育体系中甲醇的含量不超过1%。将上述溶液置于37 ℃水浴中静置5 min后,加入“2.1.2”项下NADPH辅酶溶液以启动反应。该体系总体积为200 μL,其中NADPH的终浓度为1 mmol/L,有机溶剂不超过5%[10-11]。
2.2.2 样品孵育与处理 将上述孵育体系继续置于37 ℃水浴中进行孵育,分别于孵育0、5、10、15、30、45、60 min时,加入含内标(2 μg/mL)的乙腈400 μL终止反应,涡旋混匀30 s,于4 ℃下以16 000×g离心10 min,取上清液以氮气流吹干,残渣用甲醇200 μL复溶,再以16 000×g离心10 min,取上清液适量进行UPLC-MS/MS分析,考察各时间点待测物的含量[12]。各孵育体系均平行操作3次。
2.3 UPLC-MS/MS定量分析
2.3.1 色谱与质谱条件 色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7 μm);保护柱:Waters VanGuard BEH C18(5 mm×2.1 mm,1.7 μm);流动相:水(含0.1%甲酸)-乙腈(含0.1%甲酸)(45 ∶ 55,V/V);流速:0.25 mL/min;柱温:30 ℃;进样量:2 μL;采集时间:6 min。电离源:ESI;扫描模式:选择反应监测(SRM)模式;扫描方式:负离子扫描;喷雾电压:2 963.64 V;气化温度:270 ℃;气帘气压力:25 psi;用于定量分析的离子对:m/z 353.14→309.11(CAA,透射电压:164.39 V,碰撞能:17.13 eV)、m/z 269.86→224.11(内标,透射电压:181.03 V,碰撞能:24 eV)。
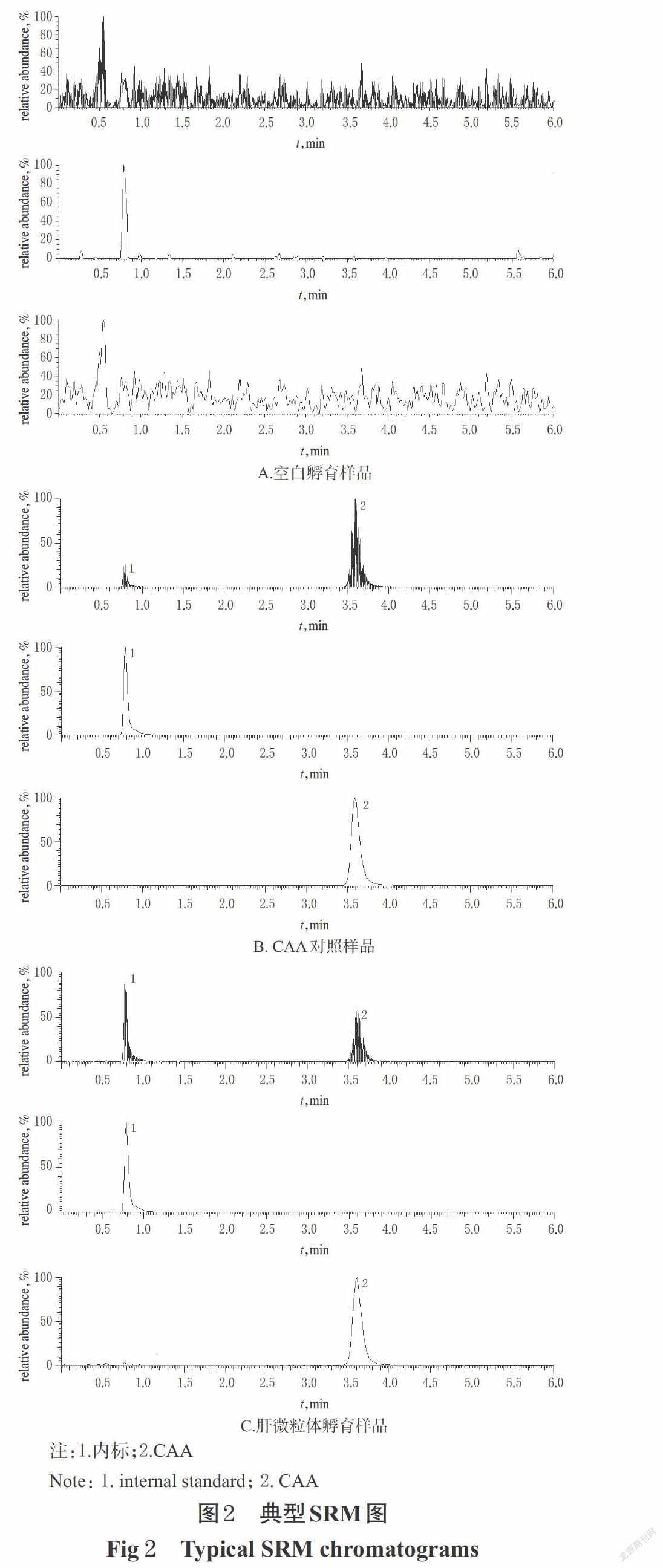
2.3.2 专属性 分别取空白孵育样品(不含待测物和内标,以经高温灭活的大鼠肝微粒为介质,按“2.2”项下方法制得)、CAA对照样品(含待测物5 μg/mL和内标2 μg/mL,以经高温灭活的大鼠肝微粒为介质,按“2.2”项下方法制得)、孵育15 min时的样品(大鼠肝微粒体,按“2.2.2”项下方法处理)各适量,按“2.3.1”项下色谱与质谱条件进样分析,记录色谱图。结果,内标和CAA的色谱峰峰形良好,其保留时间分别约为0.79、3.61 min,内源性物质不干扰待测物的测定,表明该方法专属性好,详见图2。
2.3.3 标准曲线、定量下限、最低检测限的考察 取“2.1.1”项下CAA贮备液适量,加至经高温灭活的大鼠肝微粒体孵育体系(0.2 mL)中,制得CAA质量浓度分别为0.05、0.1、0.5、1、2.5、5、10、20 μg/mL的系列标准曲线对照溶液,按“2.2.2”项下方法孵育15 min并處理,再按“2.3.1”项下色谱与质谱条件进样分析,记录峰面积。以待测物质量浓度(c,μg/mL)为横坐标、待测物与内标峰面积的比值(y)为纵坐标,采用加权最小二乘法(加权系数为1/c)进行线性回归,得回归方程为y=12.98c+0.92(R2=0.997 3)。结果,CAA检测质量浓度的线性范围为0.05~20 μg/mL,定量下限为0.05 μg/mL(信噪比为10 ∶ 1),最低检测限为0.01 μg/mL(信噪比为3 ∶ 1)。
2.3.4 准确度与精密度试验 按“2.3.3”项下方法配制CAA定量下限质量浓度(0.05 μg/mL)样品以及低、中、高质量浓度(0.1、2.5、10 μg/mL)质控(QC)样品各5份,按“2.2.2”项下方法孵育15 min并处理,再按“2.3.1”项下色谱与质谱条件进样分析,考察日内精密度;连续测定3 d,考察日间精密度。将实测质量浓度与理论质量浓度进行比较,以相对误差(RE)来考察准确度。结果,CAA定量下限质量浓度以及低、中、高质量浓度QC样品的日内、日间RSD均小于10%,RE为-4.83%~8.94%,符合生物样品定量分析的相关要求[13],详见表1。
2.3.5 提取回收率与基质效应试验 按“2.3.3”项下方法配制低、中、高质量浓度(0.1、2.5、10 μg/mL)QC样品,再按“2.2.2”项下方法孵育15 min并处理,进样分析,记录峰面积(A1);按“2.2.1”项下方法制备经灭活的大鼠肝微粒体孵育体系适量,再按“2.2.2”项下方法孵育15 min并处理,随后加入CAA贮备液适量,使最终质量浓度与上述QC样品对应,进样分析,记录峰面积(A2);以甲醇配制相应质量浓度且不含辅酶溶液的样品溶液,再按“2.2.2”项下方法孵育15 min并处理,进样分析,记录峰面积(A3)。各质量浓度平行操作5份。提取回收率=(A1/A2)×100%,基质效应=(A2/A3)×100%。结果,CAA低、中、高质量浓度QC样品的提取回收率和基质效应均符合生物样品定量分析的相关要求[13],表明提取方法、基质效应均不影响待测物的定量分析,详见表2。
2.3.6 稳定性试验 按“2.3.3”项下方法配制CAA低、中、高质量浓度(0.1、2.5、10 μg/mL)QC样品各5份,按“2.2.2”项下方法孵育15 min并处理后,考察其在自动进样器(8 ℃)内放置6 h、室温放置12 h、4 ℃冷藏12 h、反复冻融(-80 ℃~常温)3次的稳定性。结果,各样品实测质量浓度的RSD均小于10%,表明其在上述条件下稳定性良好,详见表3。
2.4 CAA在大鼠、比格犬、人肝微粒体中的代谢稳定性研究
按“2.2”项下方法进行体外代谢稳定性研究,采用底物消除法考察CAA的代谢情况。以CAA孵育0 h时的质量浓度为参照,其余时间点的质量浓度与之相比计算底物剩余百分比。上述试验平行操作3次。使用GraphPad Prism v7.0软件绘制CAA在不同种属肝微粒体孵育体系中的平均剩余百分比-时间曲线,结果见图3(由于其余时间点的实测值可能大于0 h时的实测值,故剩余百分比可能超过100%)。
将各时间点的平均剩余百分比的自然对数对孵育时间作线性回归,求得斜率(k),根据公式①②计算酶动力学参数(t1/2、CLint)[14-15]:
参照如下标准判断CAA在不同种属肝微粒体中的代谢稳定性:t1/2<30 min,表明受试物代谢不稳定;t1/2为30~90 min,表明受试物代谢稳定性中等;t1/2>90 min,表明受试物代谢稳定性良好[16]。使用GraphPad Prism v7.0软件对数据进行统计分析。组间比较采用单因素方差分析(One-way ANOVA)或t检验。P<0.05为差异有统计学意义。结果,在以NADPH启动的Ⅰ相肝微粒体孵育体系中,CAA在大鼠、比格犬肝微粒体中的代谢稳定性一般,两者的t1/2均显著短于人肝微粒体,CLint均显著高于人肝微粒体,差异均有统计学意义(P<0.05),详见表4。
3 讨论
肝脏是代谢的主要器官,是药物进行生物转化的重要场所。在这个复杂的生理过程中,药物被各种代谢酶分解、转化成不同的分子(即代谢物)以发挥其药理活性。与体内代谢研究相比,体外代谢研究具有成本低廉,操作方法简便、快速,结果重现性好等优点,适用于新药研发候选化合物代谢行为的早期研究及筛选[7-8]。为此,本研究对CAA在不同种属肝微粒体中的代谢行为进行了初步探讨。
3.1 UPLC-MS/MS条件的筛选
在建立孵育体系中CAA质量浓度测定的UPLC- MS/MS法时,考虑到比格犬和人肝微粒体价格昂贵、研究成本较高,且不同种属经灭活的肝微粒体间的差异不大,故本研究以大鼠肝微粒体为介质,进行方法学考察。
在色谱流动相的筛选过程中,本研究比较了乙腈和甲醇的分离效果。结果显示,与甲醇相比,乙腈可使待测物具有更高的质谱响应和更低的背景噪声,色谱峰峰形更佳,故选择乙腈作为流动相的有机相。此外笔者还发现,在流动相中添加适量甲酸可提高待测物的电离强度,并可缩短CAA的保留时间,故在两相比例优化的基础上,最终将流动相确定为水(含0.1%甲酸)-乙腈(含0.1%甲酸)(45 ∶ 55,V/V)。
在质谱扫描模式的考察中,本研究比较了正、负离子模式下待测物的质谱响应情况。结果发现,在正离子模式下,CAA基本无响应;而在负离子模式下,CAA和内标的响应均较强。因此,本研究选择了负离子模式。
本课题组前期对槲皮素、儿茶酚、儿茶素、染料木素、葛根素、杨梅素等内标物质进行了筛选。结果发现,以染料木素为内标时,该化合物与CAA可基线分离,且两者回收率均较高,故以染料木素作为CAA定量分析的内标。
3.2 底物濃度的选择
在体外代谢研究中,受试底物的浓度不能太高,否则将无法保证其20%的清除率;另一方面,受试底物的浓度也不宜过低,否则底物可能在极短的时间内就被清除完全[17-18]。为此,本课题组前期对1、5、10 μg/mL等3个质量浓度CAA的孵育情况进行了考察。结果显示,当CAA的质量浓度为5 μg/mL时,剩余药物浓度并不太高,且大部分种属肝微粒体中有20%的药物被清除,故最终将孵育底物CAA的质量浓度定为5 μg/mL。
3.3 酶动力学参数检测方法的选择
代谢稳定性研究多采用产物生产法和底物消除法。其中,产物生产法考察的是单位时间内代谢产物的生成量,并将产物生产速率和反应时间进行米氏方程拟合,以获得相应的酶动力学参数,适用于代谢物已知且代谢物标准品易获得的药物的代谢研究;而底物消除法则是以母体化合物在不同时间点的消除量来反映底物的消除情况,勿需代谢物的具体信息,适用于新药研发早前阶段的代谢稳定性研究[19]。鉴于研究成本及方法的易操作性,本研究选用了底物消除法对CAA的酶动力学参数和代谢稳定性进行了初步考察。
3.4 CAA在不同种属肝微粒体中的代谢特征分析
本研究结果显示,经孵育后,CAA在3个种属肝微粒体中的t1/2由小到大依次为比格犬(68.61 min)、大鼠(72.19 min)、人(364.75 min),CLint由小到大依次为人[0.003 8 mL/(min·mg)]、大鼠[0.019 2 mL/(min·mg)]、比格犬[0.020 2 mL/(min·mg)],表明该化合物在比格犬和大鼠体内代谢稳定性一般,在人体内代谢稳定性良好。这提示比格犬和大鼠与人之间存在一定差异。动物为药物代谢行为研究提供了生理学载体,但物种间的差异可能会对人体内代谢情况的模拟造成影响,故在选择实验动物时应予以关注。
综上所述,本研究成功建立了测定大鼠肝微粒体中CAA质量浓度的UPLC-MS/MS法,该方法简便、快速、专属性强、灵敏度高,可用于肝微粒体孵育体系中CAA质量浓度的测定及体外代谢稳定性的研究。CAA在大鼠、比格犬、人肝微粒体中的代谢特征有所差异,其代谢可能与Ⅰ相代谢酶有关。本课题组后续将借助高分辨质谱、波谱等手段进一步确证CAA的代谢产物,并结合体内外研究进一步阐明其代谢特征,以期为该化合物的开发利用提供更多参考。
参考文献
[ 1 ] 王璐.树豆酮酸A调节血糖血脂的作用和机理研究[D].广州:广州中医药大学,2012.
[ 2 ] GANDHI GR,JOTHI G,ANTONY PJ,et al. Gallic acid attenuates high-fat diet fed-streptozotocin-induced insulin resistance via partial agonism of PPARγ in experimental type 2 diabetic rats and enhances glucose uptake through translocation and activation of GLUT4 in PI3K/p-Akt signaling pathway[J]. Eur J Pharmacol,2014. DOI:10.1016/j.ejphar.2014.10.044.
[ 3 ] OHASHI M,GAMO K,TANAKA Y,et al. Structural design and synthesis of arylalkynyl amide-type peroxisome proliferator-activated receptor γ(PPARγ)-selective antagonists based on the helix12-folding inhibition hypothesis[J]. Eur J Med Chem,2015. DOI:10.1016/j.ejmech.2014.11.017.
[ 4 ] CHEN WZ,FAN LL,XIAO HT,et al. First total synthesis of natural products of cajanolactone A and cajanonic acid A[J]. Chin Chem Let,2014. DOI:10.1016/j.cclet.2014.03. 027.
[ 5 ] 吴桐,阳海鹰,原梅,等.雷公藤甲素在人和大鼠肝微粒体代谢消除和酶动力学的比较研究[J].中国药理学通报,2018,34(10):1414-1419.
[ 6 ] 鲁艳柳,刘浩,曾瑶,等.石斛碱在体外肝微粒体代谢的种属差异研究[J].天然产物研究与开发,2018,30(9):1538-1542.
[ 7 ] 夏媛媛,杨沮勤,朱伊婷,等. UPLC-MS/MS研究抗肿瘤化合物HK-7在不同种属肝微粒体中的代谢稳定性和代谢酶表型[J].中国新药杂志,2018,27(2):178-183.
[ 8 ] 王海蓉,李小彬,杨楸楠,等. UPLC-MS/MS研究披针灰叶素B在不同种属肝微粒体中的代谢稳定性及代谢酶表型[J].中国中药杂志,2016,41(1):124-128.
[ 9 ] 潘洁,陆苑,孙佳,等.艾迪注射液对体外人和大鼠肝微粒体中CYP450酶的抑制作用[J].中成药,2016,38(11):2332-2337.
[10] ZHOU S,GUO C,SHI F,et al. Application of an ultrahigh-performance liquid chromatography coupled to quadrupole-orbitrap high-resolution mass spectrometry for the rapid screening,identification and quantification of illegal adulterated glucocorticoids in herbal medicines[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2016. DOI:10.1016/j. jchromb.2016.10.010.
[11] 陈勇,沈少林,陈怀侠. HPLC-ESI-ITMSn法鉴定麻黄碱及其大鼠体内主要代谢产物[J].药学学报,2005,40(9):838-841.
[12] WANG Y,HE S,CHENG X,et al. UPLC-Q-TOF-MS/MS fingerprinting of traditional Chinese formula SiJunZiTang[J]. J Pharm Biomed Anal,2013. DOI:10.1016/j.jpba.2013.02.021.
[13] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:363-368.
[14] 杨洋,李静,肖涛,等.阿德福韦混膦酯衍生物体外代谢及稳定性研究[J].中国药科大学学报,2018,49(6):699- 705.
[15] 陈瑞,张丽,蔡进,等.新型胰岛素增敏剂ZG02在大鼠肝微粒体中的代谢稳定性研究[J].中国药房,2018,29(24):3359-3363.
[16] QI Y,LI S,PI Z. Chemical profiling of Wu-tou decoction by UPLC-Q-TOF-MS[J]. Talanta,2014. DOI:10.1016/j.talanta.2013.09.054.
[17] MA HY,YANG JD,HOU J,et al. Comparative metabolism of DDAO benzoate in liver microsomes from various species[J]. Toxicol In Vitro,2017. DOI:10.1016/j.tiv.2017. 06.020.
[18] 劉昌孝.发展药物代谢和药物动力学,迎接生物技术发展新时代的挑战[J].药学进展,2018,42(8):4-6.
[19] 李小彬.抗肿瘤化合物F18的肝微粒体体外代谢和大鼠体内代谢研究[D].成都:成都中医药大学,2016.
(收稿日期:2019-01-24 修回日期:2019-07-06)
(编辑:张元媛)
