弥散张量成像在脑室周围白质软化早期诊断中的应用价值
2019-09-07刘艳萍马远宁
杨 柳,高 丽,刘艳萍,李 岩,马远宁
(1.河南省人民医院儿科,河南 郑州 450003;2.郑州市儿童医院神经内科,河南 郑州 450000)
脑室周围白质软化(periventeic uler leukomacia,PVL)是患儿出生时因宫内、宫外缺氧、缺血等因素导致脑白质损伤,引起一系列神经损伤表现,如不同程度运动发育落后等,也有部分患儿伴有感觉、认知、交流、行为等障碍[1-2],多见于早产儿和窒息存活儿童。婴儿期属于神经系统发育最快时期,早诊断、早治疗是影响预后的关键因素。多数患儿因为缺乏特异的临床表现未能早期发现、诊断并进行积极治疗,导致出现脑瘫、视力障碍等后遗症[3]。有研究发现,磁共振成像(magnetic resonance imaging,MRI)检查可为早产儿脑损伤的早期诊断提供准确的影像学依据[4],但常规MRI无法全面显示出PVL患儿脑白质受损情况,不利于对患儿症状进行诠释。弥散张量成像 (diffusion tensor imagine,DTI) 是一种无创性影像技术,可通过各向异性分数 (fractional anisotropy,FA) 和平均弥散率 (mean diffusivity,MD) 等指标定量反映脑白质微结构改变[5]。DTI技术依据水分子在不同部位弥散的差异性,呈现出红(X元素)、绿(Y元素)、蓝(Z元素)3种纤维走形,可了解纤维束损伤、缺失,但不能量化具体纤维数量。髓鞘的神经纤维束中的水分子沿轴突方向的弥散速度远大于垂直方向,有很强的方向依赖性和不均匀性,即弥散的FA。TRIVED等[6]首次将此项技术运用到脑瘫患儿皮质纤维束改变的研究中,发现水分子在脑瘫患儿白质纤维束FA明显降低,证明了FA可作为神经纤维束损伤的量化指标,并用向量图或彩色编码空间纤维束变化。BASSERT等[7]研究显示,人体神经纤维束之间具有连续的轴突方向,同时明确了纤维束在各个三维方向的走形路径。本研究旨在探讨是否可以通过DTI的FA值变化反映脑白质细微的病变,现将结果报道如下。
1 资料与方法
1.1 一般资料选择2014年1月至2016年10月河南省人民医院小儿神经内科收治的PVL患儿25例(观察组),男14例,女11例,年龄0.1~1.9(0.5±0.1)岁。病例入组标准:(1)围生期有缺氧、窒息等导致PVL高危因素;(2)能配合完成头颅MRI检查;(3)能够配合完成DTI检查;(4)患儿监护人知情同意,并签订知情同意书。另选择孕期B超检查疑似头颅异常复查的10例婴幼儿作为对照组,男6例,女4例,年龄0.3~1.5(0.7±0.2)岁。入组标准:(1)足月儿,围生期无明显缺氧、窒息等高危因素,认知、运动等各项功能发育正常;(2)常规MRI检查未见明显异常,且排除潜在可能引起脑神经系统白质纤维束变性的器质性病变,如颅内感染、占位、出血、脑白质发育不良等;(3)患儿监护人知情同意,并签订知情同意书。2组受试者的年龄、性别比较差异无统计学意义(P>0.05)。本研究通过河南省人民医院伦理委员会的审核。
1.2 早期康复治疗观察组患儿早期康复治疗采用Bobath疗法及运动学习疗法,体位控制调整肌张力,抑制异常运动模式,激发并强化正常运动功能,并给予鼠神经生长因子(厦门北大之路生物工程有限公司,国药准字S20060052)9 000 AU,肌肉注射,隔日1次,2周为1个疗程,共3个疗程;神经节苷脂(长春翔通药业有限公司,国药准字H20066833)20 μg,静脉滴注,每日1次,2周为1个疗程,共3个疗程。6个月后复查DTI,同时采用标准化运动技能测验评分量化发育情况,50~69分为发育商轻度低下,35~49分为发育商中度低下,20~34分为发育商重度低下,<20分为发育商极重度低下[8]。对PVL患儿康复前后进行0~6岁小儿神经心理发育检查表评估分析。
1.3 MRI和DTI检查采用3.0T超导型MRI成像仪进行常规扫描。入组时分别对观察组及对照组患者进行头颅MRI、DTI检查,治疗后6个月再次对观察组患儿进行MRI、DTI检查,检查前30 min所有受试者统一口服100 g·L-1水合氯醛溶液镇静(0.5 mL·kg-1),熟睡后获取常规T1、T2、FLAIR等序列。采用DTI进行白质纤维束示踪成像,将皮质脊髓束(corticospinal system,CST)、内囊前肢(anterior limb of internal capsule,ICAL)、内囊后肢(posterior limb of internal capsule,ICPL)、胼胝体膝部(genu of corpus callosum,GCC)、胼胝体压部(splenium of corpus callosum,SCC)、扣带束(cingulate gyrus,CG)作为本次研究的兴趣部位(region of interest,ROI)。测量ROI的FA值时,每个部位选取2 mm范围,分别测量3次,取其平均值。观察对应部位DTI彩图中受损纤维束数量、方向;检测FA值的大小;观察DTI及FLAIR异常信号情况。
2 结果
2.1 2组受试者头颅MRI表现观察组患儿常规头颅MRI表现为侧脑室周围、半卵圆中心等白质纤维部位FLAIR序列高信号,22例患儿侧脑室前后角及周围、半卵圆中心等部位可见少量散在点片状T2、FLAI高信号,其对应脑室结构无明显改变。3例患儿侧脑室周围、半卵圆中心部位可见大片状的T2高信号,FLAIR序列高信号,可见脑室轻微扩张。6例患儿伴有不同程度VEP-P2潜伏期延长,N2-P2振幅降低,3例患儿双侧高频听阈异常。对照组受试者头颅MRI脑实质未见明显异常,脑白质髓鞘化进程基本同月龄,脑室无扩大。
2.2 2组受试者头颅DTI表现比较结果见表1。DTI的彩色图能够较好的显示出大脑内白质纤维束走向、多少以及缺失。与对照组比较,观察组患儿CST、ICAL、ICPL、GCC、SCC、CG等部位均存在不同程度的破坏甚至缺失,其相应的FA值显著降低。观察组患儿ICAL左侧和右侧、ICPL右侧、GCC、CST左侧和右侧FA值均显著低于对照组,差异有统计学意义(P<0.05);ICPL左侧、SCC、CG左侧和右侧FA值与对照组比较差异无统计学意义(P>0.05)。
表1 2组受试者FA值比较
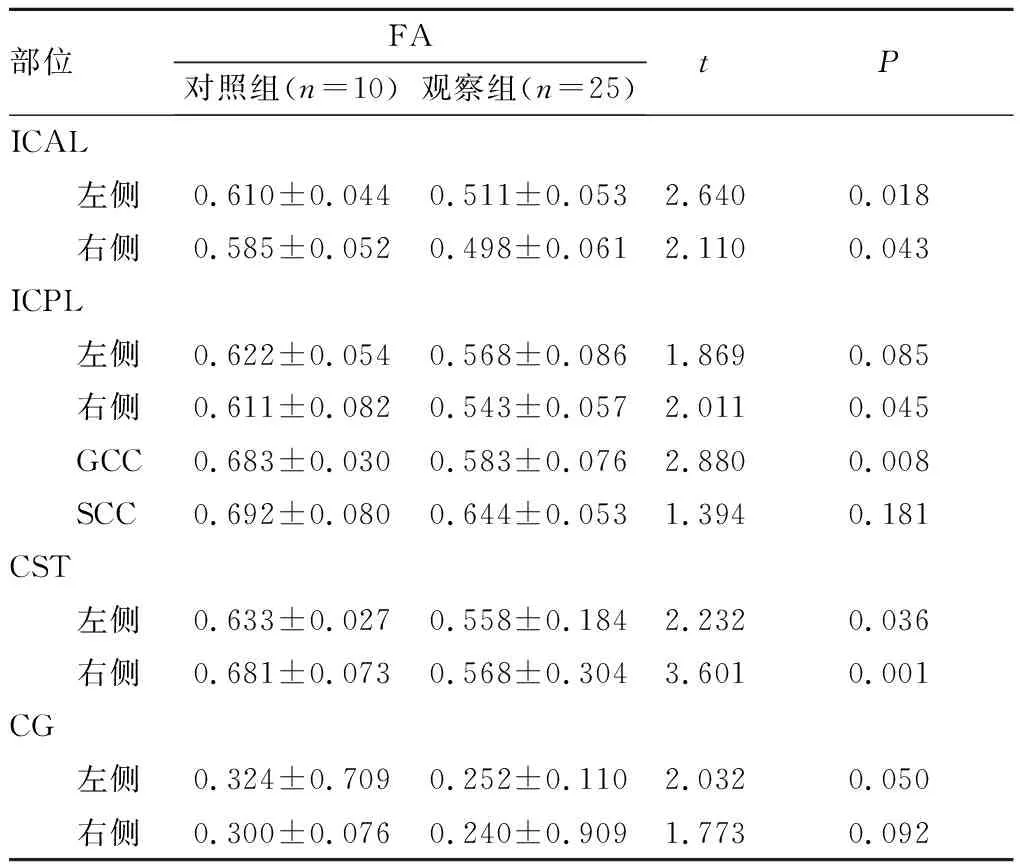
部位FA对照组(n=10)观察组(n=25)tPICAL 左侧0.610±0.0440.511±0.0532.6400.018 右侧0.585±0.0520.498±0.0612.1100.043ICPL 左侧0.622±0.0540.568±0.0861.8690.085 右侧0.611±0.0820.543±0.0572.0110.045 GCC0.683±0.0300.583±0.0762.8800.008 SCC0.692±0.0800.644±0.0531.3940.181CST 左侧0.633±0.0270.558±0.1842.2320.036 右侧0.681±0.0730.568±0.3043.6010.001CG 左侧0.324±0.7090.252±0.1102.0320.050 右侧0.300±0.0760.240±0.9091.7730.092
2.3 观察组受试者治疗前后FA值比较结果见表2。观察组患儿治疗后复查DTI发现,纤维束缺失、断裂较治疗前无明显变化。观察组患儿治疗后ICAL右侧、ICPL左侧和右侧、GCC、SCC、CST左侧和右侧、CG左侧FA值均显著高于治疗前,差异有统计学意义(P<0.05);ICAL左侧、CG右侧FA与治疗前比较差异无统计学意义(P>0.05)。
表2 观察组患儿治疗前后各纤维束FA值比较
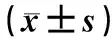
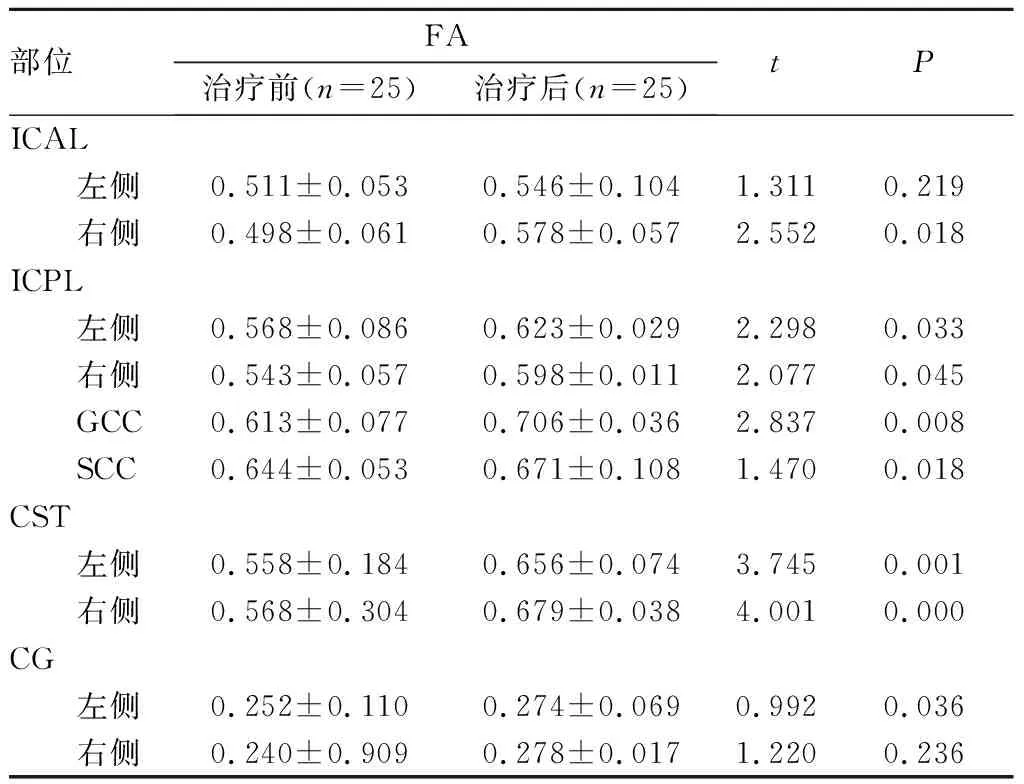
部位FA治疗前(n=25)治疗后(n=25)tPICAL 左侧0.511±0.0530.546±0.1041.3110.219 右侧0.498±0.0610.578±0.0572.5520.018ICPL 左侧0.568±0.0860.623±0.0292.2980.033 右侧0.543±0.0570.598±0.0112.0770.045 GCC0.613±0.0770.706±0.0362.8370.008 SCC0.644±0.0530.671±0.1081.4700.018CST 左侧0.558±0.1840.656±0.0743.7450.001 右侧0.568±0.3040.679±0.0384.0010.000CG 左侧0.252±0.1100.274±0.0690.9920.036 右侧0.240±0.9090.278±0.0171.2200.236
2.4 观察组患者治疗前后发育商比较康复治疗前观察组患者中发育商轻度低下7例,中度低下12例,重度低下5例,极重度低下1例;治疗后发育商正常6例,轻度低下10例,中度低下7例,重度低下2例;治疗后发育商较治疗前明显提高,差异有统计学意义(χ2=8.658,P=0.003)。
3 讨论
新生儿早期因缺血缺氧,体内的血流重新分配,髓鞘化缺陷,白质明显减少。常规头颅MRI仅严重受损白质区域信号增高,但病变轻微者MRI表现不明显,不易辨别。头颅MRI显示出明显异常时脑白质可能已经出现缺失,甚至断裂。DTI技术是通过水分子在各个方向的扩散程度来评估不同方向纤维束的完整性,FA值可对脑白质的损伤进行定量评估。PVL患儿早期给予干预治疗后,神经症状明显缓解,而MRI表现无明显改变。将FA值作为一个定量分析参数指标,其范围是0~1,组织中水分子扩散越慢,FA值信号越低。脑白质损伤早期,白质细胞毒性水肿,导致髓鞘神经纤维束之间间隙变窄,限制水分子向神经纤维束走形的方向运动,FA值明显降低,当病情逐渐加重出现血管源性水肿后,细胞损伤破裂,自由水增加,FA值进一步降低[9]。
本研究采用DTI示踪技术,分别选定CST、ICAL、ICPL、GCC、SCC、CG作为ROI,观察组患儿ROI白质纤维束较对照组明显紊乱、缺失、中断,与国外报道一致[10]。观察组患儿进行早期干预治疗后,其FA值增高,同时进行其他相关的辅助检查,例如脑干侧听、视觉诱发电位等,神经系统发育较前好转。SUZUKI等[11]研究发现,PVL患儿FA值降低的部位,主要位于双侧CST、内囊前后肢、半卵圆中心后部、上纵束、视辐射等。这些部位白质发育不良,会导致运动、认知、视力、听力等多方面的发育落后。解剖学上将脑白质区分为联络纤维、联合纤维、投射纤维,联络纤维联系同侧大脑皮质各个不同区域,联合纤维即为联络左右侧大脑,如胼胝体、前联合、穹隆联合,形成一个功能整体,正常行使极为复杂的功能活动[12-14]。投射纤维连接了皮层及皮层下部分结构往返纤维,而内囊区集中了绝大部分上下走形纤维,在神经系统中传递了大量的信息。FILIPPI等[15]对脑发育迟缓合并运动发育落后患儿不同部位脑白质进行比较,结果发现,除内囊外,其他白质部位的FA值远远落后于同龄正常儿童。本研究中PVL患儿CST、ICAL、ICPL、GCC、SCC、CG纤维束缺失、中断表现显著,说明它们在人类运动功能的生理机制中起重要作用[16]。刘娜等[17]分别对PVL行常规听力、视力电生理检测,发现5例患儿存在不同程度的视觉障碍,其严重程度与PVL的严重程度特别是与三角区周围白质减少、侧脑室后角扩大以及胼胝体的变薄显著相关,皮层的激活需要完整的视觉放射纤维的传导通路,视放射纤维束损伤程度与视觉损伤有直接关系,给予营养神经及视觉刺激等干预治疗3个月后,临床表现中追视、追听较治疗前灵敏,电生理传导延迟明显好转,与本次研究相一致。SCHMITHOMT等[18]对正常儿童进行白质纤维束追踪发现,GCC、SCC、CG相应的FA值与认知功能有相关性。
PVL患儿早期进行干预治疗,受损的纤维束能够进行修复及功能代偿,脑瘫后遗症概率大大下降。脑白质发育过程是连续的,以1~2岁最快,此期间不仅突触数目和神经连接回路迅速增多,轴突髓鞘也增加明显。FA值会随着年龄增长逐渐改变,婴幼儿各部位脑白质FA值明显低于成年人。尽管神经细胞不能再生,但纤维束受到损伤后会出现轴突绕道投射、树突分叉及纤维束间非神经性的连接,仍可保持完整的纤维回路,代偿其功能[19]。观察组患儿经过早期积极的干预治疗后,FA值明显增高,受损髓鞘功能逐渐代偿,神经系统发育评估也证实明显好转。然而纤维束损伤超过自身修复代偿范围,形成胶质增生,会导致各种后遗症,如癫痫、脑瘫等。通过DTI对PVL患儿进行早期诊断、早期治疗,在临床中是非常必要的。FA值是否可以对PVL患者进行程度分级,指导临床诊断、治疗,尚需要大样本数据来论证。
