氧化应激及炎症对糖尿病肾病的影响
2019-09-07阎婷婷赵英政易宪文徐光翠
阎婷婷,赵英政,易宪文,徐光翠
(1.新乡医学院公共卫生学院毒理学教研室,河南 新乡 453003;2.南阳市第二人民医院,河南 南阳 473200)
糖尿病是一种常见的具有遗传倾向的葡萄糖代谢和内分泌障碍性疾病,可导致糖尿病肾病(diabetic nephropathy,DN)、糖尿病视网膜病变及糖尿病周围神经病变等微血管并发症和周边动脉疾病等大血管并发症,其中DN是糖尿病患者晚期最严重的并发症,由于长期不可逆的肾脏损伤而最终导致终末期肾衰竭,是糖尿病患者死亡的主要原因之一[1]。氧化应激是机体氧化和抗氧化系统自稳态失衡,导致活性氧(reactive oxygen species,ROS)产生过量,超过机体正常的清除能力,从而引起组织器官氧化损伤,特别是线粒体损伤[2]。DN患者肾脏组织中许多炎症相关因子如细胞黏附因子、趋化因子和促炎因子表达增高[3]。研究显示,氧化应激和炎症参与了DN的发生及发展,氧化应激和炎症是DN发病机制中的重要环节甚至是中心环节[4]。临床研究显示,抗炎抗氧化药物能显著降低DN患者尿白蛋白的排泄,并降低体内炎性相关因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和丙二醛(malondialdehyde,MDA)水平[5],说明抗氧化剂对预防和治疗DN有重要作用。因此,本综述从DN的发病机制出发,探讨氧化应激及炎症对DN的影响,并进一步阐述抗氧化剂硫辛酸(alpha-lipoic acid,LA)在DN治疗中的作用。
1 氧化应激与DN
高血糖是引起糖尿病及其并发症的最主要因素,其中氧化应激是高血糖导致机体损伤的重要机制。机体在高血糖状态下可通过2种途径诱导氧化应激:(1)高血糖诱导自身氧化,这是体内ROS增多的主要原因;(2)诱导体内抗氧化酶糖基化[6],这一过程导致体内抗氧化酶活性降低或消失。这2种途径均与糖尿病患者的高血糖状态紧密相关。高血糖刺激体内氧化应激反应加强,氧化应激状态下常伴随ROS水平升高,ROS比较复杂,包括氧自由基、非自由基的氧衍生物。研究表明,氧化应激可以损伤胰岛β细胞,胰岛β细胞是氧化应激的重要靶点[7],该细胞内抗氧化酶如过氧化氢酶、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等水平较低,因此,抗氧化能力差,对ROS较为敏感。ROS不仅可以直接损伤细胞中的DNA和蛋白质而促进胰岛β细胞凋亡,还可作为信号分子参与调节胰岛素分泌,从而间接抑制β细胞功能[8]。β细胞受损使胰岛素分泌水平降低,分泌高峰延迟,影响对糖的处理能力,从而导致血糖波动加剧,因而出现难以控制的餐后高血糖(图1)。高血糖与氧化应激之间形成恶性循环,导致组织细胞发生氧化损伤[9]。
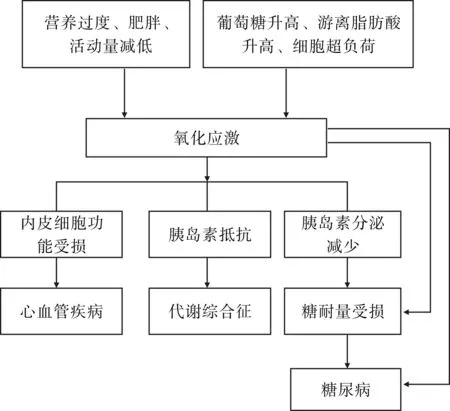
图1 氧化应激对糖尿病的影响
NAMAZI等[10]研究表明,DN的发生机制主要是由于强氧化应激状态下大量ROS的参与。正常情况下,线粒体是产生和消除ROS的主要细胞器,机体90%以上的ROS由线粒体氧化呼吸链的“电子漏”产生,并能在线粒体中通过呼吸链底物端与呼吸链氧端的电子漏动态平衡来消除ROS;另外,体内炎性因子和细胞溶质酶的释放也是引起ROS增多的重要因素[11]。糖尿病状态下肾脏长期受慢性炎症刺激,导致机体炎性因子水平增高,促进ROS生成,随着氧自由基的过量产生,体内ROS与抗氧化酶的平衡被打破,从而引起线粒体损伤,包括线粒体呼吸链损伤及膜渗透性破坏,导致一系列的氧化应激反应。
细胞和动物实验也证明了氧化应激是引起DN患者肾损伤的重要因素。SON等[12]在利用高浓度葡萄糖处理的肾细胞DN模型研究中发现,当肾细胞暴露于高血糖环境时会发生明显的脂质过氧化及ROS增多,加入抗氧化剂干预后细胞的氧化应激状态明显减轻。高血糖情况下有利于活性氧的产生,过量的ROS在DN发病机制中发挥着重要的作用。ROS的产生与糖尿病并发症的关系十分复杂,但目前一致认为其与糖尿病血管并发症的病理机制有关,如晚期糖基化终末产物(advanced glycation end products,AGEs)增多、蛋白激酶C及转化生长因子-β(transforming growth factor-β,TGF-β)激活均与ROS有密切的关系[13]。此外,动物模型研究也表明,在糖尿病及DN的发展中存在高水平的氧化应激[14]。因此,寻找合适的抗氧化剂对治疗DN具有十分重要的意义。
2 线粒体损伤与DN
线粒体是真核细胞的重要细胞器,是机体能量代谢的中心。机体约80%~90%的三磷腺苷是通过线粒体内膜上电子传递链的氧化偶联而产生,为生命活动提供最根本的能源支持。LOSCHEN[15]于1971年首次证明线粒体呼吸链可产生氧自由基,同时,线粒体是产生ROS的重要器官。糖尿病高血糖状态可导致线粒体内膜电位差增大,形成内膜超极化,电子通过辅酶Q的传递使氧分子还原,产生大量的ROS。此外,线粒体内膜中富含高不饱和脂肪酸,易受ROS的攻击,所以线粒体既是体内ROS产生的主要部位,又对ROS氧化损伤异常敏感[16]。机体高血糖状态造成氧化应激与线粒体损伤的恶性循环。LA在线粒体中合成,可保护机体免受氧化应激的刺激。糖尿病时,高血糖刺激体内线粒体合成过多的ROS,机体氧化应激加重,抗氧化剂LA生成障碍,使得LA保护机体的作用减弱,导致肾脏损伤。有证据表明,细胞和线粒体ROS增多均与DN的发病机制有关,最终可导致肾小球肥大、足细胞凋亡、系膜基质扩张、炎症细胞浸润和线粒体功能障碍[17]。尤其当线粒体DNA生成减少,线粒体膜电位去极化和三磷腺苷产生减少等线粒体存活和自噬之间发生不平衡时易发生线粒体功能障碍[18]。
SHIMADA等[19]指出,线粒体受损可导致线粒体DNA发生氧化损伤,氧化的DNA释放出线粒体后与细胞质中的核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding and oligomerization domain-like receptor family pyrin domain-containing 3,NLRP3)炎性体结合,激活NLRP3炎性体。NLRP3炎性体激活机制包括2种途径:(1)通过激活经典的核转录因子κB(nuclear factor-κB,NF-κB)炎症信号通路,随后介导NLRP3及其下游的炎性因子白细胞介素(interleukin,IL)-1β、IL-18等表达增强;(2)由于活性氧损伤线粒体,导致线粒体发生DNA氧化损伤,激活NLRP3炎性小体[20]。有实验表明,糖尿病患者的肾脏足细胞受到高浓度葡萄糖或AGEs刺激时,线粒体ROS产生增多,继而激活NLRP3炎性体,而NLRP3炎性体与DN发生明显相关。NLRP3炎性体激活肾小管上皮细胞的上皮-间质转化,这是DN中与肾小管萎缩和间质纤维化相关的过程[21]。动物实验也证明,当抑制糖尿病小鼠线粒体中ROS后,肾小球炎性体的活化减弱[22]。目前,关于ROS介导的线粒体功能障碍与糖尿病肾损伤的炎症和纤维化过程尚需要进一步研究。
3 炎症反应与DN
氧化应激和炎症紧密相连,二者相互促进,是导致DN病情进展的重要原因。炎症是细胞遭受外界刺激时的一种保护性反应,通过一系列炎症反应过程,最终去除致病因子。但炎症反应过于强烈或持久,将会对机体造成损伤。DN作为一种慢性炎症已经被大家所熟知,长期的慢性炎症刺激必然会引起肾损伤。
DN的发生与全身和局部炎症相关。有研究表明,DN患者肾脏中ROS水平升高介导巨噬细胞的浸润和炎症细胞的募集,促使炎性因子IL-1β、IL-6、TNF-α、单核细胞趋化因子-1(monocyte chemotactic protein-1,MCP-1)-1及TGF-β和NF-κB的产生,这些炎性因子在启动糖尿病肾损伤中起关键作用[23]。有研究显示,糖尿病大鼠模型的肾小球细胞和肾小管间质中MCP-1上调,同时在糖尿病患者的尿液以及肾组织活检中发现MCP-1水平升高[24]。此外,DN的进展也与血浆中IL-6和TNF-α的水平相关。据报道,IL-6和TNF-α均能促进系膜细胞增殖,细胞外基质扩增,并通过ROS产生的正反馈回路增加内皮细胞通透性[25]。NF-κB是糖尿病炎症反应起始的主要转录因子,DN患者肾脏中NF-κB表达增加,并出现肾小球系膜细胞增殖,系膜基质扩张和肾小球硬化。此外,NF-κB是一种重要的上游转录因子,可调节刺激黏附分子和促炎因子(包括MCP-1、TNF-α和IL-6)的表达[26],此过程相互促进,加快DN的发生、发展。巨噬细胞抗原复合体-1(macrophage antigen complex-1,Mac-1)是最近鉴定的表面受体,与高血糖介导的细胞炎症相呼应。YOON等[27]报道,终末期肾病患者粒细胞和单核细胞中Mac-1(CD11b/CD18)表达增加与血浆中MDA的升高及超氧化物和过氧化氢的产生有关,这表明氧化应激和炎症之间存在密切联系。
4 LA抗氧化抗炎作用对DN的保护机制
LA是在线粒体内由硫辛酸合成酶(lipoic acid synthase,LIAS)产生并参与多种代谢功能的天然抗氧化剂,LA通过清除体内多种自由基和还原其他抗氧化剂,在机体抗氧化系统扮演重要角色[28]。LA可抑制高血糖导致的氧化应激和线粒体功能失调造成的施万细胞凋亡,并潜在地保护线粒体[29-30]。LA的独特之处在于它具有良好的亲水性和亲脂性,在生物体内能很好地发挥作用。LA与其他抗氧化剂不同,其氧化及还原形式均能改善DN的症状,在医学界有万能抗氧化剂之称[31]。
此外,LA作为体内必不可少的一些酶复合物的成分,在蛋白质、碳水化合物和脂肪酸的代谢中起主要作用。LA还通过增强其细胞运输功能来调节血糖水平。除上述功能外,LA作为强抗氧化剂,还可清除细胞呼吸过程中产生的自由基[32],硫醇为存在于LA中的基团,可与自由基反应,从而提高其抗氧化能力。GONZALEZPEREZ等[33]报道,LA可增加SOD和GSH的抗氧化能力,并能再生维生素E。因此,LA是一种抵抗ROS和自由基的天然抗氧化剂,在改善体内糖脂代谢以及减弱机体氧化应激方面起着至关重要的作用[34]。体外和体内研究表明,LA可以提高体内多种天然硫醇抗氧化剂水平[35]。据报道,以0.12 g·kg-1的剂量补充LA可逆转大鼠肝细胞和心肌细胞的氧化应激[36],以1、10、100、1 000 μmol·L-1LA处理人类淋巴细胞[37]以及应用LA对糖尿病大鼠进行腹腔内注射(10 mg·kg-1)[38],均有显著的抗氧化特性。此外,在其他涉及氧化应激的慢性疾病中,已经证实了给予LA可以减少ROS并能抑制氧化应激[39]。
LA不仅能减弱氧化应激,而且在抗炎方面也发挥着重要作用。LA应用于阿尔茨海默病[40]、心血管疾病[41]和2型糖尿病[42]等慢性疾病,均展现出较好的抗炎作用。有研究显示,用H2O2处理大鼠胚胎成纤维细胞(rat embryonic fibroblasts,REF)时,细胞中TNF-α、IL-1β、IL-6等炎性因子的水平显著增高,用H2O2和LA同时处理REF细胞后,细胞中炎性因子水平显著降低[43]。转录因子NF-κB是机体发生有害刺激时重要的信号分子,当机体发生慢性炎性反应时NF-κB表达上调[44]。同样的研究显示,当REF细胞暴露于H2O2环境中时,细胞内NF-κB水平显著升高;加用LA处理后REF细胞显示出较低的NF-κB浓度[43]。这些结果表明,当机体发生氧化应激时,也伴随着炎症反应,抗氧化剂LA不仅可以减弱氧化应激,还能减轻炎症反应,并能有效地中和过量的ROS。
LA在体内发挥作用与LIAS的表达密切相关[45]。有实验表明,LIAS缺乏的糖尿病大鼠易出现微量白蛋白尿、肾小球基底膜增厚、系膜基质增多和血压升高等,其与人DN有相似的症状[46]。WANG等[47]研究表明,LA可使糖尿病大鼠的血清和肾皮质中MDA水平降低而SOD活性升高,线粒体肿胀明显减少,而线粒体膜电位显著增加。临床治疗也显示,给予糖尿病患者LA治疗后,可显著降低体内与氧化应激相关的指标,减轻DN,改善肾损伤[48]。临床试验显示,LA是一种对糖尿病周围神经炎有显著疗效的抗氧化剂[49]。
5 展望
DN是由于长期慢性高血糖刺激使得体内氧化应激反应增强,从而引起肾脏中ROS水平升高、线粒体功能障碍和抗氧化防御减弱,同时由ROS增多与线粒体损伤及炎症之间互相影响、互相促进而导致的结果。应用抗氧化剂的同时抑制炎症小体和减轻炎症反应能够对肾脏和血管起到保护作用。因此,除一般抗氧化治疗措施外,还需进一步研究确定最佳的联合治疗方法,以预防和治疗DN。
