刺糖多糖对小鼠腹腔巨噬细胞核转录因子、丝裂原活化蛋白激酶及氨基末端激酶信号通路相关基因和蛋白表达的影响
2019-09-07杨晨晨韩曾娇常军民
向 阳,杨晨晨,韩曾娇,常军民
(1.新疆医科大学第一附属医院医学检验中心,新疆 乌鲁木齐 830054;2.新疆医科大学基础医学院,新疆 乌鲁木齐 830054;3.新疆医科大学药学院,新疆 乌鲁木齐 830011)
刺糖为骆驼刺的分泌物[1]。多糖是一种毒性极小的药物,其作为广谱免疫促进剂,具有抗感染、抗凝血、降血糖、降血脂、促进生物合成等特点[2-5],被认为是天然化合物保健品。刺糖中的多糖即刺糖多糖在降血糖、抗氧化、免疫活性、抗肿瘤方面具有重要的研究价值[6-10]。信号通路是多糖参与免疫调节机制的一个重要途径,本研究主要探讨不同浓度刺糖多糖对小鼠腹腔巨噬细胞RAW264.7中丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的细胞外调节蛋白激酶1(extracellular regulated protein kinases,ERK1)、ERK2及c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路中的JNK1、JNK2、JNK3和核转录因子-κB(nuclear transcription factor,NF-κB)信号通路中的NF-κB、p65、p38 mRNA与蛋白表达的影响,为研究刺糖多糖发挥免疫调节机制的信号通路提供一定的理论依据。
1 材料与方法
1.1 细胞、试剂与仪器小鼠腹腔巨噬细胞RAW264.7购自中国科学院上海生命科学研究院细胞资源中心;刺糖药材购自新疆维吾尔民族医院(批号:20140801),由新疆医科大学天然药物化学教研室帕丽达教授鉴定为刺糖(Alhagi-honey);Fast Quant RT Kit(With gDNase)、二喹啉甲酸(bicinchoninic acid disodium,BCA)蛋白定量试剂盒(PA115-02)购自天根生化科技(北京)有限公司,SYBR Select Master Mix(4472920)购自美国ABI公司,放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)裂解液(AR0105)、蛋白酶抑制剂(AR1178)购自武汉博士德生物工程有限公司,Anti-NF-κB p65、Anti-JNK1+JNK2+JNK3、Anti-p-(ERK1/2)、Anti-(ERK1/2)、Anti-p38MAPK购自英国Abcam公司,磷酸化p38 MAPK (phospho-p38 MAPK,p-p38 MAPK)(Thr180/Tyr182)购自德国CST公司;漩涡混合器(JK-41B)、核酸蛋白定量仪(K3507)购自美国Millipore公司,化学发光成像仪系统(MUA2-7E)购自德瑞仪器有限公司,蛋白转膜仪(Mini-PROTEAN Tetra system)购自美国Bio-Rad公司,纤维素柱色谱(DEAE sepharose CL-6B)、葡聚糖凝胶柱色谱(Sephadex G-100)购自北京冬歌生物科技有限公司。
1.2 方法
1.2.1 刺糖多糖的制备原药材刺糖经过水提醇沉、石油醚脱脂、水浴回流提取、减压浓缩得到刺糖粗多糖,体积分数50%醇沉提刺糖粗多糖,依次通过AB-8大孔吸附树脂、纤维素柱色谱、葡聚糖凝胶柱色谱,0.1 mol·L-1的NaCl溶液进行洗脱,浓缩干燥得到刺糖多糖粉末。将刺糖多糖粉末使用达尔伯克必需基本培养基细胞完全培养液稀释为0.0、12.5、50.0、100.0 mg·L-1刺糖多糖溶液备用。
1.2.2 细胞培养将细胞置于37 ℃、含体积分数5%CO2的培养箱中培养,取处于对数生长期的巨噬细胞RAW264.7,使用达尔伯克改良伊格尔完全培养液稀释至1×108L-1,接种至24孔细胞培养板,每孔加500 μL细胞混悬液,24 h后弃去培养液。将细胞分为0.0、12.5、50.0、100.0 mg·L-1刺糖多糖组,加入500 μL相应浓度的刺糖多糖溶液,置于37 ℃、含体积分数5%CO2的培养箱中继续培养 24 h 后终止,每组设4个复孔。
1.2.3 实时荧光定量聚合酶链反应(quantitative real-time fluorescence polymerase chain reaction,qRT-PCR)检测巨噬细胞RAW264.7中ERK1、ERK2、JNK1、JNK2、JNK3、NF-κB p65、p38 mRNA表达采用TRIzol法提取各组细胞中RNA,反转录为cDNA,采用qRT-PCR法检测各组细胞中ERK1、ERK2、JNK1、JNK2、JNK3、NF-κB p65、p38 mRNA表达。ERK1上游引物序列为5′-TCCTTTTGGATCTGGTCCTG-3′,下游引物序列为5′-CCCCAGCAAAGTGAGAGAAG-3′;ERK2上游引物序列为5′-GGTTGTTCCCAAATGCTGAC-3′,下游引物序列为5′GAGCCTGTTCAACTTCAATCC-3′;JNK1上游引物序列为5′-TCTGTTAGTCAGCGGAGCG-3′,下游引物序列为5′-GGCCGCTACTCAATCCTGTT-3′;JNK2上游引物序列为5′-TGGGGTAAAAGACCA-GCCTTC-3′,下游引物序列为5′-TGGGGTAAAAGA-CCAGCCTTC-3′;JNK3上游引物序列为5′-GTCTCCC-TCCATCCTCGTCTG-3′,下游引物序列为5′-CGGCTAGTCACCTGCAACAAC-3′;NF-κB p65上游引物序列为5′-GGACCCTGACCATGGACGAT-3′,下游引物序列为5′-AGCGCCCCTCGCATTTATAG-3′;p38上游引物序列为5′-CACGACCCTGATGAT-GAGCC-3′,下游引物序列为5′-GGTGGCACAAAGC-TGATGAC-3′。20 μL反应体系:SYBR Select Master Mix 10 μL,上游引物0.4 μL,下游引物0.4 μL,cDNA 1 μL,ddH2O 8.2 μL。循环条件:95 ℃预变性2 min;95 ℃变性15 s,退火温度60 ℃,退火与延伸1 min。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内源参照,分析各目的基因的相对表达量。
1.2.4 Western blot法检测巨噬细胞RAW264.7中p-p38、p38、p-NF-κB p65、NF-κB p65、p-ERK1/ERK2、ERK1/ERK2、p-JNK1/2/3、JNK1/2/3蛋白表达收集各组细胞,加入800 μL含蛋白酶抑制剂的RIPA裂解液,充分混匀。4 ℃放置60 min后冰上匀浆,以 12 000 r·min-1,4 ℃离心15 min,收集上清液;采用BCA法测定蛋白浓度并标准化。将样品加入上样缓冲液,煮沸 5 min,蛋白变性后上样,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,然后转至聚偏二氟乙烯膜。于50 g·L-1奶粉中室温封闭2 h;将膜转入含50 g·L-1牛奶的一抗溶液中,一抗浓度分别为p-p38(11 000)、p38(1500)、p-NF-κB p65(1300)、NF-κB p65(1500)、p-ERK1/ERK2(1500)、ERK1/ERK2(1500)、p-JNK1/2/3(1500)、JNK1/2/3(1500),4 ℃孵育过夜;去一抗,洗膜并加入二抗于室温孵育1 h。转膜后用ChemiScope mini化学发光仪检测、拍照。通过Western blot实验结果得到经过刺糖多糖干预后各基因表达量的条带图,蛋白相对表达量=各基因表达条带吸光度值/内参条带吸光度值。
2 结果
2.1 4组小鼠腹腔巨噬细胞RAW264.7中ERK1、ERK2、JNK1、JNK2、JNK3、NF-κB p65、p38 mRNA相对表达量比较结果见表1。刺糖多糖干预巨噬细胞24 h后,与0.0 mg·L-1刺糖多糖组比较,50.0、100.0 mg·L-1刺糖多糖组细胞中ERK1、NF-κB p65 mRNA表达量显著升高,差异有统计学意义(P<0.05);12.5、50.0、100.0 mg·L-1刺糖多糖组细胞中p38 mRNA表达量显著升高,差异有统计学意义(P<0.05)。与12.5 mg·L-1刺糖多糖组比较,50.0、100.0 mg·L-1刺糖多糖组细胞中ERK1、p38、NF-κB p65 mRNA表达量显著升高,差异有统计学意义(P<0.05)。100.0 mg·L-1与50 mg·L-1刺糖多糖组细胞中ERK1、p38、NF-κB p65 mRNA表达量比较差异无统计学意义(P>0.05)。0.0、12.5、50.0、100.0 mg·L-1刺糖多糖组细胞中ERK2、JNK1、JNK2、JNK3 mRNA表达量组间比较差异均无统计学意义(P>0.05)。
表1 不同浓度刺糖多糖干预后小鼠腹腔巨噬细胞RAW264.7中ERK1、ERK2、JNK1、JNK2、JNK3、NF-κB p65、p38 mRNA相对表达量比较

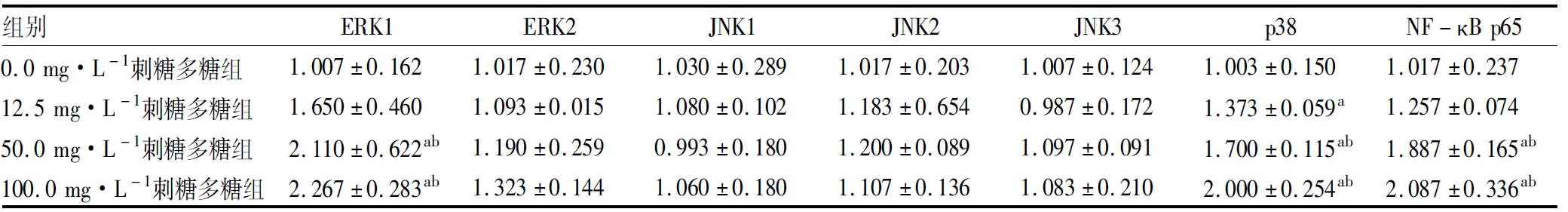
组别ERK1ERK2JNK1JNK2JNK3p38NF-κB p650.0 mg·L-1刺糖多糖组1.007±0.162 1.017±0.230 1.030±0.289 1.017±0.203 1.007±0.124 1.003±0.150 1.017±0.237 12.5 mg·L-1刺糖多糖组1.650±0.4601.093±0.0151.080±0.1021.183±0.6540.987±0.1721.373±0.059a1.257±0.07450.0 mg·L-1刺糖多糖组2.110±0.622ab1.190±0.2590.993±0.1801.200±0.0891.097±0.0911.700±0.115ab1.887±0.165ab100.0 mg·L-1刺糖多糖组2.267±0.283ab1.323±0.1441.060±0.1801.107±0.1361.083±0.2102.000±0.254ab2.087±0.336ab
注:与0.0 mg·L-1刺糖多糖组比较aP<0.05;与12.5mg·L-1刺糖多糖组比较bP<0.05。
2.2 4组小鼠腹腔巨噬细胞RAN264.7中p-p38、p38、p-NF-κB p65、NF-κB p65、p-ERK1/ERK2、ERK1/ERK2、p-JNK1/2/3、JNK1/2/3蛋白相对表达量比较结果见表2和图1。与0.0、12.5 mg·L-1刺糖多糖组比较,50.0、100.0 mg·L-1刺糖多糖组细胞中p-p38、p-NF-κB p65、p-ERK1/ERK2、ERK1/ERK2蛋白表达量显著升高,差异有统计学意义(P<0.05)。100.0 mg·L-1刺糖多糖组与50.0 mg·L-1刺糖多糖组细胞中p-p38、p-NF-κB p65、p-ERK1/ERK2、ERK1/ERK2表达量比较差异无统计学意义(P>0.05)。0.0、12.5、50.0、100.0 mg·L-1刺糖多糖组细胞中p38、NF-κB p65、p-JNK1/2/3、JNK1/2/3蛋白表达量组间比较差异均无统计学意义(P>0.05)。
表2 不同浓度刺糖多糖干预后小鼠腹腔巨噬细胞RAW264.7中p-p38、p38、p-NF-κB p65、NF-κB p65、p-ERK1/ERK2、ERK1/ERK2、p-JNK1/2/3、JNK1/2/3蛋白相对表达量比较


组别p-p38p38p-NF-κB p65NF-κB p65p-ERK1/ERK2ERK1/ERK2p-JNK1/2/3JNK1/2/30.0 mg·L-1刺糖多糖组0.319±0.0450.697±0.0060.439±0.0880.887±0.0050.410±0.0621.060±0.0020.478±0.0101.037±0.05912.5 mg·L-1刺糖多糖组0.499±0.0400.689±0.0530.477±0.0500.854±0.0520.464±0.0331.009±0.0550.490±0.0090.963±0.00350.0 mg·L-1刺糖多糖组0.680±0.127ab0.772±0.1150.753±0.141ab0.897±0.0420.680±0.065ab1.022±0.010ab0.461±0.0390.946±0.021100.0 mg·L-1刺糖多糖组0.673±0.071ab0.720±0.0470.849±0.026ab0.871±0.0520.714±0.019ab1.076±0.035ab0.476±0.0220.982±0.066
注:与0.0 mg·L-1刺糖多糖组比较aP<0.05;与12.5 mg·L-1刺糖多糖组比较bP<0.05。

A1、A2:0.0 mg·L-1刺糖多糖组;B1、B2:12.5 mg·L-1刺糖多糖组;C1、C2:50.0 mg·L-1刺糖多糖组;D1、D2:100.0 mg·L-1刺糖多糖组。
图1 不同浓度刺糖多糖组小鼠腹腔巨噬细胞RAW264.7中p-p38、p38、p-NF-κB p65、NF-κB p65、p-ERK1/ERK2、ERK1/ERK2、p-JNK1/2/3、JNK1/2/3蛋白的表达
Fig.1 Expression of p-p38,p38,p-NF-κB p65,NF-κB p65,p-ERK1/ERK2,ERK1/ERK2,p-JNK1/2/3,JNK1/2/3 proteins in peritoneal macrophages of mice in the groups of different concentrations of polysaccharides
3 讨论
真核细胞内普遍存在的2种介导炎症反应的信号级联途径是MAPK信号转导通路和NF-κB信号通路[11-12]。哺乳动物体内存在3条与炎症密切相关的经典MAPK信号转导通路,即p38通路、ERK通路和JNK通路。相关研究发现,激活p38/MAPK通路中特定细胞将导致细胞增殖被抑制,p38α还可以诱导细胞周期进入静止期,并促进DNA修复,从而抵抗化学治疗诱导的DNA损伤,p38β在各种细胞系中有抗凋亡效果,且可能直接影响肿瘤浸润和迁移[13-14]。MAPK家族主要成员ERK1/2、JNK1/2和p38MAPK均可参与对炎症的调控[15]。NF-κB是调控免疫应答的一组多效型转录因子,其主要发挥调控细胞增殖与凋亡、免疫炎症反应的作用,在巨噬细胞激活中具有重要作用。
本研究探讨刺糖多糖对巨噬细胞RAW264.7的影响及可能的调控机制,应用Western blot及qRT-PCR检测p38/MAPK和NF-κB等信号通路活化情况。通过Western blot实验结果得到经过刺糖多糖干预后各基因表达量的条带图,从p-p38和p38表达量条带图中可以看出,各浓度刺糖多糖干预巨噬细胞RAW264.7后,可诱导p38磷酸化水平明显上升。在0.0~100.0 mg·L-1的浓度范围内,条带逐渐加深,随着刺糖多糖浓度的升高,p-p38蛋白表达量明显升高,呈剂量相关性。本研究结果显示,50.0、100.0 mg·L-1刺糖多糖组细胞中ERK1、NF-κB p65 mRNA表达量高于0.0 mg·L-1刺糖多糖组;12.5、50.0、100.0 mg·L-1刺糖多糖组细胞中p38 mRNA表达量高于0.0 mg·L-1刺糖多糖组;50.0、100.0 mg·L-1刺糖多糖组细胞中ERK1、p38、NF-κB p65 mRNA表达量高于12.5 mg·L-1刺糖多糖组;50.0、100.0 mg·L-1刺糖多糖组细胞中p-p38、p-NF-κB p65、p-ERK1/ERK2、ERK1/ERK2蛋白表达量高于0.0、12.5 mg·L-1刺糖多糖组,说明刺糖多糖干预巨噬细胞RAW264.7 24 h后激活了MAPK信号通路和NF-κB信号通路,诱导p38、NF-κB p65、ERK1 mRNA表达水平呈浓度梯度升高,上调p38、NF-κB p65、ERK1/2蛋白的磷酸化水平,而JNK mRNA和蛋白水平无显著变化,提示刺糖多糖可能参与了MAPK和NF-κB信号通路,但不参与JNK信号通路。
综上所述,刺糖多糖具有免疫调节作用,调控着基因和增殖相关蛋白的表达,且能上调巨噬细胞RAW264.7中NF-κB和MAPK信号通路中相关因子表达水平。进一步深入研究刺糖多糖参与激活巨噬细胞的其他信号通路,对于多糖类免疫调节剂的开发具有指导意义。
