脑立清片的质量标准
2019-09-06陈晓颙辜明
陈晓颙,辜明
(1.湖北省药品监督检验研究院,武汉 430075;2.华中科技大学同济医学院附属协和医院药剂科,武汉 430022)
脑立清片由薄荷脑、冰片、磁石、赭石、珍珠母、牛膝等十余味中药材组成,具有平肝潜阳、醒脑安神之功效,用于头晕目眩、耳鸣口苦、心烦难寐及高血压,现行标准收载于《卫生部药品标准中药成方制剂》(第十九册)[1]。脑立清片为国家医保目录品种,现行质量标准中仅收载了处方、制法、性状、显微鉴别及薄层鉴别等项目,难以有效控制药品质量及用药安全性。近年来,随着中药制剂研究的不断深入以及药物分析技术的快速发展,对中成药的质量标准制订也提出更高的要求。
脑立清片全国共有3家生产企业,3个批准文号,笔者对其中2家生产企业的6批脑立清样品进行研究,增加了牛膝的显微鉴别、磁石、赭石的理化鉴别,增加了牛膝、猪胆汁的薄层鉴别,采用气相色谱法对薄荷脑、冰片的含量进行了测定,并采用原子吸收分光光度法测定了制剂中铁的含量,修订后的质量标准可对脑立清片进行准确的定性和定量测定,能够有效评价与控制其质量。
1 仪器与试药
1.1仪器 奥林巴斯BX53显微照相系统;Agilent 7890A气相色谱仪及FID检测器;TAS-986原子吸收分光光度计(北京普析通用仪器有限责任公司);XP205电子天平[梅特勒-托尼多仪器(上海)有限公司,感量:0.01 mg];Agilent HP-INNOWax(30.0 mm×250 mm,0.25 mm)弹性石英毛细管柱。
1.2试药 齐墩果酸对照品(批号:110709-200304)、猪去氧胆酸对照品(批号:0087-9708)、薄荷脑对照品(批号:0728-200006)、龙脑对照品(批号:110881-200706,含量:99.2%)均来自中国食品药品检定研究院;铁元素标准溶液(1000 mg·mL-1,中国计量科学院国家标准物质研究中心);其余所有试剂均为分析纯或优级纯;6批脑立清片样品分别来源于A(批号:091104,101104,100803)及B(批号:10515,100506,100803)两家生产企业。
2 方法与结果
2.1显微特征鉴别 取脑立清样品研细,置显微镜下观察(图1),草酸钙砂晶充塞于薄壁细胞中(牛膝)。不规则碎块,表面多不整齐,呈明显的颗粒性(珍珠母)。草酸钙针晶束存在于椭圆形黏液细胞中或随处散在(清半夏)。
2.2理化鉴别 取脑立清样品适量,研细,取约1 g,用水淘洗,可得少量棕褐色沉淀。取沉淀,加盐酸2 mL,振摇,滤过,取滤液,加硫氰酸铵试液2滴,即显血红色。取缺赭石、磁石的阴性样品,同法处理,结果不显血红色。
2.3薄层色谱鉴别
2.3.1牛膝的鉴别
①溶液制备。取脑立清样品适量,研细,取约5 g,加乙醇30 mL,加热回流40 min,放冷,滤过,取滤液15 mL,加盐酸1 mL,加热回流1 h,放泠,加水20 mL,用石油醚(60~90 ℃)15 mL振摇提取4次,提取液蒸干,残渣加乙醇1 mL使溶解,作为供试品溶液。按处方中比例制备缺牛膝的阴性样品,按供试品溶液制备方法制成阴性对照溶液。取齐墩果酸对照品,加乙醇制成每毫升含1 mg的溶液,作为对照品溶液。
②色谱条件。照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502[5])实验,吸取供试品溶液和阴性对照溶液各10 μL,对照品溶液3 μL,分别点于同一硅胶G薄层预制板上,以三氯甲烷-甲醇(40:1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,于105 ℃加热至斑点显色清晰[2-4]。
③鉴别结果。供试品溶液、阴性对照溶液及对照品溶液在上述色谱条件下进行薄层色谱鉴别,结果见图2。可见,在与对照品色谱相应位置上,供试品色谱中显相同颜色的斑点,阴性对照无干扰。
2.3.2猪胆汁的鉴别
①溶液制备。取脑立清样品适量,研细,取约5 g,加甲醇40 mL,加热回流2 h,滤过,滤液蒸干,残渣加10%氢氧化钠溶液10 mL,在120 ℃加热4 h,放冷,加水30 mL充分溶解,滤过,滤液加盐酸调节pH值至2~3,摇匀,用乙酸乙酯振摇提取4次,每次15 mL,合并提取液,蒸干,残渣加乙醇2 mL使溶解,作为供试品溶液。按处方中比例制备缺猪胆汁的阴性样品,按供试品溶液制备方法制成阴性对照溶液。另取猪去氧胆酸对照品,加乙醇制成每毫升含1 mg的溶液,作为对照品溶液。
②色谱条件。按照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502[5])实验,吸取上述两种溶液各5 μL,分别点于同一硅胶G薄层板上,以异辛烷-乙醚-正丁醇-冰醋酸-水(10:5:3:5:1)的上层溶液为展开剂(临用新配),展开,取出,晾干,喷以10%磷钼酸乙醇溶液,于105 ℃加热至斑点显色清晰[6]。
③鉴别结果。供试品溶液、阴性对照溶液及对照品溶液在上述色谱条件下进行薄层色谱鉴别,结果见图3。可见,在与对照品色谱相应位置上,供试品色谱中显相同颜色的斑点,阴性对照无干扰。

图1 脑立清片显微图(15×20)Fig.1 Microscopic characteristics of Naoliqing tablets(15×20)
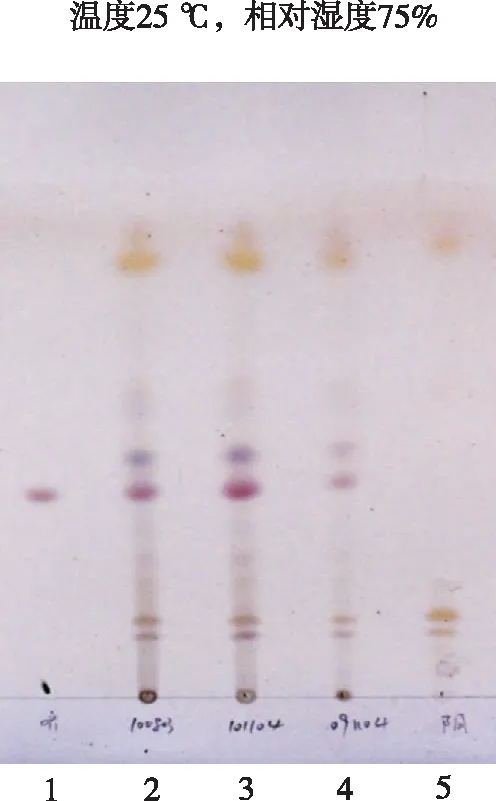
1.齐墩果酸对照品;2~4.供试品溶液;5.缺牛膝的阴性对照样品。图2 牛膝的薄层色谱图1.oleanolic acid reference;2-4.test samples;5.negative reference without Achyranthis Bidentatae Radix.Fig.2 TLC of Achyranthis Bidentatae Radix
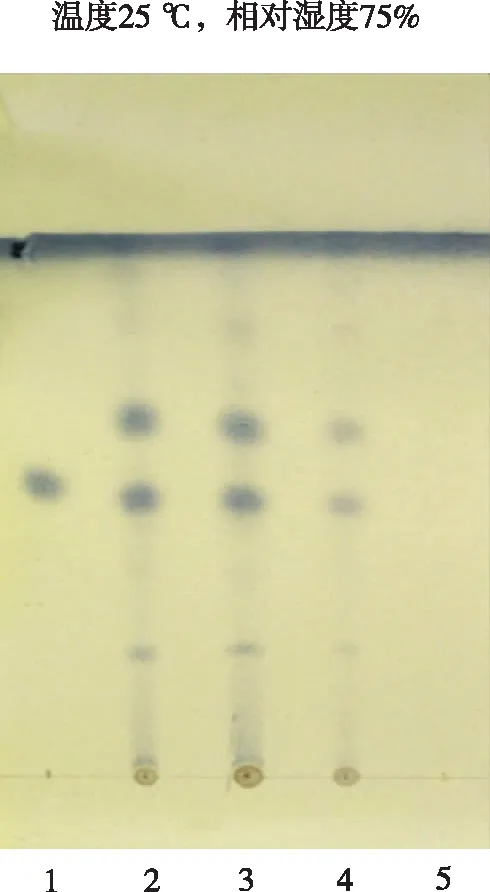
1.猪去氧胆酸对照品;2~4.供试品溶液;5.缺猪胆汁的阴性对照样品。图3 猪胆汁的薄层色谱图 1.hyodeoxycholic acid reference;2-4.test samples;5.negative reference without Fel Suillus.Fig.3 TLC of Fel Suillus
2.4含量测定
2.4.1薄荷脑和龙脑的含量测定
①色谱条件。Agilent HP-INNOWax(30.0 mm×250 mm,0.25 μm)弹性石英毛细管柱,氮气(N2)为载气,流速:1.0 mL·min-1,进样量:2 μL,柱温160 ℃;理论板数以龙脑和薄荷脑峰计算均不低于10 000。与内标物质的分离度>1.5[7-15]。
②溶液的制备。对照品溶液:取水杨酸甲酯适量,精密称定,加无水乙醇制成每毫升含约10 mg的溶液,作为内标溶液;另取龙脑对照品约10 mg、薄荷脑对照品约10 mg置10 mL量瓶中,加无水乙醇溶解后稀释至刻度;再精密吸取2 mL,置10 mL量瓶中,精密加入内标溶液1 mL,用无水乙醇稀释至刻度,摇匀,即得龙脑和薄荷脑对照品溶液。
供试品溶液:取本品20片,精密称定,研细,混匀,取约2 g,精密称定,置圆底烧瓶中,精密加入无水乙醇25 mL,称定质量,加热回流30 min,取出放冷,再称定质量,用无水乙醇补足减失的质量,摇匀,滤过,精密量取续滤液5 mL,置10 mL量瓶中,精密加入内标溶液1 mL,用无水乙醇稀释至刻度,摇匀,即得。
阴性对照溶液:按照脑立清片的处方比例分别制备缺冰片和薄荷脑的阴性样品,照供试品溶液的制备方法,制成阴性对照溶液。
③专属性实验。精密吸取混合对照品溶液、供试品溶液及阴性对照溶液,注入气相色谱仪分析(图4),结果表明阴性样品无干扰,样品与内标之间无干扰。
④线性关系考察。精密称取水杨酸甲酯0.531 4 g,置于50 mL量瓶中加适量无水乙醇溶解后,用无水乙醇稀释至刻度,摇匀,作为内标溶液。另精密称取龙脑对照品51.81 mg、薄荷脑对照品49.85 mg,置25 mL量瓶中,加无水乙醇溶解并稀释至刻度,摇匀;分别精密吸取此对照品溶液0.3,1.0,2.0,3.0,5.0 mL,置10 mL量瓶中,再精密吸取上述内标溶液1 mL,分别加入量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,分别吸取上述5种系列对照品溶液各2 μL,注入气相色谱仪,以浓度(X)为横坐标,以对照品与内标物质水杨酸甲酯的峰面积之比(Y)为纵坐标,进行回归,回归方程为:薄荷脑:Y=1.537X+0.000 7,r=0.999 9和龙脑:Y=1.574 5X+0.010 8,r=0.999 9。结果表明,龙脑对照品在0.061 6~1.028 0 mg·mL-1;薄荷脑对照品在0.059 8~0.997 0 mg·mL-1的浓度范围内线性关系良好。
⑤重复性实验。精密称取样品6份(批号:100515),按“2.4.1.2”项下方法制备供试品溶液,进样测定,结果样品中龙脑和薄荷脑的含量分别为每片2.06和1.06 mg,RSD分别为1.88%和2.35%。
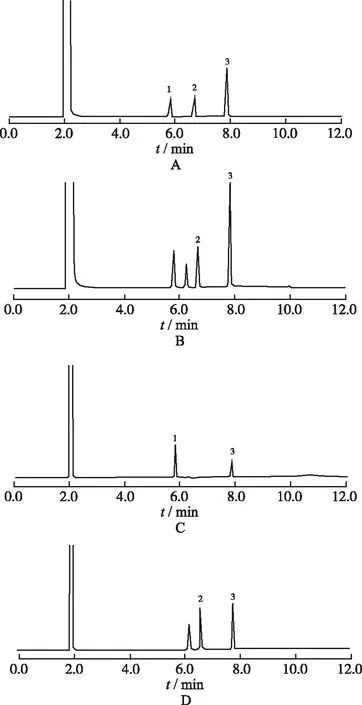
A.对照品+内标;B.供试品+内标;C.缺冰片的阴性对照+内标;D.缺薄荷脑的阴性对照+内标;1.薄荷脑;2.龙脑;3.内标(水杨酸甲酯)。图4 脑立清片气相色谱图A.reference and internal standard;B.sample and internal standard;C.negative control without borneol and internal standard;D.negative control without menthol and internal standard;1.menthol;2.borneol;3.internal standard(methyl acetylsalicylate).Fig.4 GC choromatograms of Naoliqing tablets
⑥回收率实验。精密称取6份已测定含量的样品各1 g(批号:100515;含量:龙脑4.10 mg·g-1,薄荷脑2.10 mg·g-1),精密加入混合对照溶液(龙脑:2.086 mg·mL-1、薄荷脑:1.052 mg·mL-1)2 mL,按“2.4.1.2”项下方法制备供试品溶液,测定含量,计算加样回收率,结果见表1,2。龙脑和薄荷脑的平均回收率分别为101.40%和102.70%,RSD分别为0.92%和1.26%。
⑦稳定性实验。精密吸取供试品溶液(批号:100515)2 μL,于0,2,4,6,8,12 h进样分析,记录峰面积,计算龙脑、薄荷脑与内标物的峰面积比,其RSD分别为1.59%和0.41%,说明供试品溶液在12h内稳定性良好。
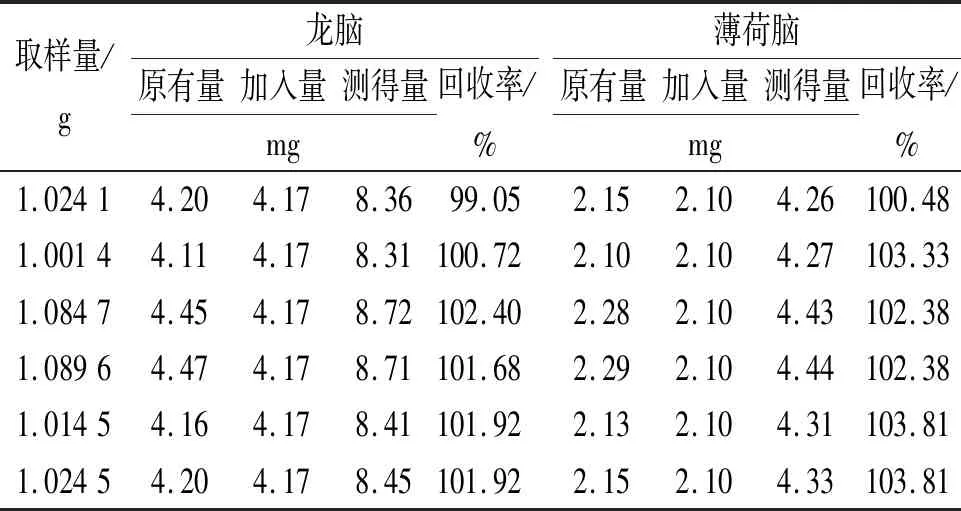
表1 脑立清片中龙脑和薄荷脑回收率测定结果Tab.1 Recovery results of borneol and menthol in Naoliqing tablets
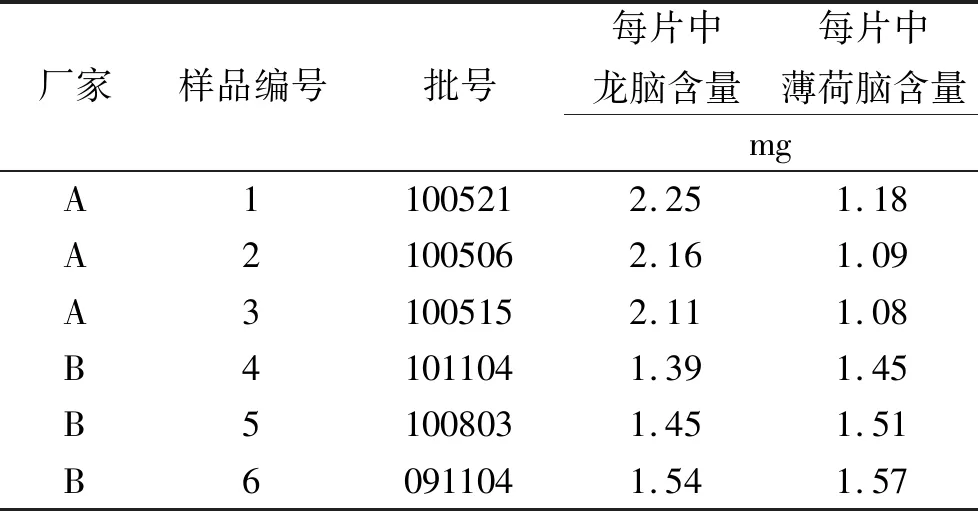
表2 样品的含量测定结果Tab.2 Content detection of borneol and menthol in samples
⑧样品的测定。取6批样品,按“2.4.1.2”项下方法制备供试品溶液,精密吸取2 μL注入气相色谱仪,记录峰面积,计算含量,结果见表2。
2.4.2磁石、赭石中铁含量的测定
①测定条件。波长:248.3 nm;狭缝:0.2 nm;灯电流:3.0 mA;光源为铁空心阴极灯。采用空气-乙炔火焰;空气流量:7.0 L·min-1;乙炔流量:1.7 L·min-1[16-20]。
②溶液的制备。对照品溶液的制备:精密量取铁元素标准液(中国计量科学院国家标准物质研究中心,含量:1000 μg·mL-1),配制成0.5,1.0,2.0,5.0及10.0 g·mL-1的标准溶液。
供试品溶液的制备:取本品20片,研细,混匀,取约0.1 g,精密称定,置凯氏烧瓶中,加硝酸-高氯酸(4:1)15 mL,混匀,瓶口加以小漏斗,浸泡过夜。置电热板上加热消解,保持微沸,若变棕黑色,再加硝酸-高氯酸(4:1)混合溶液适量,持续加热至溶液澄明后升高温度,继续加热至冒浓烟,直至白烟散尽,消解液呈无色透明或略带黄色,放冷,转入50 mL量瓶中,用2%硝酸溶液洗涤容器,洗液合并于量瓶中,并稀释至刻度,摇匀,即得。同法同时制备试剂空白溶液。
③标准曲线的制备。取“2.4.2②”项下的铁标准溶液进样,采用火焰法测定,以吸光度(A)为纵坐标,浓度(C)为横坐标,计算回归方程:A=0.009 7C-0.038 6,r=0.999 48。结果表明,铁检测浓度在0.5~10.0 μg·mL-1范围内与吸光度呈良好的线性关系。
④重复性实验。精密称取样品6份(批号:100521),按“2.4.2②”项下方法制备供试品溶液并测定,结果样品总铁含量为每片11.42 mg,RSD为3.41%,表明本方法重复性良好。
⑤回收率实验。精密称取称取6份已测定含量的样品各0.05 g(含量:23.45 mg·g-1),分别精密加入铁标准溶液(1000 mg·mL-1)1 mL,按“2.4.2②”项下方法制备样品并测定,计算加样回收率,结果表明,平均加样回收率为100.83%,RSD为1.46%(表3)。
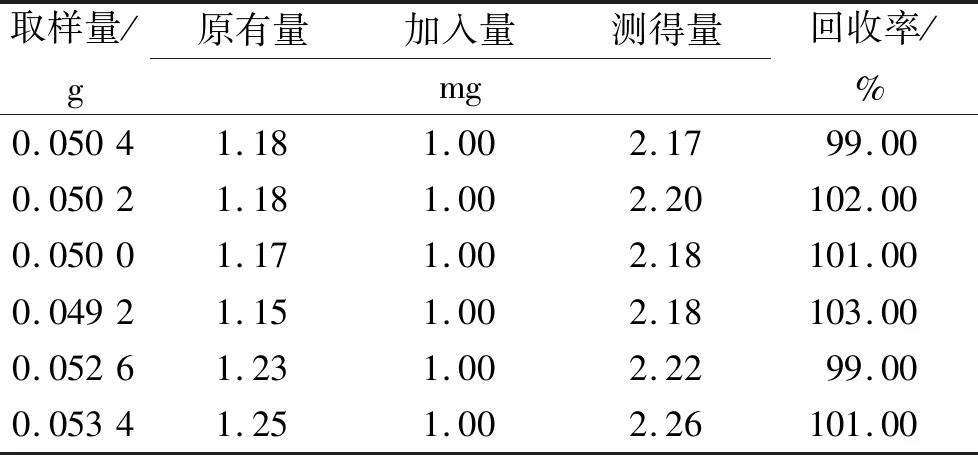
表3 铁回收率测定结果Tab.3 Recovery results of Fe
⑥样品的测定。取6批样品,按“2.4.2②”项下方法制备供试品溶液,测定,计算含量,结果见表4。
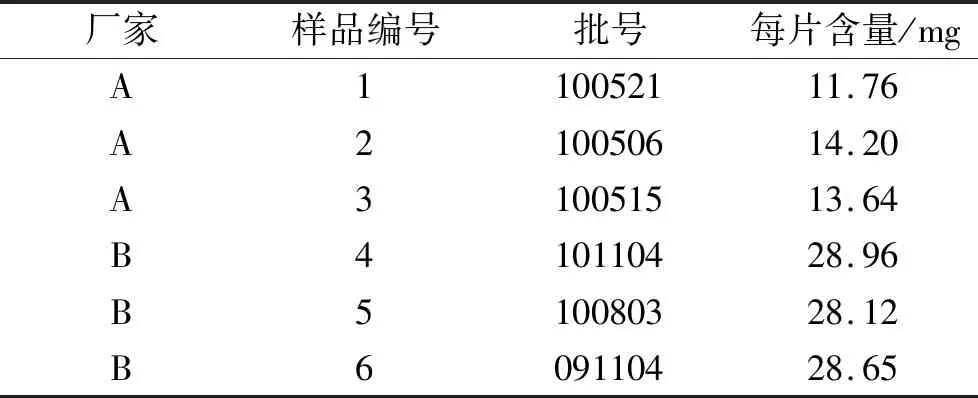
表4 样品的含量测定结果Tab.4 Content detection of samples
3 讨论
本实验对脑立清片的显微鉴别、理化鉴别及薄层色谱鉴别方法均进行了增修,增加了冰片和薄荷脑的气相色谱定量测定方法,并采用原子吸收分光光度法对本制剂中总铁含量进行了测定,从而科学、有效地评价制剂的质量。
3.1供试品的制备方法
3.1.1冰片和薄荷脑含量测定中供试品溶液的制备 实验过程中分别对提取溶剂及提取方法进行考察,采用甲醇、乙醇、乙酸乙酯3种提取溶剂,超声和回流2种提取方法测定样品中龙脑及薄荷脑的含量,结果表明,回流提取的样品中这2种成分含量较高;在此对回流时间进行了考察,最终选取回流提取30 min制备供试品溶液。
3.1.2铁含量测定中供试品溶液的制备 分别比较了湿法消解及微波消解两种方法,经方法对比分析,因样品中矿物药比较多,湿法消解过程中为非密闭式消解,方便调整酸液的用量,故最终采用湿法消解进行样品前处理。同时在消解过程中比较了硝酸、硝酸-高氯酸(9:1)及硝酸-高氯酸(4:1)等消解液,最终采用硝酸-高氯酸(4:1)混合液进行湿法消解。
3.2含量测定限度的制定
3.2.1冰片和薄荷脑含量测定限度值的制定 脑立清片中冰片及薄荷脑均为原料直接投料,理论转移率应接近90%,但按处方量计算样品中龙脑和樟脑的平均转移率仅为52.8%和21.0%,分析原因可能是因为冰片和薄荷脑均有挥发性,如贮藏保管不当易造成损失。根据上述实验结果,考虑到生产实际、冰片和薄荷脑药材的质量差异、贮存条件等的影响,并结合脑立清胶囊标准中的含量限度值,暂定本品每片含冰片(以龙脑计)为不得少于1.45 mg,含薄荷脑不得少于1.05 mg。
3.2.2冰片和薄荷脑含量测定限度值的制定 本法制剂中所用的磁石及赭石含有铁,《中华人民共和国药典》2015年版一部中规定磁石的含量以铁计算不得少于50.0%,赭石的含量以铁计算不得少于45.0%。本实验同样采用原子吸收分光光度法对原药材中的铁含量进行了测定,根据药材中铁含量的测定结果计算制剂中的平均转移率为52.21%。根据平均转移率,以合格药材投料,按处方量计算制剂中的铁含量理论值为每片16.81 mg,故最终将其限度值规定为每片16.8 mg。
3.3制剂质量评价结果 按拟定的质量标准对收集的样品进行测定,结果显示A厂家的3批样品铁含量均不合格,即磁石、赭石含量不合格,提示部分生产企业样品原料质量较差;B厂家的3批样品中1批龙脑含量不合格,1批在限度边缘,因为龙脑为原料药直接投料,提示该企业的样品在生产和贮存过程中龙脑挥发而导致含量偏低,可能需要改进生产工艺及包装材料,减少挥发性成分在生产和贮存过程的损耗。
