3,3′-二吲哚甲烷对新生大鼠炎症损伤心肌细胞的保护作用
2019-09-06杨文健焦蓉刘月孙晓东桑明
杨文健,焦蓉,刘月,孙晓东,桑明
(湖北医药学院附属襄阳市第一人民医院儿科,襄阳 441000)
脓毒症是由多种炎症因子过量产生并介导的全身性炎症反应的一类疾病[1]。严重的脓毒症与感染性休克、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)密切相关,更重要的是,心脏功能受损最为常见[1]。然而,脓毒症病理生理学尚不完全清楚,治疗方法有限。目前已知炎症反应参与脓毒症心功能障碍的发生发展[2-3]。因此,找到有效的治疗干预措施以抑制炎症信号传导,从而中断细胞因子合成的恶性循环,可以最终抑制病情恶化。
脂多糖(lipopolysaccharide,LPS)作为革兰阴性细菌细胞壁的一种成分,可在被细菌感染的宿主中引起局部或全身炎症反应。Toll样受体-4(Toll like receptor-4,TLR-4)是一种LPS受体,可以识别病原体相关的分子模式,对细胞信号传导有着至关重要的作用[4]。虽然心肌细胞不是参与先天免疫的特异性细胞,但TLR-4可在心肌细胞中表达。TLRs在脓毒症介导的心肌损伤中发挥重要作用,但是其机制尚不清楚。据报道,激活TLR-4导致MyD88(myeloid differentiation primary-response gene 88)募集,随后激活下游丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)途径[4]。MAPKs途径的激活诱导促炎基因表达上调,并促进多器官功能障碍和SIRS的进展。因此,在心血管疾病中,MAPK信号通路可能是一个新的治疗方向。
3,3′-二吲哚基甲烷(3,3′-diindolylmethane,DIM),属于吲哚-3-甲醇(indole-3-carbinol,I3C)的衍生产物,可从十字花科植物中提取,已证实具有抗血管生成、抗癌和抗肥大等作用[5-7]。此外,吲哚化合物在某些炎症性疾病中具有抗炎作用[7]。然而,关于DIM对新生大鼠心肌细胞中LPS诱导的炎性损伤的作用知之甚少。因此,在本研究中,笔者首先观察DIM是否具有抑制LPS诱导的新生大鼠心肌细胞炎症反应的作用,并进一步探讨了DIM对新生大鼠心肌细胞损伤保护作用的分子机制。
1 材料与方法
1.1药品与试剂 DMEM/F12培养基(GIBCO公司),四季青胎牛血清(浙江天杭生物科技有限公司,批号:18040502),CCK-8试剂盒(Dojindo,Kumamoto,Japan),TRIzol试剂(Invitrogen,11667-165),LPS(Sigma,L2630)。一抗包括ERK1/2(Cell Signaling Technology,4370),p-ERK1/2(Cell Signaling Technology,4695),P38(Cell Signaling Technology,9212),p-P38(Cell Signaling Technology,4511),T-JNK(Cell Signaling Technology,9258),p-JNK(Cell Signaling Technology,4668),TLR-4(Santa Cru Biotechnology,30002)和GAPDH(Santa Cru Biotechnology,25778)。二抗来自LI-COR Biosciences的山羊抗兔抗体(Lincoln,NE,USA)。DIM(通过高效液相色谱法分析测定含量为98%)购自上海医疗科技发展有限公司。
1.2设备 低温离心机(Eppendorf Centrifuge 5804 德国),电泳转膜装置(Bio-RAD,美国);数显恒温水浴锅(泰州市华普达教学仪器有限公司),Model 550 酶标仪(Bio-Rad,美国);Bio Sen SC300 凝胶图象分析系统(上海山富科学仪器有限公司);Heal Force 生物安全柜(力康生物公司);倒置荧光显微镜(Olympus 公司),共聚焦显微镜(LEICA,SP5),Smartspec Plus分光光度计(Bio-Rad),ABI 7500仪器(Life Technologies,USA)。
1.3心肌细胞的分离和分组 新生大鼠心肌细胞获自出生3 d内的SD大鼠[8]。吸入二氧化碳(CO2)法处死新生大鼠。首先,将心脏置于冷DMEM/F12的直径100 mm培养皿中,剪碎组织。心脏组织在于34 ℃、0.125%tryspin中消化15 min,轻轻摇动,重复消化5次,获得单个细胞。收集所有消化液并以1000 r·min-1(r=42 cm)离心8 min。将这些细胞重新悬浮并通过直径75 μm细胞过滤器滤过。最后将分离的细胞用含有15%FBS、1%青霉素(100 U·mL-1)和链霉素(100 mg·mL-1)的DMEM/F1培养基置于培养箱培养。细胞实验分为4组:对照组、LPS组、DIM组和LPS+DIM组。细胞饥饿处理8 h后,再给予LPS和(或)DIM。
1.4CCK-8 通过CCK-8实验检测DIM对心肌细胞活性的影响。细胞(1×105·mL-1)接种在96孔中并培养48 h,每个浓度6个副孔。细胞饥饿处理8 h后,给予不同浓度的DIM(5,10,20和60 μmol·L-1)处理24 h。每孔加入CCK-8试剂10 μL孵育4 h,并用酶标仪(Bio-Tek,Synergy HT)在450 nm(吸收波长)和630 nm(参比波长)检测吸光度。
1.5免疫荧光染色 本实验通过标记α-肌动蛋白染色心肌细胞来观察大鼠新生心肌细胞的形态。用温磷酸盐缓冲液(PBS)洗涤3次,4%多聚甲醛(Sinopharm Chemical Reagent Co.,Ltd)固定15 min,0.2%Triton X-100(Amresco)透化后,用8%山羊血清封闭。然后用1%抗-α-肌动蛋白抗体(Millipore)1:100的稀释液孵育过夜,再与山羊抗小鼠IgG二抗(Alexa Fluor 488)共孵育1 h,用含有DAPI的Slow Fade Gold抗褪色试剂固定在载玻片上。用定量数字图像分析系统(Image Pro-Plus,6.0版)测量阳性细胞的数量。
1.6实时-荧光定量聚合酶链免疫反应(RT-PCR)通过RT-PCR检测细胞内促炎递质的mRNA表达水平。向各组大鼠心肌细胞中加入适当体积的TRIzol,提取RNA。根据说明书,通过分光光度计检测RNA浓度,并使用Smartspec Plus分光光度计(Bio-Rad)使用A260/A280估算纯度。使用oligo(dT)引物和Tran-scrptor First Strand cDNA合成试剂盒(Takara,047A)在20 μL反应体积中用96孔热循环仪(Applied Biosystems)将RNA(每个样品2 μg)逆转录成cDNA。使用SYBR Green PCR Master Mix(Takara,04897030001)用ABI 7500仪器(Life Technologies,USA)定量PCR扩增,并检测白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α和HMGB1相对mRNA表达水平。以下是PCR引物:IL-6正义链:5'-GTTGCCTTCT TGGGACTGATG-3',反义链:5'-ATACTGGTCTGTTGTG GGTGGT-3';TNF-α正义链:5'-AGCATGATCCGAGTG-TGGAA-3',反义链:5'-TAGACAGAAGAGCGTGGTGGC-3';HMGB1正义链:5'-TGCT GCATATCGAGC-TAAAGG-3'和反义链:5'-CCATACTGTACC AGG-CAAGGT-3';GAPDH:正义链:5'-GACATGCC-GCCTGGAGAA AC-3',反义链:5'-AGCCCAGG-ATGCCCTTTAGT-3'。反应在95 ℃下进行30 s,然后进行40个循环,在95 ℃下10 s,在60 ℃下34 s。
1.7Western blotting法检测相关蛋白表达水平 利用蛋白质印迹评估TLR-4、P38、p-P38、ERK、p-ERK、JNK、p-JNK等相关蛋白质的表达水平。向各组新生大鼠心肌细胞加入蛋白裂解液,提取蛋白质,并用BCA蛋白质测定试剂(Thermo,23225)检测蛋白质浓度。在还原条件下,在10%SDS/PAGE上分离凝胶中的蛋白质样品(30 μg),然后使用凝胶转移装置(invitrogen)转移到聚偏二氟乙烯(PVDF)膜上。为了避免非特异性抗体结合的干扰,在室温下用5%脱脂乳将PVDF膜封闭1.5 h。PVDF膜与TLR-4、P38、p-P38、ERK、p-ERK、JNK、p-JNK及GAPDH的一抗在4 ℃孵育过夜,TBS洗脱后敷二抗。洗脱后采用电化学发光显色,再进行定量分析。
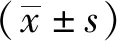
2 结果
2.1DIM对新生大鼠心肌细胞活性的影响 利用CCK8实验检测不同浓度DIM(5,10,20和60 μmol·L-1)对新生大鼠心肌细胞活性的影响。结果见图1。5,10,20 μmol·L-1DIM对新生大鼠心肌细胞没有显著的细胞毒性。然而,与对照组比较,大剂量DIM(60 μmol·L-1)作用的细胞活性显著降低。提示60 μmol·L-1DIM对新生大鼠心肌细胞具有明显的细胞毒性。为了减少DIM的非特异性细胞毒性,观察了DIM对LPS诱导的炎症损伤的影响。用LPS(10 mg·L-1)和不同浓度(5,10,20和60 μmol·L-1)的DIM共同与心肌细胞培养24 h。结果见图1。LPS+DIM组(LPS+DIM 5,10,20 μmol·L-1)细胞活性高于LPS组。60 μmol·L-1DIM 组细胞存活率明显降低。综上,DIM作用浓度以20 μmol·L-1为宜。
2.2DIM对LPS诱导的新生大鼠心肌细胞形态学改变的影响 利用免疫荧光显微镜观察心肌细胞的形态学变化,鉴别DIM对LPS诱导的新生大鼠心肌细胞形态学变化的影响。将心肌细胞与LPS(10 mg·L-1)和(或)DIM(20 μmol·L-1)共孵育24 h。对照组可观察到正常心肌细胞呈梭形或不规则扁平状,逐渐形成不规则星状,利于与其他细胞形成交织。经LPS处理后,心肌细胞体积变大,肌丝紊乱。经过DIM治疗后,LPS诱导的肌丝损伤得到改善。形态学观察结果表明DIM可以改善LPS诱导的形态学变化,见图2。

与对照组比较,*1P<0.05,*2P<0.01。图1 各组新生大鼠心肌细胞活性比较Compared with control group,*1P<0.05,*2P<0.01.Fig.1 Comparison of cell viability of cultured neonatal rat cardiomyocytes in all groups
2.3DIM显著降低炎症因子的mRNA水平 IL-6、TNF-α与LPS诱导的炎症反应密切相关[9-10]。研究证实,晚期促炎因子HMGB1亦与脓毒症临床结果密切相关,并且发现干扰HMGB1表达相对于干扰IL-6和TNF-α更有效。因此,检测早期和晚期炎症因子的mRNA表达水平,以观察LPS诱导的新生大鼠心肌细胞的炎症损伤程度。见图3,12 h后,LPS组早期促炎细胞因子的mRNA表达水平明显增加。而LPS+DIM组IL-6和TNF-α的mRNA表达水平明显低于LPS组。此外,与12 h比较,24 h细胞内IL-6、TNF-α的表达水平明显降低,而HMGB1的表达水平显著增加。LPS+DIM组可降低晚期炎症细胞因子HMGB1的基因水平。另外,与对照组比较,DIM组新生大鼠心肌细胞mRNA表达水平差异无统计学意义。
图2 各组新生大鼠心肌细胞的体外形态学变化(×200)Fig.2 In vitro morphological changes of cultured neonatal rat cardiomyocytes in all groups(×200)
2.4DIM通过TLR-4/MAPKs途径发挥作用 TLR-4参与LPS激活的炎症信号通路传导[3]。研究表明,TLR-4可以激活下游MAPK通路,MAPK是驱动脓毒症期间炎症因子产生的关键递质[11-12]。MAPK由ERK1/2、P38和JNK组成。因此,在本研究中,探究TLR-4/MAPKs途径是否参与DIM对LPS诱导的新生大鼠心肌细胞炎症损伤保护作用。利用Western blotting检测TLR-4、ERK1/2、P38和JNK相关蛋白质的表达水平。如图4所示,脓毒症组细胞TLR-4、p-ERK1/2、p-P38和p-JNK蛋白表达水平明显升高。与LPS组比较,LPS+DIM组上述蛋白表达明显减少。此外,对照组和DIM组之间的TLR-4、p-ERK1/2、p-P38和p-JNK水平没有显著差异。
3 讨论
强大的炎症反应被视为脓毒症重要的病理生理过程。LPS可与心肌细胞表面TLRs受体结合,激活体内NF-κB信号通路,促使炎症因子TNF-α、IL-6的表达,均可直接或间接抑制心肌细胞,导致细胞功能障碍;另一方面,炎症因子进一步促进NF-κB信号通路激活,形成恶性循环,引发炎症“风暴”,导致细胞氧化应激和细胞凋亡,导致多器官功能障碍甚至死亡[13-14]。LPS可导致早期促炎细胞因子的过量产生,包括IL-6和TNF-α[13]。IL-6被认为是脓毒症和脓毒性休克的重要标志物,可预测疾病的发展及其严重程度。由心肌细胞分泌的TNF-α可诱导多种补体因子、一氧化氮合酶、细胞黏附分子、血小板活化因子和多种白细胞介素的产生,与心肌细胞表面相应受体结合,启动心肌线粒体凋亡通路,在发病早期中起关键作用[1,15-16]。早期促炎症因子(TNF-α和IL-1β)在早期收缩功能下降中起关键作用,但不能解释脓毒症的长期心肌功能障碍的原因[13]。脓毒症的临床结果与晚期HMGB1递质的水平变化密切相关,而不是LPS诱导的TNF-α和IL-6等早期炎症递质。因此,HMGB1是治疗败血症的更有效靶点。本研究结果显示,DIM可以降低LPS诱导的IL-6、TNF-α和HMGB1的mRNA水平,提示DIM可显著抑制LPS诱导的促炎因子的产生。
TLR-4在心肌细胞表面表达,在LPS诱导的炎症损伤中起重要作用。TLR4可识别LPS,通过MYD88依赖性途径引起NF-κB入核,启动炎症因子转录[17],亦可激活下游MAPKs途径[18]。因此,本实验观察了TLR-4/MAPKs信号通路是否参与了DIM对新生大鼠心肌细胞炎症损伤的保护作用,结果显示DIM显著抑制TLR-4、p-ERK1/2、p-P38和p-JNK等蛋白水平。因此,TLR-4/MAPKs信号通路参与DIM对新生大鼠心肌细胞炎症损伤的保护作用,进而抑制促炎细胞因子IL-6,TNF-α和HMGB1的过量产生。

与对照组比较,*1P<0.05;与LPS组比较,*2P<0.05。图3 各组心肌IL-6、TNF-α和HMGB1的mRNA表达水平Compared with control group,*1P<0.05;compared with LPS group,*2P<0.05.Fig.3 The mRNA expression levels of IL-6,TNF-α and HMGB1 of cardiomyocytes in all groups
本研究结果为治疗脓毒症提供了新的治疗靶点,但本实验只检测了炎症指标,未检测氧化应激水平,没有体现心功能的变化及DIM对脓毒症动物模型生存率的影响,因此存在一定的局限性,需进一步进行动物实验验证细胞实验所得结论。
综上所述,DIM可以通过抑制TLR-4/MPAKs信号通路降低心肌细胞内炎症因子水平,对LPS诱导的新生大鼠炎症损伤心肌细胞具有保护作用。今后将进一步完善相关实验,探讨DIM对脓毒症的更多作用及其机制,为DIM预防脓毒症展示更广阔的前景。
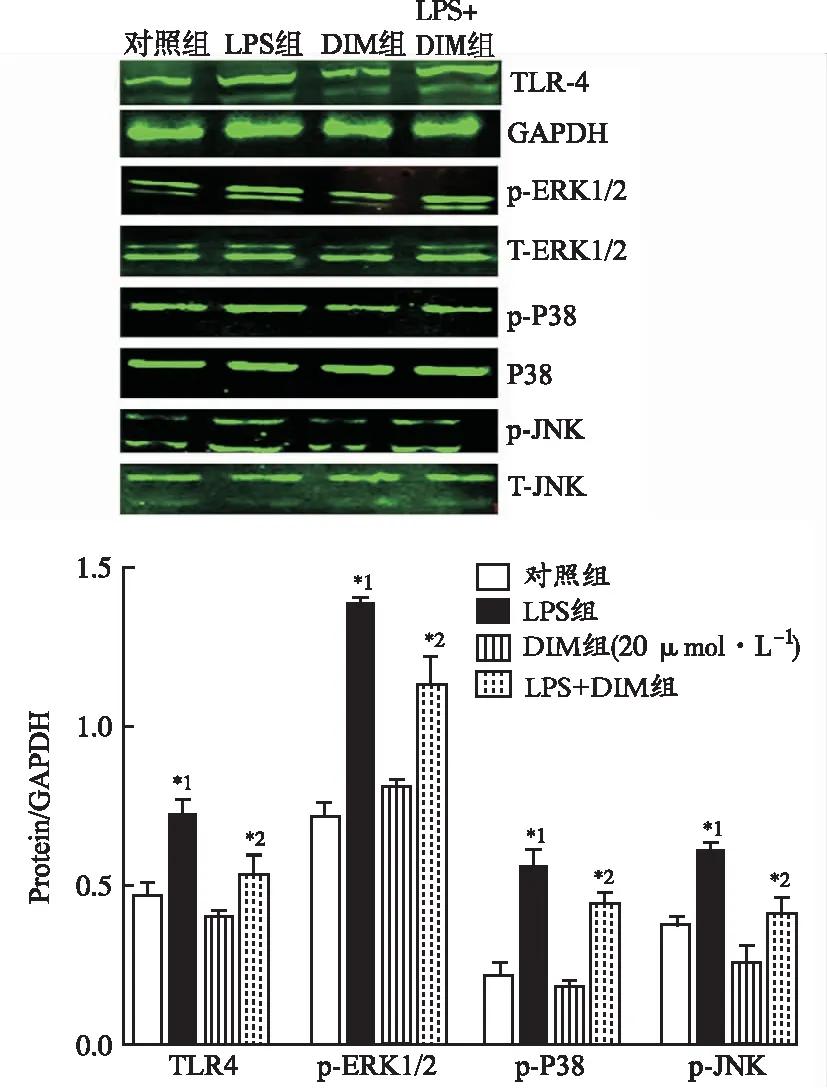
与对照组比较,*1P<0.05;与LPS组比较,*2P<0.05。图4 DIM抑制LPS激活的TLR-4 /MAPKs信号通路Compared with control group,*1P<0.05;compared with LPS group,*2P<0.05.Fig.4 Inhibition of DIM on LPS-induced TLR-4/MAPKs signaling pathways
