酿造条件对酿酒酵母发酵香气的影响
2019-09-06赵丹丹王璐璐韩舜愈杨学山
祝 霞,刘 琦,赵丹丹,王璐璐,韩舜愈,杨学山,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
葡萄酒酿造是以酿酒酵母(Saccharomyces cerevisiae)为主导的一系列复杂的微生物代谢和生物转化过程,同时还伴随有醇类、酯类、酸类等多种挥发性香气化合物生成[1-3],它们的种类、浓度、阈值以及相互作用共同决定着葡萄酒的风格与特色[2]。在发酵过程中,酿酒酵母菌株的种类及接种量[3]、浸渍过程[4]、酿造条件[5]、营养成分[6]等均可影响葡萄酒发酵香气化合物的产生。研究表明,使用不同酿酒酵母酿造的葡萄酒,其香气特点差异较大。李景明等[7]比较了3 种酿酒酵母发酵赤霞珠干红葡萄酒香气成分,结果发现D254酵母菌株产醇能力较强,CSM酵母菌株产酯能力较强,并且不同酿酒酵母菌株发酵产生的香气物质种类大致相同,但含量差异较大。Carrau等[3]分析了酿酒酵母接种量对发酵香气的影响情况,结果表明,当酿酒酵母接种量为105CFU/L时,酯类、单萜类含量增加,高级醇和中链脂肪酸含量减少。氮源作为微生物重要的营养成分,其含量高低直接影响细胞的代谢过程,进而影响酿酒酵母菌株的产香性能。侧链氨基酸转氨酶[8]、醇酰基转移酶[9]、醛脱氢酶[10]直接参与酿酒酵母发酵过程中香气物质的合成,其中侧链氨基酸转氨酶与醇类香气物质的形成有关,醇酰基转移酶参与乙酯类物质的合成调控,醛脱氢酶主要参与脂肪酸的合成,它们的酶活性都与氮源浓度密切相关。发酵温度主要影响酿酒酵母生长与代谢产物的生成。Molina等[11]在研究发酵温度对酿酒酵母产香影响的实验中发现,低温有利于酯类香气的产生,但发酵温度对高级醇的影响较为复杂。葡萄酒酿造过程以及发酵结束后常以偏重亚硫酸盐的形式添加SO2,其主要作用是抑制杂菌生长和抗氧化作用,现有研究指出,添加SO2也会对发酵香气产生一定影响。Sun Yumei等[12]研究发现,随着发酵过程中SO2添加量的增加,2-苯乙醇和异丁醇的浓度增加,正丙醇、乙酸异戊酯和乳酸乙酯的浓度减少。此外,SO2的存在还可以使葡萄酒发酵过程中氨基酸、VC以及其他营养物质更多的保留,但过量的SO2会导致酵母产生双乙酰等有害物质产生,这会严重影响葡萄酒质量[13]。目前关于不同发酵因素对葡萄酒香气品质研究的报道较多,但进行不同酿造条件对不同种类发酵香气综合变化规律的研究较少。
本实验利用葡萄汁模拟体系,接种5 株国产本土酿酒酵母菌株CY3079、LA-FR、LA-RA、MST和OFC进行发酵实验,通过顶空固相微萃取-气相色谱-质谱(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术对5 种酿酒酵母菌株产香特性进行比较,从而优选得到1 株产香性能良好的酵母,并进一步研究氮源质量浓度、发酵温度、pH值、SO2添加量4 个因素对该酵母菌株发酵香气的影响,揭示不同条件下各类香气组分的合成规律,以期为葡萄酒香气风味调控提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母菌株CY3079、LA-FR、LA-RA、MST、OFC均由上海鼎唐国际贸易有限公司提供。
α-萜品醇、β-香茅醇、香叶醇、里那醇、(Z)-橙花叔醇、β-大马士酮、乙酸异戊酯、乙酸乙酯、己酸甲酯、癸酸乙酯、戊醇、己醇、橙花醇、苯乙醇、金合欢醇(均为色谱纯),2-辛醇(内标物)标准品 美国Sigma公司;磷酸氢二铵、酒石酸氢钾、柠檬酸、酒石酸,氢氧化钠、偏重亚硫酸钠、氯化钠(均为分析纯)天津市光复精细化工研究所。
1.2 仪器与设备
SPX-150-II生化培养箱 上海跃进医疗器械有限公司;TRACE 1310-ISQ GC-MS仪、ISQ型单四极杆质谱仪美国Thermo Scientific公司;SPME装置、萃取头美国Supelco公司;PHS-3C pH计 上海雷磁有限责任公司;PAL-2数显手持糖度计 日本ATAGO公司。
1.3 方法
1.3.1 模拟汁配制
为排除葡萄果实中品种香气等香气前体物质对实验结果的影响,本实验利用模拟葡萄汁研究不同发酵因素对发酵香气的影响规律。模拟汁配方[14]:葡萄糖200 g/L、纤维二糖0.2 g/L;氮源:磷酸氢二铵1.5 g/L;酸:酒石酸氢钾2.5 g/L、L-苹果酸3.0 g/L、柠檬酸0.2 g/L;矿物质:磷酸氢二钾1.14 g/L、硫酸镁1.23 g/L。
1.3.2 酿酒酵母活化与模拟汁发酵
将酿酒酵母干粉溶于10 倍体积蒸馏水中,37 ℃静置20 min,再加入等体积的模拟葡萄汁28 ℃活化25 min,按推荐用量(0.2 g/L)将活化好的酿酒酵母菌株接种到模拟葡萄汁中,最后转移至28 ℃恒温培养箱进行发酵,待乙醇发酵结束后取样检测。
1.3.3 挥发性香气成分萃取与分析检测
参照鲁榕榕等[15]的方法并略作修改,具体操作如下:
香气成分的萃取:取8 mL待测酒样于15 mL顶空瓶中,加入2.4 g氯化钠和10 μL内标物(质量浓度7.25 mg/L),加入磁力搅拌转子,密封并摇匀,再置于恒温磁力搅拌器中,40 ℃水浴平衡30 min后顶空萃取30 min。
G C-M S分析条件:D B-WA X毛细管色谱柱(60 m×2.5 mm,0.25 μm);升温程序:初温50 ℃保持5 min,再以3.0 ℃/min升温至200 ℃,保持15 min,高纯氦气(He)流速1 mL/min;进样口温度240 ℃,不分流进样;MS接口温度280 ℃;电子电离源;离子源能量70 eV;质量扫描范围m/z20~350。
定性与定量:在质谱全离子扫描模式下,采用保留指数和NIST-11、Wiley及香精香料谱库检索比对进行定性分析。对已有标准品的化合物,利用标准曲线(R2>0.995)定量,无标准品的化合物采用化学结构、官能团相似、碳原子数相近的标准物质进行半定量。
1.3.4 酿酒酵母菌株产香性能比较
将5 株酿酒酵母(CY3079、LA-FR、LA-RA、MST、OFC)按0.2 g/L接种量分别接种于不同三角瓶内,28 ℃恒温培养发酵,待乙醇发酵结束后进行香气成分检测,设置3 次重复实验。
1.3.5 发酵条件对酿酒酵母菌株产香性能的影响
4 个发酵因素的研究采用控制变量法,即待研究因素按表1水平进行变化,其他因素均取表1中的中间水平,实验设置3 次重复。其中1.0、1.5、2.0 g/L磷酸氢二铵相当于212.13、318.19、424.26 mg/L(以N计)。模拟汁的pH值用酒石酸与氢氧化钠进行调节,SO2添加量用偏重亚硫酸钠调节。

表1 发酵条件对酿酒酵母菌株产香性能的影响Table 1 Effects of different fermentation conditions on aromaproducing performance of S. cerevisiae strains
1.4 数据统计
利用Microsoft Office Excel 2010对实验所得数据进行基本处理和作图,使用IBM SPSS Statistics 19.0进行Duncan法多因素方差分析(P<0.05,差异显著)、多元回归分析,并对香气数据进行主成分分析(principal component analysis,PCA),香气物质含量结果均以 ±s表示。
2 结果与分析
2.1 不同酿酒酵母菌株产香性能比较结果
利用SPME-GC-MS对5 种酿酒酵母菌株发酵产生的香气物质进行分析,实验共检测到65 种香气物质,其中醇类16 种、酯类22 种、酸类13 种、萜烯类9 种以及其他类5 种。由图1可知,CY3079酵母菌株共检出45 种香气成分,LA-FR酵母检出47 种,LA-RA、MST和OFC酵母分别检出43、40 种和42 种。CY3079、OFC、MST酵母产高级醇的种类相对较多,并且MST酵母菌株的高级醇产量最高为512.954 μg/L。LA-FR酵母菌株的高级酯产量为344.664 μg/L,是MST和OFC酵母菌株的6.65 倍和3.83 倍。LA-FR酵母产萜烯能力最强,萜烯类产量为83.453 μg/L,明显高于其他4 株酵母。发酵液中的挥发酸和其他类香气物质含量相对较少,并且在5 种酿酒酵母间无显著性差异。气味活性值(odor activity value,OAV)是评价单一香气化合物对整体香气的贡献程度[16],因本实验选用模拟葡萄汁进行发酵,不存在葡萄中的香气前体物质,最终发酵产生的香气物质含量远低于正常葡萄酒,OAV大于1的香气物质较少,因而本实验统计了OAV大于0.1的香气物质共9 种,LA-FR酵母产生的OAV大于0.1的香气化合物最多,为8 种,LA-RA酵母5 种,CY3079酵母3 种。

图1 酿酒酵母菌株产香特性比较Fig. 1 Comparison of aroma production characteristics of different S. cerevisiae strains
由于发酵香气成分复杂,为直观体现5 株酿酒酵母产香特点,故进行PCA,以特征值为1进行因子抽提,前2 个主成分累计方差贡献率为96.895%,PC1和PC2贡献率分别为82.544%和14.351%,基本能反映原数据的变异信息。如图2所示,PC1主要反映了B7(棕榈酸乙酯)、B5(癸酸乙酯)、D5(α-法尼烯)、D6(香叶醇)等花香、水果香味比较浓郁的香气物质信息,A7(苯乙醇)和B8(乙酸苯乙酯)则与PC1高度负相关。PC2主要反映A8(十六醇)、E3(2-壬酮)等带有脂肪味的香气物质信息,D7(金合欢基乙醛)和A11(正庚醇)与PC2呈高度负相关。由图3可知,根据这5 种酵母发酵特性可将其聚为3 类,其中LA-RA在PC1和PC2上的得分均较高,这主要代表葡萄酒中一些重要的酯类和萜烯类香气物质信息,如B5(癸酸乙酯)、B14(乙酸异戊酯)、B7(棕榈酸乙酯)、D5(α-法尼烯)、D6(香叶醇)等。OFC和MST酵母在PC1和PC2上的得分均较低,说明这类酵母产香能力较差,不适合高品质葡萄酒的酿造。LA-RA和CY3079酵母PC1得分较低,PC2得分较高,这一区域主要反映了一些醇类、酸类物质的信息,如A11(正庚醇)、C13(异丁酸)、C11(月桂酸),因而使用这类酵母酿的酒可能存在香气品质单一、乙醇体积分数高等缺点。相比之下,LA-RA酵母产香性能优于其他4 株酵母,并且产酯类、萜烯类物质能力最强,因此选择该菌株研究不同酿造条件下发酵香气的变化规律。

图2 香气化合物PCA的因子载荷图Fig. 2 Loading plot of PCA for aroma compounds

图3 酿酒酵母菌株发酵香气PCA分布图Fig. 3 PCA score plot of PC1 versus PC2 for aroma distribution of different strains of S. cerevisiae
2.2 酿造条件对LA-FR酵母菌株产香性能的影响
2.2.1 不同酿造条件下LA-FR酵母菌株发酵香气检测结果
发酵香气主要是乙醇发酵过程中由酵母代谢合成的香气化合物,本实验利用SPME-GC-MS检测了氮源、发酵温度、pH值、SO2添加量4 个发酵因素的不同水平下模拟汁中的香气物质,结果如表2所示。实验共检出65 种香气化合物,其中醇类15 种,酯类23 种,酸类、萜烯及其他类分别为13、8、6 种。各发酵条件下香气物质种类变化不大,但各类香气物质含量存在显著差异。葡萄酒发酵所需的最低氮含量为150 mg/L(相当于0.71 g/L磷酸氢二铵),氮含量过低会导致酵母生长缓慢,发酵迟缓或停滞,若氮含量超过500 mg/L(相当于2.36 g/L磷酸氢二铵)会导致危害健康的生物胺、氨基甲酸乙酯等产生[17]。由表2和图4A可知,当氮源质量浓度从1.0 g/L增加到2.0 g/L时,高级醇含量降低了31.46%,其中直链高级醇含量减少41.76%,但由Ehrlich途径合成支链高级醇如异丁醇、2-甲基-1-丙醇、3-甲基-2-丁醇含量均有明显增加;酯类含量与氮源质量浓度呈正相关,当氮源质量浓度为2.0 g/L时,酯类物质质量浓度为472.891 μg/L,相比1.0 g/L氮源时增加了72.92%,其中乙酸酯和乙基酯分别增加291.59%和62.49%。随着氮源质量浓度的升高,萜烯含量降低42.56%,其中芳樟醇和反式-橙花叔醇含量降低最明显,分别降低85.00%和31.38%,因此较低的氮源质量浓度发酵有利于高级酯等果香香气物质的积累。
通常认为,低温发酵有利于香气化合物的积累,能降低发酵速率,延长发酵时间,可产生更多复杂的香气组分,但温度过低,有可能导致发酵停滞等风险[18]。由表2和图4B可知,当发酵温度升高时,香气总量逐渐下降,其中酯类、萜烯类含量下降明显,酸类含量显著增加。发酵温度从18 ℃升高到28 ℃,醇类物质总量先升高后降低,其中苯乙醇含量降低,1-己醇等六碳醇含量先增后降,其他直链高级醇和支链高级醇含量均有不同程度的增加;酯类物质含量下降58.66%,其中乙基酯和其他酯分别下降68.44%和91.89%,但乙酸酯含量增加了43.13%,如异戊酸乙酯、2-甲基己酸乙酯等均显著降低,而乙酸苯乙酯含量有明显的上升趋势。较低的发酵温度有利于萜烯类物质的积累,随着发酵温度的升高,萜烯化合物含量降低66.19%,其中芳樟醇与α-法尼烯含量下降明显。当发酵温度升高到28 ℃时,酸类物质含量明显升高,如癸酸、2-甲基丁酸、异丁酸含量分别增加8.72、2.19、1.17 倍,酸类物质大量积累会破坏葡萄酒的平衡、降低酒的品质,因此较低温度发酵有助于提升脂类、萜烯类香气物质含量,但不利于醇类、酸类物质的积累。

表2 不同发酵条件下挥发性香气化合物GC-MS分析Table 2 GC-MS analysis of volatile aroma compounds produced under different fermentation conditions

续表2
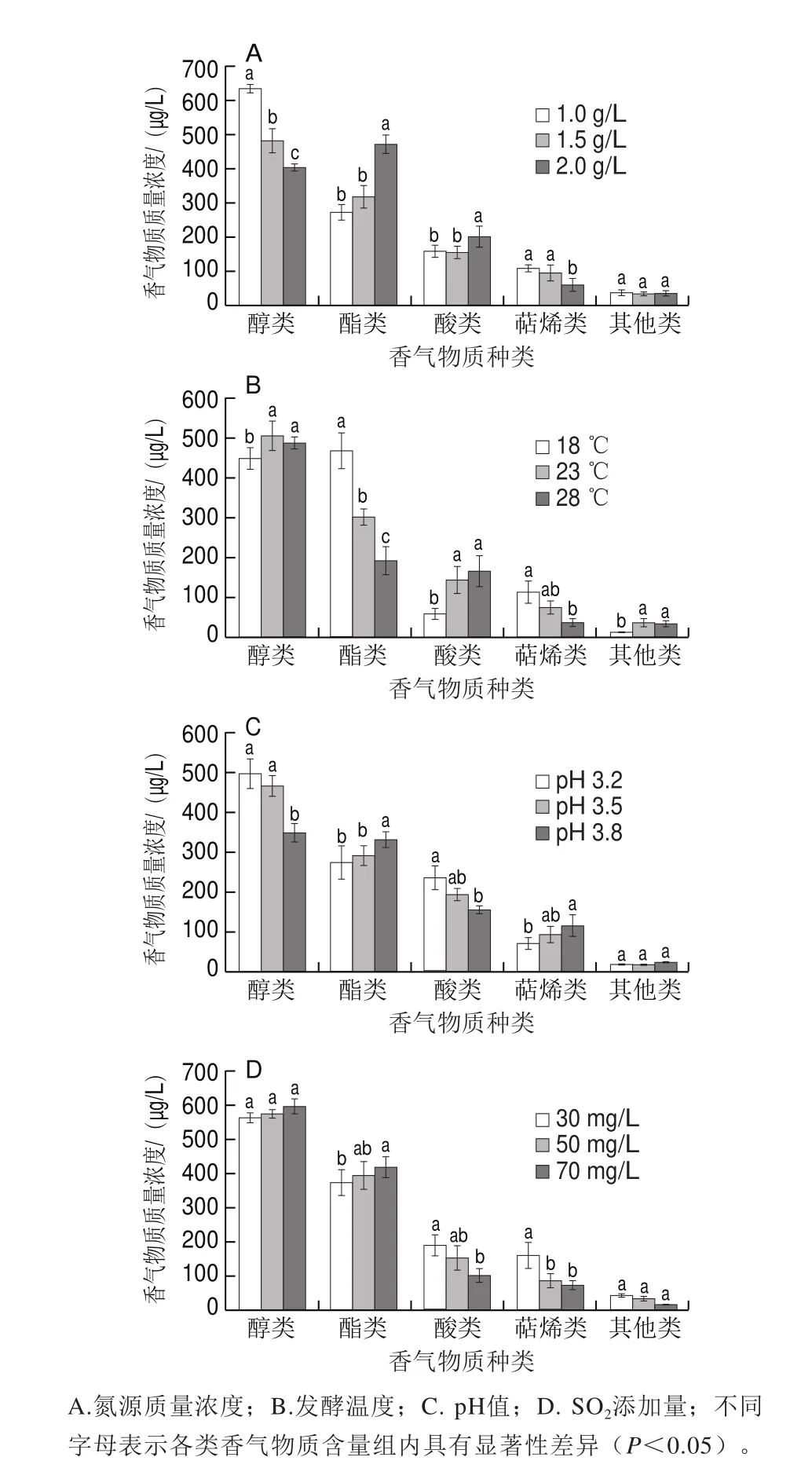
图4 发酵条件对发酵香气含量的影响Fig. 4 Effect of different fermentation conditions on aroma production
如表2和图4C所示,模拟汁的pH值由3.2升高到3.8的过程中,高级醇和酸类含量降低,酯类和萜烯类香气化合物含量升高,高级醇含量减少30.24%,其中直链高级醇、硫醇含量显著下降,但实验中还发现部分支链高级醇含量有小幅度的增加,如异丁醇、2-甲基-1-丙醇;酯类、萜烯类含量分别增加19.50%和67.43%,其中乙酸酯和其他酯含量显著增加,分别增加56.76%和48.96%。此外当pH值为3.8时,发酵产生的酸类物质减少34.16%。降低模拟汁的酸度不仅能增加带有果香、花香味的高级酯和萜烯类香气物质的含量,还能减少酸类物质积累所引起的异味,因此降低酸度对发酵香气的改善意义重大。
SO2是葡萄酒中常用的抑菌剂,常以亚硫酸盐的形式被添加[19]。由表2和图4D可知,当SO2添加量从30 mg/L增加到70 mg/L时,高级醇含量升高5.82%,其中支链高级醇增加34.21%,但直链高级醇含量下降14.50%;随着SO2添加量的增加,绝大部分酯类物质含量均有不同程度的增加,其中乙酸酯含量显著增加,乙基酯和其他酯含量增幅较小;酸类和萜烯类含量分别降低47.41%和55.75%。随着SO2添加量升高,叔十六硫醇和3-甲硫基丙醇这类对葡萄酒香气有负面影响的硫化物含量明显增加。高浓度的SO2对酵母细胞具有毒害作用,抑制酵母生长,并且SO2对人体健康也有一定的影响,因此在葡萄酒酿造过程中应合理减少SO2的用量,提高葡萄酒的安全性。
2.2.2 发酵条件对发酵香气影响的多元回归分析
由于不同发酵因素对各类香气影响作用不同,并且各影响因素的量纲也不相同,因而不能直接比较各因素对香气影响力的大小,故对原始数据进行标准化处理,再通过SPSS多元回归分析求得标准回归系数,其绝对值的大小直接反映了该因素对香气的影响程度,正值表示该因素能增加香气物质积累,负值则表示不利于香气物质合成。

表3 各发酵因素的标准回归系数Table 3 Standard regression coefficients for aroma compounds versusfermentation conditions
由表3可知,氮源质量浓度对醇类和酯类香气物质含量影响最大,并且氮源质量浓度越高,醇类物质含量越低,酯类物质含量越高,因此增加氮源质量浓度可提高模拟汁中酯类香气含量,但会降低醇类物质含量;发酵温度对酸类物质影响最大,随着发酵温度升高,酸类物质生成增多,因此发酵过程中可通过控制温度来避免因酸类物质大量积累而引起的香气品质降低;发酵过程中SO2添加量对萜烯类香气含量影响最大,其表现为抑制萜烯类物质的积累,因此控制好SO2添加量对发酵过程中萜烯类香气物质调控具有重要意义。
3 讨 论
酿酒酵母菌株在发酵过程中产生的香气物质种类繁杂,其中高级醇是发酵香气中含量最高的组分,主要由Ehrlich途径合成大量支链高级醇[20],但Ehrlich途径并非发酵过程中高级醇的唯一合成通路,少量直链高级醇是经酵母体内糖代谢途径合成。酯类是除醇类外含量最高的呈香物质,并且种类最多,对提升葡萄酒香气复杂性至关重要[21]。发酵香气中的酯类大部分是酵母等微生物活动产生的中性酯,具有类似水果香气,如淡淡的菠萝和香蕉味[22]。酯类主要分为乙酸酯和乙基酯,乙酸酯是由高级醇和乙酰CoA经醇乙酰基转移酶催化生成,其中高级醇主要来自氨基酸代谢,乙酰CoA由丙酮酸氧化脱羧生成;乙基酯合成的底物是乙醇和酰基CoA,由酰基转移酶催化生成,主要包括丙酸乙酯、丁酸乙酯、己酸乙酯等[23]。葡萄酒中的酸类物质含量较少,其主要对葡萄酒的平衡起调节作用[24]。萜烯类化合物因其感官阈值较低,具有浓郁的花香味,对葡萄酒香气贡献尤为突出。早期研究认为酵母细胞内不存在萜烯物质合成途径,不能自身合成萜烯类化合物,但近年来出现了一些有关酿酒酵母菌株产萜烯的报道[25-26]。本实验结果显示酿酒酵母菌株可以合成少量萜烯类化合物,进而证实了酵母体内存在萜烯合成途径这一假说,但关于酵母细胞合成萜烯的具体途径至今仍不清楚。
本研究结果表明,不同发酵条件均对模拟汁中香气物质的组成、含量具有显著影响。有文献指出增加氮源浓度能提高侧链氨基酸转氨酶活性,从而使经Ehrlich途径生成的支链高级醇含量增加[27-28],本实验也得到类似的结果,但实验中还发现随着氮源质量浓度增加,部分直链高级醇含量减少,这可能是由于增加氮源质量浓度改变了模拟汁中的碳氮比,导致酵母细胞生长受到抑制,从而使经糖代谢生成的直链高级醇含量减少。Stijn等[9]发现氮源浓度增加会导致醛脱氢酶活性增加,从而提高了辛酸乙酯、己酸乙酯、癸酸乙酯等乙基酯类的含量,这与本实验研究结果一致。本实验还发现提高氮源质量浓度不利于萜烯类物质的合成,这可能是因为在乙醇发酵过程中,部分葡萄糖经糖酵解等多步酶促反应生成的乙酰CoA可参与多种物质合成,如进入三羧酸循环参与高级醇的合成,或直接用于合成脂肪酸或高级酯,还有一部分乙酰CoA进入甲羟戊酸途径,参与萜烯类物质的合成,当大量的乙酰CoA进入酯类物质合成途径时,进入甲羟戊酸途径的CoA通量减少,最终可能导致萜烯物质合成减少[27]。
温度是目前研究最多的影响发酵进行的因素,大量研究表明,低温发酵有利于香气品质的提升,这主要归因于萜烯类物质的积累以及C6~C10中链高级酯含量的增加[18]。Beltran等[29]在酿酒酵母转录组分析中发现,当发酵温度从10 ℃升高到30 ℃时,酵母细胞内与氨基酸代谢相关基因的表达量下调,这会造成α-酮酸大量积累,进而生成更多的高级醇,但本实验发现高级醇含量并非始终与发酵温度呈正相关,当发酵温度超过23 ℃时,高级醇含量随发酵温度的升高而降低,这可能是因为随着发酵温度的持续升高,参与高级醇合成的部分酶偏离了其最适反应温度,从而使高级醇合成减少。Molina等[30]研究表明较高的发酵温度会降低挥发性酯类化合物的稳定性,增加蒸发损失,进而减少酯类香气物质的积累。但也有研究指出,高温导致蒸发损失增加并非酯类物质香气减少的主要原因,而是因为在每个温度条件下酯类物质的代谢活性与基因表达的差异所致[31]。一般来说,温度越高,酵母发酵速度越快,发酵所需时间减少,醇类、酸类物质大量合成,酯类、萜烯类等复杂的香气物质合成减少,本实验也得到了与此类似的结果。
酿酒酵母菌株在偏中性或微酸条件下发酵能力最强,低pH值条件下酵母菌株可代谢产生更多的挥发酸,并且高级酯降解速度也会加快[32],因此低pH值条件下模拟汁中大量的高级醇和酸类物质可能来自高级酯的降解作用;随着pH值水平的升高,高级酯降解速度减缓,酯类、萜烯类物质合成途径的相关酶活性提高,可积累大量的酯类、萜烯类香气物质,本实验结果与此一致。实验中发现随着SO2添加量增加,萜烯类物质含量迅速减小,这可能是因为随着SO2添加量的升高,其对酵母细胞的毒害作用增强,酵母细胞内的部分代谢途径发生明显改变[12],导致乙酰CoA在酵母细胞内的分配方式发生变化,使进入甲羟戊酸途径的乙酰CoA迅速减少,最终造成萜烯类物质合成减少;再者SO2的添加能增加模拟汁的酸度,可间接对发酵香气产生影响。适量浓度的SO2具有提高乙醇体积分数,保持果香味的功能[19],这与本实验中高级醇、高级酯香气含量增加的结果相符。
本实验发现氮源质量浓度变化对乙酸酯和乙基酯的影响趋势一致,而其他3 种发酵因素对乙酸酯和乙基酯影响趋势相反;发酵温度对直链高级醇与支链高级醇影响趋势一致,而其他3 种发酵因素对直链高级醇与支链高级醇影响趋势相反,并且随着发酵温度、pH值、SO2添加量4 种发酵因素的改变,支链高级醇和乙酸酯变化趋势一致,这可能是因为经Ehrlich途径合成的支链高级醇充当了乙酸酯合成的底物,因而两者变化趋势一致[20,23]。目前关于发酵因素对各类发酵香气物质合成影响的机理性研究报道较少,尤其是直链高级醇与支链高级醇、乙酸酯与乙基酯对同一发酵因素显现出不同变化趋势的研究鲜见报道,因而有待进一步探究。
4 结 论
本实验结果表明,酿酒酵母菌种与氮源质量浓度、发酵温度、pH值、SO2添加量等因素对发酵香气的影响差异较大。实验所选的5 株酿酒酵母中LA-FR菌株产酯类、萜烯类物质能力最强,产香性能优于其他4 株酵母。此外,氮源质量浓度、发酵温度、pH值、SO2添加量对发酵香气影响的结果显示,较低的氮源条件下发酵有利于萜烯类和醇类物质的生成,不利于酯类物质的积累,并且氮源对醇类和酯类香气含量影响较大;选择较低的发酵温度有利于酯类、萜烯类物质积累,发酵温度对酸类香气物质含量影响较大;在较高pH值条件下发酵的模拟汁中酯类、萜烯类物质含量明显增加,醇类、酸类物质含量减少;SO2添加量与醇类、酯类合成量呈正相关,与酸类、萜烯类合成量呈负相关,且SO2的添加量对萜烯类香气含量影响较大。
在发酵过程中,同一发酵因素对不同种类香气物质的影响不同,且不同发酵因素对同一种类香气物质的影响也不相同,所以在实际生产过程中,发酵香气的调控应考虑多个因素,并且不同因素间可能还会存在交互作用,因此,本实验所得结果可为葡萄酒香气风味调控以及深入研究复合因素作用对发酵香气的影响提供理论支持。
