壳聚糖-海藻酸钠载药微球制备工艺研究
2019-09-06史同瑞崔宇超王丽坤朱庆贺杨旭东张艳高俊峰
史同瑞,崔宇超,王丽坤,朱庆贺,杨旭东,张艳,高俊峰
(黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005)
微球(microspheres,MS)是指将药物溶解、分散、吸附或包裹在高分子聚合物的载体材料中,并制成载药的球状微粒。微球粒径一般是在1~1000 μm范围内,常见的微球粒径为1~40 μm,小于1 μm的微球称为纳米微球[1]。微球作为一种载物体系,已在药物载体、酶固定化、细胞培养微反应器、基因运载等方面开展了较为深入的研究[2,3]。微球作为药物的包封、缓释、控释与靶向释放的药物载体,具有保护敏感药物成分免受胃肠道环境破坏,提高药物稳定性,延长药物作用时间,提高药物的生物利用度等许多优点,因此,微球作为药物的载体具有广阔的开发应用前景[4-6]。
微球多采用明胶、壳聚糖、海藻酸钠等可生物降解的高分子无毒天然材料制备而成,制备方法常采用滴注法、喷雾法、原位聚合法、静电法和乳化法等方法,然而这些方法均存在着一定的弊端:一是需要使用化学有机溶剂,这不仅会造成毒性物质残留等问题,而且还可能导致药物丧失活性;二是需要复杂的生产设备,生产效率低,这给载药微球产业化生产造成了障碍[7],研究开发安全、简便、高效的生产方法是微球制剂实现产业化的技术需求。本试验结合微乳及胶体制备工艺[8],采用D相乳化法,以硫酸小襞碱为模型药物,以药物包封率为评价指标,应用响应面法筛选优化了微球的制备工艺,并制备了优良的硫酸小襞碱壳聚糖-海藻酸钠微球,这为微球制剂的产业化开发奠定了一定的技术基础。
1 材料与方法
1.1 材料 壳聚糖,分析纯,脱乙酰度DD%>85%,批号170902,武汉合中生化制造有限公司;海藻酸钠,分析纯,批号S817372,上海麦克林生化科技有限公司。硫酸小襞碱,含量98.21%,批号180301,四川恒瑞通达生物科技有限公司;硫酸小檗碱标准品,含量98.7%,中国兽医药品监察所;氯化钙,分析纯,天津市恒兴化学试剂制造有限公司;液体石蜡,批号20160905,天津市巴斯夫化工有限公司;丙二醇、正丁醇和正戊醇,液体石蜡、司班-80、吐温-80,均为分析纯,天津市巴斯夫化工有限公司。
1.2 仪器 UV1900PC型双光束紫外可见光分光光度计,上海佑科仪器仪表有限公司;winner802纳米粒度仪,济南微纳颗粒仪器股份有限公司;ZNCL-S型恒温磁力搅拌器,上海羌强仪器设备有限公司;MS104TS/02型电子分析天平,梅特勒-托利多有限公司。
1.3 微球制备方法 精密称取海藻酸钠2 g,硫酸小襞碱4 g,加入100 mL蒸馏水中,充分溶解,混合均匀;取制备的海藻酸钠-硫酸小襞碱混合液100 mL,加入液体石蜡50 mL,司班-80 5 mL,吐温-80 10 mL,丙二醇5 mL,以800 r/min充分搅拌乳化,制成含有海藻酸钠及药物的水包油型乳胶。取适量乳胶,加入等量1%氯化钙溶液中,以8000~1000 r/min高速搅拌,胶凝反应一定时间,过滤得微球;按着微球与壳聚糖溶液体积比1∶10比例将微球加入2%壳聚糖溶液中,再次胶凝1 h,蒸馏水洗涤,过滤,干燥,即得载药微球。
1.4 微球评定指标测定
1.4.1 硫酸小檗碱含量测定
1.4.1.1 硫酸小檗碱标准品溶液制备 精密称取硫酸小檗碱标准品0.1 g,置于100 mL容量瓶中,加入20 mL去离子水,充分震荡至完全溶解,再加去离子水至刻度,摇匀,制成硫酸小檗碱浓度为1000 μg/mL的标准品储备液。精确量取标准品储备液0.05、0.1、0.2、0.5、1.0、2.0、5.0 mL分别置于100 mL容量瓶中,加水定容至刻度,摇匀,制成硫酸小檗碱浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、50.0 μg/mL的标准溶液。
1.4.1.2 标准曲线绘制 取各浓度硫酸小檗碱标准液样品,以去离子水作空白对照。参照文献方法[9]在423 nm波长处测定其吸光度,各浓度标准液样品重复测定3次。以硫酸小檗碱浓度为横坐标(x),吸光度值为纵坐标(y)进行线性回归,绘制标准曲线,计算回归方程。
1.4.2 微球评定指标测定
1.4.2.1 药物包封率测定 以药物包封率作为微球制备工艺的评定指标。取制备的微球悬液用0.22 μm滤膜过滤,并用适量去离子水冲洗3次。取滤液及冲洗液混合液,按照1.4.1方法于423 nm波长处测定药物吸光度,计算混合液中硫酸小檗碱含量及微球药物包封率[10]。包封率(EE%)=微球中药物量/总投药量×100%。
1.4.2.2 微球形态与粒径测定 取硫酸小襞碱壳聚糖-海藻酸钠微球样品置于载玻片上,用显微镜观察微球形态。应用纳米粒度仪测定微球的大小及其粒径分布。
1.5 制备工艺单因素试验 在单因素预选试验基础上,确定海藻酸钠溶液浓度、氯化钙溶液浓度、壳聚糖溶液浓度,以及初次胶凝时间是影响微球质量的主要因素。根据预试验结果,每个因素选择5个水平进行单因素试验。
1.5.1 海藻酸钠溶液浓度筛选 在氯化钙溶液浓度2.0%、壳聚糖溶液浓度1.2%、初次胶凝时间30 min条件下,以海藻酸钠溶液浓度分别为0.5%、1%、1.5%、2%、2.5%水平制备载药微球,观察微球形态,测定微球药物包封率,确定海藻酸钠溶液最适浓度。试验重复3次。
1.5.2 氯化钙溶液浓度筛选 在海藻酸钠溶液浓度1.5%、壳聚糖溶液浓度1.2%、初次凝胶时间30 min条件下,以氯化钙溶液浓度分别为1.0%、1.5%、2.0%、2.5%、3.0%水平制备载药微球,观察微球形态,测定药物包封率,确定氯化钙溶液最适浓度。试验重复3次。
1.5.3 初次凝胶时间筛选 在海藻酸钠溶液浓度1.5%、氯化钙溶液浓度2.0%、壳聚糖溶液浓度1.2%条件下,以初次凝胶时间分别为10、20、30、40、50 min水平制备载药微球,观察微球形态,测定药物包封率,确定初次凝胶最适时间。试验重复3次。
1.5.4 壳聚糖溶液浓度 在海藻酸钠溶液浓度1.5%、氯化钙溶液浓度2.0%、初次凝胶时间30 min条件下,分别以为壳聚糖溶液浓度0.4%、0.8%、1.2%、1.6%、2%水平制备载药微球,观察微球形态,测定微球药物包封率,确定壳聚糖溶液最适浓度。试验重复3次。
1.6 制备工艺优化
1.6.1 试验设计 基于单因素试验结果,应用Box-Behnken设计原理,设计四因素三水平响应曲面分析试验,优化载药微球制备的各因素最适水平,因素水平设计见表1。
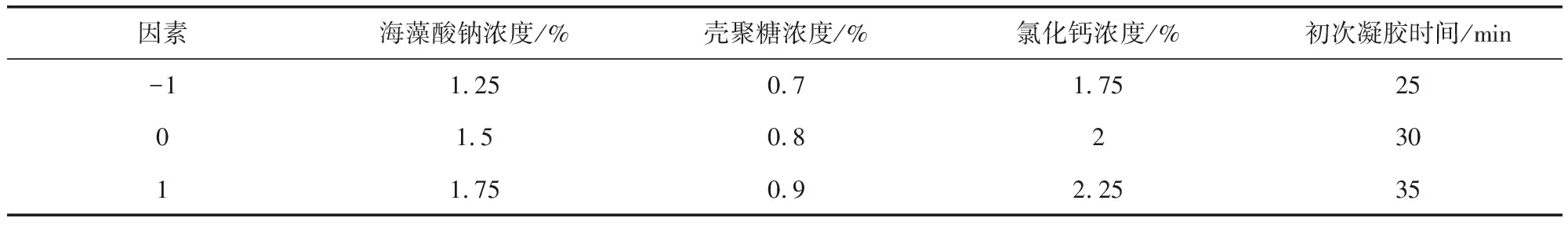
表1 Box-Behnken设计的因素水平Tab 1 The factors and levels for Box-Behnken design
1.6.2 数据处理及模型拟合 应用Design Expert 8.0.6软件中Box-Behnken方法,对制备硫酸小檗碱微球所得数据进行处理,将药物包封率(因变量)与各因素(自变量)进行多元线性回归和二项式方程拟合,响应曲面法设计方案见表2。

表2 响应曲面法设计方案Tab 2 Response surface methodology design scheme
1.6.3 验证试验 根据优化的海藻酸钠溶液浓度、壳聚糖溶液浓度、氯化钙溶液浓度,以及初次凝胶时间,按照制备工艺流程,测定微球的药物包封率,并进行3次验证试验,验证预测结果的准确性。
2 结果与分析
2.1 标准曲线绘制 以吸光度值为纵坐标,硫酸小檗碱浓度为横坐标绘制标准曲线,得出回归方程:y=0.0129x+0.0394(R2=0.999)。由图1可知,硫酸小檗碱质量浓度在0.5~50 μg/mL范围内时,其吸收度与药物浓度的线性关系良好。
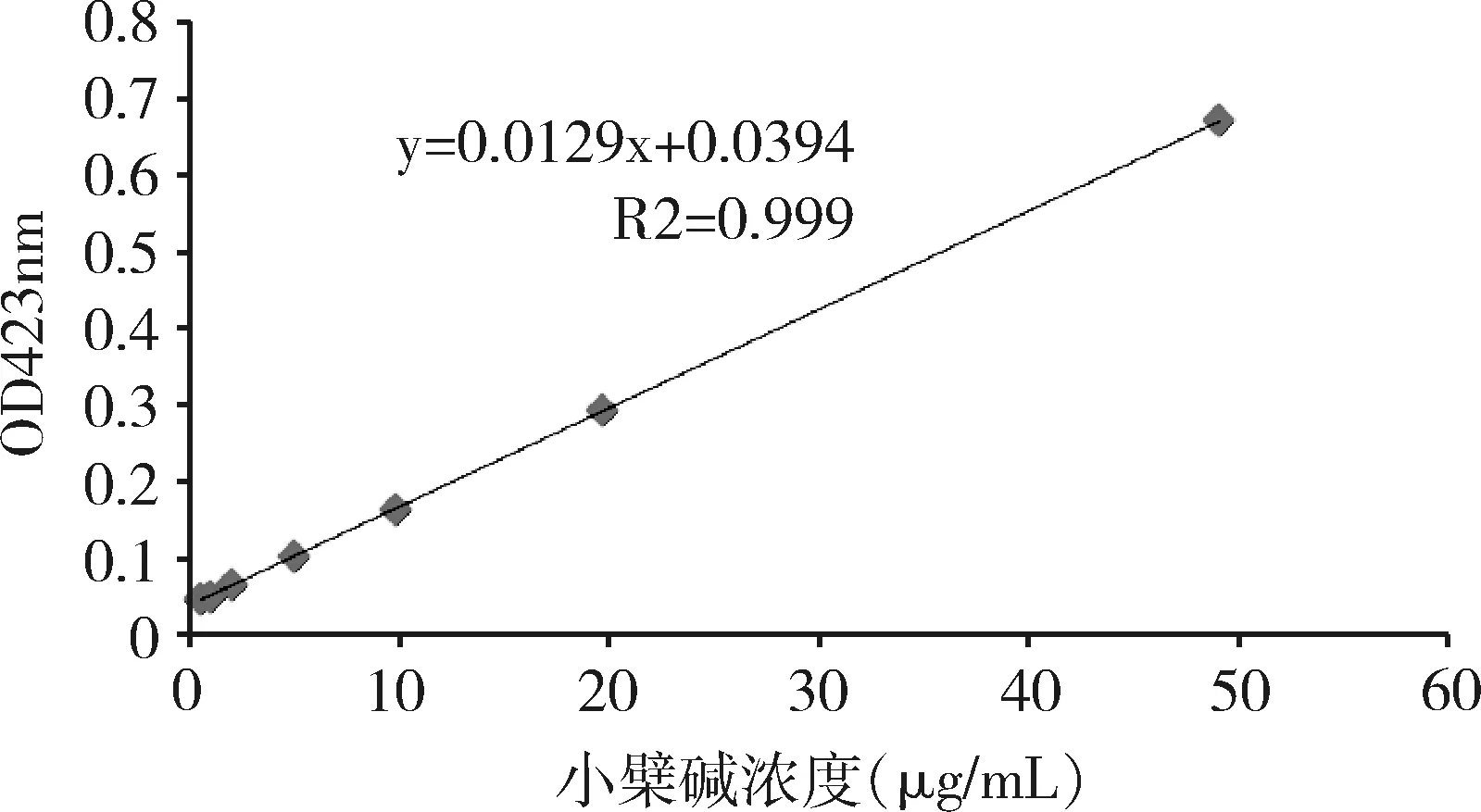
图1 硫酸小檗碱标准曲线Fig 1 Standard curve of Berberine Sulfate
2.2 单因素试验结果
2.2.1 海藻酸钠溶液浓度对微球性能的影响 由图2可知,随着海藻酸钠溶液浓度的增大,微球药物包封率逐渐升高,整齐度逐渐变好,粒径无明显变化。当海藻酸钠浓度超过2.0%时,虽然微球的包封率也逐渐升高,但微球的圆整度下降,制备微球难度加大。综合考虑各因素,选择海藻酸钠溶液的最佳浓度为1.5%。

图2 海藻酸钠浓度对微球包封率的影响(n=3)Fig 2 Effect of the sodium alginate concentration onencapsulation efficiency of microspheres
2.2.2 氯化钙溶液浓度对微球性能的影响 由图3可知,随着氯化钙溶液浓度的升高,药物的包封率也逐渐升高,但当氯化钙溶液浓度超过2%时,微囊的圆整度降低,脆性增大,因此,选择氯化钙溶液的最佳浓度为2%。
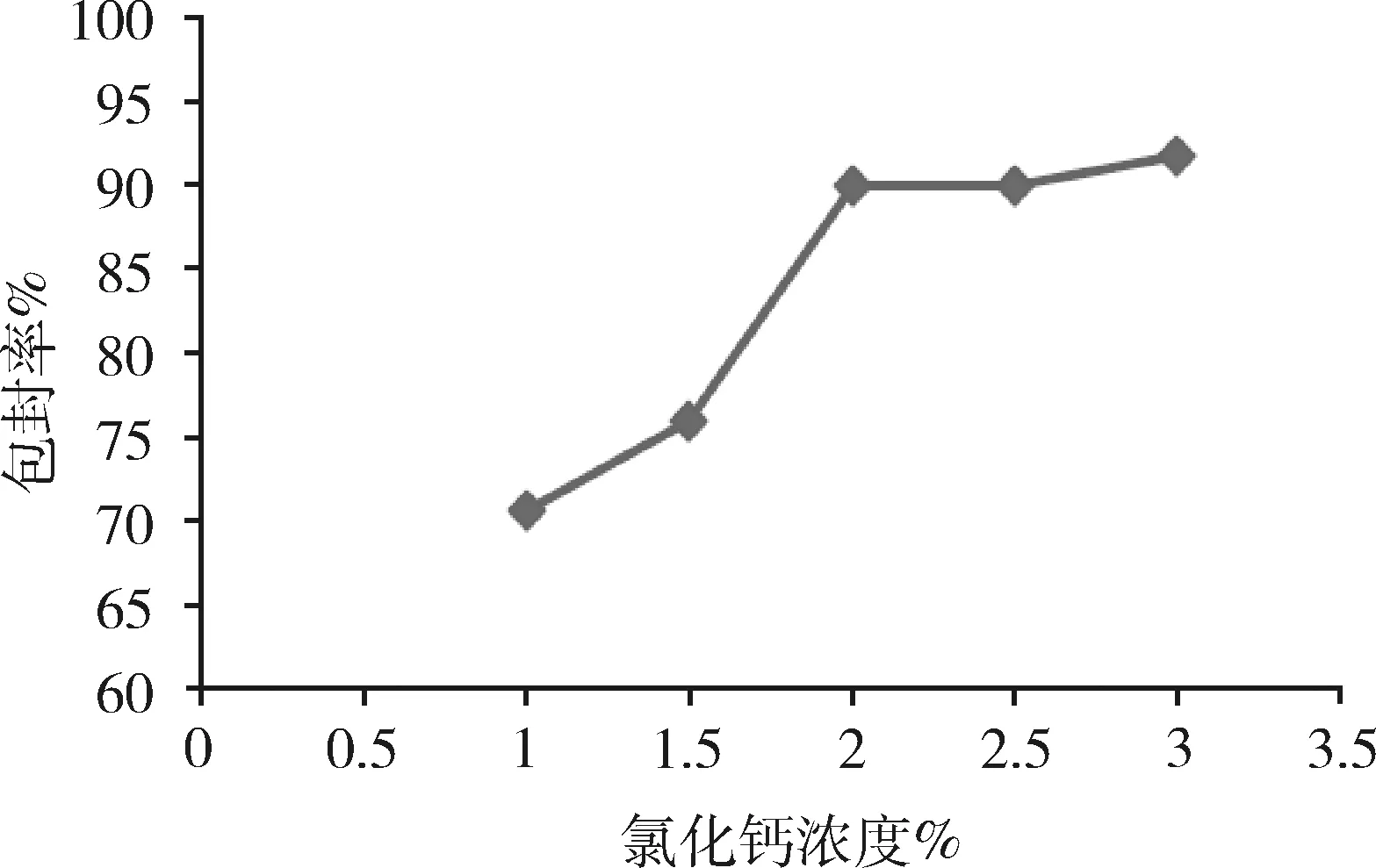
图3 氯化钙浓度对微球包封率的影响(n=3)Fig 3 Effect of the calcium chloride concentration onencapsulation efficiency of microspheres
2.2.3 初次凝胶时间对微球性能的影响 由图4可知,随着初次凝胶时间由10 min延长至30 min,微球的整齐度、药物包封率逐渐升高,但初次凝胶时间由30 min延长至50 min时,微球的整齐度和药物包封率变化不明显(P>0.05),因此,选择最佳初次凝胶时间为30 min。

图4 初次凝胶时间对微球包封率的影响(n=3)Fig 4 Effect of the gel-forming time onencapsulation efficiency of microspheres
2.2.4 壳聚糖溶液浓度对微球性能的影响 由图5可知,随着壳聚糖浓度增加,虽然微球的整齐度变化不明显,粒径也无明显变化,但壳聚糖溶液浓度为0.8%时,微球的药物包封率最高,因此,选择壳聚糖溶液最佳浓度为0.8%。
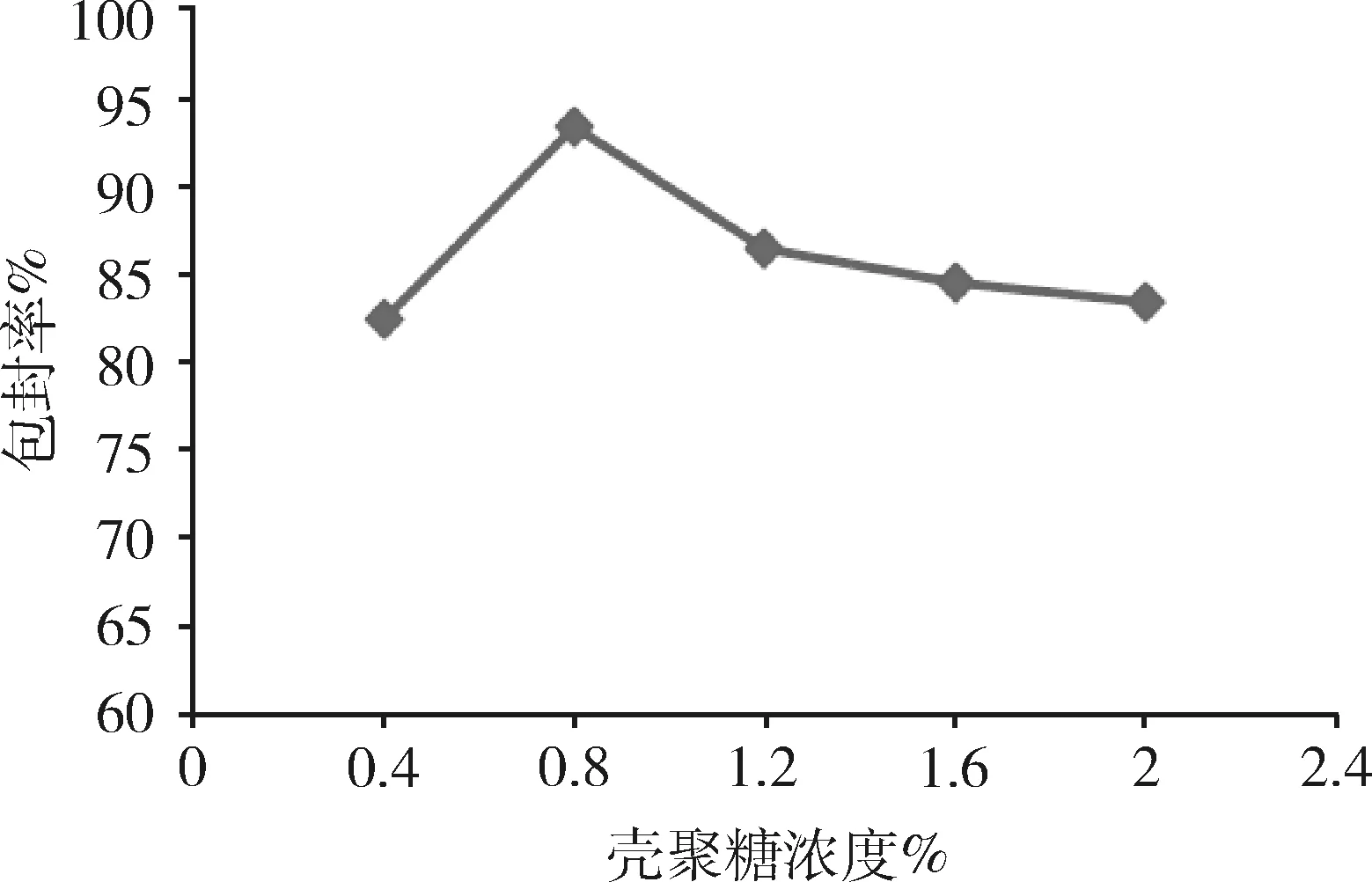
图5 壳聚糖浓度对微球包封率的影响(n=3)Fig 5 Effect of the chitosan concentration onencapsulation efficiency of microspheres
2.3 制备工艺优化结果
2.3.1 统计模型与方差分析 通过回归分析,得多元回归方程:Y=92.31+4.39X1+2.97X2+3.24 X3+0.18X4+5.000E-003X1X2-2.88X1X3+1.18X1X4+7.43X2X3+1.97X2X4+0.64X3X4-4.48X12-6.12X22-6.57X32- 8.39X42,回归系数R2=0.9059,回归方程与实际模型拟合度良好。对二项式方程中各系数进行F检验,由表3可知,X1、X2、X3为极显著因素,X2与X3的交互作用极显著(P<0.01)。此模型的失拟项Pr>F值为0.0834,大于0.05,模型失拟项不显著(P>0.05),说明模型选择合理。

表3 回归方程方差分析结果Tab 3 Variance analysis of regression equation
注:Pr>F值小于0.05,表明模型或考察因素有显著影响;Pr>F值小于0.01,表明模型或考察因素有极显著影响。
Notes: the value of Pr>F less than 0.05 indicates that the model or inspection factors have a significant influence; the value of Pr>F less than 0.01 indicates that the impact of the model or inspection factors is extremely significant.
2.3.2 响应曲面分析 利用Design Expert 8.0.6软件作响应曲面图及等高线图,在筛选因素水平范围内,微球药物包封率存在最大值,即等高线图标注的中心点。由图6可知,当壳聚糖溶液浓度一定时,随氯化钙溶液浓度的升高,包封率快速增大,然后又减小。当氯化钙溶液浓度一定时,随着壳聚糖溶液浓度的升高,包封率快速增大,然后又减小。响应曲面图的曲线比较陡峭,说明壳聚糖、氯化钙两因素的交互作用对包封率影响显著(P<0.05),包封率的最大值应在氯化钙浓度1.95%~2.15%和壳聚糖浓度0.80%~0.90%范围内。由图7可知,当初次凝胶时间一定时,随着海藻酸钠浓度的升高,包封率快速增大,然后又减小。当海藻酸钠溶液浓度一定时,随着初次凝胶时间的延长,包封率快速增大,然后又减小,包封率的最优值应在海藻酸钠溶液浓度1.45%~1.65%和初次凝胶时间29~33 min范围内。等高线图呈椭圆形,说明壳聚糖、氯化钙两因素具有一定的交互作用。

图6 氯化钙浓度与壳聚糖浓度交互响应面图及其等高线图Fig 6 Response surface and contour plots for the effect between calcium chloride concentration and chitosan concentration
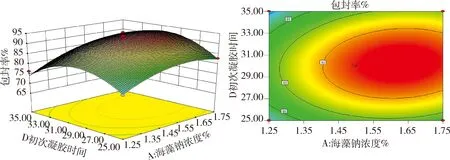
图7 海藻酸钠浓度与凝胶时间交互响应面图及其等高线图Fig 7 Response surface and contour plots for the effect between sodium alginate concentration and gel-forming time
2.3.3 优化分析 应用Design Expert 8.0.6软件,模拟的最佳工艺条件:海藻酸钠溶液浓度1.57%,壳聚糖溶液浓度0.86%,氯化钙溶液浓度2.13%,初次凝胶时间为30.71 min,在此条件下,硫酸小檗碱微球包封率理论值为94.6991%。根据最优化工艺流程进行了3次验证试验,硫酸小檗碱包封率的实测平均值为94.09%,这说明试验设计和数学模型具有可靠性和重现性。
2.4 微球形状与粒径分布 微球外观形状为规则球形,表面光滑圆整,无明显的聚集现象,见图8。纳米粒度仪测定结果表明,应用筛选的最佳工艺制备的微球平均粒径为329 nm,且呈正态分布,见图9。

图8 微球形态Fig 8 Morphology of microspheres

图9 微球粒径分布Fig 9 Distribution of particle sizes of microspheres
3 讨论与结论
3.1 微球制备的影响因素 海藻酸钠-壳聚糖载药微球的形状、致密度、药物包封率、微球降解速率,以及药物释放动力学等质量性能,主要取决于制备微球的高分子材料及其浓度、交联剂钙离子浓度、聚合反应时间、溶液pH值等因素。由于采取的制备方法、生产的原材料和包载药物的不同,因此微球制备的工艺条件也有差异。徐连敏等[11]研究表明,决定微球质量和药物包封率的影响因素依次为壳聚糖浓度>氯化钙浓度>海藻酸钠浓度>药物载量。张华等[12]确定的影响因素依次为海藻酸钠质量分数>壳聚糖质量分数>氯化钙质量分数>海藻酸钠与药物比。岳春华等[13]证实,影响微球质量的因素依次是明胶用量>药料比>乳化剂用量>壳聚糖用量。本研究通过单因素试验和响应曲面法证实,决定微球质量的主要影响因素依次为:海藻酸钠溶液浓度>氯化钙溶液浓度>壳聚糖溶液浓度>胶凝时间,从总体试验结果看,本试验与其他学者的研究结果基本一致,由此可见,这些因素是决定微球制备的关键因素。
3.2 工艺条件的筛选 在微球制备过程中,钙离子作为交联剂,首先与海藻酸钠分子的-COO-结合形成凝胶球,凝胶球再与壳聚糖溶液混合,海藻酸钠分子的羧基与壳聚糖分子的氨基络合,形成致密的微球[14-15]。由于海藻酸钠溶液、氯化钙溶液及壳聚糖溶液浓度决定着溶液的粘度及其电荷数,所以溶液的浓度直接影响着微球的形成,在一定范围内通过改变材料浓度可调节微球的质量特性。徐连敏等[11]研究表明,使用2%海藻酸钠溶液、0.5%氯化钙溶液和0.4%壳聚糖溶液,胶凝10 min,可制备理想微球。张华等[12]优化的制备工艺为2%海藻酸钠溶液、2%氯化钙溶液、0.1%壳聚糖溶液,海藻酸钠与药物比3∶1。岳春华等[13]筛选的最佳制备条件为2%明胶、1%壳聚糖、药料比1∶1,所得微球成球性好、粒径分布均匀。王家荣等[16]试验证实,制备微球的适宜海藻酸钠浓度为2%,氯化钙浓度为1.5%。朱敏莉等[17]研究显示,海藻酸钠溶液浓度为3%时,能制成分散的大小整齐的圆形微球。张志辰等[18]研究认为,氯化钙浓度为5%时,形成微球强度高、形状规则、大小均匀。本研究表明,1.57%海藻酸钠溶液、2.13%氯化钙溶液、0.86%壳聚糖溶液和初次凝胶时间为30.71 min时,可自备药物包封率最理想的微球。纵观各研究结果,虽然不同学者制备微球的材料浓度均有一定的差异,笔者认为微球形成的机理主要是海藻酸钠与钙的交联反应,以及海藻酸钠与壳聚糖的聚合反应,由于材料分子的电荷及数量的确定性,其各材料间的质量分数比例理论上应基本一致,差异只是制备微球的材料溶液浓度而已。
3.3 包封率的影响因素 微球的药物包封率是确定微球制备工艺优劣的重要指标之一。微球形成机理是在海藻酸钠水溶液中加入钙离子,海藻酸钠分子链的古罗糖醛酸的钠离子与钙离子发生交换反应,形成相互交联的网络结构海藻酸钙凝胶,海藻酸钠分子再与壳聚糖分子络合,最终形成具有机械强度和弹性的微球[19]。由此可见,海藻酸钠浓度、壳聚糖浓度和氯化钙浓度决定着微球的形成速度和致密度,从而影响着药物的包封率。本研究表明,在一定浓度范围内适度提高海藻酸钠溶液和氯化钙溶液的浓度,有利于提高微球的形成速度和药物包封率,但过高的材浓度又会降低微球圆滑度等物理特性,从而影响影响微球的性能。在本研究筛选工艺条件下,制备微球的药物平均包封率为94.09%,明显高于何清义等[20]制备微球的包封率61%,与张华等[12]制备鞣花酸壳聚糖-海藻酸钠微球的平均包封率97.73%,罗洋等[21]制备的硒太子参多糖纳米微球包封率92.46%,以及徐连敏等[11]制备地塞米松磷酸钠壳聚糖-海藻酸钠微球包封率96.90%相近,这说明本试验筛选工艺制备微球的质量良好。
3.4 微球制备方法的比较 依据微球制备工艺,微球的制备方法主要分为喷雾法和乳化法两类。喷雾法需要特殊的生产设备,乳化法需要使用甲醛、丙酮等有机溶剂。这些方法不仅生产工艺复杂,生产效率低,而且使用的有机溶剂还存在着一定的毒性,污染环境,并可能导致药物的失活,因此,现有的制备技术严重制约了微球药剂的产业化进程[22]。本研究综合D相乳化法,以及乳剂、微乳及胶体的制备方法[23],创新了微球的传统制备方法和剂型。该方法首先制备不溶于水的乳胶,然后再利用乳胶在水中的不溶性,将乳胶依次加入氯化钙和壳聚糖溶液中,乳化聚合制成载药凝胶微球。本研究采用搅拌乳化法制备微球,克服了滴注法和喷雾法的弊端,不需要特殊的生产设备,生产工艺简单,不使用有机溶剂,乳化及交联条件温和,制备微球整齐度好,药物包封率高,这为微球制剂的产业化生产奠定了技术基础。
3.5 结论 本试验应用海藻酸钠、壳聚糖可生物降解的无毒高分子材料,优化的硫酸小襞碱壳聚糖-海藻酸钠微球制备工艺条件为:海藻酸钠溶液浓度1.57%,氯化钙溶液浓度2.13%,壳聚糖溶液浓度0.86%,初次凝胶时间30.71 min,该工艺制备微球的平均粒径为329 nm,且呈正态分布,药物包封率为94.09%。
