沙门氏菌LAMP快速检测方法的建立
2019-09-06郭澍强贺生芳郝俊虎谈静慧杨旭光李婧
郭澍强,贺生芳,郝俊虎,谈静慧,杨旭光,李婧
(宁夏检验检疫局检验检疫综合技术中心,银川 750002)
沙门氏菌是肠杆菌科中的一个重要菌属[1],可引起鸡白痢、禽伤寒、犊牛腹泻、奶牛乳房炎等多种动物疾病[2-4]。同时,沙门氏菌也是一种重要的食源性致病菌,据统计,目前世界上85%的食物中毒是由沙门氏菌引起的[5]。目前,对沙门氏菌的传统检测方法需要较长的实验周期,试剂多且杂[6],在快速、特异检测方面具有一定的局限性。而其它各种检测方法敏感、快速,却需昂贵庞大的仪器设备、复杂繁琐的电泳过程等,进而使检测在受到条件限制的检验工作中,很难得到普遍应用[7]。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是Notomi等人在2000年发明的一种新的恒温核酸扩增技术。LAMP技术可实现在恒温条件下(一般在60~65 ℃)快速连续扩增,具有实验过程快速、简便,仪器设备简单、便携,检测结果特异性强、灵敏度高的优点。LAMP扩增结果观察方式多,凝胶成像系统观察结果、肉眼观察颜色变化及试纸条技术,也可使用实时荧光法和实时浊度法,通过实时荧光PCR仪或实时浊度仪对扩增结果进行实时观察[8]。针对我国目前严峻的食品安全问题和复杂的口岸卫生监控形势,本文开展了沙门氏菌LAMP快速检测方法的研究,以实现对沙门氏菌的快速检测。
1 材料与方法
1.1 材料
1.1.1 实验菌株及抗原 沙门氏菌实验用标准菌株购自中国工业微生物保存中心和北京路桥技术股份有限公司,试验用凝集抗原购自中国兽医药品监察所,详情见表1。

表1 菌种及抗原Tab 1 Strains and antigens
1.1.2 主要试剂和设备 上海生工细菌基因组DNA快速抽提试剂盒(产品批号:B518225),荣研生物科技(中国)有限公司2×反应缓冲液RM、Bst DNA聚合酶(产品批号:5Z006),天根2×Taq PCR Master Mix(产品批号:P4218),DL 1000 DNA Marker(产品编号:3591A),Applied Biosystems Veriti 96-Well PCR扩增仪,日本荣研LT-16alpha 恒温扩增基因检测系统,Bio-radChemiDocXRS+凝胶成像系统,北京市六一仪器厂DYY-12型电泳仪,Heal Force生物安全柜。
1.2 方法
1.2.1 引物的设计合成 按照LAMP引物设计原则,根据GenBank数据库中的沙门氏菌特异基因组序列,进行多序列比对,寻找一段高度保守区作为扩增对象,然后通过分子生物学软件LAMP Designer5设计4组引物。引物由生工生物工程(上海)股份有限公司合成,采用HPLC纯化方式。合成后的引物用超纯水稀释成100 pmol/L溶液,-20 ℃保存备用。各引物序列见表2。

表2 沙门氏菌的LAMP检测用引物Tab 2 Primers for LAMP Detection of Salmonella
1.2.2 最优引物的筛选 将生工生物工程(上海)股份有限公司合成的4组引物(invA引物组、hilA引物组、hut引物组、invE引物组)以沙门氏菌DNA为模板,吸取20 μL反应缓冲液和1μL Bst DNA聚合酶制备预混溶液,每个反应管添加20 μL预混溶液,再添加5 μL试样溶液或对照溶液,待上机,后续试验溶液配制同等,在荣研LT-16alpha恒温扩增基因检测系统上同时进行LAMP反应,并设空白对照,反应温度为65 ℃,反应时间为60 min。日本荣研LT-16alpha 恒温扩增基因检测系统有Left和Right两个反应槽,各反应槽有8个反应孔,其中Left反应槽的反应孔编号为NO.1-8,Right反应槽的反应孔编号为NO.9-16,反应结束后观察扩增曲线并读取Tt(浊度上升开始时间)值和Df(浊度上升值)值。
1.2.3 LAMP反应条件的优化
1.2.3.1 反应温度的优化 以1.2.2筛选的最优引物组作为反应温度优化的扩增引物,以沙门氏菌DNA为模板,95 ℃酶失活2 min,做6组对照,分别将反应混合物放在60 ℃、61 ℃、62 ℃、63 ℃、64 ℃、65 ℃反应条件下进行LAMP反应,并设空白对照,反应结束后观察扩增曲线并读取Tt值和Df值。
1.2.3.2 反应时间的优化 以1.2.2筛选的最优引物组作为扩增引物,以沙门氏菌DNA为模板,以1.2.3.1筛选的最优温度设为反应温度,95 ℃酶失活2 min,做4组对照,分别将反应混合物放在30 min、40 min、50 min、60 min反应条件下进行LAMP反应,并设空白对照,反应结束后观察扩增曲线并读取Tt值和Df值。
1.2.4 特异性试验 为了验证设计引物对沙门氏菌检测的特异性,用1.2.2反应体系和1.2.3优化后条件,以7株非沙门氏菌细菌和4株阳性对照沙门氏菌培养物提取的DNA、鸡白痢及禽伤寒沙门氏菌凝集抗原DNA、布氏杆菌试管凝集抗原DNA、炭疽沉淀抗原DNA为模板进行LAMP扩增检测,并设置空白对照,NO.2-8(a)依次为甲型副伤寒沙门氏菌、乙型副伤寒沙门氏菌、鼠伤寒沙门氏菌、鸡白痢及副伤寒沙门氏菌凝集抗原、肠炎沙门氏菌、金黄色葡萄球菌、痢疾志贺菌,NO.10-16(b)依次为阪崎杆菌、霍乱弧菌、肠出血行大肠杆菌O157:H7、致病性大肠埃希氏菌、布氏杆菌试管凝集抗原、单增李斯特菌、炭疽沉淀抗原,Left反应槽的NO.1和Right 反应槽的NO.9均为空白对照,反应结束后观察各反应孔有无扩增曲线的出现。
1.2.5 灵敏度试验 37 ℃培养后的菌液,用生理盐水10倍倍比稀释至10-10。取菌落数在30~300之间的平板作平板计数,用该浓度级的3个平板菌落均数推算细菌浓度:菌落均数×稀释倍数×10;经平板计数,沙门氏菌原菌液浓度为5×108CFU/mL,10倍倍比稀释后,对系列稀释的菌液进行LAMP与PCR检测,LAMP反应条件同上,PCR 反应条件为:95 ℃预变性5 min;95 ℃变性40 s,55 ℃退火30 s,72 ℃延伸30 s,进行30个循环;72 ℃延伸5 min,4 ℃保存反应产物,反应结束后,取反应产物进行凝胶电泳检测,预计PCR产物长度为194 bp,LAMP反应结束后观察各反应孔有无扩增曲线的出现。
2 结果与分析
2.1 最优引物的筛选 反应结束后,通过观察扩增曲线并读取Tt值和Df值。结果显示,invA引物组和hut引物组有扩增曲线,invA引物组Tt值最早,且Df最高(图1),说明invA引物组为最优引物组。invA引物组Tt值和Df值的具体数值见表3。

NO.1-5分别为空白对照、invE引物组、hilA引物组、hut引物组和invA引物组NO.1-5 were the blank control group, invE primer group, hilA primer group,hut primer group and invA primer group图1 筛选最优引物组扩增曲线图Fig 1 Screening the amplification curveof the optimal primer group
表3 LAMP引物筛选试验Tt值和Df值
Tab 3 Tt and Df values of LAMP primer screening test

NO扩增组Tt值/minDf值1空白对照----2invE引物组----3hilA引物组----4Hut引物组28∶0920255invA引物组25∶542097
2.2 LAMP反应条件的优化
2.2.1 反应温度的优化 反应结束后,通过观察扩增曲线并读取Tt值和Df值。结果显示,当反应温度为64 ℃时,引物组Tt值最早,且Df最高,扩增效果最好,说明最优反应温度为64 ℃。各反应组Tt值和曲Df值具体数值见表4。
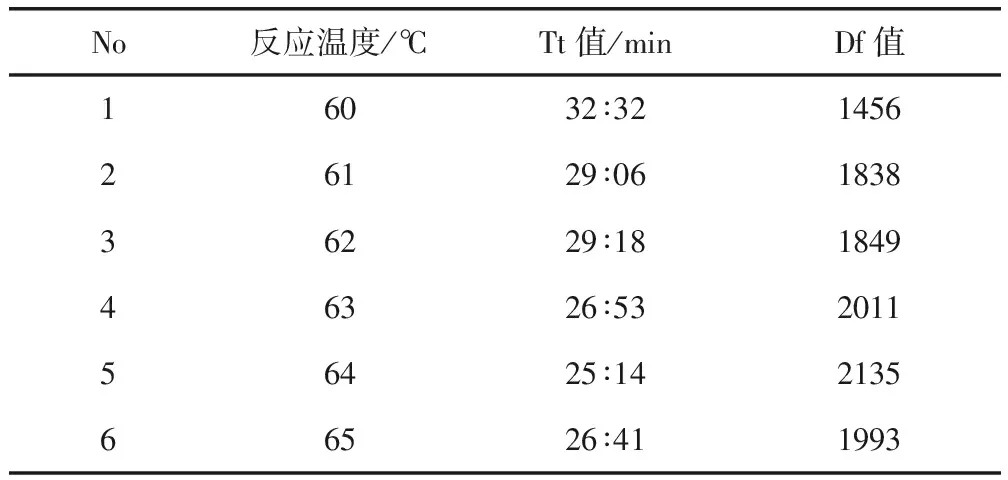
表4 LAMP反应温度优化试验的Tt值和Df值Tab 4 Tt and Df values of LAMP reaction temperatureoptimization were obtained
2.2.2 反应时间的优化 反应结束后,通过观察扩增曲线并读取Tt值和Df值。结果显示,当反应时间为40 min时,引物组Tt值最早,且Df最高,扩增效果最好,用时最短,因此,引物组invA扩增反应的最佳时间为40 min。各反应组Tt值和Df值具体数值见表5。
2.3 特异性试验 从图2可以看出,a中NO.2-6反应孔有扩增曲线,其余反应孔均无扩增曲线,说明只有以沙门氏菌纯培养物、鸡白痢及副伤寒沙门氏菌凝集抗原提取的DNA模板有扩增曲线出现,其他反应孔均无扩增曲线出现。因此,引物组invA引物组对沙门氏菌具有特异性,可用于对肠道沙门氏菌6个亚种的特异性检测。

表5 LAMP反应时间优化试验的Tt值和Df值Tab 5 Tt and Df values in optimal LAMPreaction time were obtained

NO.2-8(a)依次为甲型副伤寒沙门氏菌、乙型副伤寒沙门氏菌、鼠伤寒沙门氏菌、鸡白痢及副伤寒沙门氏菌凝集抗原、肠炎沙门氏菌、金黄色葡萄球菌、痢疾志贺菌;NO.10-16(b)依次为阪崎杆菌、霍乱弧菌、肠出血行大肠杆菌O157:H7、致病性大肠埃希氏菌、布氏杆菌试管凝集抗原、单增李斯特菌、炭疽沉淀抗原;NO.1和NO.9均为空白对照NO.2-8 (a) were Paratyphoid salmonella a, Paratyphoid salmonella b, Paratyphoid salmonella murine, Pullorum gallinae andParatyphoid salmonella agglutination antigen, Salmonella enteritis, Staphylococcus aureus, Shigella dysentery, respectively; NO.10-16 (b) were successively Enterobacter sakazakii,Vibrio cholerae, E.coli O157:H7, pathogenic E.coli, Brucella in vitroagglutination antigen, Listeria monocytogenes,and Anthrax precipitation antigen,NO.1 and NO.9 were blank controls图2 特异性实验的扩增曲线图Fig 2 Amplification curves of specific experiments
2.4 灵敏度试验 LAMP检测扩增曲线结果见表6,LAPM灵敏度试验检测结果见图3,PCR检测结果见图4。结果表明,PCR法检测限为 102CFU/mL,LAMP检测限为10,其检测灵敏度是PCR方法的10倍,说明LAMP检测方法的灵敏度优于PCR法。

表6 灵敏度试验的LAMP检测结果Tab 6 LAMP test results of sensitivity test

图3 LAPM灵敏度试验检测结果电泳图Fig 3 Electrophoresis diagram of theresults of LAPM sensitivity test

1-8分别为107~101CFU/mL菌液和空白对照图4 灵敏度试验PCR检测电泳图Fig 4 Electrophoresis was detected by PCR sensitivity test
3 讨论与结论
沙门氏菌病为人兽共患病,沙门氏菌即可引起多种动物感染,同时作为一种重要的食源性致病菌也可引起人类多种疾病。沙门氏菌在人类和动物上引起的疾病主要临床症状表现为败血症和肠炎引起的腹泻,其临床表现与其它细菌、病毒引起的疾病症状非常相似,难以鉴别。随着人们对食品安全问题的重视程度日渐增高和基层兽医、一线口岸对快速检测、快速通关的要求,传统检测沙门氏菌耗时长、过程复杂,难以满足快速检测的要求。所以,有必要建立一种能快速、准确、简便、费用低廉的检测沙门氏菌的方法。而LAMP技术在特异性、灵敏度、反应时间、反应设备等方面占据明显优势,已被应用于细菌、病毒等的检测。LAMP技术优点突出,不需要模板热变性、长时间温度循环、繁琐的电泳等过程,效率高,观察结果方便多样,非常适合基层和口岸一线工作人员大规模样品的快速检测。
相关研究表明,沙门氏菌invA基因具有属特异性,常被用作检测沙门氏菌的靶向基因[9]。本实验通过对沙门氏菌invA特异性基因设计内外侧4条引物,通过对反应条件的优化,建立了肠道沙门氏菌6个亚种的LAMP快速检测方法,方法灵敏度可达到101CFU/mL(细菌浓度),其灵敏度比普通PCR高10倍且反应结果易于观察。LAMP扩增产物进行凝胶电泳分析容易发生气溶胶污染,添加指示剂增加试验复杂程度,且观察容易出现误判。本试验利用LAMP等温实时浊度仪,通过测定扩增基因时出现的副产物焦磷酸镁的混浊度来判断是否存在目标基因。本方法通过仪器读取浊度吸光值,观察有无扩增曲线直接定性判定沙门氏菌检测阴阳性,方法操作方便快捷,灵敏度高,特异性强,恒温条件下实现快速检测,同时也避免了气溶胶对实验室的污染,特别适用于基层兽医、食品及口岸一线部门检测使用,对动物沙门氏菌及食品安全进行快速筛查具有重要意义。
