重组杆状病毒表达猪圆环病毒2型Cap蛋白的优化及蛋白免疫原性研究
2019-09-06李天增潘晓梅张伟师小潇徐龙飞贺笋
李天增,潘晓梅,张伟,师小潇,徐龙飞,贺笋
(天康生物股份有限公司,乌鲁木齐830032)
猪圆环病毒病 (Porcine circovirus disease,PCVD) 是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)引起的猪传染性疾病,自1997年Clark等首次分离PCV2以来,该病已给全世界养猪业造成了巨大的经济损失。目前,PCV2在我国猪群中普遍存在,能够引起免疫抑制、混合感染和继发感染,严重危害养猪业的发展[1-3]。
PCV2属于圆环病毒科、圆环病毒属,病毒无囊膜,病毒粒子直径约为17 nm,基因组为单链环状DNA,大小为l767 bp或1768 bp,有11个阅读框,其中ORF1和ORF2是最主要的阅读框。ORF2大小为702 bp,编码233个氨基酸,是病毒的主要结构蛋白(核衣壳蛋白)[4],具有良好的免疫原性,是构建重组疫苗和检测的首选基因,目前已在不同系统中得到有效表达[5-7]。因此,本试验利用昆虫细胞-杆状病毒表达系统对PCV2-rCap蛋白优化表达进行了研究,以期为今后开发PCV2亚单位疫苗奠定基础。
1 材 料
1.1 重组病毒株 重组病毒株vBac-SP-PCV2由天康生物股份有限公司构建和保存。High-five 细胞购自Invitrogen公司。
1.2 试剂 Ni-NTA Purification System为Invitrogen公司产品;蛋白预染Marker购自Thermo Fisher 公司;辣根过氧化物酶标记兔抗猪二抗购自Sigma公司;猪源PCV2多克隆抗体由天康生物股份有限公司制备。TEMED购白北京鼎国生物技术有限公司;咪唑为SIGMA公司产品,其他试剂为进口或国产分析纯试剂。
2 方 法
2.1 vBac-SP-PCV2表达条件的优化
2.1.1 High five细胞浓度的确定 用SFX培养基将High five细胞浓度调整为1.0×106/mL、1.5×106/mL、2.0×106/mL、3.0×106/mL,每瓶总量100 mL,分别加入2 MOI病毒感染量重组杆状病毒,细胞置于26~28 ℃培养箱中振荡培养,分别于接毒后24 h、48 h、72 h、96 h、120 h、144 h、168 h、192 h、216 h、240 h定时取样,每次收集5 mL细胞混悬液。
2.1.2 病毒感染量和蛋白表达时间的确定 用SFX培养基将High five细胞浓度调整为2×106/mL,总量100 mL,分别加入0.25、0.5、1、1.5、2、3 MOI病毒感染量重组杆状病毒,细胞置于26~28 ℃培养箱中振荡培养,分别于接毒后24 h、48 h、72 h、96 h、120 h、144 h、168 h、192 h、216 h、240 h定时取样,每次收集5 mL细胞混悬液。
2.2 表达产物的分析 将以上收取样品于4 ℃以10000 r/min离心10 min,收集表达后细胞沉淀,加入裂解液,于冰浴中进行超声破碎10 min(功率200 W,1/2探头,破碎30 s,间歇30 s),超声结束后于4 ℃以12000 r/min离心10 min,分别取上清进行Western blotting分析。
2.3 重组蛋白的纯化和浓缩 将大批表达PCV2-rCap蛋白的细胞液以10000 r/min离心10 min收集细胞沉淀,超声破碎,离心收集上清,用His Bind Purification Fits进行纯化。将细胞裂解物10~15 mL加入准备好的含有8 mL填料的纯化柱中。4 ℃轻柔振荡结合过夜,以保持细胞裂解产物能始终混悬填料。静止,让Ni-NTA琼脂糖填料靠重力的作用自己沉降完全澄清。放出上清液,上清液取样。将30 mL PBS加入纯化柱中,不断轻柔换向扣敲纯化柱混悬Ni-NTA琼脂糖。静止,让Ni-NTA琼脂糖填料靠重力的作用自己沉降完全澄清。放出上清液,PBS洗脱2次。上清液取样存放于4 ℃进行SDS-PAGE分析。固定好柱子,使用5 mL的洗脱液洗脱蛋白。收集1 mL的洗脱液用于SDS-PAGE分析, BCA法检测蛋白浓度。
2.4 Cap蛋白纯化浓缩产物的SDS-PAGE和Western blotting分析 取蛋白样品60 μL与20 μL 4×上样buffer混合,进行SDS-PAGE及Western blotting分析。然后将SDS-PAGE胶上的蛋白条带转移到PVDF膜上,置含5%的脱脂奶粉的PBST中,4 ℃封闭30 min,清洗,加入稀释1∶500倍一抗猪源PCV2多克隆抗体,4℃缓慢振荡过夜;清洗,加入稀释1∶5000倍含辣根过氧化物酶标记的兔抗猪的二抗,室温作用1 h,清洗,于暗室内进行显色。
2.5 纯化蛋白的电镜观察 将纯化浓缩蛋白吸取3 μL铺在经特殊处理的喷碳的铜网上,1 min后用滤纸吸干,用5%磷钨酸pH7.0负染1 min,干燥后用电子显微镜进行观察蛋白分子形状。
2.6 纯化的PCV2-rCap免疫原性试验 纯化蛋白配制疫苗,免疫豚鼠,以相同剂量相同方式分别进行二次免疫。免疫后每周采血,离心取血清,采用IFA检测PCV2 Cap蛋白抗体效价。56 ℃水浴槽30 min。在PCV2抗原盘盖子上写好标示。将所有孔加入75 μL 3% PBA。在第1排每孔加入25 μL血清样品 (第1排血清稀释倍数为4倍)。之后为连续4倍稀释血清。第12排为阴性空白对照孔(PCV2阴性血清样本)。置于4 ℃感作12 h。去除一抗后,每孔加入200 μL的PBST,洗板4次。将每孔的PBST倒干后,每孔加入以1% PBA 稀释二抗Goat anti mouse FITC 50 μL,置25 ℃感作4 h。去除二抗后,每孔加入200 μL的PBST,洗板 4次。将每孔的PBST倒干后,再加入50 μL PBST,并于倒立荧光显微镜下判读荧光细胞。
3 结果与分析
3.1 最佳蛋白表达条件的确定
3.1.1 最佳High five细胞浓度的确定 重组PCV2-rCap蛋白表达试验,按2MOI接种病毒时,当细胞密度不低于2.0×106/mL,培养时间为168 h,蛋白含量最高。
3.1.2 最佳病毒感染量和蛋白表达时间的确定 以2.0×106/mL High five细胞浓度,不同病毒感染量、蛋白表达时间进行蛋白表达条件优化,根据不同的接毒量和表达时间表达的重组PCV2-rCap蛋白(细胞沉淀超声后上清)Western blotting AlphaEaseFC软件灰光度值分析结果,筛选出表达量相对较高的0.25 MOI(168 h和192 h)、0.5 MOI(192 h和216 h)、1 MOI(168 h)、1.5 MOI(168 h)、2 MOI(144 h)、3 MOI(168 h)8个杆状病毒表达的重组PCV2-rCap蛋白,进行下一步的最佳接毒量和表达时间的筛选试验。由图1 AlphaEaseFC软件灰光度值分析结果:确定2.0×106/mL High five细胞浓度、1.5 MOI病毒感染量、蛋白表达时间168 h为重组PCV2-rCap蛋白表达的最佳条件。
3.2 重组蛋白的纯化和浓缩 将细胞沉淀超声破碎离心收集上清用His Bind过柱纯化,收集洗脱液进行Western blotting分析,图2结果表明,在纯化浓缩液中蛋白条带大小与重组蛋白吻合,说明重组蛋白已经得到纯化,且纯度较高。
3.3 纯化重组蛋白用于Western blotting中蛋白质定量分析 BCA法检测纯化蛋白浓度约1 mg/mL。Western blotting中蛋白质定量分析,稀释的标准蛋白采用软件线性拟合曲线分析R2=0.99,在可信度范围(R2≥0.95)之内,可用于蛋白定量分析。
3.4 纯化PCV2-rCap蛋白的电镜观察 PCV2b ORF2基因编码蛋白经昆虫细胞表达系统表达后具有正常的结构和功能,能够形成病毒样颗粒,大小均匀,直径为20 nm左右(图3)。
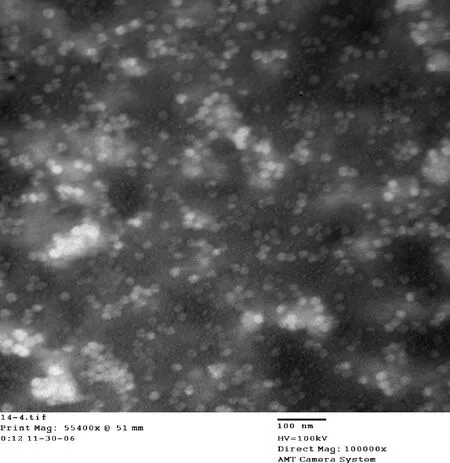
图3 纯化浓缩重组蛋白的病毒样颗粒图(100nm)Fig 3 Virus-like particle diagram of purifiedrecombinant protein concentration (100nm)
3.5 纯化的PCV2-rCap免疫原性试验 纯化蛋白配制疫苗,免疫豚鼠,免疫7日后即有抗体产生,免疫21日后所有豚鼠抗体均转阳,免疫28日抗体达到较高水平(图4、图5),表明蛋白的免疫原性好,能高效诱导机体产生良好的体液免疫。
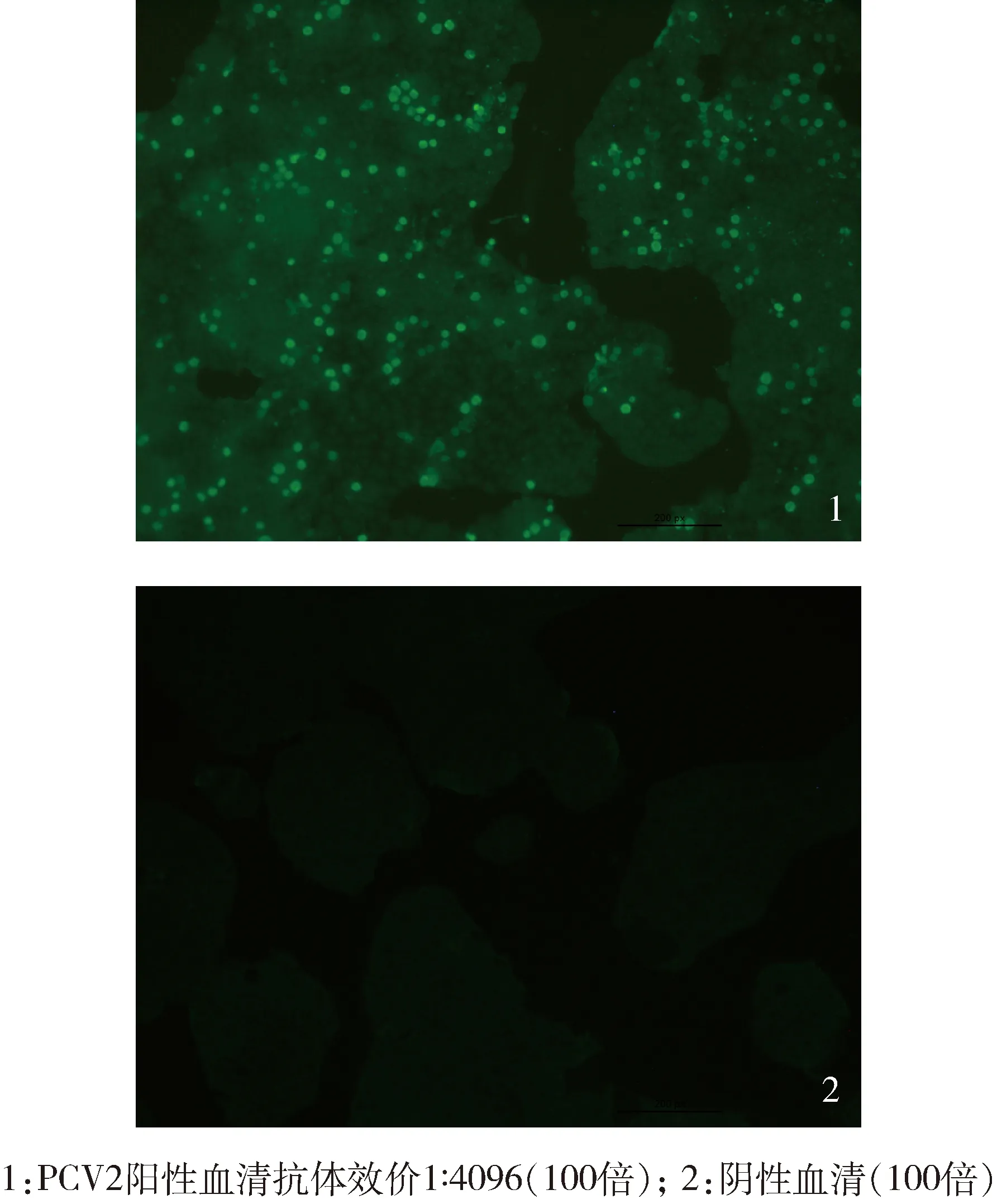
图4 IFA检测PCV2阳性血清抗体结果(彩图)Fig 4 IFA detection of PCV2 positive serumresults (color map)
4 讨论与结论
杆状病毒表达系统为高效表达外源蛋白表达体系,目的蛋白在昆虫细胞内能够正确折叠、二硫键的搭配及寡聚物的形成,表达产物在结构及功能上接近天然蛋白[8]。病毒感染复数、病毒感染时间、细胞密度等是影响杆状病毒表达系统为高效表达的关键因素[9-10],因此本研究对影响杆状病毒表达系统为高效表达的关键因素进行探讨研究优化。结果显示,当细胞密度不低于2.0×106/mL时,随着病毒感染复数增加到一个临界值1.5MOI后,蛋白表达量不再增加;随着病毒感染时间延长,蛋白表达量不断增加,168 h为峰值,192 h蛋白表达量略有下降,进一步说明病毒感染复数和病毒感染时间是影响蛋白表达量的重要因素。
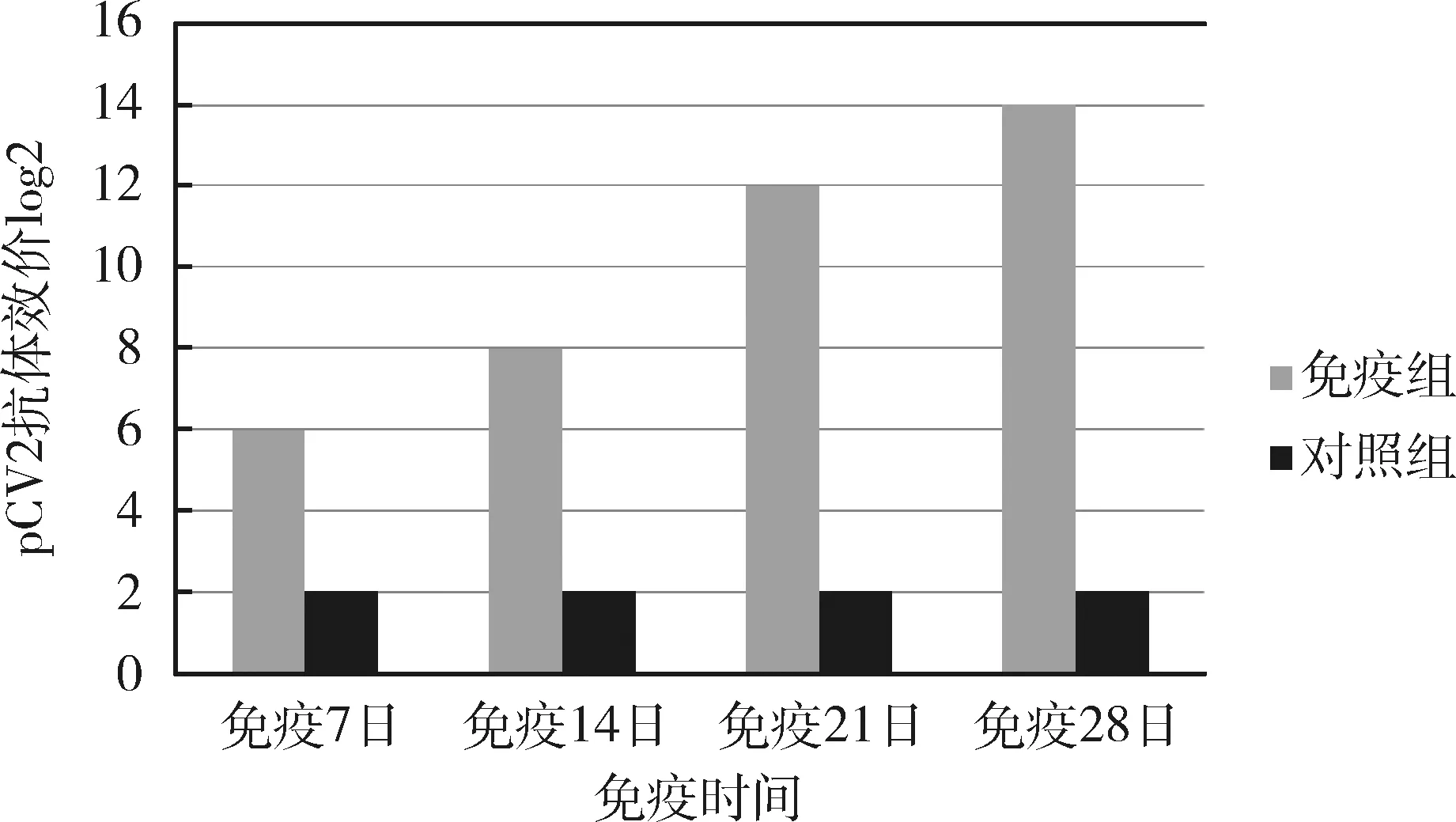
图5 免疫豚鼠PCV2抗体结果分析图Fig 5 Results of immune guinea pigPCV2 antibody analysis
本研究利用昆虫细胞杆状病毒表达系统表达了Cap蛋白,电镜观察显示形成了病毒样颗粒,同时在重组蛋白的C末端设计了His.tag序列,外源基因与组氨酸标签融合表达,为重组蛋白的纯化创造了条件[11-12],提高了纯化效率,同时不会因为插入组氨酸标签影响外源基因蛋白的活性,为进一步研发猪圆环病毒的亚单位疫苗奠定了基础。
蛋白百分比定量方法定量是基于普通的蛋白电泳,目的蛋白处有可能有降解的蛋白沉降此处,会导致蛋白定量偏高。而Western blotting分析是指将蛋白质样品经聚丙烯酰胺凝胶电泳分离,然后转移至到固相载体(例如硝酸纤维素薄膜)上,然后用抗体通过免疫学反应检测目的蛋白,是抗原抗体的特异性反应[13],因此本试验的定量更为准确。
