尿激酶与rt-PA对急性心肌梗死大鼠血管新生和心肌炎症的影响
2019-09-05刘海峰刘红伟马宝新张文水
刘海峰,刘红伟,马宝新,张文水
(山东省东营市广饶县人民医院心血管内科,东营 257300;*通讯作者,E-mail:W08Lieri@163.com)
急性心肌梗死(acute myocardial infarction,AMI)是由冠状动脉急性、持续性缺氧缺血导致的心肌坏死[1]。AMI是造成心血管相关疾病的重要诱因之一,是全球人口死亡率和发病率的主要原因,对人们的生活质量和水平具有重大影响[2]。过劳、暴饮暴食、便秘、吸烟等均可诱发AMI。在AMI死亡的人中,小部分患者在出现症状后1 h内死亡[3]。随着医疗水平的不断提升,AMI的治疗获得了较大的进步[4]。目前AMI的常用治疗方式之一为溶栓治疗,如溶栓药物中重组组织型纤溶酶原激活物(recombinant tissue-type plasminogen activator,rt-PA)、尿激酶是两种常见的AMI溶栓治疗药物,但其治疗机制尚未完全明确[5,6]。
血管新生是指从已存在的毛细血管或毛细血管后静脉形成新的血管,是一个涉及多种细胞因子的繁杂过程[7]。成纤维细胞生长因子、血管内皮生长因子等均可增加血管的新生。增加缺血部分血管的新生已逐渐成为诊治血管闭塞性相关疾病的关键方法,且在动物实验研究、临床试验中获得较好的疗效[8]。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)是促进血管新生的两个关键因子[9]。近年来也有研究发现,AMI发病机制不仅仅与血管新生有关,炎症反应也参与AMI后心室重塑,是AMI后引发心脏损害的关键原因[10]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白介素-1β(interleukin-1β,IL-1β)、IL-6等是涉及机体炎症反应的重要细胞因子。已有研究发现,AMI中TNF-α,IL-1β及IL-6等炎症因子高表达[11,12]。同时已有研究表明,给予AMI治疗后均可增加血管新生及降低心肌炎症的发生[13]。但是rt-PA和尿激酶对AMI患者血管新生和心肌炎症的疗效是否具有差异,仍有待进一步研究。基于溶栓药物rt-PA及尿激酶均可治疗AMI,本研究将探讨rt-PA及尿激酶溶栓治疗AMI的可能机制是否与增加血管新生及降低心肌炎症的发生有关,且两种药物的治疗有无明显差异。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂 rt-PA(昂德生物药业有限公司)、尿激酶(丽珠集团丽珠制药厂)、戊巴比妥钠(上海信裕生物科技有限公司)、一抗和二抗稀释液(北京博奥森生物技术有限公司)。
1.1.2 主要仪器 定速抽血泵(LDB-H型电子蠕动泵)、显影成像仪器(上海培清科技有限公司)。
1.2 实验动物及分组
8周大小的雄性SD大鼠60只(SPF),由山东省药学科学院提供,许可证号SYXK(鲁)20180031。体质量为(220±20)g,购于南京君科生物工程有限公司。随机将大鼠分组为:假手术组,AMI组,AMI+尿激酶组,AMI+rt-PA组,尿激酶组,rt-PA组,每组10只大鼠。
1.3 急性心肌梗死大鼠模型的建立
所有大鼠适应新环境1周后,采用左冠状动脉结扎法建立急性心肌梗死(AMI)大鼠模型。具体方法步骤:用2%戊巴比妥钠0.3 ml/100 g腹腔注射麻醉大鼠,行气管插管,在第3-4肋间切口打开胸腔,切开心包膜,完全暴露冠状动脉,在动脉圆锥和左心耳下1 mm处分离并结扎左侧冠状动脉后,逐步关闭并缝合大鼠胸腔。假手术组大鼠只穿线不结扎,其余操作与AMI模型大鼠一致。造模后分别经尾静脉注射rt-PA 10 mg/kg或尿激酶40 000 U/kg,注射速度为2 ml/min。
1.4 放射性微球法检测各组大鼠局部心肌血流量
最后一次给予尿激酶和rt-PA治疗24 h后,立即采用99mTc标记的放射性微球测定各组大鼠局部心肌血流量的情况。大鼠颈动脉插管,连接颈动脉插管与定速抽血泵(LDB-H型电子蠕动泵)。打开胸腔,暴露左心耳,用注射器注入99mTc标记的放射性微球0.15 ml(含微球3×105)。从注射微球前10 s开始,以1 ml/min的速度抽血2 min。收集血液2 ml,置于4根放射计数管中。切下心脏,切除心房,秤取其重量。将抽出的血液和组织送到同位素室观察放射性数。根据公式Qm=(γm×Qr)/γr,计算局部心肌血流量Qm。γm:每克心肌组织,Qr:定速泵抽血速率(1 ml/min),γr:血样的γ计数。
1.5 Western blot检测bFGF、VEGF、IL-1β、IL-6和TNF-α蛋白表达水平
测量心肌血流量后,腹腔注射2%戊巴比妥钠(0.3 ml/100 g)麻醉大鼠,迅速打开胸腔,取心肌组织,用生理盐水冲洗表面血液,吸干水分并秤取组织质量。按照BCA蛋白定量试剂盒的说明书测量标准曲线及计算蛋白总浓度。按照目的蛋白分子量配置分离胶以及浓缩胶,并加入之前定量的蛋白体积,电泳80-120 V。电泳后进行湿转,然后封闭2 h,用一抗稀释液(anti-VEGF、anti-bFGF、anti-IL-1β、anti-IL-6、anti-TNF-α、anti-β-actin,稀释比例均为1 ∶1 000)于4 ℃摇床孵育过夜。用TBST于摇床上洗膜3次,每次10 min。二抗稀释液(1 ∶5 000)室温孵育,孵育2 h后立即同样洗膜3次,每次10 min。用成像仪器显影保存图片,使用软件计算灰度值。
1.6 统计学分析
本实验数据均采用SPSS18.0统计学软件,并以平均数±标准差表示,用Pearson相关性方法进行相关性分析,组间比较采用t检验,多组间差异进行单因素方差分析。以P<0.05视为差异具有统计学意义。
2 结果
2.1 尿激酶和rt-PA对AMI大鼠bFGF和VEGF蛋白表达水平的影响
采用Western blot方法检测各组大鼠与血管新生相关的两个关键因子:bFGF和VEGF。与假手术组相比,AMI大鼠bFGF(P=0.009 6)和VEGF(P=0.005 8)的蛋白表达水平均明显降低,而给予尿激酶和rt-PA治疗均能显著升高AMI大鼠bFGF(P=0.005 2,P=0.003 4)和VEGF(P=0.005 2,P=0.024 5)的蛋白表达水平,且两组VEGF蛋白表达有显著性差异(P=0.032,见图1)。

与假手术组相比,**P<0.01;与AMI组相比,#P<0.05,##P<0.01;与AMI+尿激酶组相比,△P<0.05图1 尿激酶和rt-PA分别对AMI大鼠bFGF和VEGF的蛋白表达水平的影响Figure 1 The effects of urokinase and rt-PA on the expression of bFGF and VEGF in rats with AMI
2.2 尿激酶和rt-PA对AMI大鼠局部心肌血流量的影响
为了进一步明确尿激酶和rt-PA分别对AMI大鼠局部心肌血流量的影响,采用放射性微球法观察各组大鼠局部心肌血流量的情况。与假手术组相比,AMI大鼠的局部心肌血流量明显减少(P=0.008 7),而给予尿激酶和rt-PA能明显增加AMI大鼠的局部心肌血流量(P=0.006 4,P=0.001),且rt-PA治疗后AMI大鼠的局部心肌血流量明显高于尿激酶治疗后(P=0.045,见图2)。
2.3 尿激酶和rt-PA对AMI大鼠心肌炎症的影响
为了明确尿激酶和rt-PA分别对AMI大鼠心肌炎症的影响,采用Western blot检测各组大鼠相关炎症因子:IL-1β、IL-6和TNF-α的表达情况。与假手术组相比,AMI大鼠的IL-1β(P=0.007 3)、IL-6(P=0.001)和TNF-α(P=0.001)蛋白表达水平明显升高,而给予尿激酶和rt-PA能显著降低AMI大鼠的IL-1β(P=0.007 7,P=0.001)、IL-6(P=0.001,P=0.001)和TNF-α(P=0.004 5,P=0.001)蛋白表达水平,且rt-PA治疗后IL-1β(P=0.035)和TNF-α(P=0.036)表达比尿激酶更低(见图3)。

与假手术组相比,**P<0.01;与AMI组相比,##P<0.01,###P<0.001;与AMI+尿激酶组相比,△P<0.05图2 尿激酶和rt-PA对AMI大鼠局部心肌血流量的影响Figure 2 Effects of urokinase and rt-PA on regional myocardial blood flow in AMI rats
2.4 VEGF、IL-1β与局部心肌血流量的相关性
相关性分析结果表明,尿激酶和rt-PA均可改善AMI大鼠血管新生以及心肌炎症,最后采用Pearson相关性方法分析VEGF和IL-1β分别与局部心肌血流量的关系。VEGF与局部心肌血流量呈正相关,相关系数r=0.894(P<0.001),而IL-1β与局部心肌血流量呈负相关(r=-0.804,P<0.001,见图4)。
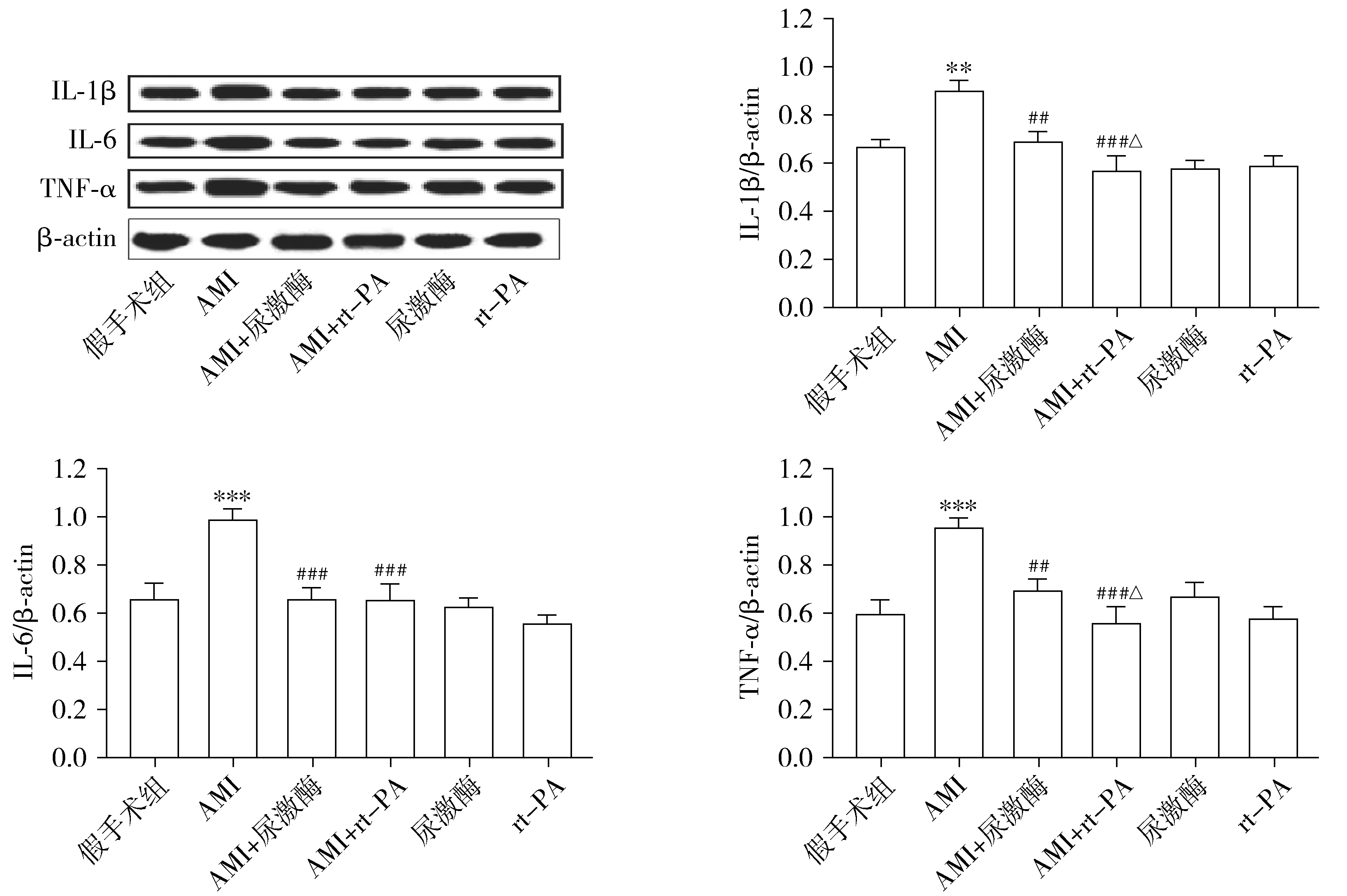
与假手术组相比,**P<0.01,***P<0.001;与AMI组相比,##P<0.01,###P<0.001;与AMI+尿激酶组相比,△P<0.05图3 尿激酶和rt-PA对AMI大鼠心肌炎症的影响Figure 3 Effects of urokinase and rt-PA on myocardial inflammation in rats with AMI

图4 VEGF、IL-1β分别与局部心肌血流量的相关性分析Figure 4 Correlation analysis of VEGF and IL-1β with regional myocardial blood flow in AMI rats
3 讨论
AMI是冠状动脉疾病最严重的表现,且是全球发病和死亡的主要原因之一[14]。AMI主要的诱因是冠状动脉粥样斑块破裂,血小板在破裂的斑块周围积聚,造成血栓,甚至诱使心肌缺血坏死等[15]。由于AMI发病较为突然,且死亡率逐年增加,因此需及时采用高效的治疗手段。目前AMI治疗手段主要以静脉溶栓治疗为主,即rt-PA和尿激酶两种溶栓药物[16],但两种药物的治疗机制仍未清晰。
血管新生指在已存在的血管中形成新血管的生物学过程。血管新生的过程主要受其刺激与抑制因子之间的相互作用以及新生成的血管网血流量的调控[17]。已有研究表明,bFGF、VEGF、胰岛素样生长因子、上皮生长因子等均是促进血管新生作用的生长因子,其bFGF、VEGF与促进血管新生的关系最密切[18]。bFGF是一种神经营养因子,能够促进成纤维细胞生长,可诱导血管新生,促进创伤愈合与组织修复。VEGF作为内皮生长因子,可诱导干细胞分化为心肌,也可在体内促进血管新生的发生。
炎症细胞因子在调控心脏结构和功能中发挥重要作用。炎症反应是临床常见的一个病理过程,也参与了急性心肌梗死的发病过程。研究表明,促炎因子TNF-α、IL-1β、IL-6等炎症因子在正常心肌中有稳定的表达,但在AMI中可迅速激发心肌炎症的发生,出现TNF-α、IL-1β和IL-6高水平[19]。同样在本实验中,AMI大鼠的血管新生相关因子bFGF、VEGF为低表达,而炎症因子TNF-α、IL-1β和IL-6为高表达,且AMI大鼠的局部心肌血流量明显降低。
目前临床常用治疗AMI的手段主要包括药物保守治疗、手术介入和静脉溶栓等,其中溶栓治疗操作较简单方便、疗效较好。尿激酶属于第一代溶栓类药物,rt-PA是一类安全高效,副作用较少的溶栓药物。本实验结果同样显示AMI大鼠的血管新生功能明显减弱和心肌炎症明显增加,而AMI大鼠给予尿激酶和rt-PA治疗后均能明显增加AMI大鼠bFGF、VEGF的表达,且降低TNF-α、IL-1β和IL-6的蛋白表达,增加局部心肌血流量,表明尿激酶和rt-PA可明显改善血管新生和心肌炎症,且rt-PA疗效更高。而为了进一步分析AMI发病机制中的心肌炎症与局部心肌血流量的关系,本文采用了Pearson分析,结果显示VEGF和IL-1β分别与局部心肌血流量呈正相关和负相关,表明AMI心肌炎症与局部心肌血流量密切相关,可作为临床检测AMI患者的评判指标,同时为尿激酶和rt-PA的AMI治疗提供疗效指标。
本研究提示,尿激酶和rt-PA治疗AMI的机制可能与促进血管新生以及抗炎作用有关。此研究进一步明确了尿激酶和rt-PA可明显改善AMI的血管新生以及心肌炎症,将为防治AMI提供新的研究思路。
