卵巢癌组织中CXCR4表达的临床意义及与β-catenin的相关性分析
2019-09-05程子芸
王 佳,程子芸,赵 娟,杨 婷,李 臻
(西安交通大学第一附属医院妇产科,西安 710061;*通讯作者,E-mail:wangjia-80@163.com)
卵巢癌在妇科肿瘤中死亡率位居第一,由于起病隐袭,大部分卵巢癌患者确诊时已发生转移,发生转移的卵巢癌患者5年生存率不足30%[1]。细胞转移是一个多因素过程,其中趋化因子及其受体在肿瘤转移和侵袭中具有重要作用。目前已发现50多个趋化因子及20多个趋化因子受体,其中只有趋化因子受体4(chemokine reptor 4,CXCR4)在卵巢癌细胞上表达[2]。CXCR4是一类与蛋白耦联的具有7个疏水跨膜结构的受体,其主要表达细胞为嗜中性粒细胞、单核巨噬细胞、树突状细胞等[3]。CXCR4是组织表达最为广泛的细胞因子受体之一,在多种恶性肿瘤细胞的生长和转移中起重要的作用[4],但CXCR4在肿瘤细胞转移的具体机制尚不明了。Wnt/β-catenin通路在细胞增殖、迁移等方面起重要作用[5],该通路主要组分β-catenin在异常情况下胞质大量蓄积并入核与核内T细胞转录因子(TCF)结合,增加下游靶基因的转录合成。在胚胎发育研究中发现,CXCR4通过调控Wnt/β-catenin影响多器官发育,我们推测在卵巢癌的发生发展过程中,CXCR4也可能通过Wnt/β-catenin进行调控。为此,本课题拟首先检测CXCR4在卵巢癌组织和细胞中的表达以及与临床特征之间的关系,同时研究β-catenin在卵巢癌的表达并分析其与CXCR4在卵巢癌中表达的相关性。
1 材料与方法
1.1 材料
1.1.1 组织标本 均来自华中科技大学附属协和医院妇产科,其中包括7例正常卵巢上皮组织及49例恶性卵巢上皮性肿瘤。恶性肿瘤中包括31例浆液性囊腺癌,12例黏液性囊腺癌,2例内膜样腺癌及4例透明细胞癌。患者年龄18-66岁(中位年龄45岁),所有病例均为初次探查手术,且术前未接受放化疗及其他特殊处理。所有标本来自术中切除,每个肿瘤组织一分为二,一份立即放于液氮中冰冻,另一份用10%福尔马林固定后石蜡包埋。正常的卵巢上皮组织来自于子宫肌瘤或子宫内膜异位症行子宫附件全切的病人。组织标本的收集获得协和医院伦理委员会批准。
1.1.2 细胞株 卵巢癌细胞株CAOV3、SKOV3、A2780均由华中科技大学附属协和医院妇产科实验室保存。
1.1.3 主要试剂 鼠抗人CXCR4单克隆抗体购自英国Abcam公司,兔抗人β-catenin单克隆抗体购自武汉博士德生物有限公司,鼠抗人β-actin单克隆抗体购自武汉博士德生物有限公司,免疫组化SABC试剂盒购自武汉博士德生物有限公司,DAB酶底物显色试剂盒购自武汉博士德生物有限公司,DMEM培养基购自美国GIBCO公司,胎牛血清购自美国GIBCO公司,Trizol RNA提取试剂购自美国Invitrogen公司,RIPA细胞裂解液购自美国Amresco公司。
1.2 实验方法
1.2.1 免疫组织化学方法检测卵巢癌CXCR4、β-catenin的表达 用免疫组织化学试剂盒对7例正常卵巢上皮组织及49例恶性卵巢上皮性肿瘤组织CXCR4和β-catenin进行常规染色,小鼠CXCR4单克隆抗体(1 ∶100)和兔子多克隆β-catenin抗体(1 ∶100)孵化过夜。阳性细胞定义为细胞膜、细胞质或细胞核内见棕黄色颗粒,染色强度高于非特异性背景。评价蛋白的表达、染色强度评分为0分(负)、1分(弱)、2分(中)或3分(强)。染色范围为0分(0%),1分(1%-10%),2分(11%-50%),3分(51%-80%)和4分(>81%),百分比为阳性染色面积占肿瘤总面积的百分比。最后由强度和程度相乘得到染色分级。用PBS代替一抗做空白对照,由两位医师分别双盲阅片。
1.2.2 细胞培养 卵巢癌细胞株SKOV3常规培养在含100 ml/L小牛血清的DMEM培养基中,培养条件为37 ℃,5%CO2饱和湿度,待细胞长满瓶底时,2.5 g/L胰蛋白酶消化传代。当细胞达到对数生长期时,进行实验。
1.2.3 real-time PCR反应检测CXCR4 mRNA在正常卵巢上皮组织、卵巢癌组织及卵巢癌细胞株中的表达 Trizol法提取细胞总RNA,测定RNA浓度与纯度,按反转录试剂盒说明书将mRNA反转录为cDNA。在ABI7300荧光定量PCR仪上进行检测。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环,用2-ΔΔCt法[6]计算基因相对表达水平。实验重复3次。
1.2.4 Western blot法检测CXCR4蛋白的表达 裂解提取细胞总蛋白,采用BCA蛋白质定量试剂盒测定总蛋白浓度,煮沸5 min使蛋白变性,12%的SDS-PAGE电泳分离后,湿转到硝酸纤维素膜上,将膜置于50 g/L脱脂奶粉中室温封闭1 h,再以含5%的脱脂奶粉的TBST稀释的一抗(CXCR4,1 ∶100;β-actin,1 ∶500)封闭NC膜,4 ℃过夜。TBST洗膜8 min×5次,再与HRP标记二抗(anti-mouse 1 ∶2 000)室温孵育2 h,TBST洗膜后,以ECL显色,使用Image-Lab软件进行成像扫描记录。蛋白表达以光密度表示,以目的蛋白/β-actin比值来表示蛋白的相对表达量,Image-Lab软件对结果进行分析并拍照。
1.3 统计方法
全部数据经SPSS 13.0统计软件进行统计分析,正态分布的计量资料以均数±标准差表示。多组间比较采用单因素方差分析(ANOVA),两组间比较采用t检验,非正态分布数据组间差异分析采用非参数检验,相关性分析采用Pearson分析法。以α<0.05为检验水准或P<0.05为差异具有统计学意义。
2 结果
2.1 CXCR4与β-catenin在卵巢癌中的表达
通过免疫组织化学方法检测了CXCR4和β-catenin在7例正常卵巢组织及及49例卵巢癌组织中的表达。在检测的56例组织标本中,正常的卵巢上皮组织未见CXCR4和β-catenin的表达。在卵巢癌组织中,91.8%(45/49)的卵巢癌组织可见CXCR4胞质表达,卵巢癌组织中β-catenin胞质胞核表达率为85.7%(42/49)(见图1)。同时对CXCR4和β-catenin的表达进行了相关性分析,Pearson分析结果提示,CXCR4和β-catenin的表达具有显著相关性(r=0.628,P<0.001,见图2)。

A.正常卵巢组织中未见CXCR4表达;B.卵巢癌组织中可见胞质内CXCR4表达;C.正常组织中未见β-catenin的表达;D.卵巢癌组织可见胞质及胞核β-catenin的表达图1 CXCR4与β-catenin在正常卵巢组织及卵巢癌组织中的表达 (×400)Figure 1 Expression of CXCR4 and β-catenin in ovarian tissues and ovarian cancer tissues
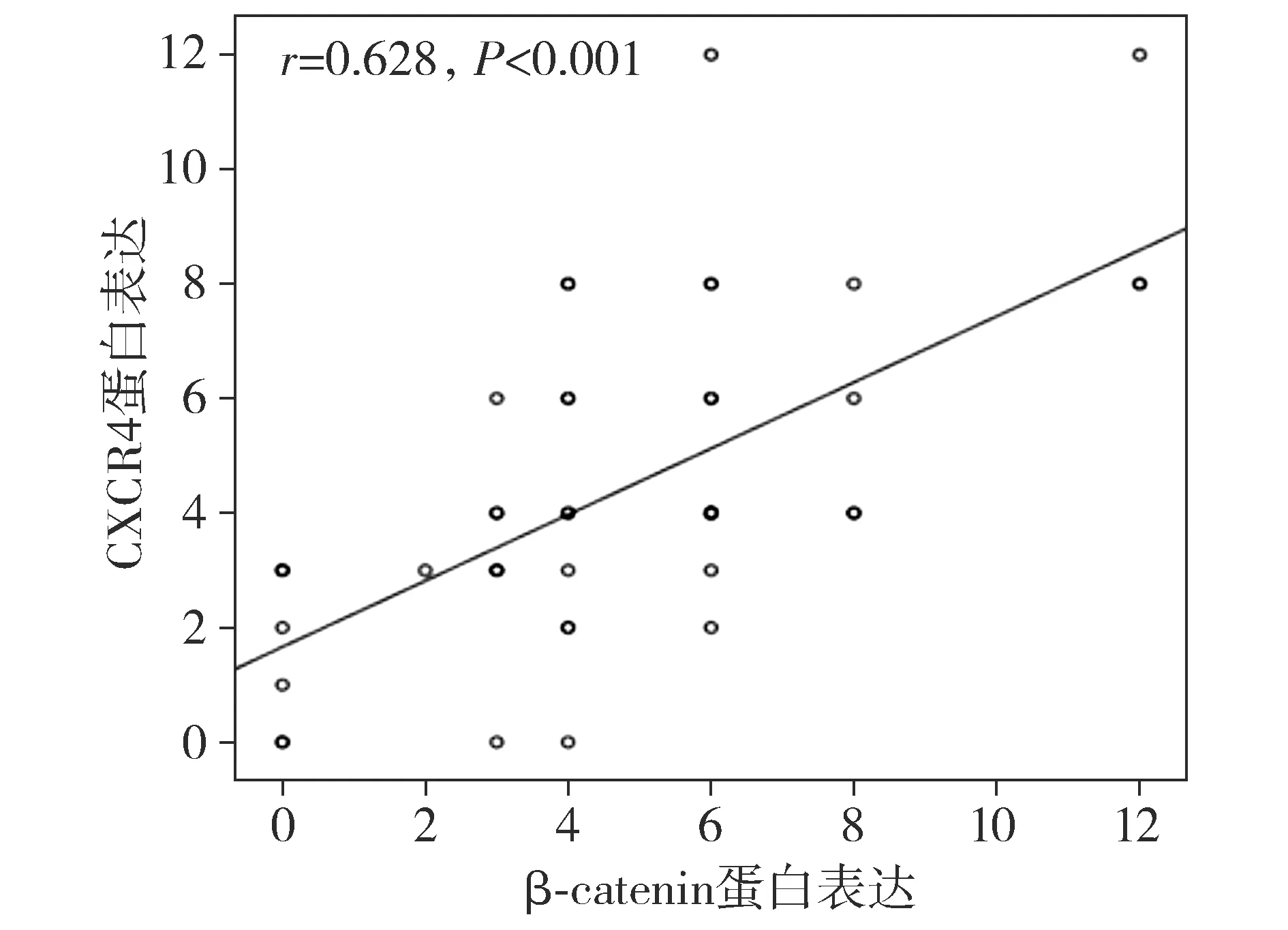
图2 CXCR4与β-catenin在卵巢癌中表达的相关性Figure 2 Correlation of CXCR4 and β-catenin expression in malignant ovarian tumors
2.2 卵巢癌患者CXCR4表达与临床病理特征的关系
为进一步探讨CXCR4表达与卵巢癌侵袭、转移的相关性,将所有卵巢癌病例按年龄、分化程度、FIGO分期及淋巴结转移情况进行分组,比较CXCR4在不用分组中的表达差异。结果表明,CXCR4在淋巴结转移阳性患者组织中的表达比无淋巴结转移的组织中的表达明显增加,差异有统计学意义(P=0.016),在不同年龄、肿瘤分化程度及FIGO分期患者卵巢癌组织中表达差异无统计学意义(P>0.05,见表1),提示CXCR4表达与卵巢癌侵袭和转移密切相关。
2.3 CXCR4 mRNA在卵巢癌组织及细胞中表达
本研究采用real-time PCR对CXCR4 mRNA在卵巢癌组织及细胞中表达进行分析,结果证实,CXCR4 mRNA在卵巢癌组织及细胞株中都具高表达,与正常卵巢上皮组织比较差异有统计学意义(P<0.001),其中细胞株CAOV3中CXCR4 mRNA表达水平最高(见图3)。
表1 CXCR4表达与卵巢癌临床病理特征之间的关系
Table 1 Correlation between CXCR4 expression and clinicopathological features of patients with ovarian cancer
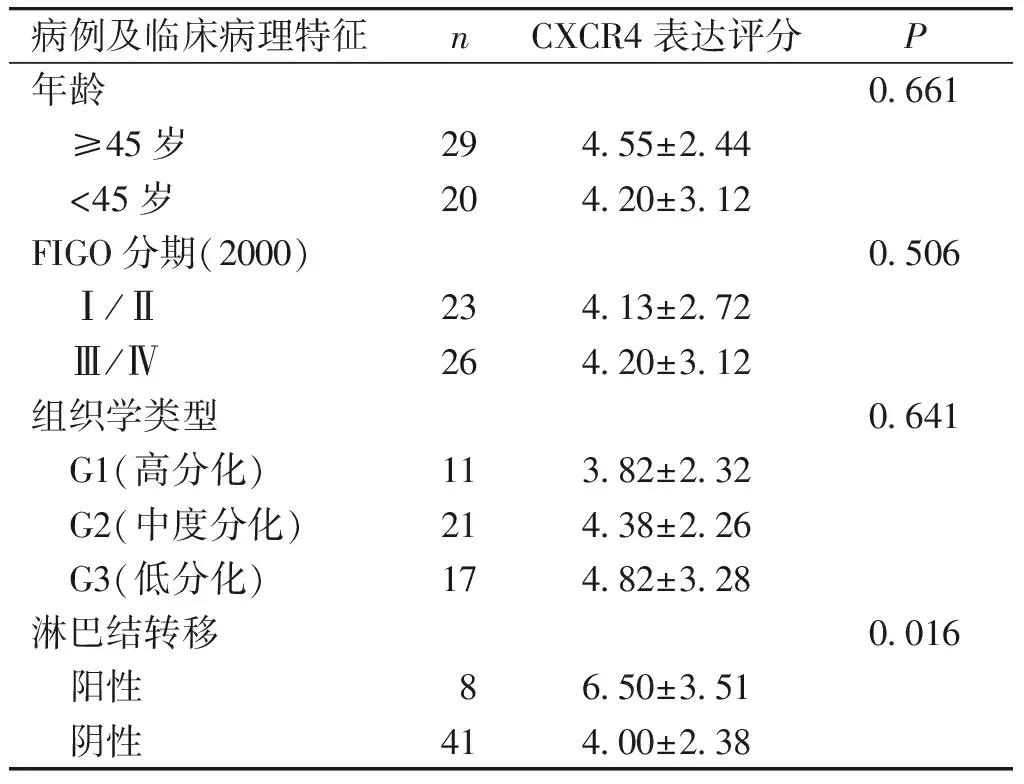
病例及临床病理特征nCXCR4表达评分P年龄0.661 ≥45岁294.55±2.44 <45岁204.20±3.12FIGO分期(2000)0.506 Ⅰ/Ⅱ234.13±2.72 Ⅲ/Ⅳ264.20±3.12组织学类型0.641 G1(高分化)113.82±2.32 G2(中度分化)214.38±2.26 G3(低分化)174.82±3.28淋巴结转移0.016 阳性86.50±3.51 阴性414.00±2.38
2.4 CXCR4蛋白在卵巢癌细胞株中的表达
本研究采用Western blot法进一步研究了CX-CR4蛋白在三种卵巢癌细胞株中和正常卵巢上皮组织中的表达,结果显示,CXCR4蛋白在卵巢癌细胞株CAOV3、SKOV3和A2780中高表达,分别是正常卵巢上皮组织中的3.51±0.08,2.95±0.14,2.82±0.10倍,差异具有统计学意义(P<0.001,见图4)。

与正常卵巢上皮组织相比,*P<0.001图3 CXCR4 mRNA在正常卵巢上皮组织、卵巢癌组织及卵巢癌细胞株中的表达Figure 3 Expression of CXCR4 mRNA in ovarian tissues, ovarian cancer tissues and ovarian cancer cells

与正常卵巢上皮组织相比,*P<0.001图4 Western blot法检测CXCR4蛋白在正常卵巢上皮组织及卵巢癌细胞株中的表达Figure 4 Expression of CXCR4 in ovarian tissues and ovarian cancer cells by Western blot
3 讨论
卵巢癌是妇科最常见恶性肿瘤之一,死亡率位居妇科肿瘤之首,由于其首发症状不明显,就诊时多已为中、晚期,多数患者已发生远处转移。转移是卵巢癌治疗失败和患者死亡的主要原因,如何控制肿瘤细胞转移,成为目前肿瘤治疗中最有价值的研究课题[7]。转移机制具有器官选择性,其与炎性细胞的迁移相类似,越来越多的研究证明,肿瘤细胞可以限定性地表达参与各种免疫反应例如感染、炎症以及组织修复等的趋化因子或趋化因子受体,提示趋化因子及其受体在恶性肿瘤细胞的侵袭及转移中起重要作用[8]。Kuratsu等[9]于1989年首次成功分离到MCP-1(monocyte chemoattractant protein-1),接下来又成功克隆并鉴定了其cDNA序列,在肿瘤研究中,Muller等[10]首次阐述了趋化因子受体与乳腺癌转移之间的关系,提示趋化因子受体与肿瘤转移是密切相关的。
趋化因子受体CXCR4,最初引起研究者的关注是因为其在感染中的作用[11,12],近年来研究发现CXCR4与其特异性的配体SDF-1相互作用形成SDF-1/CXCR4轴,不但参与炎性细胞浸润、细胞迁移和器官发育等体内许多重要的病理生理反应[13],而且在肿瘤的转移中起重要作用[14]。SDF-1/CXCR4轴在肿瘤转移中的作用已经分别在乳腺癌、非小细胞肺癌、前列腺癌、胰腺癌、横纹肌肉瘤等20多种肿瘤中得到研究证实。高表达CXCR4的肿瘤细胞在SDF-1的趋化、牵引作用下,逆浓度梯度向配体产生源器官转移,从而形成器官特异性肿瘤转移[15,16]。在本研究中,通过免疫组织化学方法检测了49例卵巢癌组织中CXCR4的表达情况,并与7例正常卵巢上皮组织中CXCR4的表达相比较,结果显示,正常组织未见CXCR4的表达,而大多数卵巢癌组织都有CXCR4的表达,表达率达91.8%(45/49),表明CXCR4表达在卵巢癌中是一个普遍特征。对CXCR4的表达进行病理学评分后,我们分析了CXCR4表达与临床病理特征之间的关系,发现CXCR4的表达程度影响了卵巢癌的淋巴结转移,而与患者年龄、肿瘤分化程度及FIGO分期无关,初步证明了CXCR4可能参与了卵巢癌的侵袭转移过程,提示CXCR4可能是协同卵巢癌进展、侵袭及转移的一个重要的分子标志物。同时我们研究了不同卵巢癌细胞株中及卵巢癌组织中CXCR4的基因和蛋白表达水平,卵巢癌组织及细胞株中CXCR4 mRNA表达水平与正常卵巢组织相比明显增高,卵巢癌细胞株中CXCR4蛋白表达也明显高于正常组织,而且,在细胞株CAOV3中其CXCR4基因和蛋白水平都明显高于其他卵巢癌细胞株,是CXCR4高表达的一个代表性卵巢癌细胞株。
Wnt/β-catenin通路活化在多种人类肿瘤中得到证实[17],而且有研究证明,Wnt/β-catenin靶基因的活化可以引起肿瘤的侵袭和转移、增殖以及血管发生[18]。β-catenin是Wnt经典通路中的关键性基因,在该通路中起重要作用。在本研究中,我们同样采用免疫组织化学方法对β-catenin在卵巢癌组织中的表达进行研究,我们的实验结果证明,与正常卵巢上皮组织相比,β-catenin在卵巢癌组织中有异常表达,此外,研究中还发现,卵巢癌组织中β-catenin与CXCR4表达具有显著的相关性,可以推测CXCR4与Wnt/β-catenin通路具有一定的内在的联系性,需要我们进一步探讨。
综上所述,CXCR4高表达于卵巢癌组织及卵巢癌细胞株,并且CXCR4的表达与卵巢癌的淋巴结转移密切相关,初步证明了CXCR4可能参与了卵巢癌的侵袭转移过程,提示CXCR4有可能成为卵巢癌患者基因治疗的有效靶点。同时我们还发现β-catenin在卵巢癌组织中高表达,且与CXCR4的表达具有显著的相关性,但其具体作用机制还待进一步研究。
