一株高产Monacolin K紫红曲霉菌株筛选、鉴定及发酵条件优化
2019-09-05张红星谢远红金君华
赵 娜,张红星,谢远红,金君华,贾 宇
北京农学院食品科学与工程学院 农产品有害微生物及农残安全检测与控制北京市重点实验室食品质量与安全北京实验室 微生态制剂关键技术开发北京市工程实验室,北京 102206
红曲霉(Monascus)是一类小型丝状腐生真菌,属子囊菌亚门(Ascomycotina)不整囊菌纲(Plectomycetes)散囊菌目(Eurotiales)红曲科(Monascaceae)[1],某些红曲霉菌株在培养过程中能够产生生理活性物质Monacolin K[2,3]。而Monacolin K是HMG-CoA还原酶的抑制剂,具有降低胆固醇的作用[4,5]。
自 20世纪70年代末,日本Endo等[6]发现了红曲霉代谢产物中降胆固醇活性物质Monacolin K 及其类似物,便有力地促进了红曲霉Monacolin K相关方面的研究与应用[7]。Monacolin K属于聚酮类化合物,具有复杂的分子结构,因此化学合成的方法不能应用于大规模的生产[8],所以采用生物发酵方法是其工业生产的主要途径之一[9]。目前,液态发酵Monacolin K具有规模大,自动化程度高,人力成本低,生产过程易控制等显著优点[10],但由于液态发酵产量低,故需在高产Monacolin K菌株的筛选和工艺优化上取得突破[11]。本实验从天然发酵的红曲米中分离30株红曲霉菌,筛选得到高产Monacolin K菌株,采用正交试验法优化发酵工艺,以期为高产Monacolin K的红曲霉微生物发酵提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
从天然发酵的红曲米中分离的30株红曲霉菌株,编号见表2。
1.1.2 主要试剂
酵母浸粉、蛋白胨、牛肉膏,均为生物制剂,北京奥博星生物技术有限责任公司;葡萄糖、蔗糖、NaNO3、MgSO4·7H2O、KH2PO4,均为分析纯,国药集团化学试剂有限公司;琼脂粉,北京畅华志诚技有限公司;米粉,宁波市江北五桥粮油有限公司;马铃薯葡萄糖琼脂(PDA),北京陆桥技术有限公司;甲醇、乙腈,均为色谱纯,Fisher公司;Monacolin K标准品,青岛普瑞邦生物工程有限公司;Taq 聚合酶,宝日医生物技术(北京)有限公司(takara中国);真菌基因组DNA快速抽提试剂盒,生工生物工程(上海)股份有限公司。
1.1.3 培养基
斜面培养基:PDA培养基。
种子培养基(L)[12]:米粉30 g,葡萄糖20 g,蛋白胨15 g,NaNO32 g,MgSO4·7H2O 0.5 g,KH2PO41.5 g,pH自然。
发酵培养基(L)[12]:葡萄糖70 g,牛肉膏15 g,NaNO32 g,MgSO4·7H2O 0.5 g,KH2PO41.5 g,pH自然。
1.2 主要仪器与设备
BSA2202S型电子天平,赛多利斯工业称重设备(北京)有限公司;DL-CJ-2ND1型洁净工作台,北京东联哈尔仪器制造有限公司;MLS-3750型立式压力蒸汽灭菌锅,日本三洋电器股份有限公司;THZ-C型恒温振荡器,苏州培英实验设备有限公司;1260型高效液相色谱仪,安捷伦科技有限公司;DYY-6D型电泳仪,WD-9413B凝胶成像分析仪,均为北京六一生物科技有限公司。
1.3 实验方法
1.3.1 红曲霉菌株的筛选
将采样自福建地区的天然发酵的红曲米磨碎,以接种环蘸取少量红曲米接种于PDA培养基平板上,进行连续多次划线分离,直到产生早期为白色、后期为红色或紫色的单菌落,再用PDA固体培养基纯化培养,将所获菌株编号,编号见表2,置4 ℃冰箱中保存,备用。
1.3.2 发酵液Monacolin K产量测定
将所筛菌种接种于PDA斜面培养基,28 ℃恒温培养6 天。种子液制备:100 mL三角瓶装入种子培养基50 mL,接种0.5 cm×0.5 cm大小的菌块,八层纱布包扎,28 ℃、160 rpm恒温摇床中培养3 天。液体发酵培养:100 mL三角瓶装入发酵培养基50 mL,按体积分数7%的接种量接种,八层纱布包扎,28 ℃、160 rpm恒温摇床中培养7 天。
取2 mL发酵液于50 mL的离心管中,加入8 mL无水甲醇。混匀放置于摇床中160 rpm震荡提取3 h,5 000 rpm离心10 min取上清[13], 用0.22 μm有机滤膜过滤后通过高效液相色谱法(High performance liquid chromatography,HPLC)进行Monacolin K产量测定[14]。
HPLC检测条件,色谱柱ZORBAX300SB-C18:柱长150 mm;内径4.6 mm;粒径5 μm。流动相V(乙腈)∶V(0.01%磷酸)=65∶35;检测波长237 nm;进样体积20 μL;流速1.0 mL/min;柱温30 ℃。
1.3.3 菌株Monacolin K产量稳定性研究
将高产Monacolin K的优势菌株作为目的菌株进行传代培养,连续培养10代,通过测定每一代发酵液的Monacolin K产量分析其稳定性,测定方法同上。
1.3.4 菌株鉴定
将目的菌株接种于PDA平板上培养7 天,观察目的菌株在PDA培养基上菌落形态和显微结构。采用真菌基因组DNA快速抽提试剂盒提取红曲霉基因组DNA[15],采用PCR方法扩增ITS rDNA基因,引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),PCR反应体系见表1。
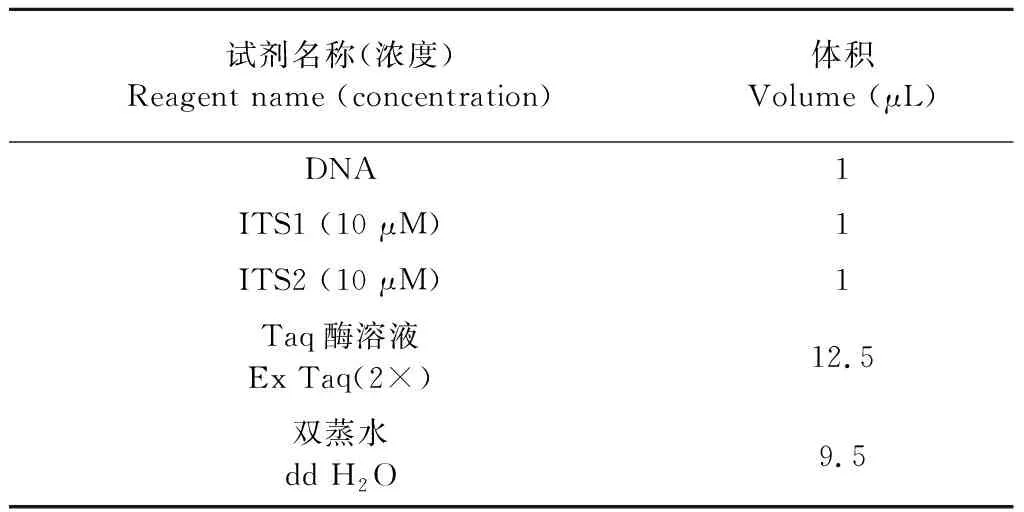
表1 红曲霉菌株PCR反应体系
PCR循环条件为95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火45 s,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min[16]。
PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至生工生物工程(上海)股份有限公司测序。将测序结果在NCBI数据库中进行BLAST对比分析。将目的菌株送至中国科学院微生物研究所进行微生物菌种鉴定。
1.3.5 发酵条件优化
以发酵液Monacolin K产量为评价指标进行单因素试验,发酵培养基配方同上,并设定初始培养条件为:发酵温度为28 ℃,初始pH值自然,接种量为体积分数7%,发酵时间为7 天。对发酵培养的主要影响因素(接种量、发酵温度、发酵时间、初始pH)进行单因素优化试验[17],接种量分别设定为体积分数6%、7%、8%、9%、10%;发酵温度设定为24、26、28、30、32 ℃;发酵时间分别设定为6、8、10、12、14 天;初始pH值设定为3.0、4.0、5.0、6.0、7.0。测定各条件下发酵液中Monacolin K的产量,每个实验重复3次。
在此单因素试验基础上,设计正交试验方案如表4。
2 研究结果与分析
2.1 高产Monacolin K红曲霉菌株筛选
将PDA平板上分批次分离的30株红曲霉菌株,分别标记菌株代号为ZX1、ZX2…ZX30。分别对30株红曲霉进行产Monacolin K能力检测试验。结果如表2所示,有9株红曲霉的发酵液在检测波长237nm处有特征吸收峰,说明具有产Monacolin K的能力;其余21株没有特征吸收峰,可初步判断这些菌株不产Monacolin K。9株红曲霉产Monacolin K能力差异较大,其中编号ZX26菌株产Monacolin K能力最强,达到101.60 mg/L,故在后继发酵条件优化中选择编号ZX26为目标菌株。
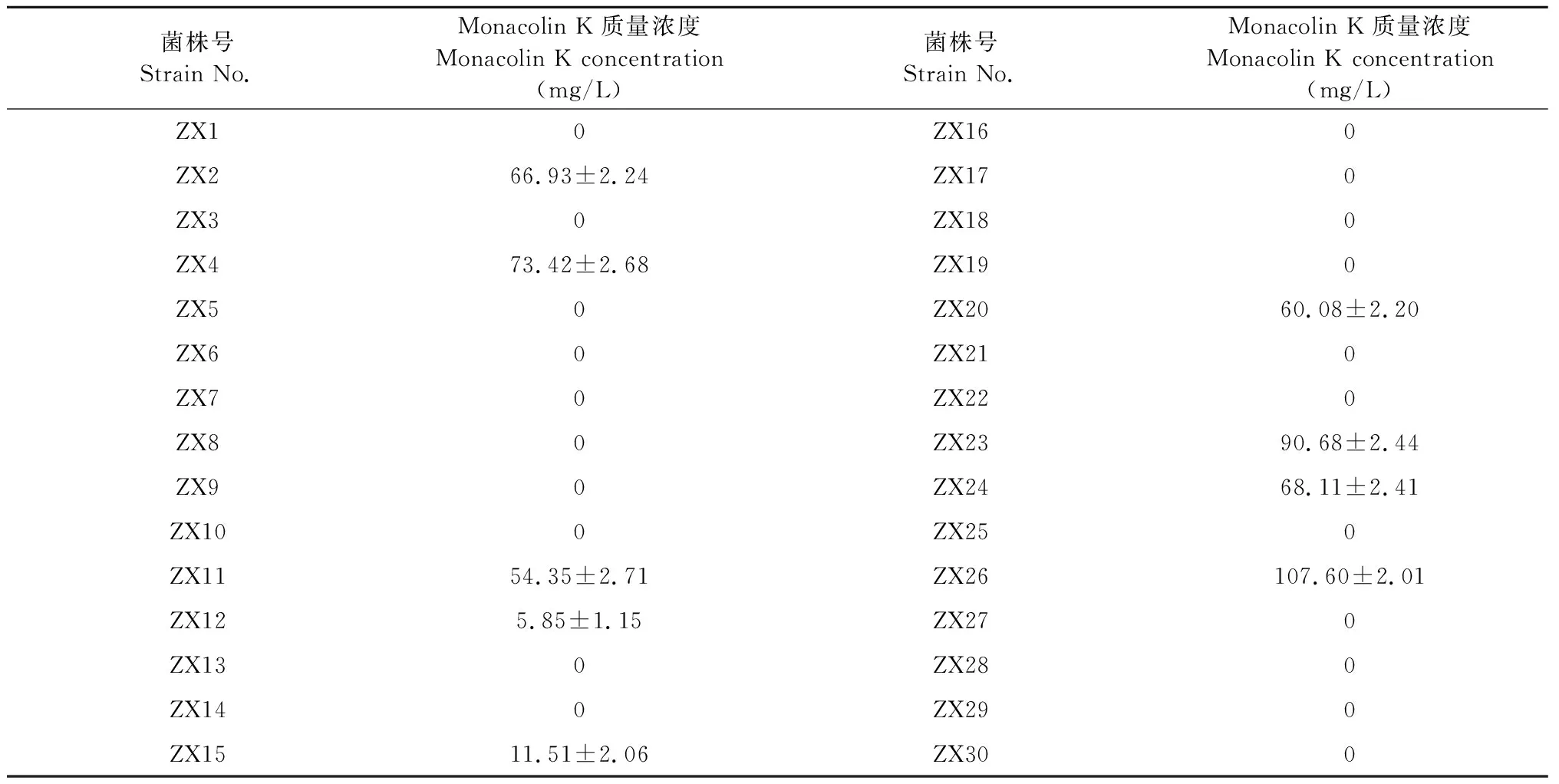
表2 红曲霉菌株Monacolin K产量
2.2 红曲霉ZX26 Monacolin K产量稳定性
将编号为ZX26菌株传代培养,进行产Monacolin K稳定性试验,通过测定每一代发酵液的Monacolin K质量浓度,来判断产Monacolin K稳定性。结果如表3所示。

表3 红曲霉ZX26产Monacolin K稳定性(连续培养10代)
结果表明,红曲霉ZX26菌株连续培养10代后,其Monacolin K产量仍然处于较高水平,可以基本判断ZX26菌株在产Monacolin K能力方面具有良好的稳定性。
2.3 ZX26菌株的形态学鉴定与分子学鉴定
2.3.1 ZX26菌株的菌落形态及显微特征
将编号为ZX26菌株接种于在PDA平板培养基上28 ℃培养7天,直径5 cm,紫红色,绒毛状,皱裂(图1a),反面紫红色。菌丝具隔膜,多分枝,直径3~6 μm。闭囊壳球形,直径25~50 μm(图1b),橙红色至紫红色。子囊孢子椭圆形,5~6×4~5 μm。分生孢子着生于孢梗顶端,单个或成串,近球形或倒梨形,8~11×6~8 μm(图1c)。
2.3.2 ZX26菌株的分子测序结果
将编号为ZX26菌株ITS rDNA 基因PCR扩增后的结果送至生工生物工程(上海)股份有限公司进行ITS测序,得到了大小为571bp的序列。在NCBI 中检索与该菌株序列相似性较高的菌株,结果表明ZX26菌株与GenBank数据库中红曲霉菌株同源性高达98%~99%。进化性分析表明(图2),红曲霉ZX26与Monascuspurpureusstrain FRR 1596亲缘关系最近,因此并将其命名为紫红曲霉ZX26(MonascuspurpureusZX26),且经中国科学院微生物研究所进行微生物菌种鉴定,此菌株为紫红曲霉(Monascuspurpureus),并于2018年07月11日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC NO.15992。
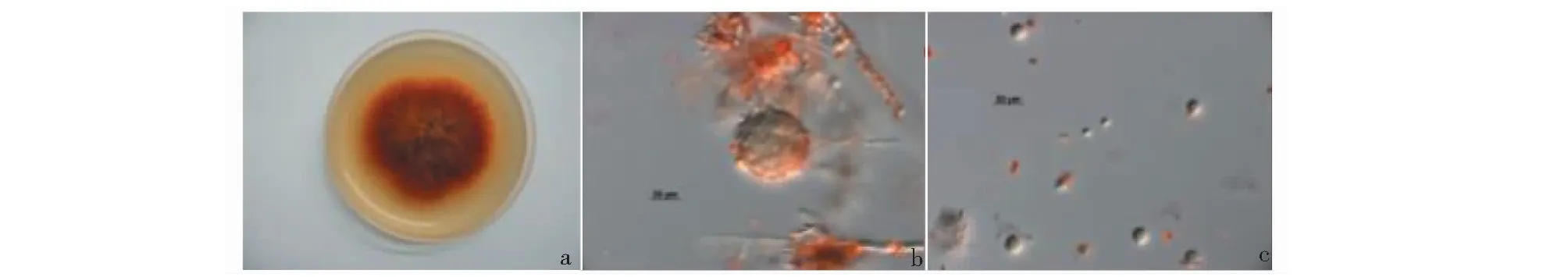
图1 菌株ZX26 形态学鉴定Fig.1 Morphological identification of strain ZX26
2.4 单因素培养条件确定
2.4.1 接种量的确定
不同接种量对紫红曲霉ZX26的影响结果如图3所示,接种量在体积分数7%~9%时,有利于Monacolin K产量增加,在体积分数为7%的接种量时Monacolin K产量最高,为101.62 mg/L。当接种量大于体积分数9%时,Monacolin K产量开始下降。分析由于随着接种量的增加,菌体繁殖速度加快,Monacolin K的产量也相应增加,但当接种量过高,菌体需要的能量大于培养基能提供的能量时,由于营养物质匮乏导致紫红曲霉ZX26生命活力下降,故Monacolin K的产量也相应减少。
2.4.2 发酵温度的确定
不同发酵温度对紫红曲霉ZX26的影响结果如图4所示,随着发酵温度的提高,Monacolin K产量增加,在30 ℃时Monacolin K产量达到最大值,为111.47 mg/L,随后随着温度的升高,Monacolin K产量开始下降。分析由于菌体对温度较为敏感,温度过高或过低都会使Monacolin K产量降低。

图2 基于菌株ZX26 的ITS 序列构建的系统进化树Fig.2 Phylogenetic tree of strain ZX26 based on ITS sequences

图3 不同接种量下Monacolin K的产量Fig.3 The effects of different inoculum on Monaeolin K production

图4 不同发酵温度对Monacolin K 产量的影响Fig.4 The effects of different temperature on Monaeolin K production
2.4.3 发酵时间对Monacolin K产量的影响
不同发酵时间对紫红曲霉ZX26的影响结果如图5所示,随着发酵时间的增加,Monacolin K产量也随之增加。在14 天时Monacolin K产量达到峰值为100.30 mg/L,但是,相对比10 天时,Monacolin K产量仅增加了0.63 mg/L,结合实际分析,故认为最佳生长时间为10天。推测是因为在发酵初期,培养基内的营养物质充裕,菌体大量繁殖,故Monacolin K产量增加。后期培养基内的营养物质减少,同时菌体处于衰亡期,菌体数量开始减少,故产生Monacolin K的产量也相应减少。
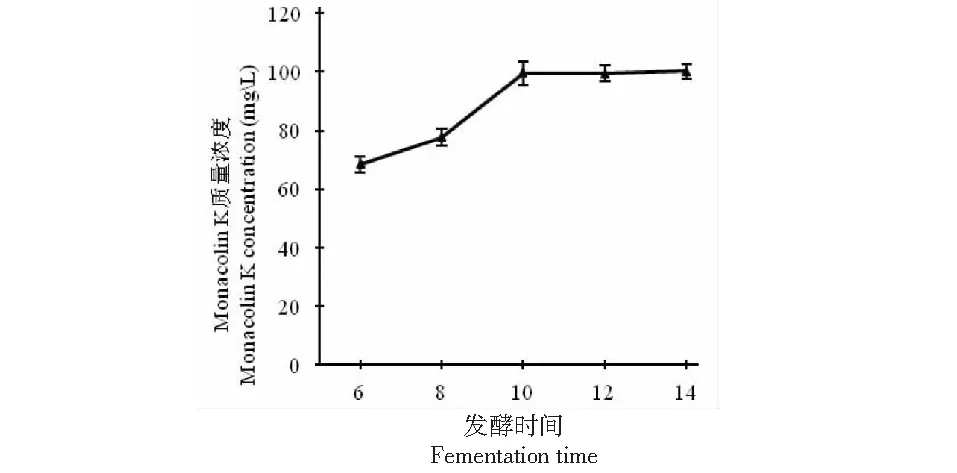
图5 不同发酵时间对Monacolin K 产量的影响Fig.5 The effects of different fermentation time on Monaeolin K production
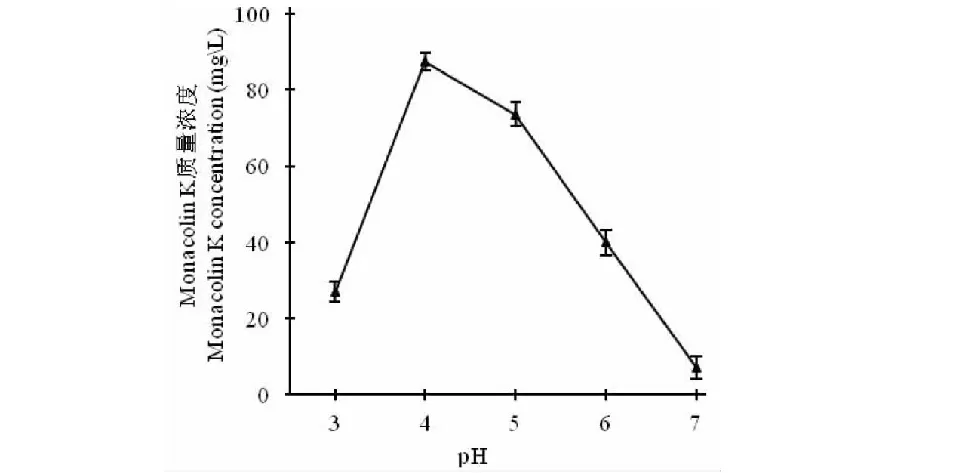
图6 不同初始pH对Monacolin K产量的影响Fig.6 The effects of different potential of hydrogen on Monaeolin K production
2.4.4 初始pH对Monacolin K产量的影响
初始pH对紫红曲霉ZX26的影响结果如图6所示,Monacolin K产量在初始pH 4~6范围内较为理想。当发酵液的初始pH为4.0时,Monacolin K产量达到峰值为87.5 mg/L。当发酵液pH大于5.0时,Monacolin K产量急剧下降。
2.5 正交试验结果
为了更加方便快捷的确定各因素对Monacolin K产量的影响,以接种量、发酵温度、发酵时间、初始pH值设计了单因素试验并结合单因素试验的结果,设计四因素三水平正交试验L9(34)。试验设计如表4,试验结果如表5。

表4 不同元素水平

表5 发酵条件优化正交试验结果与分析
结果所示,极差R值大小顺序为:RB>RD>RA>RC,说明发酵温度是Monacolin K产量最显著的影响因素。K值分析结果显示,4个因素的最优组合为A1B1C3D3,即接种量为体积分数7%,发酵温度为30 ℃,发酵时间为10天,初始pH值为4.0。根据此组合进行发酵试验验证(设置3个平行组),得出最终Monacolin K产量271.36 mg/L,高于正交试验中所有的组合结果,说明该组合确实为最佳发酵条件。
3 结论
本文从高产Monacolin K的红曲霉菌株筛选出发,获得一株Monacolin K产量较高的紫红曲霉ZX26菌株,并对培养条件进行进一步优化。获得结论为,在培养基组分为葡萄糖70 g/L,牛肉膏15 g/L,NaNO32 g/L,MgSO4·7H2O 0.5 g/L,KH2PO41.5 g/L下其最优发酵条件为:接种量为体积分数7%,发酵温度为30 ℃,初始pH值为4.0,发酵时间为10 天。在此条件下,紫红曲霉ZX26发酵液中Monacolin K产量达271.36 mg/L,相对于培养条件优化前Monacolin K产量提高152.19%,经验证此培养条件下Monacolin K产量最佳。通过实验为紫红曲中Monacolin K的进一步研究提供了理论基础。
