臭椿酮诱导人黑色素瘤A375细胞凋亡及其机制研究
2019-09-05陈小宇曲传俊李德芳郑秋生
陈小宇,陈 颖,曲传俊,李德芳,郑秋生,2*
1滨州医学院中西医结合学院,烟台 264000;2石河子大学药学院 新疆特种植物药资源省部共建重点实验室,石河子 832000
恶性黑色素瘤(malignant melanoma,MM)是一种极具侵袭性的肿瘤,好发于皮肤表面。皮肤恶性黑色素瘤的死亡率占皮肤相关肿瘤死亡率的80%[1],其发生率与死亡率多年来一直高居不下[2,3]。据资料统计,2012年全球黑色素瘤新发病例为232 000例,死亡55 000例,死亡率占新发病例的23.7%[4];2011年我国黑色素瘤新发病例6 505例,死亡病例2 660例,死亡率占新发病例的40.9%[5],黑色素瘤已成为严重危害我国人民健康的疾病之一,因此开发与研究黑色素瘤治疗药物显得尤为重要。
臭椿Ailanthusaltissima(Mill.) Swingle,又名椿树和木砻树,属落叶乔木,因叶基部腺点发散臭味而得名,其树皮、根皮、果实均可入药,具有清热燥湿、收涩止带、止泻、止血之功效[6]。臭椿酮是臭椿树叶中分离的一种苦味素类化合物,具有广谱的生物活性,包括抗炎、抗HIV、抗疟疾、抗过敏、抗溃疡和抗微生物等[6]。近几年研究发现,臭椿酮也具有抗肿瘤活性,并在人前庭神经鞘瘤细胞[7]、人肝癌Huh7细胞[8]、人前列腺癌C4-2B细胞[9]、人胃癌SGC-7901细胞[10]、人非小细胞肺癌A549,H1299和H1975细胞[11]、人乳腺癌MCF-7细胞[12]、人早幼粒急性白血病HL-60细胞[13]中得以验证。但是,臭椿酮对黑色素瘤的影响未见报道。因此,本研究以人黑色素瘤A375细胞为研究对象,通过多种分子生物及生物化学手段检测了臭椿酮对人黑色素瘤A375细胞生长增殖的影响,并探讨了可能的分子机制。
1 材料与仪器
1.1 药品与试剂
臭椿酮(Ailanthone,AIL)购于宝鸡辰光生物科技有限公司,纯度≥98%。DMEM培养基购于Hyclone公司;胎牛血清购于Gibco公司;青霉素-链霉素和胰蛋白酶消化液购于索莱宝生物科技有限公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购于碧云天生物技术有限公司;BCA蛋白定量试剂盒和Hoechst 33258细胞凋亡检测试剂盒购自索莱宝生物科技有限公司;caspase-3和caspase-9活性检测试剂盒均购于碧云天生物技术有限公司;p-PI3Kβ(Ser1070),PI3Kβ,p-Akt (Ser473),Akt和β-actin抗体购自Cell signaling公司,山羊抗兔二抗和山羊抗鼠二抗均购自索莱宝生物科技有限公司,ECL发光试剂盒购自Thermo Fisher Scientific公司。分析纯化学试剂均购自山东济南汇丰达化工有限公司。
1.2 仪器
二氧化碳培养箱购自Thermo公司,超净工作台购自苏州净化设备有限公司,多功能酶标仪购于Tecan公司,AXIO OBSERVER A1倒置荧光显微镜购自Carl Zeiss AG公司,BD FACSCalibur流式细胞仪购自BD公司,垂直电泳仪购自Bio-RAD公司,UVP凝胶成像系统购于美国BioSpectrum公司。
1.3 细胞及培养
人黑色素瘤A375细胞购于中国科学院典型培养物保藏委员会细胞库,用含10%胎牛血清的DMEM培养基培养,并加入100 U/mL青霉素和100 μg/mL链霉素,于37 ℃、5% CO2培养箱中培养,每2天传代一次。
2 实验方法
2.1 MTT法检测药物对细胞活力的影响
取对数生长期的A375细胞,以每孔4×103个接种于96孔板,每组设置6个复孔。次日,待细胞贴壁后,加入0、4、8、12 μM臭椿酮作用24 h。待培养结束后,每孔加入5 g/mL MTT试剂20 μL,继续培养4 h。孵育结束后,弃去孔内培养液,每孔加入150 μL DMSO,置于微孔振荡器上振荡10 min,使紫色结晶完全溶解,用多功能酶标仪在570 nm处测定吸光度。并依据公式计算细胞存活率:
细胞存活率=实验组吸光度/对照组吸光度×100%
2.2 倒置相差显微镜观察细胞形态
取对数生长期的A375细胞2×105个/孔接种于6孔板中。次日,待细胞融合度达到70%时,加入0、4、8、12 μM臭椿酮,置于37 ℃、5% CO2培养箱中培养24 h。之后,将培养板从培养箱中取出,置于倒置相差显微镜下观察细胞形态并拍照。
2.3 Hoechst 33258染色
取对数生长期的A375细胞2×105个/孔接种于6孔板中。次日,待细胞融合度达到70%时,加入0、4、8、12 μM臭椿酮作用24 h。待培养结束后,弃去孔内培养基,用PBS润洗2~3次,用4%多聚甲醛室温固定20 min,之后弃去固定液,用PBS润洗2次,吸出孔内液体,加入Hoechst 33258染色液500 μL,室温避光染色30 min,弃去染色液,用PBS润洗2次,置于荧光显微镜下观察细胞形态变化并拍照。
2.4 流式细胞仪检测细胞凋亡
取对数生长期的A375细胞2×105个/孔接种于6孔板中。次日,待细胞融合度达到70%时,加入0、4、8、12 μM臭椿酮作用24 h。待培养结束后,弃去孔内培养基,用PBS润洗2~3次,按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书上的操作收集细胞并分别加入Annexin V-FITC和PI,室温避光染色20 min后。离心收集细胞,弃去荧光染液,用试剂盒中提供的缓冲液润洗细胞3次,最后加入500 μL缓冲液,用流式细胞仪检测。
2.5 Caspase-3和caspase-9的活性检测
取对数生长期的A375细胞2×105个/孔接种于6孔板中。次日,待细胞融合度达到70%时,加入0、4、8、12 μM臭椿酮作用24 h。待培养结束后,弃去孔内培养基,用PBS润洗2次,用胰蛋白酶消化细胞,600 g在4 ℃离心5 min收集细胞沉淀,加入200 μL试剂盒中提供的裂解液,冰浴裂解15 min,取该溶液于4 ℃用16 000 g离心15 min,将上清转移至新的离心管中备用。取待测溶液50 μL,加入40 μL检测缓冲液及10 μL底物,于405 nm处测定样品吸光度。把试剂盒提供的pNA(p-nitroaniline)(10 mM)稀释至0、10、20、50、100 μM,每个浓度取100 μL并设置3个复孔用酶标仪在405 nm处进行检测,制作出pNA浓度相对于A405的标准曲线。用样品的A405的数值在标准曲线上比对,可以得到相应的pNA浓度,用pNA浓度大小表示caspase-3和caspase-9活性的高低。
2.6 Westerm blot检测相关蛋白表达
取对数生长期的A375细胞2×105个/孔接种于6孔板中。次日,待细胞融合度达到70%时,加入0、4、8、12 μM臭椿酮作用24 h。待培养结束后,弃去孔内培养基,用PBS润洗2次,用胰蛋白酶消化细胞,600 g在4 ℃离心5 min收集细胞沉淀,加入800 μL RIPA细胞裂解液,置于冰上裂解30 min后,1 000 g在4 ℃离心10 min后取上清,用BCA蛋白定量试剂盒进行蛋白定量,之后取适量蛋白溶液与上样缓冲液按比例混匀,于沸水中煮15 min使蛋白变性,取40 μg蛋白上样,采用10% SDS-PAGE凝胶电泳分离蛋白,用湿转法将蛋白转印至PVDF膜,用5%脱脂奶粉室温封闭2 h后,加入相应的一抗(1∶1 000)4 ℃孵育过夜,之后用TBST洗3次,加入相应的二抗于室温在摇床摇2 h,用TBST润洗3次后用ECL发光试剂盒显色,用UVP凝胶成像系统记录图像。
2.7 统计学分析
实验数据以平均值±标准差(Mean±SD)表示,用SPSS 19.0软件单因素方差(ANOVA)进行分析,P<0.05认为具有统计学意义。
3 结果与分析
3.1 臭椿酮对A375细胞活力的抑制作用
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,用MTT法检测臭椿酮对人黑色素瘤A375细胞活力的影响。如图1所示,臭椿酮(4、8、12 μM)作用A375细胞24 h后,能够明显抑制A375细胞活力且呈现剂量依赖性。其中12 μM臭椿酮作用A375细胞24 h后,使A375细胞活力下降78.9%。

图1 臭椿酮对人黑色素瘤A375细胞活力的抑制作用Fig.1 Inhbitory effect of AIL in human melanoma A375 cells注:Ctrl为对照组,*与对照组相比有显著差异(P<0.05),**与对照组相比具有非常显著差异(P<0.01)。Note:Ctrl means control group,*significant difference with control group (P<0.05),very significant difference with control group (P<0.01).
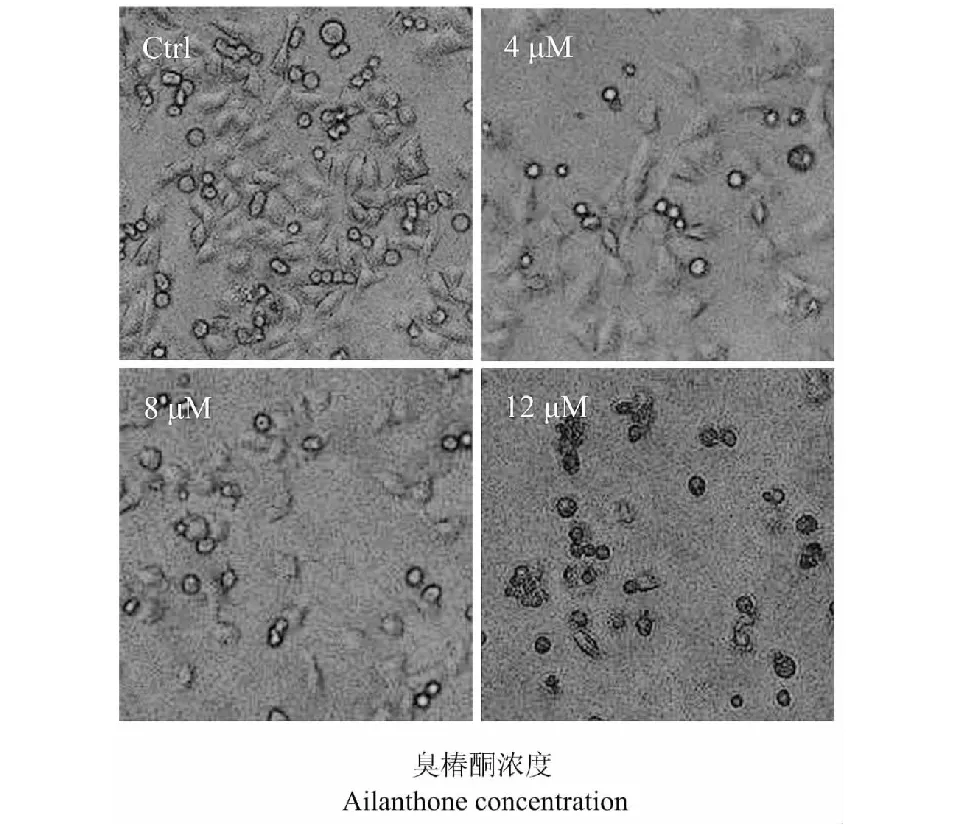
图2 不同浓度臭椿酮作用A375细胞24 h后细胞形态的变化Fig.2 Morphological change of A375 cells treated with different concentrations of AIL for 24 h注:Ctrl为对照组。Note:Ctrl means control group.
3.2 臭椿酮对A375细胞形态的影响
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,将6孔板从培养箱中取出,置于倒置相差显微镜下观察细胞数目和形态变化。如图2所示,臭椿酮作用后A375细胞的数目明显减少,并呈现剂量依赖性。随着臭椿酮剂量的增加,A375细胞变的更圆,其中12 μM臭椿酮作用A375细胞24 h后,A375细胞明显变小、数目变少,并且透光性降低,还使A375细胞的附着力变弱,上清液出现许多漂浮的细胞。
3.3 臭椿酮对A375细胞核形态的影响
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,用Hoechst 33258荧光染料对A375细胞进行染色来检测AIL对A375细胞核形态的影响。如图3所示,臭椿酮作用后细胞数目相较于正常组明显减少(表现为细胞核数目减少),还可以观察到A375细胞染色质出现浓缩进而产生的高亮,而对照组细胞核亮度较低,边缘光滑完整,染色质分布均匀。

图3 臭椿酮对A375细胞核形态的影响 (200 ×)Fig.3 The effect of AIL on cell nuclear feature in A375 cells (200 ×)注:Ctrl为对照组。Note:Ctrl means control group.
3.4 臭椿酮对A375细胞凋亡的影响
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,用Annexin V-FITC和PI染料进行双染,接着用流式细胞仪进行检测。如图4所示,与正常组相比,臭椿酮作用组细胞凋亡率明显增加,表现在Q4象限(早期凋亡)和Q2象限(晚期凋亡)细胞数均明显增加。

图4 臭椿酮能够诱导A375细胞凋亡Fig.4 AIL induced apoptosis of A375 cells注:Ctrl为对照组,PI为碘化丙啶,FITC为异硫氰酸荧光素。Note:Ctrl means control group,propidine iodide is represented as PI,fluorescein isothiocyanate is represented as FITC.
3.5 臭椿酮对A375细胞caspase-3和caspase-9活性的影响
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,与正常组对比,不同浓度臭椿酮作用后caspase-3和caspase-9的活性增加,其中8 μM和12 μM臭椿酮作用后,能够使caspase-3的活性显著增加,臭椿酮(4、8、12 μM)作用后能够使caspase-9的活性显著增加。
3.6 臭椿酮对A375细胞PI3K/Akt信号通路的影响
臭椿酮(0、4、8、12 μM)作用A375细胞24 h后,用Western blot检测臭椿酮作用后对PI3K/Akt信号通路蛋白表达的影响。如图5所示,与对照组相比,不同浓度臭椿酮作用后p-PI3K和p-Akt表达明显下降,说明臭椿酮能够抑制PI3K和Akt的磷酸化,而PI3K和Akt总蛋白并无明显变化。上述结果说明,臭椿酮能够使PI3K/Akt信号通路失活。


Table 1 Effect of AIL on caspase-3 and caspase-9 activities in A375 cells (n =
注:与正常组相比,*P<0.05,**P<0.01。
Note:Compared with control group,*P<0.05,**P<0.01.

图5 臭椿酮作用A375细胞后对PI3K/Akt信号通路蛋白表达的影响Fig.5 Effect of AIL on the expression of PI3K/Akt signaling pathway proteins in A375 cells注:Ctrl为对照组。Note:Ctrl means control group.

图6 臭椿酮联合LY294002对PI3K/Akt信号通路蛋白表达的影响Fig.6 Effect of AIL combined with LY294002 on the expression of PI3K/Akt signaling pathway proteins注:Ctrl为对照组。Note:Ctrl means control group.
3.7 臭椿酮使PI3K/Akt信号通路失活来诱导A375细胞凋亡
LY294002是PI3K特异性抑制剂,用LY294002预处理2 h后,再加入0、4、8、12 μM臭椿酮作用A375细胞24 h,用Western blot检测臭椿酮作用后对PI3K/Akt信号通路蛋白表达的影响。如图6所示,臭椿酮作用A375细胞后对总PI3K和Akt的表达没有明显影响,但是使磷酸化PI3K和Akt表达明显下降,当臭椿酮和PI3K抑制剂LY294002联用后,使磷酸化PI3K和Akt表达下降更为明显,进一步说明臭椿酮能够使PI3K/Akt信号通路失活。
接着,我们又检测了LY294002联合臭椿酮对A375细胞凋亡的影响,发现与只臭椿酮处理组相比,臭椿酮与LY294002联用后使A375细胞凋亡数明显增加,进一步确认了臭椿酮通过使PI3K/Akt信号通路失活来诱导A375细胞凋亡。
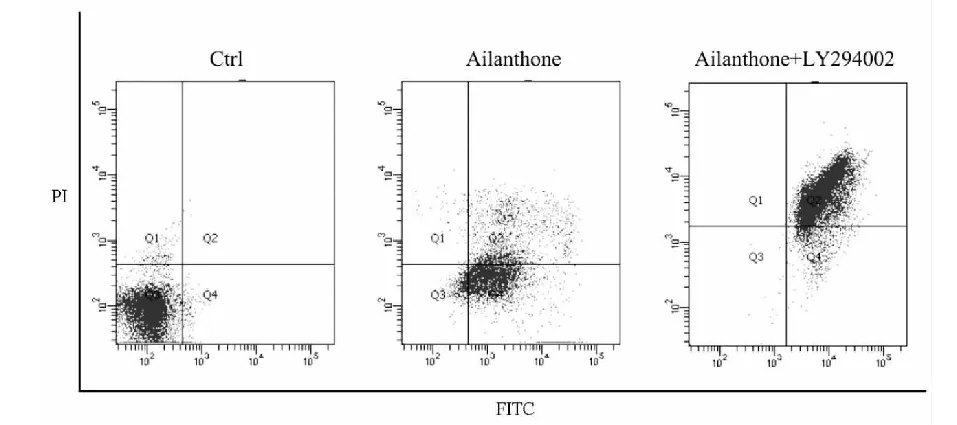
图7 臭椿酮通过PI3K/Akt信号通路诱导A375细胞凋亡Fig.7 AIL induced apoptosis of A375 cells via PI3K/Akt signaling pathway注:Ctrl为对照组,PI为碘化丙啶,FITC为异硫氰酸荧光素。Note:Ctrl means control group,propidine iodide is represented as PI,fluorescein isothiocyanate is represented as FITC.
4 结论
黑色素瘤是一种恶性程度相当高的肿瘤,大多原发于皮肤,也可起源于眼、鼻腔等处,早期可发生转移,转移部位多见肺、脑,黑色素瘤的死亡率之高已严重危害我国人民健康。因此,寻找低毒、高效的抗癌药物是黑色素瘤治疗领域的重要方向。
臭椿酮是臭椿中的一种化合物,具有抗炎、抗HIV、抗疟疾、抗过敏、抗溃疡和抗微生物的生物活性,还能够通过提升自身免疫而发挥多种治疗作用[6]。Zhuo等[8]发现臭椿酮能够通过激活ATM/ATR信号转导通路抑制人肝癌HepG2、Hep3B、Huh7细胞增殖并导致人肝癌细胞周期阻滞。He等[9]发现在难去势的前列腺癌细胞中臭椿酮通过靶向p23克服MDV3100耐药。Chen等[10]发现臭椿酮通过诱导G2/M期阻滞和凋亡来抑制人胃癌SGC-7901细胞增殖。Ni等[11]通过cDNA基因序列的方法探索了臭椿酮抑制非小细胞肺癌增殖的作用机制,发现臭椿酮作用后会下调RPA1进而抑制非小细胞肺癌DNA复制。Wang等[12]发现臭椿酮能够诱导人乳腺癌MCF-7细胞凋亡和周期阻滞。Wei等[13]发现臭椿酮通过诱导凋亡和自噬抑制人早幼粒急性白血病HL-60细胞增殖。Rosati等[14]发现臭椿酮能够诱导Jurkat细胞线粒体膜电势下降并激活caspase-3,进而诱导Jurkat细胞凋亡。目前尚未见有关臭椿酮对黑色素瘤影响的报道。本实验以臭椿酮为研究对象,探讨了臭椿酮对人黑色素瘤A375细胞增殖、凋亡的影响及作用机制。
在光学显微镜下观察,凋亡细胞和未凋亡的细胞有着明显的形态变化,凋亡的细胞体积变小,贴壁细胞出现皱缩、变圆、附着力变弱的现象。细胞发生凋亡时,染色质会发生固缩,Hoechst 33258是一种着色于DNA的染料,因此在Hoechst 33258染色后,用荧光显微镜观察可以发现凋亡细胞的细胞核会呈现致密浓染或碎块化致密浓染,颜色发白呈现高亮[15,16]。磷脂酰丝氨酸(phosphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin V是一种分子量为35~36 KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。碘化丙啶(propidium iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,但对于凋亡中晚期的细胞和坏死的细胞,由于其细胞膜破裂,PI能够透过细胞膜而使细胞核染红[17]。因此,用Annexin V和PI双染能够标记凋亡细胞和坏死的细胞。Caspase-9也称为ICE-LAP6或Mch6,是细胞凋亡信号转导过程中比较上游的一个caspase,线粒体释放细胞色素C后,caspase-9可以和细胞色素C和Apaf1形成复合物,同时被激活。活化的caspase-9可以激活caspase-3从而促进后续的细胞凋亡信号[18,19]。我们的实验结果发现,臭椿酮作用后使A375细胞变小、透光性降低,附着力变弱表现为上清液出现许多漂浮的细胞;Hoechst 33258染色后,用荧光显微镜观察,发现臭椿酮作用后能够使A375细胞染色质出现固缩,从而表现为荧光高亮;Annexin V-FITC/PI双染后,用流式细胞仪检测,发现臭椿酮作用后使A375细胞早期凋亡和晚期凋亡的细胞占比均增高;用分光光度法检测caspase-3和caspase-9的活性,发现臭椿酮作用后与正常组对比,能够使caspase-3和caspase-9的活性明显升高。以上结果说明臭椿酮能够诱导人黑色素瘤A375细胞凋亡。
PI3K/Akt信号通路通过多种途径参与调控细胞凋亡,其作用机制主要有三个:(1)活化的Akt使促凋亡蛋白Bad磷酸化,使其与伴侣蛋白结合,从而阻断其与Bcl-2形成二聚体,最终导致Bad促凋亡作用丧失;(2)调控细胞周期,从而促进细胞增殖。Akt磷酸化可以激活其下游分子mTOR,激活的mTOR可以将信号传递给S6K1和4E-BP1,S6K1和4E-BP1活化后会使细胞由G0/G1期进入S期,进而促进细胞增殖;(3)在凋亡信号的刺激下,线粒体渗透性转换孔开放,线粒体膜通透性增加,线粒体膜电位下降,细胞色素C释放,激活caspase级联反应,继而导致细胞凋亡。Akt激活后能够抑制细胞色素C的释放,从而产生抗凋亡的作用[20]。本研究发现,臭椿酮作用A375细胞后,对总PI3K和Akt的表达没有明显影响,但是使磷酸化PI3K和Akt表达明显下降,并且当臭椿酮和PI3K抑制剂LY294002联用后,使磷酸化PI3K和Akt表达下降更为明显,并且凋亡的细胞数明显增加,进一步说明PI3K/Akt信号通路参与臭椿酮诱导的人黑色素瘤A375细胞凋亡。
综上所述,臭椿酮对人黑色素瘤A375细胞的增殖有明显的抑制作用,并且能够诱导其凋亡,主要通过上调caspase-3和caspase-9的活性和使PI3K/Akt信号通路失活来实现。我们的实验结果表明,臭椿酮具有体外抗黑色素瘤细胞的作用,为开发抗黑色素瘤的药物提供了理论依据。
