秦皮甲素对AGEs致损的ECV304细胞增殖及氧化应激的影响
2019-09-05夏大静
李 甘,夏大静
1楚雄州人民医院输血科,楚雄 675000;2浙江大学公共卫生学院,杭州 310058
糖基化终末代谢产物(AGEs)是葡萄糖与各种蛋白质、核酸或脂质大分子在非酶的条件下形成的糖基化代谢产物,该反应在体内可缓慢进行,随着年龄的增长而逐渐增加,而在糖尿病或尿毒症患者中该反应速度显著加快,形成量明显增多。AGEs可以通过多种机制对全身许多组织及器官产生损害,在糖尿病中研究较多,被认为是糖尿病血管病变的触发因素[1]。AGEs通过作用于血管内皮细胞,可以使其结构和功能受到影响。有多种阻止AGEs累积与形成的治疗方法,降糖药如二甲双胍[2]、氨基胍类化合物、ALT 946吡哆胺(pyridoxamine)等[3],它们分别可以通过不同途径阻滞AGEs形成,而AGEs裂解剂可以裂解已经形成的AGEs交联结构。有研究表明[4],AGEs抑制剂以及AGEs交联结构裂解剂,可以从不同的阶段阻断AGEs的形成,特别是AGEs裂解剂能够逆转或软化由AGEs造成的组织、器官以及血管的硬化,有希望成为一类新型治疗药物,尤其针对眼底和肾组织的终末血管变化。
秦皮甲素(Esculin)为木犀科植物苦枥白蜡树(FraxinusrhynchophyllaHance)、白蜡树(FraxinuschinensisRoxb.)、尖叶白蜡树(FraxinusszaboanaLingelsh)或宿柱白蜡树(FraxinusstylosaLingelsh.)等4种干燥枝皮或干皮提取物。最早见于汉代的药学专著《神农本草经》,中国《本草纲目》对该味药的表述为:“秦皮,治目病,惊癎,取其平木也。”同时也有《淮南子》:“秦皮色青,治目之要药也”。现代药理研究表明[5],秦皮具有抗炎镇痛、降低尿血酸、抗凝、止咳祛痰平喘以及抗肿瘤作用,主要用于治疗肠炎、痢疾、白带、慢性气管炎、结膜炎,用于治疗痛风效果甚佳。秦皮中主要成分为香豆素类(含秦皮甲素、秦皮乙素、秦皮苷、秦皮素、宿柱白蜡苷、6,7-二甲氧基香豆素等)[6],此外还有酚类、皂苷和鞣质等。秦皮甲素可以改善链脲菌素(Streptozotocin,STZ)诱导的糖尿病小鼠的血脂异常、炎症反应、以及肾损伤[7]。有文献证明AGEs通过损伤内皮细胞可导致内皮细胞功能紊乱,最终引起糖尿病等血管并发症的发生[8]。基于糖尿病以及终末肾病中AGEs的大量生成及所产生的生物学效应。本实验应用AGEs作用人脐静脉内皮细胞系(ECV304),模拟糖基终末化产物对内皮细胞的损伤,并用秦皮甲素干预,观察对ECV304增殖和氧化应激指标的影响。考察秦皮甲素对AGEs损伤后内皮细胞功能的研究,探讨其机制是否与抑制糖基化终末产物(AGEs)的生物学活性有关,将有助于进一步阐明秦皮甲素是否存在潜在的血管保护作用,为进一步的临床应用奠定基础。
1 材料和方法
1.1 主要试剂
秦皮甲素,成都曼思特生物科技有限公司(货号:A0020,纯度:HPLC≥98%);无水乙醇,北京化学试剂厂;青霉素,华北制药有限公司;链霉素,华北制药有限公司;磷酸盐缓冲液(PBS,pH7.4),福州迈新生物技术开发有限公司;超氧化物歧化酶(SOD)试剂盒(货号:20180326)、活性氧(ROS)测定试剂盒(化学荧光法)(批号:20180326)、丙二醛(MDA)试剂盒(批号:20180326)、一氧化氮(NO)测定试剂盒(批号:20180326)、乳酸脱氢酶(LDH)试剂盒(批号:20180326)、甘油三酯(TG)测定试剂盒(批号:20180326)、低密度脂蛋白胆固醇(LDL)(批号:20180326)、总胆固醇(CHO)测定试剂盒(批号:20180326)均由南京建成生物工程研究所提供;非对称二甲基精氨酸(ADMA)检测试剂盒为美国CUSABIO公司提供(批号:CSB-E09298h);ECV304细胞为宁波医学科学研究所药理室赠送,经免疫荧光鉴定,eNOS和vWF均为阳性;DMEM培养基,Trypsin,胎牛血清 (FBS)均购自Life technology公司;溴乙锭(EB)、CCK-8为Dojindo产品;二甲亚砜购自国药化学试剂有限公司;Trizol试剂购自invitrogen公司;逆转录及SYBR Green I Real Time PCR试剂购自大连宝生物公司;引物由GENEWIZ(金唯智)合成;血管内皮细胞粘附因子-1(VCAM-1,货号:ab212937)和细胞间粘附因子1(ICAM-1,货号:ab171123)抗体均为Abcam公司产品。
1.2 实验方法
1.2.1 AGEs的制备
参照文献的方法[9],用冻干牛血清白蛋白和糖制备无内毒素的糖基化修饰的牛血清白蛋白(AGE-BSA)。
1.2.2 细胞培养
ECV304的培养液为含10% FBS的DMEM培养基,用0.25% 的胰蛋白酶消化传代后,将ECV304置37 ℃、5% CO2培养箱内静置培养,2天换液1次。实验所用细胞为第6~8代。
1.2.3 CCK-8检测细胞活力
取对数生长期细胞制成单细胞悬液,以150 μL/孔接种于96孔板,细胞数2×104/孔,培养24小时后,加入无血清的DMEM培养基,再孵育24小时使细胞生长同步进入休止期(同步化)。吸弃上清液,每组设置6个重复孔,分别加入不同浓度的AGEs达到终浓度(0、25、50、100、150、200、250 mg/L),培养24小时,CCK-8法观察不同浓度AGEs对ECV304增殖的影响。同一水平6孔并列,在加入终浓度为200 mg/L AGEs的同时分别给予终浓度为2.5 、5、10、15、20、25 mg/L的秦皮甲素溶液,并设AGEs培养组和DMEM对照组。在37 ℃饱和湿度5% CO2培养箱内培养48小时。取出后,每孔加入16.7 μL CCK-8溶液,37 ℃孵箱继续培养4小时,用酶标仪检测波长450 nm时的光密度值[D(450)值]。
1.2.4 氧化应激指标及其相关指标检测
按照试剂盒说明书收集细胞和培养基上清检测相应指标: ROS、MDA、LDH、LDL、CHO、TG。对细胞裂解物中的SOD进行检测。
1.2.5 血管粘附分子检测
免疫印迹检测VCAM-1和ICAM-1的表达水平,过程如下:细胞在AGEs和秦皮甲素共同孵育24小时,使用RIPA法裂解,收集细胞裂解液。裂解后,取3 μL裂解液用于二喹啉甲酸法(BCA)定量。蛋白样品95 ℃孵育10分钟变性处理,变性后的蛋白-20 ℃保存备用。制备10%的SDS-page胶,进行电泳分离。蛋白分离后经200 mA恒流1.5小时电转移到PVDF膜后,使用含5%脱脂牛奶的封闭液封闭1小时,与一抗4 ℃孵育过夜,次日加入内参抗体β-actin室温孵育1小时,洗膜后加入含二抗室温作用1小时后,TBST洗膜3次,取出膜后加入ECL发光液,暗室中压片显影。使用Image J软件对条带灰度值进行量化分析,ELISA法确定样本基本浓度。
1.2.6 RT-qPCR检测相关基因的表达
收集细胞,参照Trizol试剂说明裂解细胞后提取RNA。引物序列见表1。实时定量PCR 25 μL反应体系由以下成份组成:12.5 μL 2 × Power SYBR Green PCR Master Mix,1.0 μmol/L 上、下游引物,1 μL逆转录产物,超纯水构成。反应程序为:95 ℃ 10分钟;循环反应为95 ℃ 8 s,60 ℃ 40 s,40个循环,在各循环的60 ℃ 40 s步骤进行荧光检测;最后为融解曲线步骤。每个样品目的基因的表达域值与其内参基因表达域值的差ΔCt为其相对表达量。以2-ΔCt表示为目的基因在药物处理组的表达量与在正常组表达量的比值。

表1 实时定量 PCR 检测基因的引物序列
1.2.7 NO以及相关指标检测
应用Griess法对细胞上清液中NO水平进行检测。采用酶联免疫吸附试验对ADMA进行检测,操作严格遵循说明书实施。
1.2.8 统计学处理
本研究中实验重复3次以上,计量数据以平均值及标准差(mean±SD)表示,数据结果采用Prism6.0统计软件进行处理。组间具有方差齐性时,组间比较使用t检验,多组比较采用单因素ANOVA分析,方差不齐者采用非参数检验。P<0.05有统计学意义。
2 结果
2.1 秦皮甲素对内皮细胞增殖的影响
AGEs作用ECV304细胞24小时后,如图1A所示,与空白对照组相比,当AGEs浓度高于50 mg/L时,其存活率显著降低(P<0.05)。由图1B可知,不同浓度(2.5、5、10、15、20、25 mg/L)秦皮甲素作用于AGEs致ECV304损伤的细胞,当秦皮甲素的浓度高于15 mg/L时对AGEs致损的ECV304细胞有显著的保护作用(P<0.05),同时呈现剂量依赖性。

图1 秦皮甲素削弱AGEs对ECV304细胞抑制效应Fig.1 Esculin diminished the inhibitory effect of AGEs on ECV304 cells注:A:AGEs对ECV304细胞增殖的影响;B:甲素对AGEs致ECV304损伤影响。*代表与BSA组比较,P<0.05。Note:A:the effect of AGEs on the proliferation of ECV304 cells.B:the effect of esculin on AGEs-treated ECV304 cells.*Compared with the control group,P<0.05.
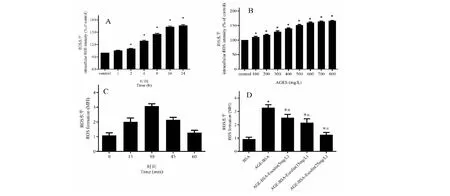
图2 秦皮甲素对AGEs诱导ROS形成的影响 Fig.2 Effect of esculin on ROS formation induced by AGEs 注:A:200 mg/L AGEs作用不同时间细胞内ROS的水平;B:不同浓度AGEs对细胞内ROS的生成的影响;C:秦皮甲素作用不同时间后对ECV304细胞内ROS生成的影响;D:秦皮甲素对AGEs作用后ECV304细胞内ROS水平的影响。*代表与control组比较,P<0.05 #代表与control组比较,P<0.05。Note:A:The level of intracellular ROS at different time after treatment with 200 mg/L AGEs.B:The effect of different concentrations of AGEs on the production of ROS in cells.C:The effect of esculin on ROS production in ECV304 cells at different time.D:The effect of esculin on ROS levels in ECV304 cells after AGEs treatment.*Compared with the control group,P<0.05.# Compared with the AGEs model group, P<0.05.
2.2 秦皮甲素对AGEs 诱导的活性氧以及相关酶的影响
测定秦皮甲素对AGEs致损的ECV304细胞中ROS、SOD、MDA、LDH等相关指标的影响。在AGEs作用下,随着AGEs作用时间的增加,细胞内ROS的浓度随之增加,呈现剂量与时间依赖性(如图2A和2B)。细胞中的ROS水平在秦皮甲素作用30分钟后出现下调趋势(图2C)。随着秦皮甲素作用浓度增加,ROS的水平呈现降低的趋势(图2D),相关酶的表达情况如图3所示,可以得出经AGEs处理过的细胞,其MDA,LDH,CHO,LDL,TG含量增加,SOD酶活性降低,与空白对照组比较有显著差异(P<0.01);而加入秦皮甲素后可提高SOD酶活力,降低MDA、LDH、CHO、LDL、TG含量,与AGEs模型组相比具有显著性差异(P<0.05)。

图3 秦皮甲素对氧化应激相关指标的影响Fig.3 Effect of esculin on oxidative stress related indicators 注:A:对SOD酶活性的影响;B:对MDA浓度的影响;C:对LDH浓度的影响;D:对CHO浓度的影响;E:对LDL浓度的影响;F:对TG浓度的影响。*代表与control组比较,P<0.05,#与AGEs模型组比较,P<0.05。Note:A:Effect of esculin on SOD enzyme activity.B:Effect of esculin on MDA concentration.C:Effect of esculin on LDH concentration.D:Effect of esculin on CHO concentration.E:Effect of esculin on LDL concentration.F:Effect of esculin on TG concentration.*Compared with the control group,P<0.05.# Compared with the AGEs model group,P<0.05.
2.3 AGEs 对血管粘附因子表达的影响
在AGEs 作用下VCAM-1和ICAM-1明显增高,只加入秦皮甲素不会导致VCAM-1和ICAM-1的上升。在添加AGEs的培养基中加入秦皮甲素可以发现,VCAM-1和ICAM-1的含量下降,且VCAM-1随秦皮甲素浓度增加下调趋势明显,而ICAM-1随秦皮甲素加入降低效果不明显,在15 mg/L秦皮甲素处理时ICAM-1含量高于AGEs组。表明秦皮甲素选择性抑制内皮粘附因子的表达。RT-qPCR检测VCAM-1 mRNA和ICAM-1 mRNA的表达结果发现,在AGEs 作用下VCAM-1 mRNA和ICAM-1 mRNA的表达显著上调,表达量分别是对照组的5.9±0.2和4.4±0.7倍,在添加AGEs的培养基中加入秦皮甲素后可以发现,VCAM-1 mRNA的表达显著下调,25 mg/L秦皮甲素处理组的VCAM-1 mRNA表达量仅为对照组的1.4±0.03倍,ICAM-1 mRNA随秦皮甲素浓度增加降低效果不明显。
2.4 秦皮甲素对细胞上清液中NO和ADMA的影响
AGEs(200 mg/L)处理内皮细胞可显著升高细胞培养上清液中ADMA水平,同时下调NO水平。与AGEs(200 mg/L)处理组相比较,可以得到秦皮甲素(25 mg/L)处理组内皮细胞的ADMA水平呈现明显的下调,有显著性统计意义(P<0.05);而秦皮甲素(25 mg/L)处理组内皮细胞NO水平与AGEs(200 mg/L)处理组相比较则明显的升高(P<0.05)。
3 结论
研究表明,在糖尿病并发症以及心血管疾病的发生发展中,AGEs通过与其配体结合,通过多种细胞途径,对内皮细胞造成损伤。在糖尿病并发症过程中具有重要意义[10]。有不少研究显示,天然植物中存在可抑制AGEs形成的活性物质,如VB6[11],粳稻的提取物[12]都可一定程度上削弱AGEs对血管,肾等器官的损伤,探索抑制AGEs的活性物质在糖尿病并发症的防治中有着重要的意义。
在本研究中,通过构建AGEs培养的人脐静脉内皮细胞显示,高浓度的AGEs可对ECV304细胞造成显著的损伤。在50 mg/L浓度时,即可对细胞增殖造成影响。有研究显示高浓度的AGEs可诱导ECV304细胞凋亡,并与处理时间和浓度相关[8]。加入AGEs后,脐静脉内皮细胞ROS含量,MDA以及LDH含量随即增加,提示在细胞水平存在损伤,与文献相符[13]。在加入AGEs同时,给予不同浓度的秦皮甲素溶液处理,在一定浓度区间内(15~25 mg/L),细胞增殖率有显著差别,同时,前几项指标出现显著下降。降低了由AGEs引起的LDH,MDA增加,提示秦皮甲素对细胞的保护作用,且具有剂量依赖性。有研究显示,秦皮甲素对DPPH等自由基有较强的清除能力[14],可较好拮抗AGEs带来的负面效应。本研究进一步证实,秦皮甲素可以抵抗由AGEs诱导的细胞内ROS生成,并与浓度有关。

图4 秦皮甲素对血管粘附有关分子表达的影响Fig.4 Effect of esculin on expression of vascular adhesion related molecules注:A:不同处理组ICAM-1蛋白的表达水平;B:不同处理组VCAM-1蛋白的表达水平;C:不同处理组ICAM-1 mRNA的表达水平;D:不同处理组VCAM-1 mRNA的表达水平。*代表与control组比较,P<0.05,#代表与AGE-BSA组比较,P<0.05。Note:A:Expression levels of ICAM-1 protein in different treatment groups.B:Expression levels of VCAM-1 protein in different treatment groups.C:Expression levels of ICAM-1 mRNA in different treatment groups.D:Expression levels of VCAM-1 mRNA in different treatment groups.*Compared with the control group,P<0.05.# Compared with AGE-BSA group,P<0.05.
AGEs作用内皮细胞后还可以增加LDL和HDL的糖基化,影响脂质代谢[15 ],在本次实验中,检测脂代谢相关指标CHO,LDL和TG显示,加入秦皮甲素后显著改善LDL和TG水平,但不同浓度间未见有统计学显著。可见,秦皮甲素在一定程度上可以改善由AGEs引起的脂质代谢紊乱。
本次实验还检测了细胞粘附分子ICAM-1和VCAM-1水平。AGEs与RAGE结合后,可通过核因子kB(NF-kB)引起ICAM-1和VCAM-1表达水平的增高[16],诱导平滑肌细胞的增殖。加入秦皮甲素后可显著抵抗由AGEs诱导的VCAM-1水平增加,而对ICAM-1改变并不明显。在某种程度上抑制平滑肌增生。
内皮细胞产生的缩血管因子和舒血管因子之间的平衡是内皮细胞功能正常的标志。NO起舒张血管平滑肌,保持血管正常功能。ADMA做为L-精氨酸类似物,与精氨酸竞争性地抑制活性,达到减少NO生成,调节NO的生成起着重要作用[17],ADMA浓度增加时,NO的生成减少。近年来大量的研究证实ADMA也可作为是内皮功能不全的主要标志之一[18],也是心血管疾病以及糖尿病血管损伤的危险因子。研究显示[19],体外培养的内皮细胞中加入AGEs后,NO生成减少和eNOS蛋白表达下调,而ICAM-1的水平增加,本研究中发现,秦皮甲素加入后一定程度上抵抗由AGEs诱导的NO下调,同时可以减少ADMA的上调。
综上,在本研究中,我们发现秦皮甲素可以从抑制氧化应激,脂质糖基化,抑制血管平滑肌增生,维持血管正常功能等方面保护血管内皮细胞免受AGEs的损伤,通过降低ROS水平,增加抗氧化应激酶SOD含量,NO的水平等抵抗由于AGE对血管带来的负面影响。可以考虑将秦皮甲素作为糖尿病并发症防治的候选化合物进行深入研究,从而达到控制AGEs的效应,减少糖尿病患者血管的损伤的效果。
