基于丝状支原体丝状亚种P35反应原性的验证及其间接ELISA方法的建立
2019-09-04赵雅芝郝文君辛九庆
闫 磊,潘 巧,赵雅芝,郝文君,李 媛,辛九庆*
(1.吉林农业大学动物科技学院,吉林长春130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物支原体病创新团队,黑龙江哈尔滨150069)
牛传染性胸膜肺炎(Contagious Bovine Pleuropneumonia,CBPP)是由丝状支原体丝状亚种(Mycoplasma mycoidessubsp.Mycoides,Mmm)感染引起牛的一种烈性传染疾病[1]。该病感染导致牛的肺部和呼吸道严重病变,发病率和死亡率极高[2],被世界动物卫生组织(OIE)规定为必需报告的疾病[3]。早在1765年就有人描述过CBPP的临床症状,直到1773年才真正发现和认识了CBPP并对感染牛进行扑杀来控制该病[4]。CBPP在中国从19世纪20年代开始流行,1958年开始在全国各地大规模使用CBPP兔化弱毒苗和CBPP兔化-绵羊化适应菌苗高密度接种以来,已基本控制和消灭CBPP,到目前一直没有发现CBPP的病例[5]。2011年经OIE认可我国为无CBPP(简称“牛肺疫”)国家[6],成为世界上第7个无牛肺疫的国家。本实验室作为CBPP国家参考实验室,每年会对该病进行全国范围的监测,并且一直致力于CBPP诊断试剂的研发工作。本研究利用生物信息学技术分析选定了Mmm表面脂蛋白P35,并建立了间接ELISA方法,为CBPP流行病学监测提供了一个候选技术手段。
1 材料与方法
1.1 菌株与血清 Mmm Ben-1菌株的核酸、CBPP阳性血清80份、阴性血清300份,牛鼻支原体(MB)阳性血清、牛无乳支原体(Ma)阳性血清、牛支原体(M.bovis)阳性血清、质粒pET-28a、感受态细胞DH5α和BL21(DE3)均由国家CBPP参考实验室制备并保存。口蹄疫(FMD)阳性血清、牛病毒性腹泻病毒(BVDV)阳性血清、牛传染性鼻气管炎病毒(IBRV)阳性血清均由中国农业科学院哈尔滨兽医研究所牛羊传染病创新团队提供。
1.2 主要试剂 Mmm Antibody Test Kit(cELISA)购自北京元亨生物科技有限公司;DNA提取试剂盒、DNA柱式胶回收试剂盒、His标签蛋白纯化试剂盒购自哈尔滨牧乐生物技术有限公司;限制性核酸内切酶BamHⅠ、SalⅠ、DNA连接酶购自宝生物工程(大连)有限公司;兔抗牛IgG-HRP、底物显色液(TMB)购自Sigma公司;酶标板购自Jetbiofil公司。
1.3 重组质粒的构建与鉴定 参考菌株Mmm Ben-1基因组(AME10749.1)序列,根据0584基因设计一对引物(P1:5'-CGGGGATCCAAAAAACTAT TAACTATTTTAAGT-3'/P2:5'-CAGGTCGACATTAG AAGATTCAGTAGTATTAGT-3');以 Mmm Ben-1基因组为模板扩增目的基因,并回收PCR产物,经限制性内切酶BamHⅠ和SalⅠ双酶切后克隆于pET-28a中,构建重组质粒pET-28a-P35,经双酶切鉴定为阳性的重组质粒由哈尔滨擎科公司测序鉴定。
1.4 重组蛋白rP35的制备与反应原性的检测
1.4.1 重组蛋白rP35的制备 将pET-28a-P35转化至大肠杆菌表达菌BL21中,培养菌液OD600nm值至0.4~0.6时,加入IPTG至终浓度为1 mmol/L,37℃诱导约6 h。收集菌体(8 000 r/min),超声破碎,4℃离心(8 000 r/min)15 min,收集上清,利用His标签蛋白纯化试剂盒纯化蛋白后经超滤浓缩去除咪唑后用BCA蛋白定量试剂盒定量。
1.4.2 Western blot试验 将纯化的rP35蛋白经SDS-PAGE凝胶电泳后,转移到硝酸纤维素膜上,经过含5%鱼明胶4℃封闭过夜,以CBPP阳性血清(1∶50)为一抗,兔抗牛 IgG-HRP(1∶8 000)为二抗,DAB显色,对rP35蛋白进行western blot分析。
1.4.3 Dot-blot试验 取纯化后的rP35蛋白10 μL、BCA标准品蛋白(稀释至与rP35蛋白相同浓度)10 μL,不经过煮沸裂解直接点于硝酸纤维素膜上,干燥固定,参照1.4.2操作,进行dot-blot分析。
1.5 间接ELISA方法的建立
1.5.1 反应条件的优化 采用棋盘滴定法,对rP35蛋白的包被浓度(10 μg/mL~0.075 μg/mL,100 μL/孔)、抗原的包被时间、封闭液的选择和作用时间、CBPP阳性血清和阴性血清(PBS缓冲液稀释)稀释倍数(1∶20~1∶640,100 μL/孔),最佳作用时间、酶标二抗稀释倍数和作用时间、底物反应时间等进行优化。
1.5.2 临界值的确定 采用已确定的最佳ELISA反应条件对80份已知CBPP阳性血清与80份阴性血清进行ELISA试验,并设立阳性和阴性对照。计算S/P值(样品OD450nm-阴性OD450nm)/(阳性OD450nm-阴性OD450nm),利用MedcAlc软件进行统计学分析,确定cut-off值。
1.5.3 特异性试验 利用已建立的rP35间接ELISA方法分别检测 Ma、M.bovis、FMD、MB、BVDV、IBRV等阳性血清,每份样品重复3孔,同时设立CBPP阳性血清和阴性血清对照,判断是否有交叉反应。
1.5.4 敏感性试验 将CBPP的阳性血清从1∶20开始2倍倍比稀释至1∶2 560,采用已建立的间接ELISA方法进行检测,同时设立阳性与阴性对照,分析该ELISA方法的敏感性。
1.5.5 重复性试验 批内重复性试验:取8份抗体水平不同的CBPP血清,用同一批次包被的酶标板,按照建立的间接ELISA方法对每份血清进行3次重复性试验,结果进行统计学分析。批间重复性试验:将上述8份血清,用不同批次包被的酶标板,按照建立的间接ELISA方法对每份血清进行3次重复性试验,结果进行统计学分析。
1.5.6 符合率试验 采用本实验建立的rP35间接ELISA方法和商品化试剂盒(cELISA方法)对80份已知CBPP阳性血清和300份已知阴性血清进行检测,比较两者之间符合率。
2 结果
2.1 重组质粒的构建与鉴定 以菌株Mmm Ben-1 DNA为模板,利用引物P1/P2 PCR扩增,结果显示扩增的目的条带约为540 bp,与预期大小一致(图1A)。将目的基因克隆于pET-28a中构建重组质粒并对其双酶切鉴定,结果显示得到一条约5 500 bp和一条约540 bp的两条DNA片段,与预期相符(图1B)。重组质粒pET-28a-P35测序结果与Mmm Ben_0584基因序列进行比对分析结果显示,同源性为100%。表明正确构建了重组质粒pET-28a-P35。
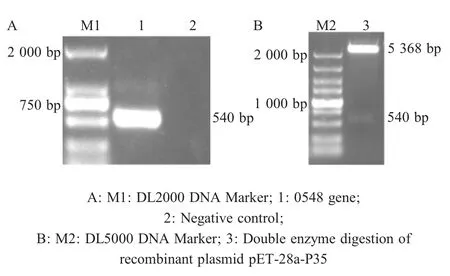
图1 重组质粒pET-28a-P35的构建与鉴定Fig.1 Construction and identification of recombinant plasmid pET-28a-P35
2.2 重组蛋白rP35的制备与免疫反应原性的检测结果
2.2.1 重组蛋白rP35的制备 对重组菌pET-28a-P35/DE3在37℃条件下经IPTG诱导,纯化后经SDS-PAGE分析,结果显示在约35 ku处出现目的条带,与预期大小一致(图2)。表明制备了重组蛋白rP35。经测定重组蛋白浓度为2.5 mg/mL。
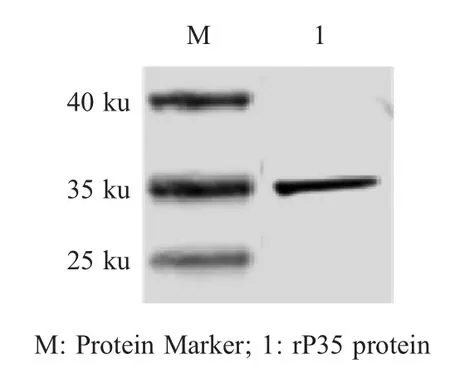
图2 rP35纯化后SDS-PAGE分析Fig.2 SDS-PAGE of the purified recombinant protein rP35 by SDS-PAGE
2.2.2 Western blot试验 rP35蛋白经SDS-PAGE电泳后,电转移到硝酸纤维素膜上,利用western blot检测rP35蛋白的免疫反应原性,结果显示未出现特异性目的条带(图略)。表明该蛋白经过煮沸变性后进行的western blot试验未与CBPP阳性血清发生反应。
2.2.3 Dot-blot试验 将纯化的rP35蛋白和BCA蛋白分别点在硝酸纤维素膜上,进行dot-blot试验,结果显示点rP35蛋白处出现了特异性的斑点(图3)。对比2.2.2结果,表明该蛋白可能是因为高温煮沸后构象发生了改变,从而丧失抗原性,而dot-blot试验未经高温变性所以具有免疫反应原性。
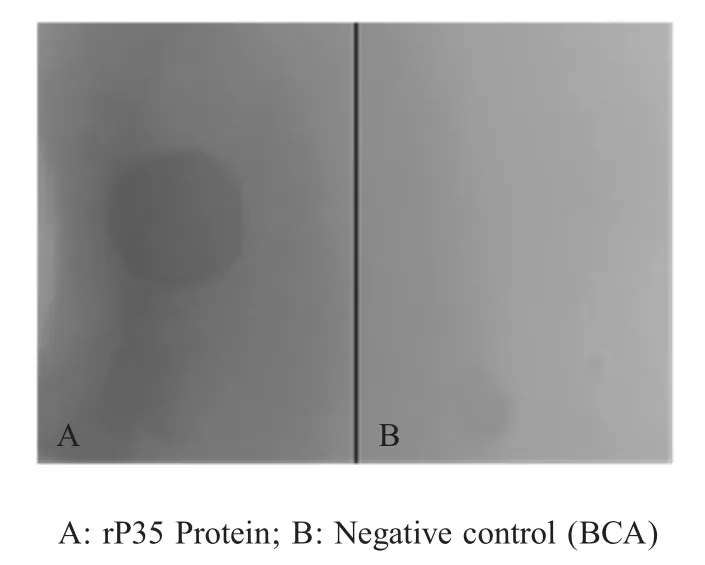
图3 rP35的dot-blot分析Fig.3 Dot-blot analysis of the purified recombinant protein rP35
2.3 间接ELISA方法的建立
2.3.1 最适反应条件的确定 采用棋盘滴定法进行ELISA条件优化,最佳反应条件见表1。
2.3.2 临界值的确定 将80份已知的阳性血清与80份阴性血清,利用rP35-iELISA方法检测后,将OD450nm转化成S/P值汇集于MedCalc软件中进行交互式点状式分析(图4),结果显示,当敏感性为89.8%、特异性为88.0%时,cut-off值为0.46,因此当血清样品的S/P值大于0.46时,判定为阳性,当血清样品的S/P值小于0.46时,判定为阴性。
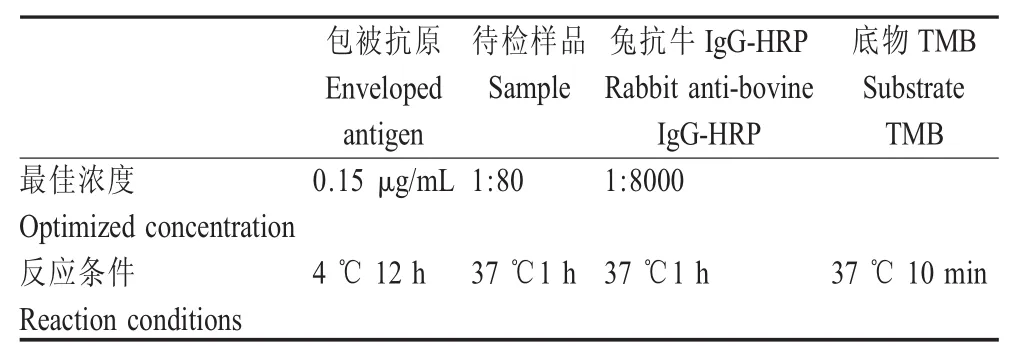
表1 间接ELISA最适反应条件的确定Table 1 Determination of optimum conditions
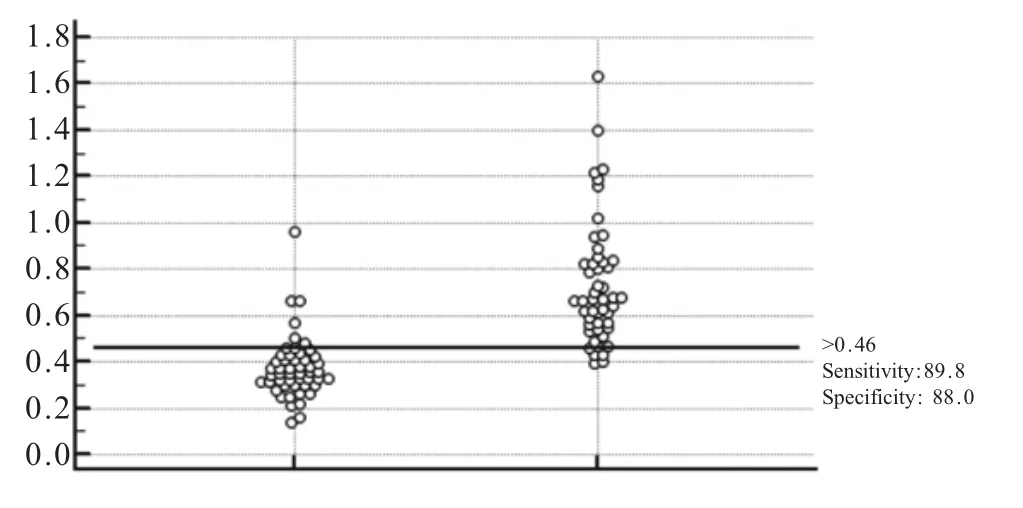
图4 用MedCalc统计学软件对间接ELISA的数据进行交互式点状分析Fig.4 Interactive point analysis of indirect ELISA data using MedCalc statistical software
2.3.3 特异性试验结果 采用本实验建立的rP35-iELISA方法对牛源性其它常见疾病阳性血清进行特异性检测,结果显示,rP35-iELISA检测方法除Mmm阳性外,均不与 M.bovis、Ma、FMD、MB、BVDV、IBRV等的阳性血清发生交叉反应(图5),结果表明该方法具有较强的特异性。
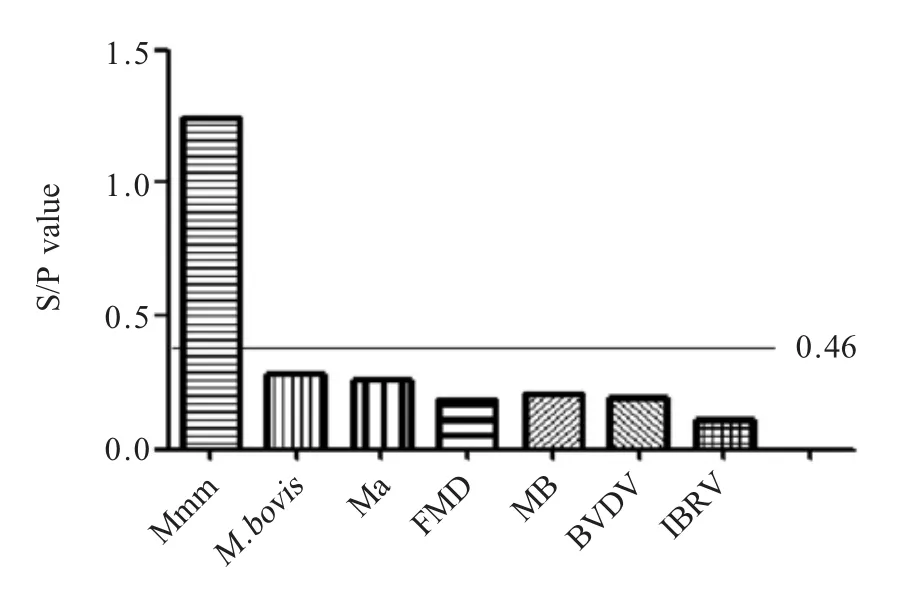
图5 特异性试验结果Fig.5 Cross-reactivity test of rP35-iELISA
2.3.4 敏感性试验结果 采用rP35-iELISA方法对1.5.4中选取的一份不同稀释度的CBPP阳性血清进行检测,评估rP35-iELISA方法的敏感性,结果显示当阳性血清稀释度为1∶640仍检出为阳性,S/P值大于0.46,当1∶1 280稀释时检出为阴性,S/P值小于0.46,即最低检测下限的阳性血清稀释度为1∶640(图6),表明该方法具有较高的敏感度。
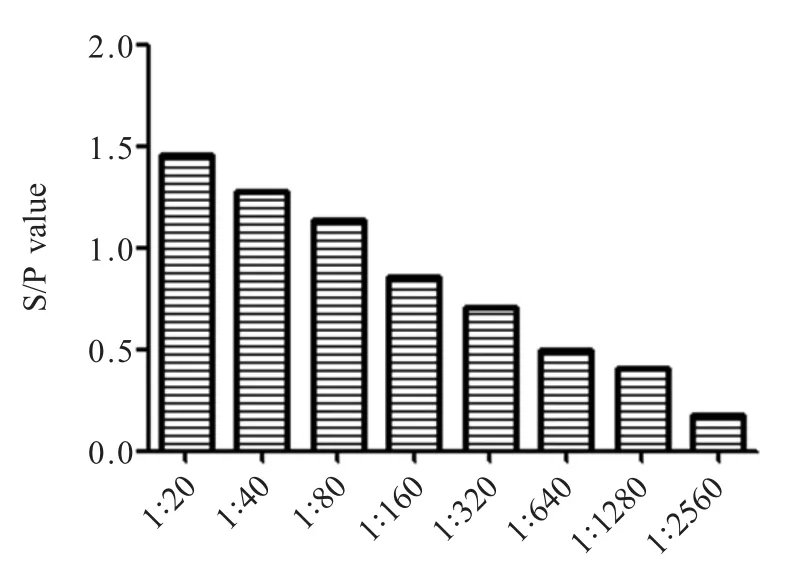
图6 敏感性试验结果Fig.6 Sensitivity test of rP35-iELISA
2.3.5 重复性试验 对1.5.5中所述8份血清样品用rP35-iELISA方法分别进行批内、批间重复性试验。结果显示批内变异系数在0.88%~6.84%,批间变异系数在1.74%~7.73%(表2),表明同一份血清在同一块或不同块酶标板上的变异程度很小,该方法具有良好的重复性。
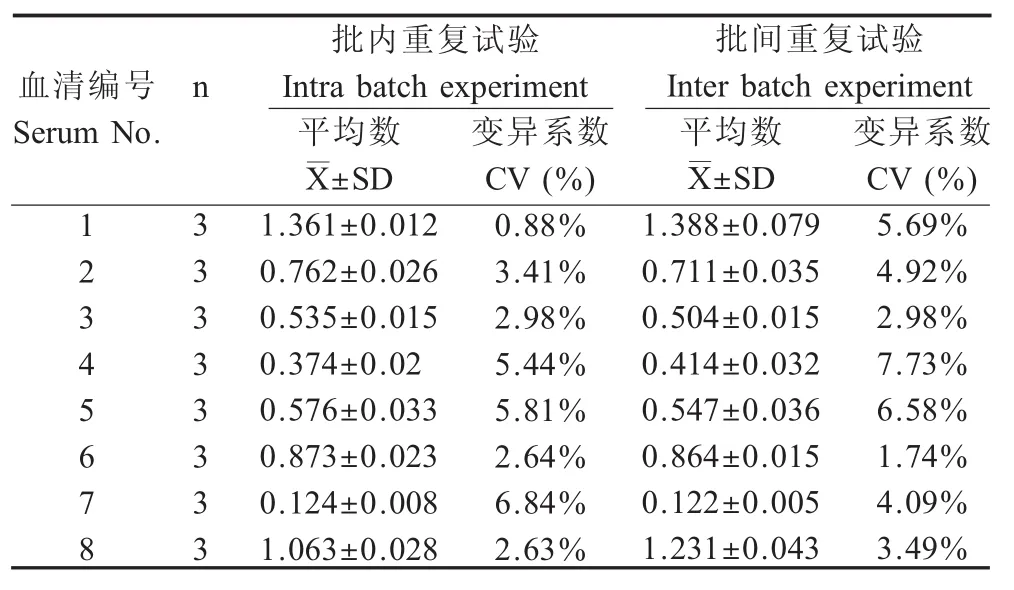
表2 重复性结果Table 2 Repetitive results
2.3.6 符合率试验 采用rP35-iELISA方法和cELISA检测方法分别对已知血清同时进行检测,结果显示,二者阳性符合率为80.60%,阴性符合率为89.60%,总符合率为84.8%。表明两者具有较高的符合率,本实验建立的rP35-iELISA方法可以用于临床样品检测。
3 讨论
我国虽已消灭了“牛肺疫”,但根据OIE要求我国每年依然在对其进行全国范围的监测工作。目前在CBPP血清学诊断技术研究方面报道了几种血清学方法,其中包括玻片凝集试验(SAT)、补体结合试验(CFT)、琼脂扩散试验(AGP)、被动血凝抑制试验(PHA)和微量凝集试验(MA),但这些检测方法也有它自身的局限性[7]。OIE推荐的血清学检测方法包括CFT[8]和cELISA[9],其中cELISA试剂盒是检测CBPP血清抗体的唯一商品化试剂盒。由于我国每年开展CBPP流行病学监测工作需要检测大量的血清样品,而进口试剂盒价格昂贵并存在供货不及时等诸多问题,因此研制拥有自主知识产权、敏感性、特异性好的CBPP血清抗体ELISA检测试剂盒是一种非常迫切的现实需要。
由于脂蛋白的抗原性较强,常被应用于血清学诊断,因此受到国内外学者的广泛关注。目前Mmm的一些脂蛋白已经被详细研究,包括LPPA、LPPB、LPPC、LPPQ以及Vmm在抗原性和基因的特征方面已经研究得比较详细[10]。本实验在鉴定rP35蛋白反应原性时western blot试验结果显示为阴性,但dot-blot试验结果为阳性,推测其原因可能是原核表达的重组蛋白空间构象形成并不稳固,在煮沸和变性后发生构象改变[11],其抗原性可能是依赖于蛋白的空间构象,因此western blot试验结果为阴性;而Dot-blot试验没有经过变性过程,因此其结果为阳性。而这种现象在本实验室对多个支原体重组蛋白进行反应原性鉴定时均出现过。
对于临界值的判定很多研究报告采用的是计算阴性血清标准差的方法[12],本研究中通过对ELISA反应进行条件优化,采用MedCalc软件分析S/P值确定其临界值,该方法从理论上显著的减少实验人员操作过程与计算过程的误差,更为科学与方便[13]。本研究建立的rP35-iELISA方法和商品化试剂盒还存在一些差距,分析其原因为:商品化试剂盒使用的是针对性较强的单克隆抗体建立的竞争性ELISA方法,本研究选用重组膜蛋白rP35作为抗原建立的间接ELISA方法,其蛋白针对的抗体或许不一致,是造成两种检测方法差异的原因之一;此外本研究采用pET-28a载体表达目的蛋白,该载体中带有6个His标签,而His蛋白广泛存在于哺乳动物中,因此His蛋白可能干扰了检测结果。为此,在进一步的研究中将利用凝血酶切除rP35中的His蛋白,同时也将对P35的N端和C端的免疫原性进一步鉴定。总而言之,rP35蛋白具有成为CBPP抗体诊断试剂候选蛋白的潜在价值。
