表达RGD和MEL重组沙门氏菌的构建及其对B16细胞凋亡作用的研究
2019-09-04孟佳丽尚翠玲蓝肇煜王小月金天明
李 昕,孟佳丽,尚翠玲,李 丹,蓝肇煜,王小月,金天明
(天津农学院动物科学与动物医学学院,天津300384)
黑色素瘤(Melanoma)是死亡率极高的皮肤恶性肿瘤,在兽医临床上常见于老龄动物,在全球范围内发病率呈逐年上升趋势。其特点是恶性程度高、进展快,易远处转移,是一种对常规治疗药物具有较强的抗性,在临床治疗过程中颇为棘手的恶性肿瘤,对食品卫生和公共安全构成极大的危害。随着分子生物学、免疫学及相关学科的发展,基因治疗逐渐显示出巨大的优势,现已成为肿瘤治疗研究的热点[1-2]。黑色素瘤作为一种浅表性肿瘤,非常适用于基因治疗的观察和研究[3]。
减毒菌株鼠伤寒沙门氏菌(LH430,pho P/pho Q基因缺失)在敲除鼠伤寒沙门氏菌的pho P/pho Q基因后,菌株毒力与亲本菌株相比大为降低,但仍保留了亲本菌株的侵袭力,是适宜的疫苗及载体候选菌株[4]。基因敲除的减毒菌株具有减毒机理明确,毒力不返强,增殖周期短等优点,可以安全的用于临床治疗及其研究。
肿瘤靶向肽RGD是细胞能够识别的最小的蛋白质一级结构中所特有的结构单位,是细胞外基质与细胞整合素αvβ3间结合的强效竞争性拮抗剂。RGD可竞争性与整合素结合,抑制整合素与CDH17的结合,进而通过封闭整合素的细胞信号转导通路而抑制血小板聚集,最终达到抑制血管再生,实现抗肿瘤细胞增殖、黏附、迁移和浸润等作用,同时诱导肿瘤细胞发生凋亡[5]。蜂毒肽(Melittin,MEL)是蜂毒液中最主要的毒性成分。MEL可以阻断TGFβ/Smad和MAPK-JNK信号通路,从而通过抑制肝上皮-间质转化,进而抑制细胞癌变[6]。尽管MEL具有多种机制抑制肿瘤生长,但是由于其存在非特异性细胞毒性,以及细胞降解和溶血在内的若干问题,MEL的临床治疗应用受到限制。为了避免这些问题的出现,让MEL在到达肿瘤微环境后再释放出来,可以有效避免其对正常组织的伤害作用[7]。
鉴于以上所述,本研究选择编码MEL基因作为黑色素瘤的治疗基因,同时利用LH430和RGD的双靶向作用,构建了携带RGD-MEL双基因的减毒沙门氏菌LH430,以期降低蜂毒对正常组织伤害作用的同时保持MEL原有的治疗效果,从而实现其更有效更直接的抑瘤作用。
1 材料与方法
1.1 主要实验材料 沙门氏菌LH430由吉林大学基础兽医学实验室惠赠;重组质粒pMD-RGD-MEL和pMD-MEL(AmpR)由上海捷瑞生物工程有限公司合成;pEGFP-N1质粒(KanR)及小鼠黑色素瘤B16细胞由本实验室保存。
TRIzol Reagent购自美国Ambion公司;兔GFP抗体、GAPDH抗体购自美国Cell Signaling Technology公司;RGD-MEL肽、MEL肽由生工生物工程(上海)公司合成;SanPrep柱式质粒DNA小提试剂盒、SanPrep柱式DNA胶回收试剂盒均购自生工生物工程(上海)公司;限制性内切酶、T4 DNA连接酶购自Thermo Scientific公司;LipofectamineTM2000转染试剂购自Invitrogen公司;Annexin V-PE细胞凋亡检测试剂盒购自BD公司。
1.2 引物设计 根据GenBank中RGD基因序列(1FUL_A)和 MEL基因序列(AY745248.1)设计扩增RGD-MEL基因的引物,根据MEL基因序列(AY745248.1)设计引物,所有引物均由上海捷瑞生物工程有限公司合成(表1)。
1.3 重组沙门氏菌的构建 利用限制性内切酶BglⅡ和HindⅢ分别对重组质粒pMD-RGD-MEL和pEGFP-N1进行双酶切;利用限制性内切酶HindⅢ和EcoRⅠ分别对质粒pMD-MEL和pEGFP-N1进行双酶切。采用T4连接酶连接后分别获得pEGFPRGD-MEL、pEGFP-MEL重组质粒,参照文献[8]方法将上述两质粒和pEGFP-N1分别转化LH430感受态细胞,通过卡那霉素抗性筛选的阳性菌株,利用引物F1/R1、F2/R2进行PCR鉴定,并分别用BglⅡ/HindⅢ以及HindⅢ/EcoRⅠ进行酶切鉴定,阳性重组菌分别命名为LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL 和 LH430/pEGFP,50%甘油∶菌液 =1∶1混合均匀后,-80℃保存备用。
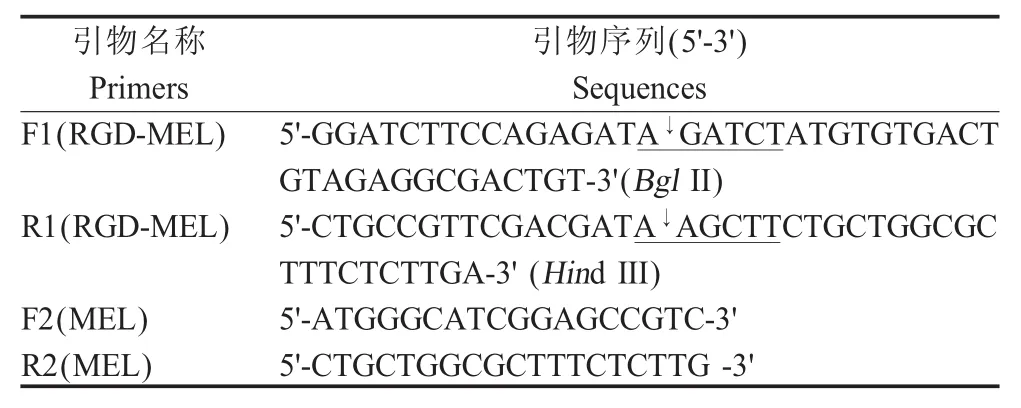
表1 本研究中所使用的引物Table 1 Primers used in this study
1.4 重组减毒沙门氏菌侵染B16细胞及其外源基因的检测 将小鼠黑色素瘤B16细胞分为4组,每组3孔,每孔1 mL(1×105个/mL)分别加入6孔板中,于10%FBS的RPMI1640完全培养基中培养,待细胞融合度达40%~50%时,用PBS洗涤2次,并用无抗RPMI1640培养液培养2 h,随后每孔分别接种100 μL(1 ×107cfu/mL)LH430/pEGFPRGD-MEL、LH430/pEGFP-MEL和LH430/pEGFP,于37℃孵育箱中共孵育3 h,之后用PBS洗涤细胞3次,每孔加入2 mL含10%FBS的RPMI1640完全培养基,于37℃再孵育3 h后加无抗RPMI1640培养液,培养6 h~24 h后利用荧光显微镜观察绿色荧光蛋白的表达情况[9]。采用TRIzol法从侵染48 h后的B16细胞中提取细胞总RNA,利用逆转录试剂盒获得cDNA后以其为模板,分别以F1/R1、F2/R2为引物,PCR检测目的基因,反应程序:95℃5 min、95℃ 30 s、60℃ 30 s;73℃ 1 min,35个循环,73℃ 15 min。
1.5 Western blot检测蛋白表达
1.5.1 各实验组目的蛋白表达的检测 本实验中将RGD-MEL基因和MEL基因分别融合表达于GFP基因前,借助GFP抗体可以间接检测RGD-MEL蛋白和MEL蛋白表达情况。分别取经重组菌LH430/pEGFP-RGD-MEL、 LH430/pEGFP-MEL 和LH430/pEGFP侵染48 h后的各组B16细胞,PBS洗涤,利用RIPA裂解液处理后提取细胞总蛋白,利用BCA蛋白定量试剂盒检测各组蛋白浓度后,调整上样体积使总蛋白浓度一致。总蛋白经SDS-PAGE电泳分离后,采用半干转膜法转膜,以1∶3 000稀释GFP抗体(鼠源)为一抗,1∶2000稀释的羊抗鼠IgG-HRP为二抗,进行western blot检测,采用ECL化学发光试剂盒在Bio-Rad凝胶成像仪上显影,拍照记录。同时每组设GAPDH为参照蛋白。
1.5.2 ELISA检测Caspase-3、Bcl2、Bax蛋白的表达状况 按1.5.1中方法提取LH430/pEGFP-RGDMEL、LH430/pEGFP-MEL和LH430/pEGFP、治疗肽组 RGD-MEL(40 μg/孔)、MEL(40 μg/孔)和 PBS侵染或处理的B16细胞总蛋白,测定蛋白浓度后将浓度调整一致。分别以稀释的Caspase-3、Bcl2、Bax抗体(兔源)(1∶1 000)为一抗,羊抗兔 IgG-HRP(1∶1 000)为二抗,利用ELISA方法检测各凋亡蛋白表达情况。同时每组设GAPDH为参照蛋白。
1.6 细胞凋亡实验 按照每孔1 mL B16细胞(1×105个 /mL)加入 6孔板,10%FBS的 RPMI1640完全培养基中培养至细胞融合度大于70%时分别加入 LH430/pEGFP-RGD-MEL(1×106cfu/孔)、LH430/pEGFP-MEL(1×106cfu/孔)、LH430/pEGFP(1×106cfu/孔)、治疗肽组 RGD-MEL(40 μg/孔)、MEL(40 μg/孔)和PBS作用24 h,PBS洗涤两次,收获细胞,调整细胞浓度至1×106/mL,取100 μL细胞分别经PE、7AAD染色后,按照流式细胞术操作方法检测细胞凋亡率,采用One-Way ANOVA统计方法对结果进行分析比较。
2 结果
2.1 LH430/pEGFP-RGD-MEL、LH430/pEGFPMEL构建及鉴定 提取携带pEGFP-RGD-MEL和pEGFP-MEL的重组菌中质粒,经PCR鉴定,酶切鉴定及测序,结果显示均获得大小为121 bp和94 bp的片段,与预期结果相符(图1)。表明重组质粒pEGFP-RGD-MEL和pEGFP-MEL正确构建,并转化减毒沙门氏菌LH430。
2.2 重组沙门氏菌侵染B16细胞检测结果 重组减毒沙门氏菌LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL和 LH430/pEGFP侵染B16细胞 48 h后细胞出现CPE,荧光显微镜观察可见细胞呈现绿色荧光;未侵染细胞状态正常,且在荧光显微镜下未观察到绿色荧光(图2)。同时观察可见携带RGD-MEL的重组菌侵染的B16细胞(图2B1、B2)绿色荧光表达量以及细胞出现CPE的数量明显高于仅携带MEL的重组菌(图2C1、C2)和仅携带空载体pEGFP的重组菌(图2D1、D2)。表明质粒 pEGFP-RGDMEL、pEGFP-MEL和pEGFP在B16细胞中表达,且经LH430/pEGFP-RGD-MEL侵染的细胞病变最明显。
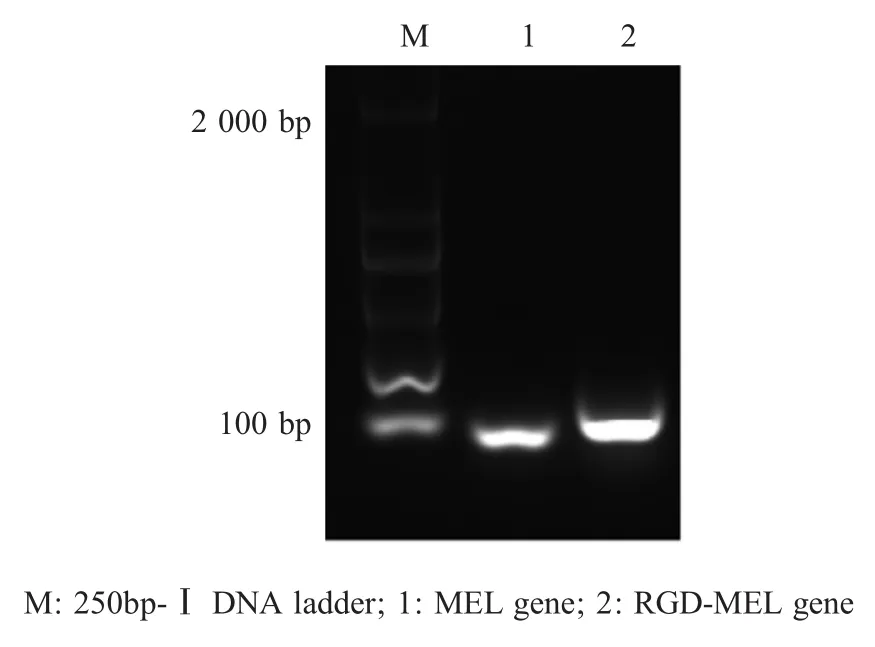
图1 PCR扩增RGD-MEL和MEL基因片段Fig.1 Amplification of RGD-MEL and MEL fragments by PCR
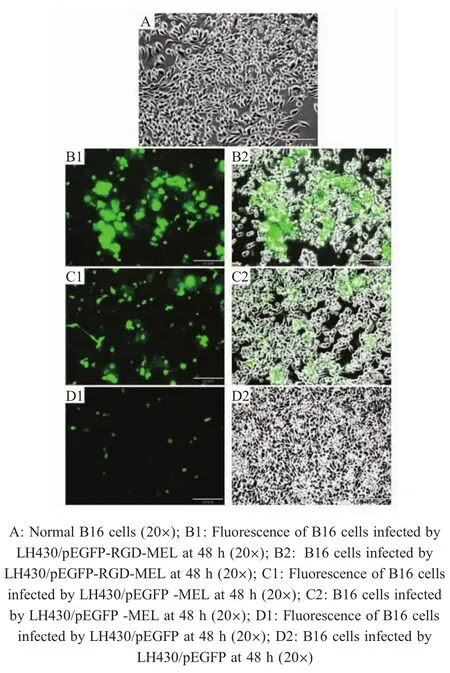
图2 重组减毒沙门氏菌侵染B16细胞后各组结果Fig.2 Images of B16 cells infected by various attenuated Salmonella recombinant strains
2.3 RT-PCR检测目的基因的结果 分别利用F1/R1,F2/R2为引物,PCR检测各重组减毒沙门氏菌 LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL侵染48 h后的B16细胞中RGD-MEL基因和MEL基因转录情况,结果显示获得大小为121 bp和94 bp的预期片段(图3)。表明pEGFP-RGD-MEL、pEGFPMEL在B16细胞中转录了RGD-MEL基因和MEL基因。
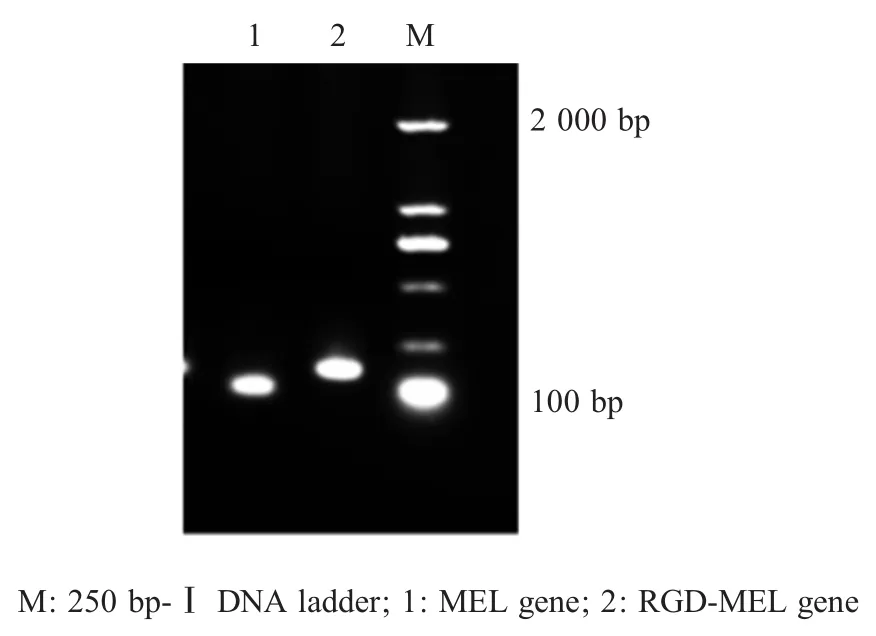
图3 重组沙门氏菌各目的基因RT-PCR检测结果Fig.3 Transcription of target genes examined by RT-PCR
2.4 Western blot检测蛋白表达的结果 Western blot检测经各重组沙门氏菌侵染的B16细胞中与GFP融合表达的RGD-MEL蛋白、MEL蛋白以及GFP蛋白表达情况,结果显示各组均在29 ku处出现特异性条带,与预期GFP融合表达的目的蛋白分子质量大小相当(图4)。表明LH430/pEGFP-RGDMEL、LH430/pEGFP-MEL和 LH430/pEGFP侵染组中,融合蛋白RGD-MEL-GFP,MEL-GFP和GFP蛋白正确表达。
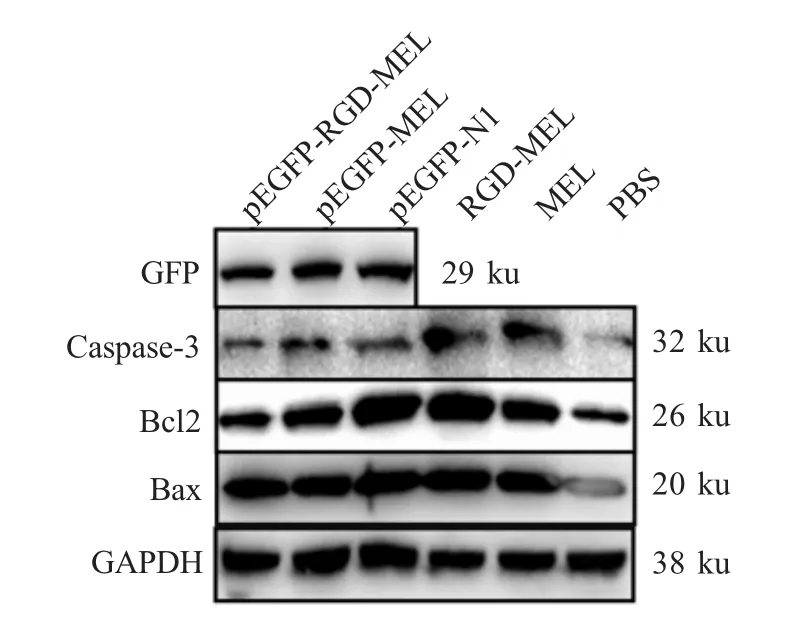
图4 Western blot检测各目的蛋白表达的结果Fig.4 Protein production examined by western blot
ELISA检测经各重组沙门氏菌、治疗肽组RGD-MEL、MEL和PBS处理的B16细胞中各凋亡蛋白状况。结果显示,以各组GAPDH表达量为参照,Caspase-3在各组中表达量分别为:0.22±0.06、0.22 ±0.01、 0.22 ±0.02、 0.47 ±0.07、 0.46 ±0.05、0.13±0.02;Bcl2 在各组中表达量为:0.65±0.04、0.73 ±0.07、 1.06 ±0.05、 1.15 ±0.04、 0.74 ±0.06、0.39±0.05;Bax 在各组中表达量为:1.34±0.15、0.99±0.04、 1.19 ±0.07、 1.49 ±0.15、 1.31 ±0.10、0.61±0.14(图4)。经过两两组间比较显示,与PBS组相比,LH430/pEGFP-RGD-MEL、LH430/pEGFPMEL、LH430/pEGFP、RGD-MEL肽和MEL肽组表达Caspase-3、Bcl2、Bax均显著增多(p<0.05)。其中RGD-MEL肽和MEL肽组Caspase-3的表达量,以及LH430/pEGFP和RGD-MEL肽组Bax的表达量分别较高于LH430/pEGFP-RGD-MEL组。表明LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL、LH430/pEGFP均可以引起细胞凋亡蛋白表达量的增多,与RGD-MEL肽和MEL肽作用效果基本一致,但是经过重组的减毒沙门氏菌LH430/pEGFP-RGD-MEL与RGD-MEL肽相比,诱导细胞凋亡的通路发生改变。
2.5 细胞凋亡实验结果 B16细胞分别被LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL、LH430/pEGFP、RGD-MEL肽、MEL肽和PBS侵染或者处理24 h后,利用流式细胞仪检测细胞凋亡(图5)。结果显示:上述各组诱导B16细胞的凋亡率分别为:48.60±0.75%、38.30±0.62%、32.00±1.16%、39.67±1.17%、18.17±0.45%、14.70±0.96%。各组凋亡率多重比较结果显示,各组诱导B16细胞的凋亡作用相对于PBS对照组均显著增强(p<0.05)(表2),其中LH430/pEGFP-RGD-MEL诱导B16细胞的凋亡作用最为显著(p<0.05)。表明 LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL、LH430/pEGFP均可以使细胞凋亡率上升。
3 讨论
寻找合适的靶向性载体和治疗基因是黑色素瘤基因治疗的核心和关键点。研究表明,肿瘤患者在细菌感染后会出现肿瘤生长抑制的现象[10]。鼠伤寒沙门氏菌,作为众多伤寒菌中的一种虽有致病性,但是不会使机体产生长时间的免疫反应,是最佳的载体菌株之一[11]。有研究表明,蜂毒肽可以通过调节肿瘤相关巨噬细胞来抑制肿瘤[12],但因其存在非特异性细胞毒性,使MEL在临床治疗中的应用受到限制。本研究中将RGD和MEL基因片段克隆至真核表达载体pEGFP-N1,并导入减毒鼠伤寒沙门氏菌LH430中构建出能够融合表达RGD和MEL蛋白的重组减毒沙门氏菌LH430/pEGFP-RGD-MEL。利用LH430和RGD提高MEL对癌细胞的靶向性,从而降低其对正常细胞的非特异性毒性。
表2 流式细胞术检测重组减毒沙门氏菌对B16细胞的凋亡作用(±S,n=3)Table 2 Apoptotic effects of attenuated Salmonella recombinant strains on B16 cells determined by flow cytometry

表2 流式细胞术检测重组减毒沙门氏菌对B16细胞的凋亡作用(±S,n=3)Table 2 Apoptotic effects of attenuated Salmonella recombinant strains on B16 cells determined by flow cytometry
注:a~e表示在p<0.05时,各处理组平均数从大到小排列,无相同字母组之间存在差异显著性(p<0.05,n=3);Note:The averages of each group were arranged in descending order,and were marked with letters from a toe,respectively.There is significant difference between groups with different letters(p<0.05,n=3).
Recombinant attenuated Salmonella LH430/pEGFP-RGD-MEL LH430/pEGFP-MEL LH430/pEGFP RGD-MEL MEL PBS Apoptosis rate 48.60±0.75%a 38.30±0.62%b 32.00±1.164%c 39.67±1.17%b 18.17±0.45%d 14.70±0.96%e
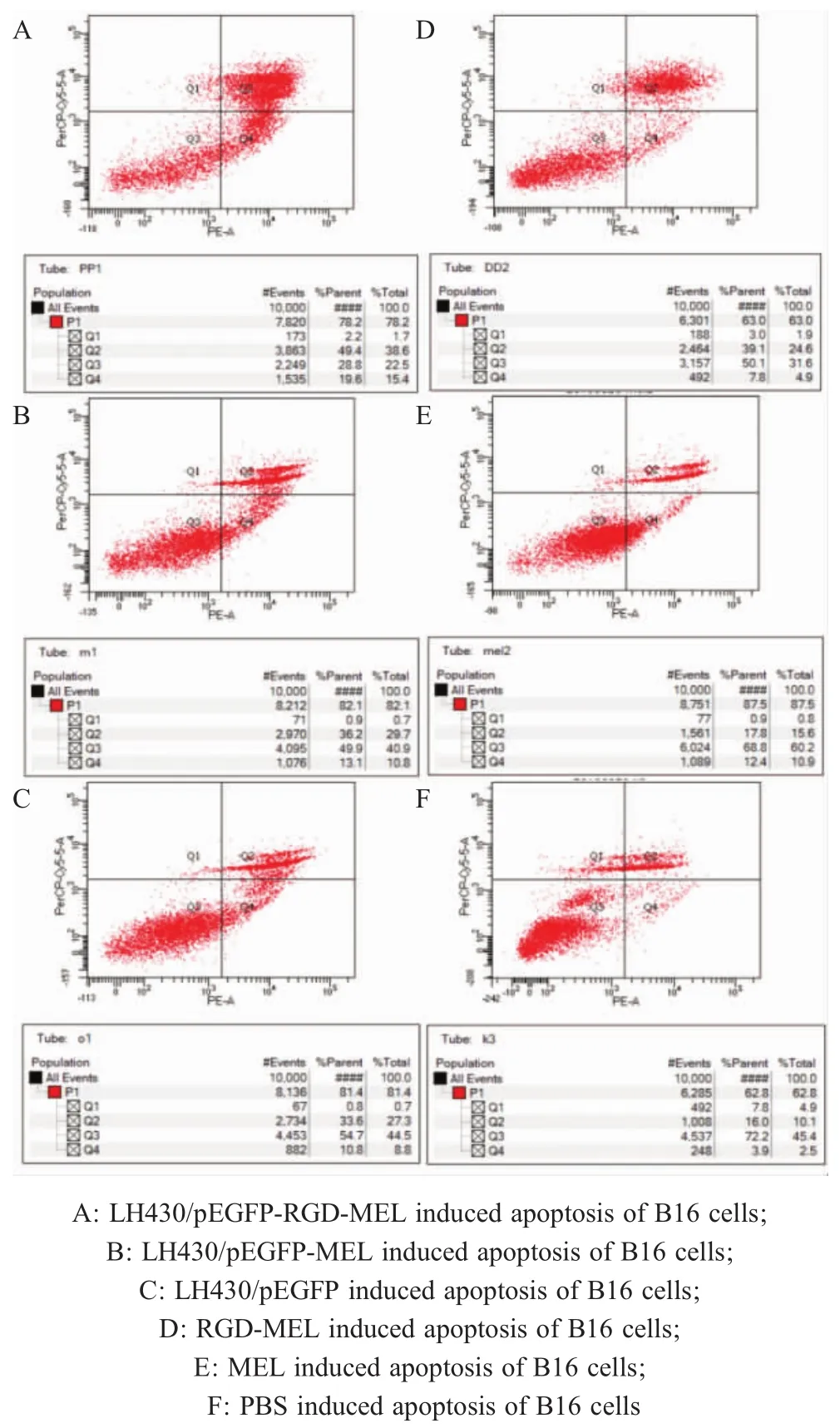
图5 流式细胞术检测各组诱导B16细胞凋亡作用Fig.5 Flow cytometry was used to detect the apoptosis of B16 cells induced by various bacteria strains
本研究构建了重组菌LH430/pEGFP-RGD-MEL、LH430/pEGFP-MEL、LH430/pEGFP,荧光显微镜观察可见,各组均有绿色荧光表达;RT-PCR结果显示目的基因RGD-MEL基因和MEL基因在B16细胞中均获得转录。本实验中将RGD-MEL基因和MEL基因与GFP基因融合为RGD-MEL-GFP,MEL-GFP基因,借助GFP抗体,通过western blot检测GFP蛋白得到表达,结果间接表明RGD-MEL-GFP蛋白和MEL-GFP蛋白得到表达。
细菌一方面可以通过其自身的毒力物质,如内毒素和侵袭素等诱导宿主细胞凋亡;另一方面宿主细胞经刺激后可产生如肿瘤坏死因子、白细胞介素、凋亡蛋白等作用于自身引起凋亡。鼠伤寒沙门氏菌,作为一种侵袭性细菌,与伤寒沙门氏菌、猪霍乱沙门氏菌一样均可引起小鼠细胞凋亡[13]。LH430虽然敲除了pho P/pho Q致病基因,但是由于其侵袭性的存在,依然具有一定的诱导宿主细胞凋亡作用。研究表明,MEL可以促进癌细胞凋亡[14]。有报道称MEL诱导肺癌细胞凋亡与Bax蛋白表达增加有关[15]。Moon等研究表明,MEL对人类白血病U937细胞的凋亡作用具有Bcl-2和Caspase-3依赖性[16]。本实验为研究LH430/pEGFP-RGD-MEL诱导B16细胞的凋亡机制,对凋亡蛋白Caspase-3、Bcl2、Bax进行了检测,发现与PBS组相比,其余各组凋亡蛋白表达量均显著增多。其中LH430/pEGFP为导入空载体pEGFP-NI的重组减毒沙门氏菌,由于减毒沙门氏菌LH430本身便具有抑制肿瘤生长的能力,因此LH430/pEGFP也可以诱导细胞发生凋亡。利用流式细胞仪检测重组减毒沙门氏菌对B16细胞凋亡的作用,分析结果表明各组减毒沙门氏菌对B16细胞均有明显的诱导凋亡作用,其中尤以RGD和减毒沙门氏菌具有双靶向作用,所以携带治疗基因MEL的LH430/pEGFP-RGD-MEL组更能有效的抑制小鼠黑色素瘤细胞B16的生长,并发挥出显著的诱导其凋亡作用。将凋亡蛋白表达情况和细胞凋亡率结果结合来看,LH430/pEGFP-RGDMEL组诱导细胞凋亡率显著高于其它各组,且其表达凋亡蛋白Caspase-3、Bcl2和Bax量虽然高于PBS对照组,却较低于RGD-MEL肽和MEL肽治疗组,表明由减毒沙门氏菌携带的RGD-MEL与RGD-MEL肽相比,诱导细胞凋亡的通路不同,可以进一步对LH430/pEGFP-RGD-MEL诱导细胞凋亡的通路进行研究。
本研究首次将RGD基因和MEL基因融合表达,构建出能够高效稳定融合表达外源基因的真核表达载体pEGFP-RGD-MEL,并导入减毒沙门氏菌LH430中,利用该重组减毒沙门氏菌能够稳定携带外源基因的特性,侵染B16细胞,发挥双靶向抑瘤作用。
