进口白羽肉种鸡J亚群禽白血病病毒的全基因组序列分析
2019-09-04马美哥于蒙蒙许传田黄庆华孟照洁王素艳邢立晓常方方刘长军祁小乐王永强孙延鸣王笑梅高玉龙
马美哥,于蒙蒙,许传田,黄庆华,孟照洁,王素艳,邢立晓,常方方,刘长军,祁小乐,王永强,孙延鸣,王笑梅*,高玉龙*
(1.石河子大学动物科技学院,新疆石河子832003;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽免疫抑制病创新团队,黑龙江哈尔滨150069;3.山东省农业科学院畜牧兽医研究所山东省畜禽疫病防治与繁育重点实验室,山东济南250100;4.山东和康源生物育种股份有限公司,山东济南271018)
禽白血病(Avian Leukosis,AL)是由禽白血病病毒(Avian leukosis virus,ALV)引起的禽类多种恶性或良性肿瘤性疾病的统称,以成年鸡淋巴样肿瘤和产蛋量下降为主要特征。ALV是一种反转录病毒,根据病毒囊膜干扰性、宿主范围和病毒交叉中和反应,ALV可分为11个亚群,分别命名为ALV-A~J[1]和近几年分离到的K亚群[2]。其中A、B、C、D、J、K亚群的ALV属于外源性ALV[2],E亚群为内源性ALV[3]。ALV为反转录病毒科的α反转录病毒属,其前病毒基因组具有典型的C型反转录病毒的结构特征,即5'LTR-5'UTR-gag-pol-env-3'UTR-3'LTR。包含3个主要编码基因gag、pol和env。env基因编码囊膜表面蛋白gp85和穿膜蛋白gp37。gp85蛋白含有病毒受体决定簇,其对病毒抗原性以及病毒侵入宿主细胞具有重要作用,决定亚群特异性和宿主范围[4]。前病毒两末端结构完全相同的U3-R-U5长末端重复序列(LTR)在ALV的复制中至关重要,其与细胞DNA连接,有启动子和增强子活性,与病毒RNA的复制和翻译有关,其中U3区有多种重要的转录调控元件,在病毒的复制及转录过程中起调控作用,并在病毒复制传播过程中容易发生变异[5]。另外,3'端非编码区(3'UTR)不编码蛋白质,但其中的元件:env基因下游的rTM(redundant TM)、单拷贝正向重复单位DR(Direct repeat)和E元件(E element)在ALV病毒粒子的装配、致瘤性方面均起着重要作用[6]。
J亚群禽白血病是由J亚群禽白血病病毒(Subgroup J Avian Leukosis Virus,ALV-J)引起的以髓细胞瘤和其它细胞恶性肿瘤为特征的肿瘤性传染性疾病,是近年来一种致病性更强和传播能力更快的外源性ALV,主要引起肉用型鸡发生骨髓细胞瘤[7]。2018年以来,辽宁、山东等地某品种进口白羽肉种鸡发生了严重的禽白血病,主要发生在17~19周的父母代肉种鸡,引起严重的肿瘤疾病,损失非常严重,本团队前期研究确诊了引起进口白羽肉种鸡发生禽白血病的病原为ALV-J[8]。为进一步研究引起这次疫情的病毒来源及其变异趋势,本研究对从发病进口白羽肉种鸡分离的8株ALV-J进行了全基因组克隆测序分析,以期对ALV-J变异趋势提供数据支持。
1 材料与方法
1.1 病毒株及主要试剂 8株病毒均分离自2018年5月~7月山东、辽宁等发病白羽肉鸡肾、肝、脾等脏器,均为 ALV-J[8],分别命名为 SD1801、SD1802、 SD1804、 SD1805、 SD1806、 SD1807、SD1808及SD1809。DH5a大肠杆菌感受态细胞由本实验室制备保存。ExTaq酶、pMD18-T载体、DL2000 DNA Marker等均购自TaKaRa公司;DNA提取及胶回收试剂盒均购自AXYGEN公司。
1.2 8株ALV-J病毒株的全基因组扩增及测序以GenBank登录的ALV-J原型病毒株(HPRS-103,Z46390)为参考株,设计6对全长扩增引物(表1)。引物由吉林省库美生物科技有限公司合成。

表1 前病毒全基因组DNA扩增的引物序列Table 1 Primers used to amplify the proviral full genomic DNA
取200 μL各病毒培养液,利用DNA提取试剂盒提取各病毒株的DNA,并以其为模板,应用上述设计的特异性引物通过PCR方法分别扩增8株ALV-J病毒株的6个基因片段。反应条件为:95℃5 min;95℃ 30 s、50℃ 30 s、72℃ 2 min 30 s,30个循环;72℃10 min。6个基因片段的PCR产物经1%琼脂糖凝胶电泳检测后,利用胶回收试剂盒回收纯化PCR产物,并将其克隆于pMD18-T载体中,选取每个基因片段的3~5个阳性克隆送吉林省库美生物科技有限公司测序。
1.3 8株ALV-J病毒株全基因组序列分析 利用DNAStar中的SeqMan软件对各病毒株6个基因片段的测序结果进行剪辑、拼接。利用MegAlign对拼接的全基因组序列与GenBank中登录的18个ALV-J肉鸡分离株(包括HPRS-103、美国肉鸡分离株、国内肉鸡)及16个蛋鸡分离株序列进行核苷酸及gp85蛋白氨基酸的同源性分析。利用MEGA6.0软件中的minimum-evolution方法绘制gp85蛋白氨基酸及U3区基因序列系统进化树谱。利用Soft Berry软件分析U3区转录调控元件。
2 结果与讨论
2.1 8株ALV-J病毒株全基因组序列测定与分析以提取的各病毒分离株基因组DNA为模板,利用设计的6对全基因组DNA扩增引物,进行分段扩增及测序,利用DNAStar中SeqMan软件对6个片段的测序结果进行剪辑和拼接,得到了8株ALV-J病毒株全基因组的核苷酸序列。8株ALV-J基因组全长7 447 bp~7 452 bp。3个主要结构基因gag、pol、env长度分别为2 106 bp、2 622 bp和1 521 bp,分别编码701、873和506个氨基酸,与HPRS-103的各段结构基因大小完全一致;3'UTR主要包括rTM、DR-1和E元件,长度为375 bp;3'LTR长度为314 bp。将8株ALV-J与肉鸡分离株(HPRS-103、美国肉鸡分离株和国内肉鸡分离株)及国内蛋鸡分离株进行了同源性分析。结果表明,gag、pol、gp37基因相对保守,与参考株的同源性为95%~96.7%;而分离株gp85、3'UTR、U3区基因差异较大。
2.2 8株ALV-J病毒株与其它参考株gp85氨基酸序列的比较分析 位于病毒粒子表面的gp85蛋白在ALV的进化中发挥着重要的作用,其与病毒的抗原性、组织亲嗜性以及毒力密切相关,是ALV致肿瘤的关键蛋白[4]。gp85蛋白氨基酸的多重变异决定了ALV病毒株的变异,其变异主要集中于hr1、hr2及可变区3(vr3),已有研究证实hr1、hr2对受体结合起主要作用,其突变更有利于病毒逃避宿主免疫监视,更好的适应环境压力[9]。本研究利用MegAlign对已得到的8株ALV-J病毒株的gp85氨基酸序列与ALV-J参考株进行序列分析比较,结果显示,8株ALV-J病毒株的gp85基因,长度为918bp~924bp,分别编码306~308个氨基酸。8株ALV-J gp85氨基酸序列之间同源性为95.8%~100%;其与肉鸡分离株的氨基酸同源性均低于92.2%。而与2014年父母代白羽肉种鸡分离株GD14J2的同源性较高,为93.5%~95.1%。遗传进化树分析结果显示,8株ALV-J的gp85氨基酸与GD14J2病毒株处于同一分支(图1)。
与肉鸡分离株及国内蛋鸡分离株相比,8株ALV-J gp85编码的氨基酸区段有14个氨基酸位点发生一致性突变,即:5M、54N、61N、65E、75R、79A、115S、118T、119缺失、175G/S、176G、189G、200G、297M,其中高变区1(hr1)有2个氨基酸(115S、118T)突变及1个氨基酸(119位)缺失,hr2有2个氨基酸(189G、200G)突变。其中有6个氨基酸(6/14):5M、51N、65E、190G、200G、297M的突变和GD14J2相同。以上结果表明可能在免疫选择等环境压力作用下,该病毒已出现新的变异,但这些氨基酸变异与病毒致病性及毒力的改变是否有关,还有待进一步研究。
2.3 8株ALV-J病毒株与其它参考株3'UTR基因序列的比较 3'UTR在病毒粒子组装和诱导肿瘤形成中起着关键作用[6]。研究发现,我国早期肉鸡ALV-J分离株一般保留有rTM,而蛋鸡ALV-J rTM区出现了175 bp的缺失,近年来在大量ALV-J病毒株中均发现rTM的缺失[10],本研究8株ALV-J的rTM区出现了203 bp的缺失,表明rTM的缺失不影响病毒的复制与传播,但可能与该病毒的进化和毒力有关,其作用不容忽视。DR-1存在于所有ALV-J分离株的3'UTR中,先前研究表明DR-1作为一个结构性转运元件,其在病毒复制中发挥重要作用,它的缺失或突变会降低ALV的感染效率[11]。早期蛋鸡ALV-J DR-1存在30 bp缺失[12],本研究中8株ALV-J病毒株的3'UTR包括env基因下游的rTM、DR-1和E元件,其与肉鸡分离株及国内蛋鸡分离株的同源性仅为64.4%~87.4%,而与2014年父母代白羽肉种鸡ALV-J分离株GD14J2的同源性最高,为99.4%。与HPRS-103相比,3'UTR的rTM缺失203 bp,DR-1区缺失7 bp;同时E元件缺失125 bp,仅保留了22个碱基(图2)。暗示E元件高度保守的20 bp~22 bp核苷酸序列可能对病毒复制是必需的,其与病毒导致严重肿瘤的相关性还需进一步研究。以上8株ALV-J在3'UTR区的变异均与2014年父母代白羽肉鸡分离株GD14J2 3'UTR区的变异相似,表明它们在3'UTR区有类似的进化。
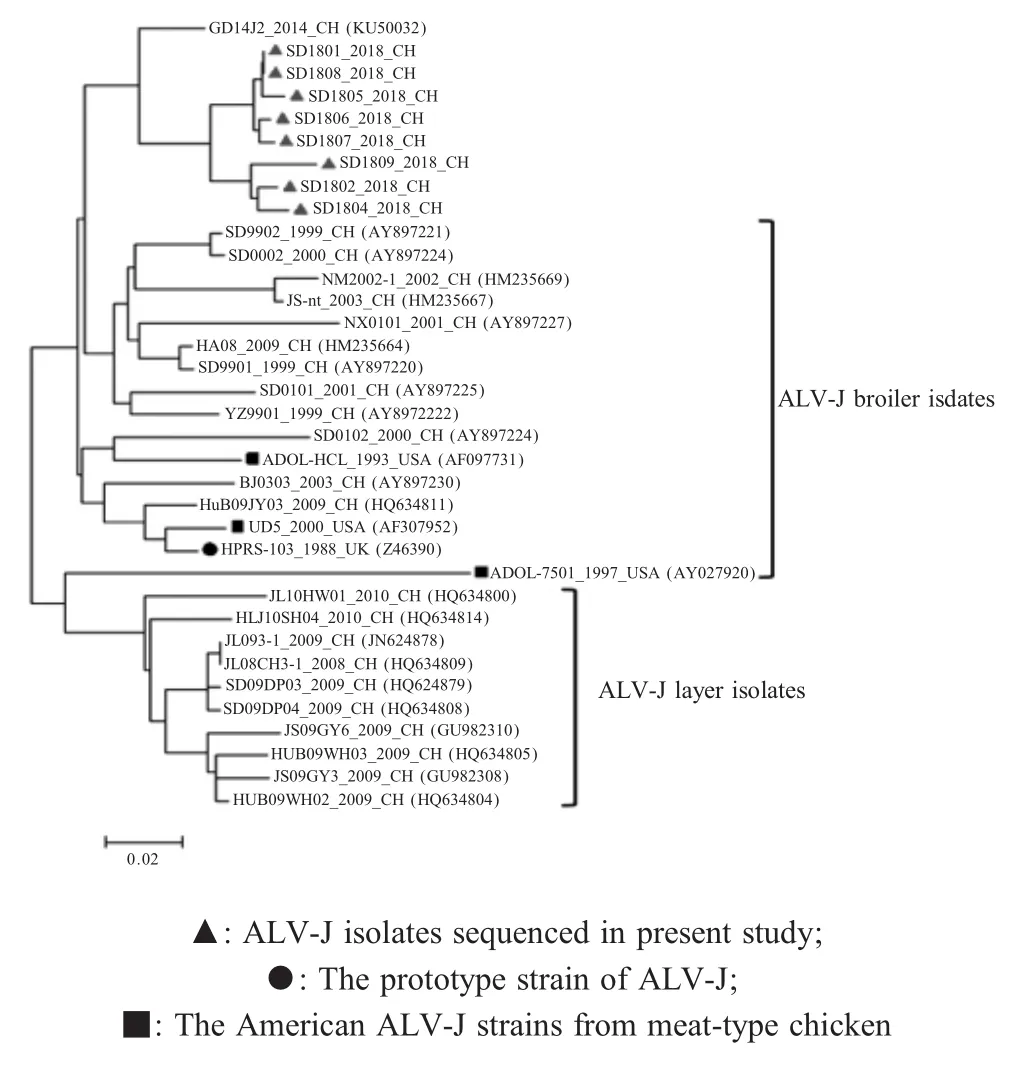
图1 本研究新分离ALV-J病毒株gp85氨基酸进化树分析Fig.1 Phylogenetic tree analysis of gp85 amino acid Sequences of the new ALV-J isolates and reference strains

图2 ALV-J分离株3'UTR核酸序列比较Fig.2 Comparison of the nucleotide deletions in the 3'UTR of ALV-J isolates
2.4 8株ALV-J病毒株与其它参考株3'LTR基因序列的分析 LTR由U3、R、U5组成,作为反转录病毒的一种强转录调控单元,LTR U3区含有高度保守的转录启动子和增强子等转录调控元件,能够驱动禽类许多细胞中病毒基因的转录[5]。本研究结果显示8株ALV-J的3'LTR之间关系密切,基因同源性为98.6%~100%。其中U5和R区高度保守,与其它参考株的同源性为95.2%~96.8%。U3区与肉鸡分离株及国内蛋鸡分离株同源性均低于91.5%,而与2014年父母代白羽肉鸡分离株GD14J2的亲缘关系较近,同源性为94.3%~96.3%,处于同一分支(图3)。U3区有7个碱基:19T、111A、115C、137T、151A、155G、164T出现一致性突变,其中3个碱基:137T、155G、164T的突变与GD14J2一致。利用Soft Berry软件对8株ALV-J的U3区分析发现,其包含多个较为保守的转录调控元件,均含有2个CArG box和Y box,符合典型复制能力较强的外源性ALV的特点。另外发现,164位碱基突变(C/T)形成1个新的转录调控元件AIB REP2,112~122位出现连续11 bp碱基缺失形成另一个新的转录调控元件AIB REP1。这些缺失和突变有可能造成LTR启动基因转录活性的改变,进而影响ALV的毒力和致瘤性。
综上所述,8株白羽肉种鸡ALV-J分离株的gp85、3'UTR、U3区基因与肉鸡分离株(包括ALV-J原型株HPRS-103、美国肉鸡分离株和国内肉鸡分离株)及国内蛋鸡分离株同源性较低,而与国内2014年父母代白羽肉种鸡ALV-J分离株GD14J2亲缘关系较近,属于同一遗传分支。因而推测,引起本次进口白羽肉种鸡禽白血病的ALV-J可能与GD14J2分离株为同一来源,尽管对该分离株的来源未见报道,但目前国内的白羽祖代肉种鸡主要依赖进口,故推测本研究白羽肉种鸡ALV-J可能由进口国外白羽祖代肉种鸡引入,该分离株的致病性及对我国已净化肉种鸡、蛋种鸡和本地鸡群的影响正在评估中。本研究在分析父母代白羽肉种鸡ALV-J分子特征的基础上,探究了这次疫情的病毒株来源及其变异趋势,为该病的有效防控和净化提供参考依据,同时警示,将禽白血病等种源性疾病纳入到进口祖代鸡必检项目势在必行,以防止疫病随进口动物传入我国,影响我国动物安全生产。
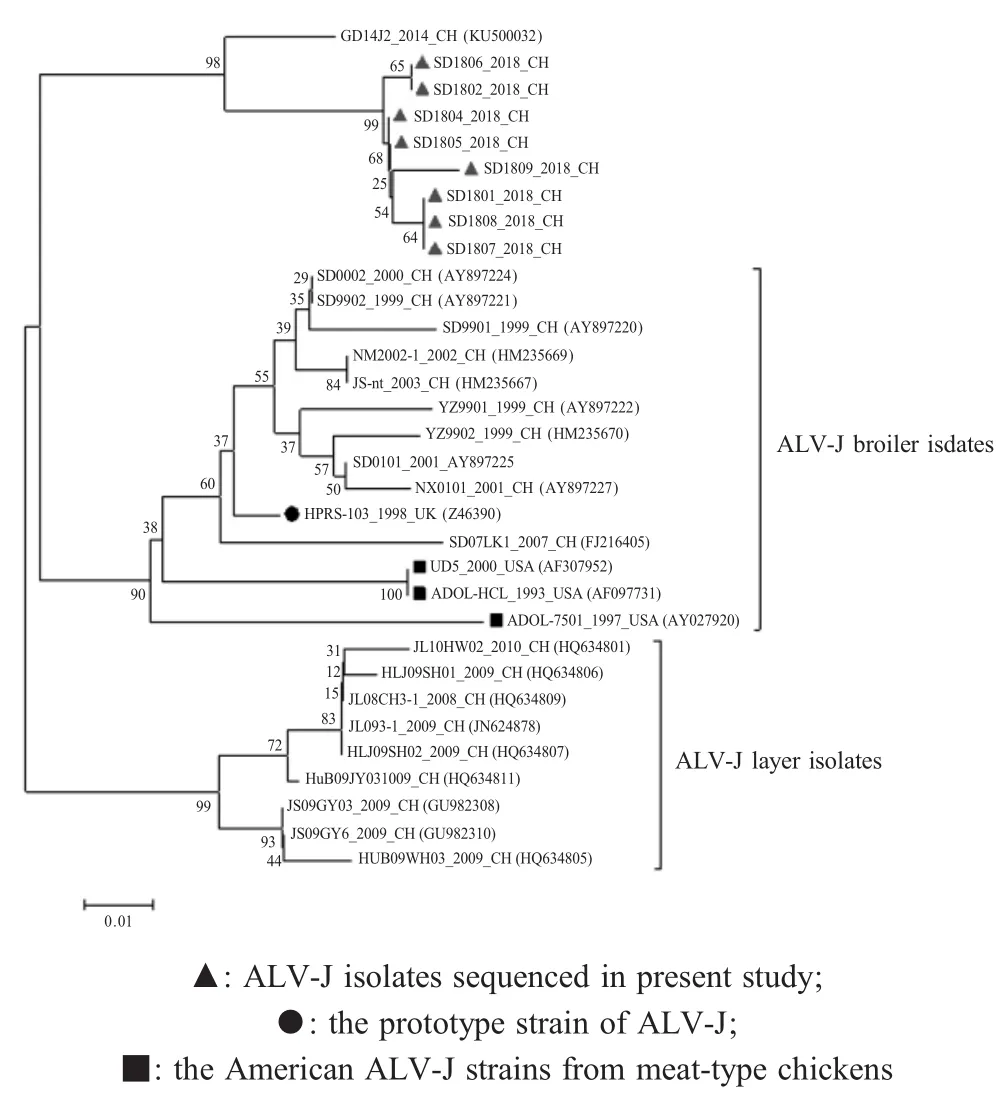
图3 本研究新分离ALV-J病毒株U3区基因序列遗传进化树分析Fig.3 Phylogenetic tree analysis of the U3 region of new ALV-J isolates sequenced in present study
