弓形虫突触融合蛋白STXQa1对虫体生长的作用研究
2019-09-04付佳雯陈赫明张朝霞曹世诺王彩云贾洪林
付佳雯 ,陈赫明,杨 娟,张朝霞,郑 君,曹世诺,王彩云,贾洪林*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特010018;2.中国农科院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150069)
刚地弓形虫(Toxoplasma gondii)是一种人兽共患的专性细胞内寄生的顶复门原虫,能够在几乎所有人和恒温动物(鸟类和哺乳动物)的有核细胞内寄生并建立感染[1-2]。其在宿主细胞内建立感染的过程中需要向虫体膜表面、虫体外以及宿主细胞内转运、分泌大量的感染相关蛋白分子。这些蛋白的分泌依赖于其顶端独特的分泌细胞器:微线体、棒状体和致密颗粒。微线体蛋白(MICs)、棒状体蛋白(ROPs)和致密颗粒蛋白(GRAs)对弓形虫的侵入,细胞内存活以及逸出发挥着至关重要的作用[3]。近期研究显示位于弓形虫高尔基体中的分拣蛋白样受体(Tg-SORTLR)是顶端分泌细胞器亚细胞定位和形成所必需的,其能够特异性的结合棒状体蛋白和微线体蛋白,调节分泌蛋白的分选和转运[4-5]。因此,微线体和棒状体的生物合成是经过高尔基体分选,囊泡出芽之后在类内体途径的参与下经囊泡运输发生和成熟的[6]。
在真核细胞中,无论是内吞系统还是分泌系统,均离不开囊泡运输过程。虽然囊泡运输途径和携带的物质各异,但基本的分子机制却呈现出高度相似性和保守性。细胞内囊泡运输主要包括运输囊泡的出芽、定向移动、拴留和膜融合。囊泡的运输和融合在弓形虫分泌细胞器的生物发生及蛋白分泌过程中发挥着重要作用。弓形虫有一套独特的内吞及外泌系统[7],近期的研究显示内体途径特异性小GTP酶(Small GTPase)、SNARE(可溶性NSF附着蛋白受体)蛋白STX6和网格蛋白接头蛋白复合物AP1等能够调节弓形虫分泌细胞器微线体和棒状体的形成[8-9]。HOPS栓系复合物和内吞体到高尔基体的逆转运复合物(Vps35-Vps26-Vps29)在弓形虫中不但对微线体和棒状体的形成,而且对于致密颗粒的生物发生也发挥关键作用[10-11]。SNARE家族蛋白是具有约70个氨基酸残基组成的SNARE基序(Motif)的小分子膜蛋白,其主要功能是调节囊泡融合[12-13]。鉴于SNARE蛋白在囊泡融合过程中的关键作用,筛选并研究弓形虫SNARE蛋白的功能将有助于增进对虫体分泌细胞器的成熟以及分泌蛋白运输相关分子机制的理解。
1 材料与方法
1.1 主要实验材料 弓形虫强毒株RH(ΔHxGPRT)由本实验室保存、人包皮成纤维细胞(HFF)购自ATCC、非洲绿猴肾细胞(Vero)购自中科院细胞库;HRP标记的羊抗鼠IgG(HRP-IgG)购自Jackson公司;Alexa Fluor 594标记的羊抗鼠/兔IgG、Alexa Fluor 488标记的羊抗鼠/兔IgG、DAPI均购自Thermo公司;EcoRV限制性内切酶,ExTaqDNA聚合酶、Shield 1药物购自TaKaRa公司;KOD高保真PCR试剂盒、ReverTra Ace RT-qPCR Kit试剂盒均购自TOYOBO公司;RIPA、DMSO、Hanks平衡液、HA标签单克隆抗体(HA-MAb)均购自Sigma公司;弓形虫外膜蛋白(TgSAG2)、顶质体标记蛋白(TgCPN60)、微线体标记蛋白(TgM2AP)、棒状体标记蛋白(TgRON4)、纳虫空泡膜(PVM)标记蛋白TgGRA7等的多克隆抗体(PAb)均由本实验室制备;早期内体标记蛋白(ELC)TgRab5a和空泡样隔室(VAC)标记蛋白TgCP抗体由金斯瑞公司制备;Human T Cell Nucleofector Kit购自LONZA公司;TIANamp Genomic DNA提取试剂盒购自TIANGEN公司;RNA提取试剂盒、质粒小量提取试剂盒购自QIAGEN公司;同源重组试剂盒购自Thermo公司;弓形虫电转试剂盒购自Lonza公司;pBSHX-ddFKBP-HA为本实验室保存。
1.2 STXQa1基因的克隆 从NCBI基因数据库中获得哺乳动物SNARE蛋白的氨基酸序列,在弓形虫数据库ToxoDB(http://toxodb.org/)中经Blast分析蛋白质氨基酸序列获得弓形虫含有经典SNARE功能结构域的基因STXQa1。并利用CSS-Palm algorithm(http://csspalm.biocuckoo.org/)分析 STXQa1基因结构域和跨膜域,以验证Blast的结果。利用RNA提取试剂盒对纯化的弓形虫RH虫株提取总RNA,测定RNA的质量和浓度,立即置于冰上,反转录为cDNA后,测定该cDNA浓度,于-30℃保存。根据STXQa1基因序列(TGGT1_220190),设计一对引物ddFKBP-HA-Tg STXQa1 F/R(5'-CAG ACTACGCTAGTTTAAACATGTCTTTTGCATTC-3'/5'-CGCATCACTTTCGTCGTAGTCTTGGATCCCCCG GG-3'),以弓形虫RH株的cDNA为模板,PCR扩增STXQa1的基因序列。
1.3 pBSHX-ddFKBP-HA-STXQa1重组质粒的构建与鉴定 扩增的STXQa1目的基因片段与pBSHX-ddFKBP-HA载体进行同源重组连接,构建重组质粒pBSHX-ddFKBP-HA-STXQa1(图1)。重组质粒转化DH5α感受态细胞后,挑取单菌落,根据质粒中弓形虫GRA启动子序列设计引物JD-F/R(5'-GTG GAGCTTCTAAAACCGGA-3'/5'-GGCGCCGCAAGTG CAGACCG-3'进行PCR鉴定。鉴定为阳性菌培养后提取质粒,PmeⅠ酶切鉴定。
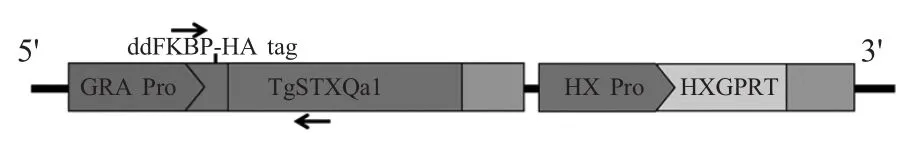
图1 重组质粒pBSHX-ddFKBP-HA-STXQa1构建示意图Fig.1 Schematic representation of the recombinant plasmid
1.4 稳定表达STXQa1蛋白虫株的构建及筛选将弓形虫RH株接种于Vero细胞,37℃培养48 h,2 000 r/min离心10 min,收集从细胞自然逸出的RH虫株。使用Human T Cell Nucleofector Kit并采用电穿孔的方式将10 μg重组质粒pBSHX-ddFKBPHA-STXQa1转入上述虫株。转染后的虫株接种HFF细胞,8 h后加入霉酚酸(终浓度25 μg/mL)和黄嘌呤(终浓度25 μg/mL)进行筛选,在药物控制下连续培养3代后,稀释至每孔一个虫体后接种到96孔板中的HFF细胞中,6 d后在普通光学显微镜下筛选单克隆虫株转移至12孔板扩大培养,收集从细胞自然逸出的单克隆虫株2 000 r/min离心5min,向虫体沉淀中加入一定体积预冷的裂解液(RIPA)冰上裂解30 min后,SDS-PAGE检测STXQa1-HA蛋白的表达。然后以抗HA-MAb(1∶2 000)为一抗,羊抗鼠HRP-IgG(1∶5 000)为二抗通过 western blot检测单克隆虫株总蛋白。将自然逸出的经筛选获得的单克隆虫株接入铺满HFF细胞的共聚焦小皿,通过间接免疫荧光试验(IFA):以鼠抗HA-MAb/兔抗TgSAG2 PAb(1∶1 000)为一抗,Alexa Fluor 488/594 标记的羊抗鼠/兔IgG(1∶1 000)为二抗后,利用激光共聚焦显微镜观察TgSTXQa1的表达。将表达TgSTXQa1的虫株命名为ddFKBP-HA-STXQa1。
1.5 STXQa1蛋白的亚细胞定位 将经筛选鉴定获得的单克隆虫株接种HFF细胞中并置于37℃5%CO2条件下培养,待虫株侵入细胞后,加入Shield 1(稳定ddFKBP结构域)诱导20 h,PBS洗3次,去除未侵入的虫子,加入4%多聚甲醛,4℃固定30 min,PBS清洗两次,加入0.3%Triton-X100透膜剂,室温15 min。PBS清洗2次,加入5%BSA/PBS室温封闭30 min。分别以TgCPN60、TgM2AP、TgRON4、TgRab5a、TgCPL PAb(1∶500)和 HA-MAb(1∶1 000)作为一抗,Alexa Fluor 488/594标记的羊抗鼠/兔IgG(1∶1 000)为二抗,通过IFA检测STXQa1以及TgCPN60、 TgM2AP、 TgRON4、 TgRab5a、 TgCPL蛋白,并利用激光共聚焦显微镜观察重组STXQa1与 TgCPN60、TgM2AP、TgRON4、TgRab5a、TgCPL蛋白标记的顶质体、微线体、棒状体、ELC、VAC的共定位情况。
1.6 STXQa1蛋白过表达虫株生长水平的检测 按照1.4的方法将自然逸出的100个STXQa1过表达单克隆虫株接种至HFF单层细胞中,加入Shield 1诱导STXQa1基因的过表达(Shield 1+),对照组虫株加入DMSO(Shield 1-),下面的试验同样分组。培养至第8 d去除培养液,用冷甲醇4℃固定30 min,吉姆萨染色1 h,PBS冲洗4次,室温放置至残留液体干燥,在光学显微镜下观察噬斑大小并拍照,使用Image J软件对拍摄噬斑图中的20个噬斑面积进行统计。
1.7 STXQa1蛋白过表达虫株侵入细胞能力的检测对新鲜消化的Vero细胞计数,并按照3×105个/孔铺于12孔板中,37℃过夜培养。次日,将自然逸出的5×105个STXQa1过表达虫株接种于事先准备的Vero细胞单层中,培养3 h后PBS洗去培养液中未侵入的虫体,4%多聚甲醛4℃固定30 min。以兔抗 TgSAG2(1∶1 000)为一抗,以 Alexa Fluor 594标记的羊抗兔IgG(1∶1 000)为二抗,室温孵育1 h,PBS洗涤3次,使胞外未侵入的虫株带红色荧光,0.3%Triton-X100透膜10 min,5%BSA封闭30 min后,再以兔抗TgSAG2(1∶1 000)为一抗,Alexa Fluor 488-Rabbit标记的羊抗兔IgG(1∶1 000)为二抗IFA检测侵入细胞内的虫体。在倒置荧光显微镜下观察同一视野下不同颜色荧光的染色情况并拍照计数。带红色荧光又带绿色荧光的为未侵入细胞的虫体,仅带绿色荧光为已侵入细胞的虫体。统计100个虫体,每组试验设置3次重复。
1.8 STXQa1蛋白过表达虫株胞内增殖水平的检测同1.7所述,将虫株接种于单层Vero细胞,3 h后用PBS洗去未侵入的虫体,加培养液继续培养24 h,PBS洗涤3次,4%多聚甲醛4℃固定30 min,0.3%Triton-X100透膜10 min,5%BSA封闭30 min后,以兔抗TgSAG2 PAb(1∶1 000)为一抗,羊抗兔Alexa Fluor 488-Rabbit-IgG(1∶1 000)为二抗,通过 IFA检测弓形虫膜表面蛋白,置于倒置荧光显微镜下观察并计数100个纳虫空泡中虫体的复制情况,每次试验设置3个重复,检测虫株在细胞内的复制水平。
1.9 STXQa1蛋白过表达虫株胞内逸出能力的检测将自然逸出的3×105个STXQa1基因过表达虫株接入HFF单层细胞中,培养至24 h,加入Shield1诱导STXQa1过表达至32 h,去掉培养液,用PBS洗去胞外的虫体,用 Hanks平衡液稀释的 3 μM A23187钙离子载体37℃作用5 min后,用4%多聚甲醛4℃固定。以兔抗TgSAG2和鼠抗Tg-GRA7(1∶1 000)为一抗,Alexa Fluor 488 标记的羊抗兔IgG、Alexa Fluor 594标记的羊抗鼠IgG(1∶1 000)为二抗。通过IFA检测弓形虫膜表面蛋白以及弓形虫纳虫空泡膜表面蛋白,并置于倒置荧光显微镜下观察,计数100个纳虫空泡中虫体的逸出数量。每次试验设置3个重复,检测虫株从细胞内的逸出能力。
1.10 统计学分析 利用GraphPad Prism软件对上述试验数据进行统计学分析,使用t检验检测组间差异。
2 结果
2.1 pBSHX-ddFKBP-HA-STXQa1重组质粒的鉴定 将PCR扩增的STXQa1基因克隆至pBSHX-ddFKBP-HA中,构建重组质粒pBSHX-ddFKBP-HASTXQa1。经PCR扩增鉴定该质粒结果显示,在约750 bp处扩增出目的条带(图2A);酶切鉴定结果显示,酶切后出现约1 700 bp的目的条带,与预期相符(图2B)。表明正确构建重组质粒pBSHX-ddFKBPHA-STXQa1。Western blot结果显示,shield1药物可以调控STXQa1基因过表达(图3A)。IFA结果显示,在STXQa1过表达虫株中检测到STXQa1蛋白的表达(图3B)。表明,正确构建了STXQa1过表达虫株。
2.2 STXQa1蛋白的亚细胞定位结果 利用IFA检测STXQa1蛋白在虫体内的亚细胞定位,结果显示STXQa1蛋白与TgCPL共定位于VAC,与TgCPN60、TgRab5a、TgRON4、TgVP1等虫体内极性细胞器的标记蛋白相邻,与TgproM2AP标记的ELC样隔室相距较远(图4)。VAC为弓形虫胞吞以及胞吐途径中重要的一个细胞器,也是EL(早期内体),LL(晚期内体)下游细胞器,综上所述,表明STXQa1可能在弓形虫细胞器的成熟以及蛋白运输过程中发挥作用。
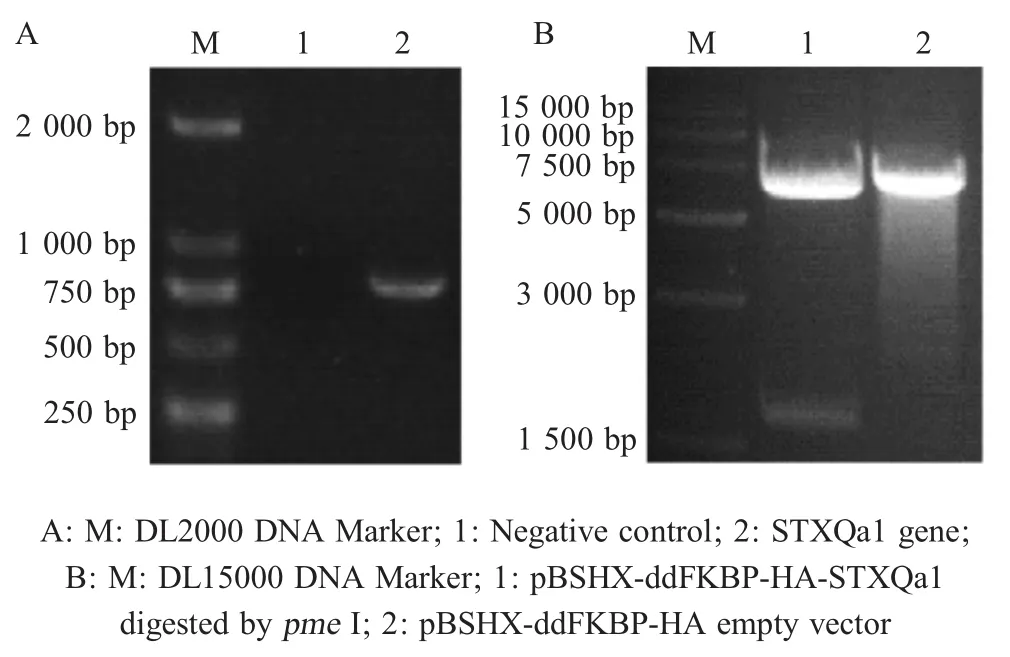
图2 pBSHX-ddFKBP-HA-STXQa1重组质粒的PCR鉴定(A)和酶切鉴定(B)Fig.2 PCR identification(A)and restriction enzyme digestion(B)of pBSHX-ddFKBP-HA-STXQa1

图3 STXQa1蛋白过表达虫株的检测Fig.3 Detection of T.gondii overexpressing STXQa1

图4 STXQa1与TgCPN60、TgRab5a、TgproM2AP、TgRON4、TgVP1、TgCPL共定位检测结果Fig.4 Colocalization of STXQa1 with TgCPN60,TgRAB5a,TgRON4,TgproM2AP,TgVP1 and TgCPL inT.gondii
2.3 STXQa1蛋白过表达对弓形虫生长能力影响的检测结果 为探究STXQa1基因过表达虫株在宿主细胞内生长的能力。将STXQa1基因过表达单克隆虫株感染HFF细胞8 d后,通过吉姆萨染色,在普通光学显微镜下观察到虫体侵蚀宿主细胞形成的空白噬斑(图5A),统计20个噬斑的大小,结果显示STXQa1蛋白过表达虫株与对照虫株相比噬斑明显减小,差异极显著(p<0.0001)(图5B)。表明STXQa1基因的过表达严重影响虫体在细胞内的生长水平。
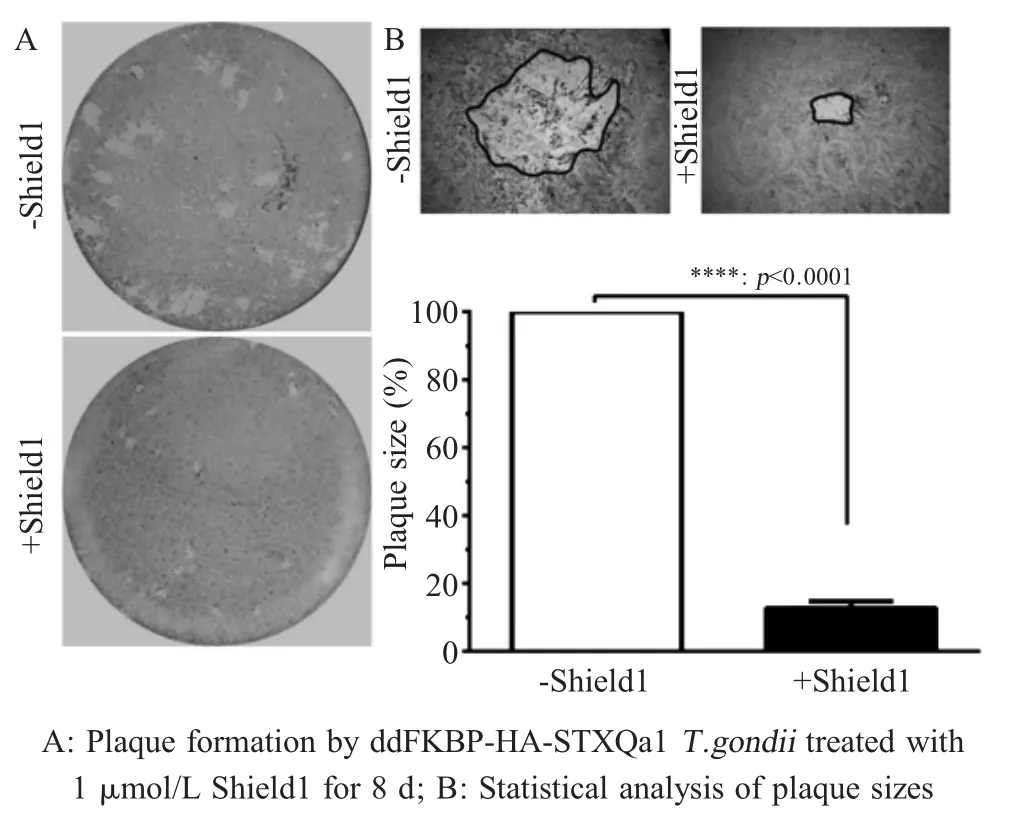
图5 STXQa1基因过表达对弓形虫生长影响的检测结果Fig.5 Effect of STXQa1 overexpressing on growth ofT.gondii
2.4 STXQa1蛋白过表达对弓形虫侵入宿主细胞能力的影响 在STXQa1蛋白过表达虫株感染Vero细胞3 h后,对胞内及胞外的虫体分别采用红绿双色染色计数,不经透膜处理时,此时被染色的是胞外仅发生粘附的虫子(红色),透膜处理后,所有粘附和侵入细胞的虫子均染成绿色。通过IFA对虫体膜表面蛋白SAG2进行染色,在荧光显微镜下将红绿通道叠加,橙色的虫子是仅发生粘附而未能侵入的,只有着绿色的虫子是完全侵入细胞的弓形虫。对两种情况进行统计,结果显示+Shield1虫株与-Shield1虫株相比二者的粘附行为所占比例无差异;而位于胞外的虫体数量显著增多,-Shield1虫株的侵入率为80%,过表达虫株侵入率降低至60%,差异显著(p<0.01)(图6)。表明,弓形虫过表达STXQa1基因后,其侵入宿主细胞的能力明显受到了抑制,但并不是通过抑制其粘附能力而发挥的作用。
2.5 STXQa1蛋白过表达对弓形虫胞内增殖水平影响的检测结果 将STXQa1过表达虫株感染Vero细胞24 h后,通过IFA对虫体膜表面蛋白SAG2染色,在普通荧光显微镜下观察并统计100个纳虫空泡中虫体复制为2只、4只、8只和大于8只虫体的包囊数,结果显示+Shield1虫株与-Shield1虫株相比,前者在分裂增殖为每个纳虫空泡8个及大于8个的包囊数明显减少,其复制增殖能力与-Shield1虫株相比明显下降(p<0.05)(图7)。结果表明过表达STXQa1明显抑制弓形虫在宿主细胞内的复制增殖能力。

图6 STXQa1基因过表达对弓形虫侵入细胞影响的检测结果Fig.6 Effect of STXQa1 overexpressing on invasion ofT.gondii
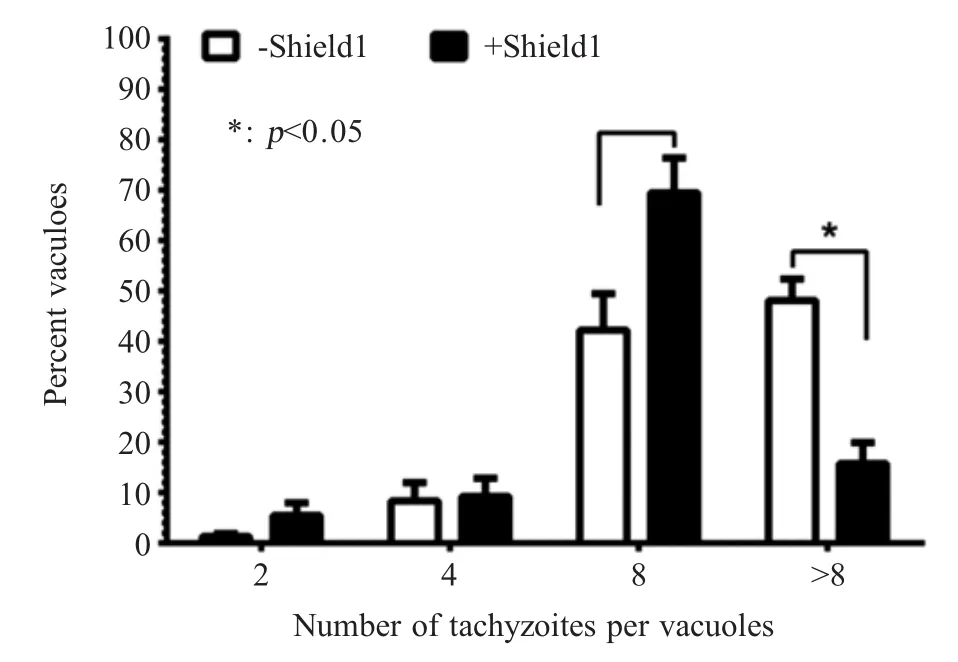
图7 STXQa1基因过表达对弓形虫增殖影响的检测结果Fig.7 Effect of STXQa1 overexpressing on replication ofT.gondii
2.6 STXQa1蛋白过表达对弓形虫胞内逸出能力的影响 本研究利用了钙离子载体A23187对宿主细胞内的弓形虫进行诱导性逸出,诱导5 min后,通过IFA对纳虫空泡膜及虫体膜染色后,普通荧光显微镜下观察并统计100个纳虫空泡中逸出虫体的包囊数量,结果显示经过5 min钙离子载体诱导,+Shield1虫株与-Shield1虫株几乎全部的纳虫空泡均发生破碎,虫体快速从宿主细胞中逸出,二者逸出率差异不显著(p>0.05)(图8)。表明过表达STXQa1并不影响虫体从宿主细胞逸出的能力。

图8 STXQa1基因过表达对弓形虫逸出能力影响的检测结果Fig.8 Effect of STXQa1 overexpressing on egress ofT.gondii
3 讨论
囊泡运输是一个十分复杂的过程,其为真核细胞的多种重要生命活动提供所需的各类蛋白质和脂类物质,如真核生物细胞器的形成与维持、蛋白质靶向运输、神经递质释放以及细胞生长等[7]。囊泡的运输主要涉及以下过程:①供体膜的出芽、装配以及断裂来形成不同的转运膜泡;②在细胞内的马达蛋白驱动下的膜泡运输;③转运膜泡与特定靶膜的锚定和融合。转运膜泡的形成、运输及其与靶膜的融合是一个特异性的过程,涉及对多种蛋白的识别、组装、去组装的复杂调控,膜泡与靶膜的选择性融合是保证细胞内定向膜流的重要因素之一。SNARE蛋白是膜融合最关键的核心成分。SNARE家族蛋白的主要功能是调节囊泡融合,介导转运膜泡与靶膜融合的主要机制是SNARE蛋白之间的配对。目前认为囊泡融合至少涉及3种SNARE蛋白质的参与,包括运输囊泡中的SNARE、靶膜中的SNARE和SNAP、Rab GTP酶、栓系因子和Sec1/Munc18(SM)家族蛋白的参与完成[14-17]。
现已知酵母细胞表达20多种不同的相关SNARE蛋白,对每一种编码SNARE基因进行的突变缺陷分析表明,每种SNARE蛋白均参与特异性的膜融合事件,本研究通过序列比对,在弓形虫基因数据库中找到具有SNARE家族蛋白特有的功能域基因STXQa1,其与酵母细胞的SNARE蛋白家族无同源相似物,表明弓形虫既保留了真核细胞的运输机制又特化出了独特分子,而其所特有的一些分泌细胞器的形成以及蛋白的分泌也是需要SNARE复合物参与囊泡运输的过程。
STXQa1定位于弓形虫的VAC中,弓形虫在侵入宿主细胞时其顶端的分泌细胞器微线体和棒状体分泌的蛋白起着关键作用[18],微线体在弓形虫侵入时分泌的MICs蛋白能够帮助虫体黏附于宿主细胞表面,棒状体分泌的棒状体蛋白RONs分泌虫体侵入时所需的MJ复合物进而帮助虫体进入宿主细胞[19-20],而这类蛋白在运输过程中有时需要在VAC中加工与成熟,通过对STXQa1定位及功能的研究表明其在这一过程起着巨大作用。相关文献报道[8],对SNARE基因的过表达与敲除一样会造成虫体的不正常运作,STXQa1蛋白过表达后显著影响虫体侵入宿主细胞的能力以及虫体在宿主细胞内增殖的能力,因此推测其通过影响弓形虫棒状体、微线体这类侵入关键蛋白的形成或分泌,进而影响了弓形虫的侵入及生长能力。通过深入了解SNARE家族蛋白在弓形虫分泌性细胞器生物发生过程中发挥功能的分子机制,可以揭示弓形虫分泌蛋白转运的关键环节,对弓形虫病的防控提供有力的依据。
