PRRSV在感染早期通过活化CREB竞争抑制p65与CBP结合
2019-09-04李先斌谭祥梅陈鹏飞赵雄伟虞凌雪姜一峰童光志周艳君
李先斌,王 鑫,谭祥梅,陈鹏飞,赵雄伟,吴 瑕,虞凌雪,高 飞,姜一峰,于 海,童光志,周艳君
(中国农业科学院上海兽医研究所,上海200241)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种对养猪业危害极为严重的病毒性传染病。该病病原PRRS病毒(PRRSV)感染能够抑制宿主的免疫系统,影响或干扰宿主先天免疫反应和获得性免疫反应功能的发挥,进而逃逸宿主的免疫监视。而天然免疫系统是机体抵御病原体入侵的第一道防线,I型干扰素(IFN-I)作为先天性免疫应答的关键组成部分,在先天性免疫应答中起到了重要的作用,已有研究表明 , PRRSV 的 NSP1α、 NSP1β、 NSP2、 NSP4、NSP11和核衣壳蛋白(N)会抑制仙台病毒或dsRNA刺激诱导产生的IFN-I表达[1-6]。PRRSV的NSP1α和NSP1β是调节IFN-I反应的主要蛋白,NSP1α能够抑制NF-κB介导的IFN-I的产生,NSP1β能够抑制IRF3介导的IFN-I的产生。其中NSP1α通过削弱转录因子cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB)和 CREB结合蛋白(CREB-binding protein,CBP)而影响 IFN-β 的表达[1]。
IL-10作为机体重要的免疫调节细胞因子,在病毒感染过程中发挥很重要的作用,其可能与宿主的免疫抑制有关。研究表明HP-PRRSV感染后能够在体外和体内显著上调IL-10的表达[7],进而抑制促炎性因子的表达,因此认为IL-10是HP-PRRSV感染引起免疫抑制的主要因素之一。现已证实HP-PRRSV的N蛋白能够激活IL-10启动子的转录活性,并证实 NF-κB p38 MAPK通路均参与了HP-PRRSV N蛋白诱导的IL-10上调[8]。最近研究表明,突变HP-PRRSV N蛋白的两个磷酸化位点S105A和S120A能够从mRNA水平下调IL-10[9]。另外,IL-10的表达还可以由脂多糖(Lipopolysaccharides,LPS)刺激诱发,LPS刺激人外周血单核细胞产生IL-10主要是通过p38通路,最终引起转录因子CREB的磷酸化而启动IL-10的转录[10]。CREB是一种调节基因转录的蛋白质,磷酸化的CREB通过bZIP(Basic and leucine zipper,bZIP)结构域结合在IL-10的启动子区域引起IL-10的转录[11]。也有研究表明磷酸化的CREB可以结合到DNA序列中的cAMP反应原件(cAMP-responsive element,CRE)-TGACGTCA,这一过程需要招募并结合CREBCBP[12]。CBP作为多效转录蛋白因子,还可以与p65结合启动p65激活转录相关基因,p65启动转录的基因多数与天然免疫相关,其中最重要的为IFN-I的转录。然而,细胞内CBP的数量是相对恒定的,当感染HP-PRRSV后,CBP与CREB或p65结合情况尚不清楚。本研究证实HP-PRRSV感染后通过激活p38丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)通路活化CREB,活化的CREB与p65竞争性结合CBP,抑制了p65与CBP的结合,从而在HP-PRRSV感染初期抑制了IFN-I转录的启动活性,有助于进一步了解HP-PRRSV的免疫抑制机理。
1 材料与方法
1.1 主要实验材料 HP-PRRSV HuN4株(EF635006)由本实验室分离鉴定[13]。Marc-145细胞培养在含10%的胎牛血清(FBS)(Gibco)的 DMEM(Sigma)中。PAMs从猪肺中经灌洗制备,并利用含10%FBS、100 U/mL青霉素G和100 μg/mL硫酸链霉素的RPMI-1640培养基(Gibco)将其于37℃ 5%CO2培养箱中培养。抗 CREB、抗 p65、抗磷酸化 CREB(p-CREB)、抗磷酸化p65、抗CBP、抗磷酸化p38 MAPK、抗磷酸化ERK1/2和抗β-actin等单克隆抗体(MAb)、辣根过氧化物酶标记的山羊抗鼠/兔IgG(IgG-HRP)、PKA通路抑制剂 H-89、p38 MAPK通路抑制剂SB203580、人肿瘤坏死因子(hTNF-α)和琼脂糖磁珠Protein G、Protein A均购自Cell Signaling公司;SYBR Premix ExTaq试剂盒购自TaKaRa公司。Rever Aid First strand cDNA Synthesis Kit试剂盒、RIPA细胞裂解液、Pierce IP Lysis Buffer、ECL显影液试剂盒均购自Thermo Fisher公司;蛋白酶抑制剂PMSF购自Sigma-Aldrich公司;RNA提取试剂盒RNeasy mini kit购自Qiagen公司。
1.2 病毒感染 将PAMs和Marc-145细胞预先培养于6孔细胞培养板内,待细胞长成90%以上单层时,每孔分别按照MOI 0.1、MOI 1和MOI 5等不同剂量接种F5代HuN4病毒(HuN4-F5),37℃ 5%CO2感作1 h,用PBS洗3遍,更换成含2%FBS的DMEM细胞维持液,继续培养。以不接毒的细胞为空白对照,分别于病毒感染后12 h和24 h收取细胞样品进行后续试验。
1.3 IL-10的荧光定量PCR检测 根据RNeasy mini kit的说明书提取上述病毒感染后的细胞及未接毒细胞样品总RNA,按照转录试剂盒说明书将总RNA反转录成cDNA。利用表1中引物使用SYBR green PCR mix对cDNA样品进行荧光定量PCR检测。以GAPDH为参照,根据2-ΔΔCT的计算方法,计算IL-10 mRNA的相对表达量。
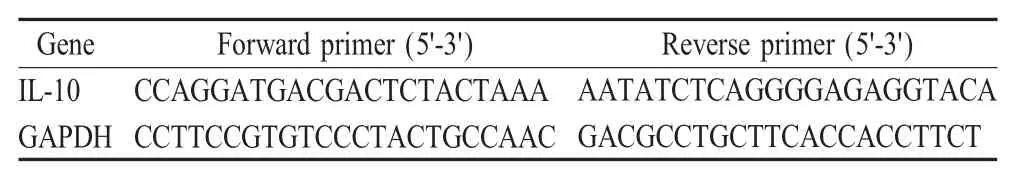
表1 本研究中使用的IL-10的荧光定量PCR引物Table 1 Sequences of real-time PCR primers for cytokine genes used in this study
1.4 CREB的磷酸化水平的检测 将PAMs培养于6孔板,待其长至90%单法时,采用MOI 1 HuN4-F5感染,分别于感染后15 min、30 min、1 h、2 h、6 h、12 h和24 h收取细胞样品。利用含1%蛋白酶抑制剂PMSF的细胞裂解液RIPA在冰上裂解细胞样品10 min,然后将蛋白样品经SDS-PAGE电泳后转移到硝酸纤维膜上,以抗p-CREB MAb(1:1 000)为一抗,以山羊抗兔IgG-HRP为二抗(1∶5 000)孵育后,利用ECL曝光,进行western blot鉴定。
1.5 CREB上游激活通路分析 采用MOI 1的HuN4-F5分别感染PAMs和Marc-145细胞,并在感染后15 min、30 min、1 h和2 h收取细胞样品,如1.4所述处理细胞样品,分别以抗p38和抗p-ERK1/2的 MAb(1:1 000)为一抗,以山羊抗兔IgG-HRP 为二抗(1∶5 000)孵育,通过 western blot分析p38 MAPK和ERK1/2通路的激活情况。同时利用10 μmol/L PKA通路的抑制剂H-89预处理PAMs和Marc-145细胞30 min,对照细胞用含同样浓度的DMSO处理30 min,然后用1 MOI的HuN4-F5感染PAMs,1 h后收集细胞样品,如1.4所述处理细胞样品,并以抗p-CREB MAb(1∶1 000)为一抗,以山羊抗兔 IgG-HRP为二抗(1∶5 000)孵育,经 western blot分析PKA通路对CREB磷酸化的影响。
1.6 CREB磷酸化对CBP与p65结合的影响 用MOI 1 HuN4-F5与10 ng/mL的hTNF-α混合孵育感染Marc-145细胞,阳性对照为10 ng/mL hTNF-α+2%FBS的DMEM细胞培养基培养的细胞,阴性对照用2%FBS的DMEM细胞培养基培养的细胞,37℃5%CO2培养箱内分别感染1 h或24 h,收集细胞一部分用于提取细胞总RNA,一部分用Pierce IP Lysis Buffer于冰上裂解10 min,12 000 r/min 4℃离心2 min,弃沉淀,在上清中加入抗CBP或CREB MAb(1∶400),4℃过夜孵育,随后在混合液中加入Protein G和Protein A琼脂糖磁珠,室温孵育30 min,用Pierce IP Lysis Buffer对琼脂糖磁珠洗5遍后经SDS-PAGE电泳后转移至硝酸纤维膜上,分别利用抗p-CREB、抗 p-p65、抗 CBP、抗 CREB和抗 p65的MAb(1∶1 000)为一抗,以山羊抗兔IgG-HRP为二抗(1∶5 000)孵育,进行 western blot鉴定,分析CO-IP实验结果。将提取的细胞总RNA反转录为cDNA后,利用表2中的引物通过荧光定量PCR方法检测IL-10及IFN-β的转录水平,同时设GAPDH为参照。
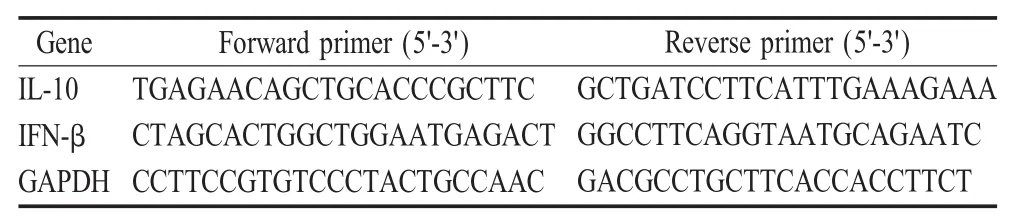
表2 本研究中使用的细胞因子基因的荧光定量PCR引物Table 2 Sequences of real-time PCR primers for cytokine genes used in this study
1.7 抑制剂对CREB与CBP结合的影响 分别用10 μmol/L的PKA通路抑制剂H-89和p38通路抑制剂SB203580处理Marc-145细胞,随后用MOI 1 HuN4-F5感染,阳性对照用MOI 1 HuN4-F5感染Marc-145细胞,阴性对照用与抑制剂相同体积的DMSO处理,37℃5%CO2培养箱内感染1 h或24 h,收集细胞样品,按1.6方法进行CO-IP试验,同时提取细胞总RNA,反转录为cDNA,用表2中的引物经荧光定量PCR检测抑制剂对IL-10转录水平的影响。
2 结果
2.1 HP-PRRSV感染PAMs可上调IL-10表达将以不同MOI HP-PRRSV HuN4-F5感染PAMs后12 h和24 h收取的细胞样品,利用相对荧光定量PCR检测IL-10的转录水平,结果显示HP-PRRSV HuN4-F5感染PAMs 12 h和24 h后与对照组相比,IL-10的mRNA转录水平均显著提高,并呈现剂量依赖性关系(图1),表明HuN4感染PAMs能够上调IL-10的表达。
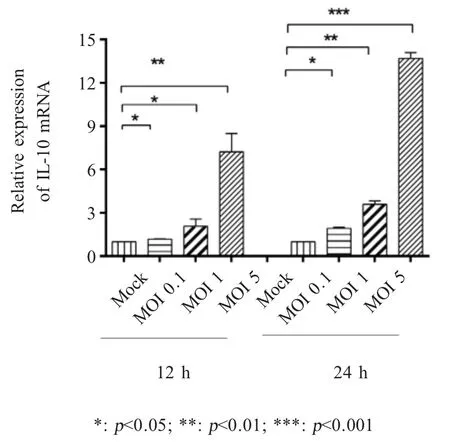
图1 不同剂量HP-PRRSV HuN4-F5感染PAMs对IL-10转录水平的影响Fig.1 Effect of PAMs infected with different doses of HP-PRRSV HuN4-F5 on IL-10 expression
2.2 HP-PRRSV感染后CREB磷酸化水平的检测结果 CREB作为IL-10的转录因子,其133位的丝氨酸(Ser)残基的磷酸化活性形式对于IL-10的转录是必须的。用HP-PRRSV HuN4-F5病毒以MOI 1的剂量感染PAMs,对感染后15 min、30 min、1 h、2 h、6 h、12 h和24 h的细胞样品进行western blot分析CREB磷酸化水平,结果显示,HP-PRRSV感染PAMs 15 min后CREB即可出现明显的磷酸化,并持续至24 h(图2),表明强毒HuN4株在感染早期即可显著提高IL-10转录因子CREB的磷酸化水平。
2.3 CREB上游激活通路的检测结果 CREB的磷酸化主要通过PKA通路、p38 MAPK通路和ERK1/2通路调控。对1 MOI HP-PRRSV HuN4-F5感染 PAMs和 Marc-145细胞后 15 min、30 min、1 h和2 h的细胞样品进行western blot分析,结果显示,HP-PRRSV感染PAMs和Marc-145细胞15 min后p38磷酸化水平明显增强,而ERK1/2的磷酸化水平相对于对照组略有增加(图3、图4)。用PKA通路抑制剂H-89分别处理PAMs和Marc-145细胞后,结果显示,在感染HuN4-F5的PAMs中CREB的磷酸化水平不受影响,而在Marc-145细胞中CREB的磷酸化水平明显降低(图5)。表明 HPPRRSV感染后CREB的磷酸化主要通过活化p38 MAPK通路来调控。
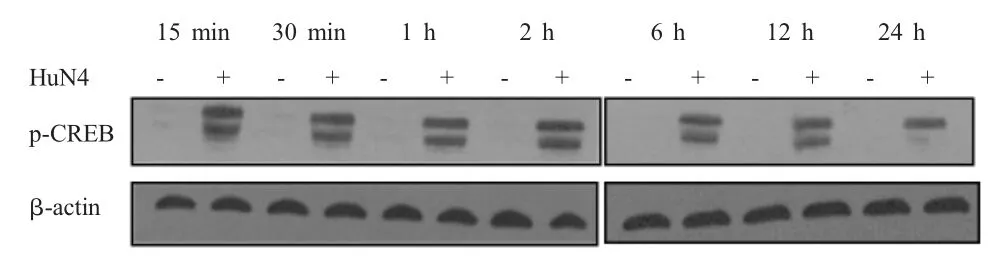
图2 HP-PRRSV感染PAMs后CREB的磷酸化水平Fig.2 The phosphorylation level of CREB in PAMs after HP-PRRSV infection
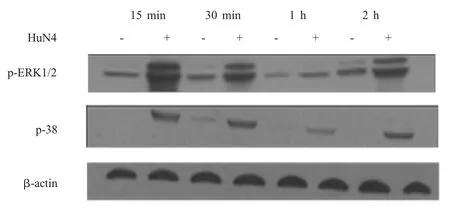
图3 HP-PRRSV感染PAMs对p38 MAPK通路和ERK1/2通路的影响Fig.3 Effect of HP-PRRSV infection on p38 MAPK pathway and ERK1/2 pathway in PAMs
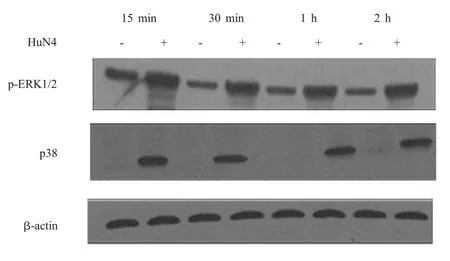
图4 HP-PRSSV感染Marc-145细胞对p38 MAPK通路和ERK1/2通路的影响Fig.4 Effect of HP-PRRSV infection on p38 MAPK pathway and ERK1/2 pathway in Marc-145 cells
2.4 磷酸化的CREB可抑制CBP与p65的结合对MOI 1 HuN4-F5病毒和10 ng/mL的hTNF-α共孵育后感染Marc-145细胞1 h后的蛋白样品进行了CO-IP试验。结果显示,单独用hTNF-α处理的Marc-145细胞仅 p65被磷酸化,而 hTNF-α和HuN4-F5共孵育后感染的Marc-145细胞,p65和CREB均被磷酸化(图6A),CO-IP试验结果显示,当CREB被磷酸化后,可以检测到CREB与CBP之间相互结合,但是,p65与CBP之间的结合则受到了抑制(图6B)。同时,利用相对荧光定量PCR方法分析了CBP被竞争结合后IL-10和IFN-I的表达情况,结果显示,用hTNF-α刺激HuN4-F5感染的Marc-145细胞,细胞中IFN-β的mRNA转录水平显著降低(图6C),而IL-10的mRNA转录水平则显著上调(图6D),表明磷酸化的CREB能够与p65竞争性结合CBP,从而抑制IFN-I的转录水平。
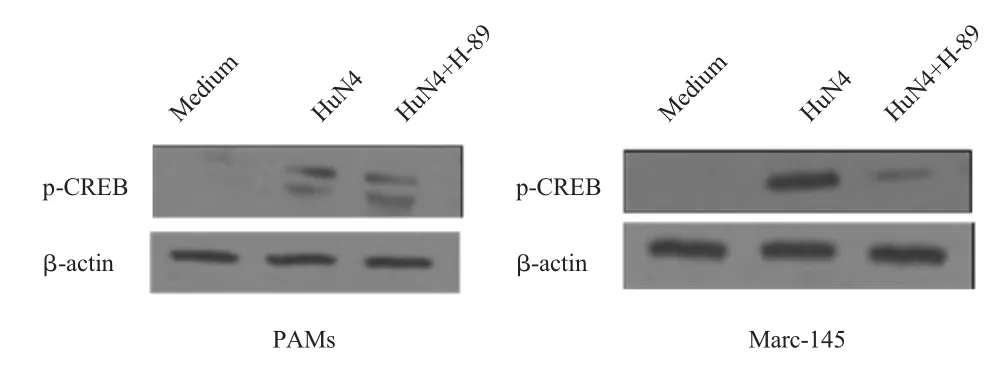
图5 HP-PRRSV感染PAMs和Marc-145细胞PKA通路对p-CREB的影响Fig.5 Effect of PKA pathway in HP-PRRSV-infected PAMs and Marc-145 cells on p-CREB
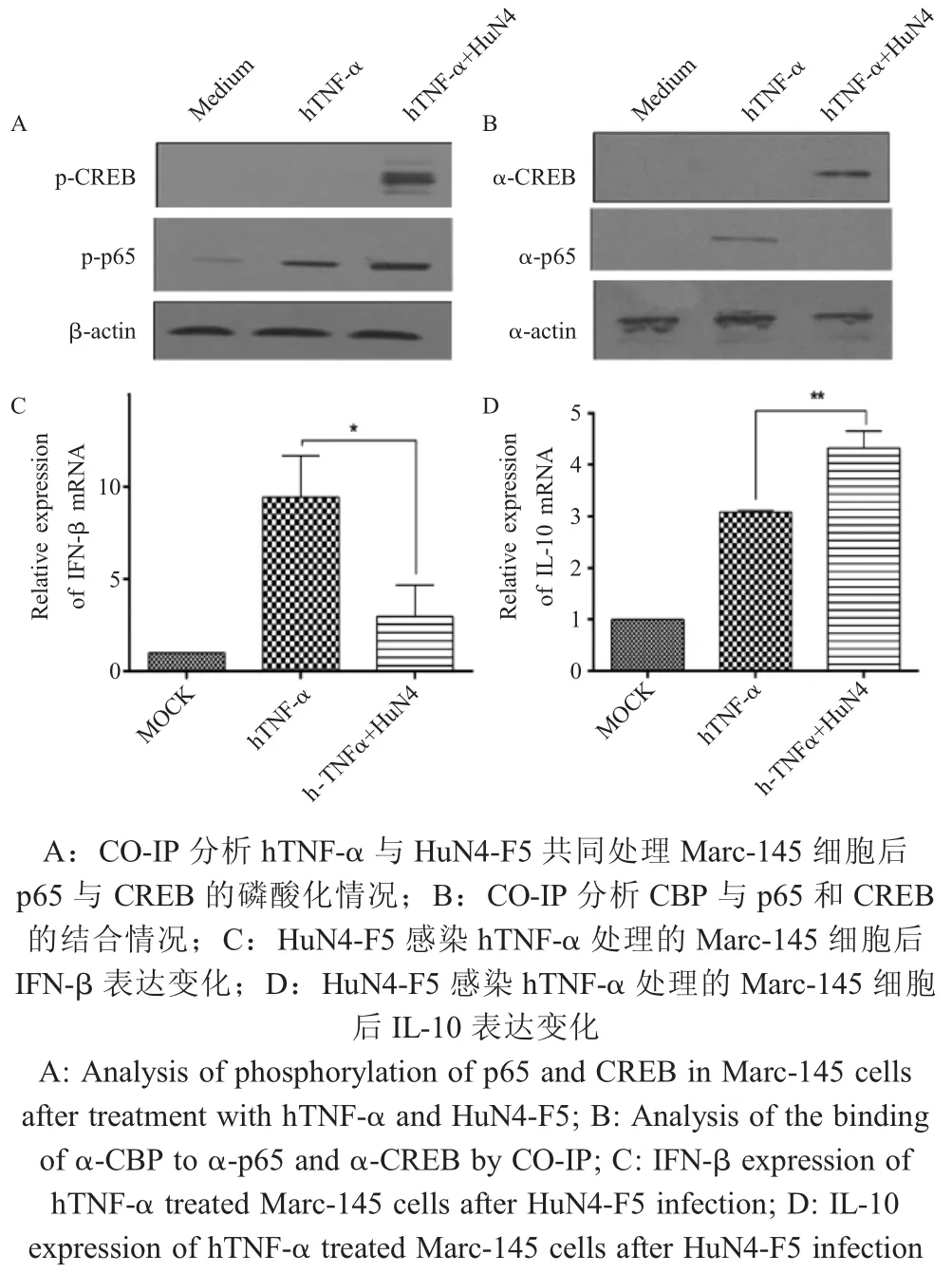
图6 HP-PRRSV感染后利用磷酸化的CREB抑制CBP与p65结合影响I型IFN的表达Fig.6 The phosphorylated CREB inhibits the binding of CBP to p65 after HP-PRRSV infection to affect the IFN-I expression
2.5 抑制剂可以抑制CREB与CBP的结合 利用PKA通路抑制剂H-89和p38通路抑制剂SB203580处理MOI 1 HuN4-F5感染的Marc-145细胞后,对收集的细胞样品进行CO-IP试验,结果显示,经过抑制剂H-89和SB203580处理后,CREB的磷酸化水平明显降低,同时使CREB与CBP的结合也受到了抑制(图7)。利用荧光定量PCR方法检测细胞中IL-10 mRNA转录水平,结果显示,与阳性对照相比,经过抑制剂H-89和SB203580处理后细胞中IL-10 mRNA转录水平明显下降(图8),表明作为IL-10的转录因子CREB磷酸化受阻后,其与CBP的结合能力也同时被抑制,并进一步影响了IL-10的表达。
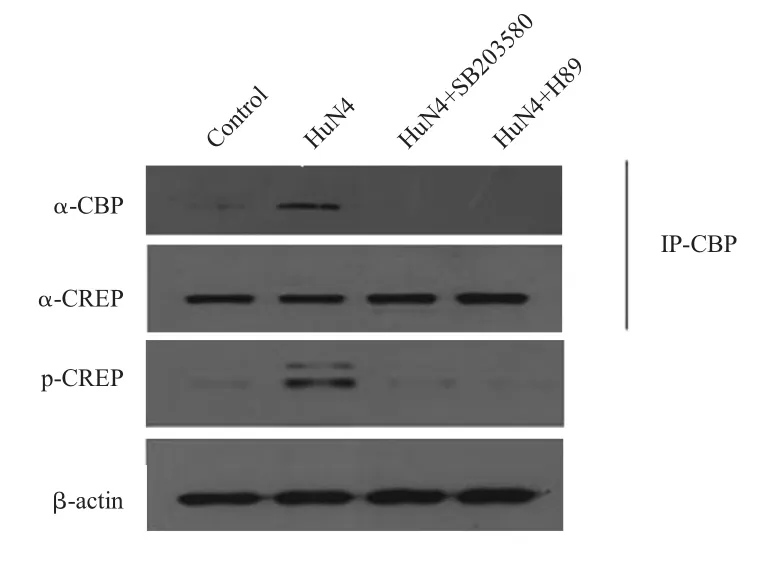
图7 抑制剂H-89和SB203580抑制CREB与CBP的结合Fig.7 The inhibitor H-89 and SB203580 inhibit the interaction between CREB and CBP
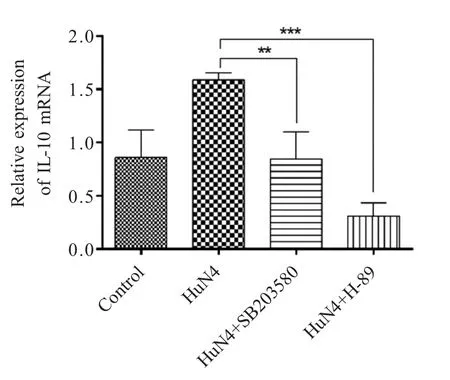
图8 PKA通路和p38通路抑制剂可以抑制IL-10的表达Fig.8 The inhibitors of PKA pathway and p38 pathway inhibit IL-10 expression
3 讨论
PRRSV属于免疫抑制病毒,感染后可以上调机体内IL-10的表达,IL-10作为重要的细胞因子可以抑制免疫反应,发挥负调控的作用。此前有研究表明 PRRSV感染后,可以引起 PAMs、BMDMs和MDMs细胞内 IL-10的显著上调[14],但也有一些PRRSV,如北美洲型SD-23983病毒株在DCs中不引起IL-10的上调,还有利用感染性克隆拯救的HP-PRRSV vFL12株也不具有上调IL-10的能力[15]。本研究证实HP-PRRSV HuN4株感染PAMs后可以显著上调IL-10的mRNA转录水平。CREB作为IL-10的转录因子,其活性形式与IL-10的表达密切相关。HuN4株感染PAMs后,最早在感染后15 min就可以检测到CREB的磷酸化上调,而且持续较长时间,表明PRRSV感染后,可以使细胞内CREB持续处于活性状态,这可能与发生持续转录的IL-10有关。已有研究证实IL-10可以通过PKA通路、p38 MAPK通路和ERK1/2通路被激活[8,16],本研究结果显示HP-PRRSV感染Marc-145细胞后p38 MAPK的磷酸化水平显著增加,ERK1/2的磷酸化水平变化不明显,通过PKA通路抑制剂H-89处理细胞,发现在HP-PRRSV感染初期CREB的磷酸化明显受到抑制,结果表明在Marc-145细胞中通过PKA通路和p38 MAPK通路的激活来磷酸化CREB。在PRRSV感染的PAMs中,p38的磷酸化水平明显提高且持续时间较长,而经PKA通路抑制剂H-89处理的细胞,CREB磷酸化水平几乎没有影响,表明在PAMs中CREB的磷酸化主要是通过p38 MAPK通路活化。CREB与CBP结合才具有mRNA的转录功能,而CBP可以和多种转录因子形成基底转录装置,然后结合基底转录因子TFIIB起始转录的发生。其中p65也能够与CBP结合,p65与CBP的结合是NF-κB发挥生物活性的重要形式。CREB的磷酸化是CREB与CBP结合的必要条件,本研究利用HP-PRRSV感染Marc-145细胞,经CO-IP试验,证实HP-PRRSV诱导产生的磷酸化CREB通过与CBP的结合竞争性抑制了p65与CBP的结合,并进一步抑制了IFN-I的表达。利用PKA通路抑制剂H-89和p38 MAPK通路抑制剂SB203580处理细胞,结果显示当CREB磷酸化受阻后,其与CBP的结合能力随之减弱,导致IL-10的表达水平也随之降低。此前一些研究表明PRRSV感染后通过其非结构蛋白 NSP1α、NSP1β、NSP2、NSP4和 NSP11阻断先天免疫信号通路来抑制IFN-I的表达[1-5],根据本研究结果,推测HP-PRRSV在感染初期,可以通过p38 MAPK通路的激活来磷酸化CREB,磷酸化的CREB与p65竞争性结合CBP,使其在表达的免疫抑制因子IL-10发挥作用前,阻断IFN-I的表达,进而抑制宿主的天然免疫反应。本研究结果对深入了解HP-PRRSV的先天免疫抑制机理具有重要作用。
