持续高容量血液滤过对急性呼吸窘迫综合征患者氧代谢的影响
2019-09-03蒋勇肖仁威缪碧丽文勇梁德坚曾佑强邓光进
蒋勇,肖仁威,缪碧丽,文勇,梁德坚,曾佑强,邓光进
(英德市人民医院重症医学科,广东 清远 513000)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是发生于严重感染、休克、创伤或烧伤等疾病过程中,由肺毛细血管内皮细胞和肺泡上皮细胞炎性损伤而造成的弥漫性肺泡损伤,导致急性低氧性呼吸功能不全或呼吸衰竭,临床表现为急性起病、呼吸窘迫、顽固性低氧血症等,目前针对ARDS的治疗主要为控制原发病、纠正低氧血症、改善器官功能。但由于ARDS病因复杂多样,原发病常常在短时间内不能解除,而顽固性低氧导致其高病死率,早期改善患者氧代谢尤为重要,而持续高容量血液滤过(high volume hemofiltration,HVHF)能快速改善ARDS患者的氧代谢。本研究采用持续HVHF治疗我院重症医学科收治的重度ARDS患者,临床疗效较好,报道如下。
1 对象与方法
1.1 研究对象
选取2017年6月至2018年12月我院重症医学科收治的重度ARDS患者64例,随机分为研究组和对照组,每组32例。研究组男16例、女16例;年龄44~87岁,平均(67.38±6.85)岁;急性生理与慢性健康状况评分(APACHEII)为(18.16±3.21)分;直接性病因13例,包括肺炎9例、肺挫伤4例,间接性病因19例,包括脓毒症9例、重症胰腺炎3例、重症腹腔感染7例。对照组男16例、女16例;年龄46~85岁,平均(67.59±6.53)岁;APACHEII评分为(18.21±3.37)分;直接性病因13例,包括肺炎10例、肺挫伤3例,间接性病因19例,包括脓毒症10例、重症胰腺炎3例、重症腹腔感染6例。两组性别、年龄、APACHEII评分、病因构成比等组间比较,差异均无统计学意义(均P>0.05)。本研究经伦理学委员会讨论通过,实施前经患方签署知情同意书。
1.2 纳入及排除标准
以2012年ARDS柏林定义为患者纳入标准[1]:(1)已知临床发病或呼吸症状新发或加重后1周内;(2)X线或CT扫描示双肺致密影,并且胸腔积液、肺叶/肺塌陷或结节不能完全解释;(3)肺水肿原因为无法用心力衰竭或液体超负荷完全解释的呼吸衰竭,如不存在危险因素则需要进行客观评估(如超声心动图)以排除流体静力型水肿;(4)呼气末正压(PEEP)>5 cmH2O时,氧合指数(OI)≤100 mmHg(1 cmH2O=0.098 kPa,1 mmHg=0.133 kPa)。
排除标准:(1)原发病不能缓解的恶性肿瘤患者;(2)有危及生命的活动性出血患者;(3)对肝素、鱼精蛋白及循环管路或滤器过敏者。
1.3 治疗方法
研究组采用内科常规治疗,包括病因治疗、一般支持治疗、保护性机械通气治疗等,同时采用HVHF治疗。HVHF治疗使用德国贝朗连续性血液净化治疗(CRRT)机,滤器采用德国贝朗Diacap Acute滤器,滤器使用时间≤24 h;血管途径采用股静脉置管,血流速度设置为200 mL/min;置换液选择碳酸氢盐配方,根据患者血pH值及离子浓度调节,治疗剂量50~60 mL/(kg·h);采用普通肝素(马鞍山丰原制药)抗凝,监测患者活化部分凝血活酶时间在1.5~2.5倍;治疗方式采用持续HVHF治疗。
对照组采用内科常规治疗,包括病因治疗、一般支持治疗、保护性机械通气治疗。出现急性肾损伤需要静脉-静脉血液滤过治疗时使用CRRT机、滤器、置换液及抗凝方法与研究组相同,治疗剂量25~30 mL/(kg·h),以改善肾功能为治疗目的。
1.4 观察指标
采用美国NOVA Prime血气分析仪进行患者血气分析检查,血气分析仪质控采用NOVA Prime专用质控系统。记录治疗前及治疗后6、12、24、48 h两组患者动脉血氧分压(PaO2)、中心静脉血氧分压(PcvO2)、OI、血乳酸(Lac)水平。
1.5 统计学方法
2 结 果
治疗前、治疗后6、12、24、48 h两组患者PaO2、PcvO2、OI、Lac水平比较见表1。治疗前两组PaO2、PcvO2、OI、Lac组间比较,差异无统计学意义(均P>0.05)。治疗后6 h,研究组PaO2、PcvO2、OI均较治疗前增加,Lac较治疗前降低(均P<0.05)。治疗后6 h研究组PaO2和OI升高,治疗后12 h对照组PaO2和OI升高,显示研究组PaO2和OI改善早于对照组。治疗后6、12、24、48 h研究组PaO2、PcvO2、OI均高于对照组,Lac均低于对照组(均P<0.05)。
3 讨 论
ARDS发病机制复杂,至今尚未完全阐明,肺内、肺外原因均可导致,全身炎症反应是各种病因致ARDS的共同途径和根本原因。当各种原因引起大量炎性因子释放,而内源性抗炎因子又不足以抵消其作用时,全身炎症反应综合征(SIRS)与代偿性抗炎症综合征(CARS)失衡,细胞因子由保护效应变为自身破坏作用,而肺是其最易损害的首位靶器官[2]。
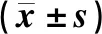
表1 治疗前后不同时点两组患者PaO2、PcvO2、OI、Lac水平比较
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
血浆中肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6、IL-8等炎症介质作用于肺泡毛细血管内皮细胞和肺泡上皮细胞,导致肺血管通透性增加、肺水肿、肺泡塌陷、通气/血流比值失调,进而诱发肺损伤,出现ARDS。ARDS患者氧代谢的特点是:(1)由于肺容积减少、弥散功能下降、通气/血流比值失调导致氧合不足,氧输送减少;(2)由于原发病出现发热、疼痛等以及缺氧出现的呼吸窘迫,导致氧需量、氧耗量增加。在原发病不能短时间内改善时,首先改善患者氧代谢,维持组织、器官功能十分重要。
文献表明,连续性静脉-静脉血液滤过可有效清除炎症介质,其主要原理是对流传质[3]。影响对流传质的效果主要有两个方面:一是滤过膜,即滤过膜的面积、通透性、滤过系数等;二是血流速度,血流速度越快对溶质清除越多。HVHF是在常规血液滤过和连续性静脉-静脉血液滤过治疗基础上发展起来的一种血液净化模式,通过大剂量的治疗,能够有效清除非肾脏适应症患者体内炎症介质[4]。O’Leary等[5]研究表明,ARDS患者TNF-α、IL-1β、IL-6、IL-8等炎症介质水平与病情严重程度呈正相关。HVHF治疗清除ARDS患者体内炎症介质,能减轻肺泡损害,降低肺血管通透性,减缓疾病进展;同时,超滤能精确容量管理,使肺血管外组织水肿减轻,增强肺泡对氧的弥散能力,提高PaO2,在一定范围内可改善ARDS患者的氧输送[6]。亦有研究表明HVHF治疗可改善重度ARDS患者OI、降低肺水肿[7]。另外,体温每下降1 ℃,氧摄取率下降5%~10%,HVHF可在短时间内有效缓解患者高热状态,可降低患者代谢率、减少氧耗;同时提高氧分压后,患者呼吸窘迫、气促可部分缓解,亦使患者氧耗减少[8]。本研究显示,研究组可更快地改善患者PaO2、OI。血Lac水平是反应组织缺氧的敏感指标,本研究显示治疗后研究组血Lac水平均低于对照组,也反应了全身组织器官氧代谢得到明显改善。
综上述,持续HVHF能显著提高ARDS患者动、静脉氧分压,改善氧合,降低血Lac,改善组织器官缺氧,为ARDS患者原发病的进一步治疗争取了时间,值得在临床推广。
