白及提取物小鼠体内抗流感病毒药效研究
2019-09-03张兵卢亦愚程东庆
张兵 卢亦愚 程东庆
1.浙江中医药大学医学技术学院 杭州 310053 2.浙江省疾病预防控制中心
甲型流感病毒由于其高致病性及高致死性,对人类健康和畜牧业均造成了重大危害,是全球公共卫生面临的重大威胁之一。其中H3N2型甲型流感病毒是引起流感大流行的重要亚型之一,20世纪以来出现过3次流感世界性大流行,1968年H3N2型甲型流感病毒导致的流感大流行至少造成全球100万人死亡[1]。疫苗是流感防治的主要方法之一,然而由于流感病毒易于发生抗原性变异、温度敏感性变异等,疫苗极易失效[2]。临床上,抗流感药物主要包括M2离子通道蛋白抑制剂和神经氨酸酶抑制剂两大类[3],随着这些药物的长期广泛使用,流感病毒耐药性不断增强,因此急需开发治疗流感的新药物。
中药治疗流感自古有之,从中药中寻找有效成分以开发新药治疗流感已逐渐引起研究者重视[4]。兰科植物白及(Bletilla striata)在我国境内分布广泛,研究证实,联苄类和菲类是白及的主要有效成分,其生物活性包括抗氧化、抗诱变、抗炎、抗菌、抗血小板聚集等[5]。因此,本研究建立流感病毒鼠肺适应株感染小鼠模型,探讨白及提取物在小鼠体内抗流感病毒的药效,为开发抗流感的新药物提供实验依据,并为临床治疗流感提供新思路。
1 对象和方法
1.1 病毒株和鸡胚 流感病毒A/Sydney/5/97(H3N2)由浙江省疾病预防控制中心保存并提供;9~10d龄SPF级鸡胚购于浙江立华农业科技有限公司[实验动物生产许可证号:SCXK(浙)2016-0003]。
1.2 实验动物 SPF级雌性BALB/C小鼠181只,6~8周龄,体质量18~20g,购于上海西普尔必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2018-0006],饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2018-0012]。
1.3 药物和试剂 白及于2012年采挖自浙江省杭州市临安区,经浙江中医药大学医学技术学院丁志山教授鉴定。白及块茎洗净后,置于35℃的烘箱中烘干、粉碎,并过40目筛。准确称取200g粉末,加入95%乙醇3 000mL,回流提取2h,减压抽滤,再向滤渣中加入95%乙醇1 500mL,回流提取、抽滤,合并两次滤液,减压浓缩,干燥备用。使用时以二甲基亚砜(dimethyl sulfoxide,DMSO)配制成生药质量浓度为1.4mg·mL-1的储备液,过滤除菌后置于-20℃储存。达菲胶囊购于瑞士巴塞尔豪夫迈·罗氏有限公司(规格:75mg;批号:10077524);Prime ScriptTMOne Step RT-PCR Kit试剂盒购于TaKaRa公司(批号:AK3001);白细胞介素-2(interleukin-2,IL-2)、干扰素-α(interferon-α,IFN-α)和IFN-β ELISA试剂盒购于ebioscience公司(批号:1702201、1703151、1702151)。
1.4 主要仪器 1300型生物安全柜为Thermo公司产品;Milli-Q Biocel超纯水仪购于美国Millipore公司;BSS260型鸡胚孵育箱购于德国Grumbach公司。
1.5 方法
1.5.1 流感病毒鼠肺适应株的制备 参考文献[6]的方法,将16只雌性BALB/C小鼠以完全随机法分成4组,并用苦味酸进行标记称重。对流感病毒毒株A/Sydney/5/97(H3N2)进行倍比稀释,稀释浓度为 10-1~10-3,稀释后滴鼻感染小鼠,每只小鼠的接种剂量为90μL,每个稀释度重复3次,接种病毒后每天观察小鼠的生命体征。选择活动减弱明显、精神状态不佳及体质量变化最大的小鼠,当生命体征下降较明显时处死小鼠,并分离其病变肺,冰上研磨,以荧光定量PCR检测肺组织匀浆上清液Ct值。参考文献[7-8]的方法,再次增殖病毒并进行血凝实验。当血凝滴度达到1:1 024时,则可作为流感病毒鼠肺适应株,分装并置于-80℃冰箱保存备用。
1.5.2 流感病毒半数致死剂量(mouse influenza virus median lethal dose,MLD50) 的测定 将 56只雌性BALB/C小鼠以完全随机法分成7组,每组8只,分别称重并用苦味酸标记。流感病毒从10-1开始,以0.9%氯化钠溶液进行10倍连续倍比稀释,根据Reed-Muench法确定最适滴鼻浓度[9]。乙醚麻醉后,病毒滴鼻感染小鼠,每只小鼠的接种剂量为90μL,分两次滴鼻完成,中间间隔2h。接种病毒后的小鼠正常饲养,每日观察小鼠的活动、精神状态及体质量变化,观察周期为14d[10]。计算小鼠的死亡率,根据Reed-Muench方法计算MLD50[9]。
1.5.3 白及提取物对小鼠的毒性试验 取雌性BALB/C小鼠25只,随机分成5组,每组5只,分别称重并用苦味酸标记。毒性试验高、中、低剂量组分别以16g/kg·d、8g/kg·d、4g/kg·d 白及提取物灌胃,正常对照组给予0.9%氯化钠溶液灌胃,DMSO组给予等量DMSO 灌胃,灌胃体积均为 200μL/只,1次/d,连续给药7d。每日观察并记录小鼠的活动、精神状态、体质量变化[11],并计算小鼠死亡率。根据死亡率确定白及提取物的最大无毒剂量,即小鼠模型的给药剂量。
1.5.4 小鼠感染模型的建立及给药 参考朱华等[12]的方法,84只小鼠适应性培养2d后,采用完全随机法分为7组:模型组、达菲组、白及提取物高剂量组、中剂量组、低剂量组、正常对照组及DMSO组,每组12只。将1.5.3得出的白及最大无毒剂量确定为高剂量,然后依次进行两次2倍稀释,即为中、低剂量。乙醚麻醉小鼠后,模型组、达菲组和白及提取物高、中、低剂量组小鼠以0.1MLD50的病毒鼠肺适应株90μL滴鼻感染;正常对照组和DMSO组以等量0.9%氯化钠溶液滴鼻,分两次滴鼻完成,中间间隔2h。接种病毒后2h,模型组、正常对照组分别予以0.9%氯化钠溶液灌胃,达菲组予达菲0.03g/kg·d灌胃,白及高、中、低剂量组分别予白及提取物 8g/kg·d、4g/kg·d、2g/kg·d灌胃,DMSO组给予等量DMSO灌胃,灌胃体积均为 200μL/只,1 次/d,连续给药 7d。
1.5.5 白及提取物对小鼠血清炎性细胞因子的影响 感染后第 1、3、5、7天各组随机选取3只小鼠,禁食不禁水4h后称重,摘取眼球取血后处死。血液标本室温静置1h,3 000r/min离心10min分离血清,按ELISA试剂盒说明书分别检测IL-2、IFN-α和 IFN-β 的含量[13]。
1.5.6 白及提取物对小鼠肺指数及肺指数抑制率的影响 前期操作同1.5.5,小鼠摘除眼球取血后,打开胸腔,在无菌条件下分离全肺,以PBS冲洗2次,滤纸吸干肺脏水分,称量肺质量,并计算肺指数及肺指数抑制率。肺指数(%)=肺脏质量/体质量×100%;肺指数抑制率(%)=(模型组平均肺指数-药物组平均肺指数)/模型组平均肺指数×100%[14]。
1.5.7 白及提取物对小鼠肺组织病理学的影响 各组剩余小鼠第7天称重完毕后,开胸分离右肺,以10%甲醛固定,再以乙醇梯度脱水,二甲苯透明,石蜡包埋后制备成4~5μm常规切片,HE染色后光镜下观察肺组织形态学改变[15]。
1.5.8 白及提取物对小鼠肺组织病毒载量的影响 各组剩余小鼠第1、3、5、7天称重完毕后,开胸分离左肺,加入1mL磷酸盐缓冲液,用玻璃匀浆器研磨,3 000r/min离心1min,取其上清液,以Qiagen试剂盒提取肺组织中的流感病毒RNA。甲型流感病毒通用引物和探针由浙江省疾病预防控制中心提供,引物序列见表1。采用Prime ScriptTMOne Step RT-PCR试剂盒及甲型流感病毒通用引物、探针来检测病毒RNA合成量。反应体系共 25μL,2×One Step RT-PCR BufferⅢ12.5μL,TaKaRa Ex TaqTMHS(5U·μL-1)0.5μL,Prime ScriptTMRT Enzyme Mix Ⅱ 0.5μL,20μmol·L-1的 PCR 上下游引物各 0.6μL,20μmol·L-1的探针0.3μL,以RNase Free dH2O补足至25μL。反应条件为:42℃逆转录 30min,95℃预变性 2min,95℃变性5s,55℃退火35s,共40个循环。反应完成后,分析得出各个样品的Ct值。用Ct值来表示病毒载量,Ct值越小,则病毒载量越大,小鼠流感病毒感染程度越严重[16-17]。

表1 引物序列Tab.1 Primer sequences
1.6 统计学分析 应用SPSS 20.0统计软件进行统计学分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 MLD50测定结果 以小鼠的死亡率作为判断指标,依据Reed-Muench法计算得出MLD50为10-5/90μL。见表2。本实验要求所有小鼠均存活,但临床表现处于异常状态且肺组织形态存在病理性变化,基于小鼠的死亡率及上述因素,最终确定流感病毒毒株的最佳接种剂量为0.1MLD50。
2.2 白及提取物小鼠毒性试验结果 小鼠连续给药7d,并记录小鼠的活动、精神状态和死亡情况,计算小鼠死亡率。结果显示,白及提取物剂量为16g/kg·d时,对小鼠存在毒性作用。见表3。因此,后续试验中以8g/kg·d为高剂量,然后依次对半稀释得到4g/kg·d、2g/kg·d,即为中、低剂量。
2.3 各组小鼠肺指数及肺指数抑制率比较 流感病毒感染后,模型组小鼠的肺指数持续增加,感染后第3、5、7天,均高于正常对照组(P<0.01),在第 7 天达到最高值,说明成功建立流感病毒小鼠模型。第1天时,达菲组及白及提取物高、中、低剂量组小鼠肺指数低于模型组,但差异无统计学意义(P>0.05);而第3、5、7天达菲组肺指数均低于模型组,且差异有统计学意义(P<0.01);第 3、5、7 天白及提取物高剂量组,第5、7天中剂量组肺指数也低于模型组,且差异有统计学意义(P<0.05,P<0.01)。各时间点白及提取物各剂量组的肺指数均高于DMSO组,差异具有统计学意义(P<0.05,P<0.01)。第 5、7天白及提取物各剂量组肺指数均显著高于达菲组(P<0.01)。见表4。表明达菲对小鼠流感感染模型的保护作用要优于白及提取物。第1、3、5、7天,白及提取物各剂量组和达菲组随着时间延长,肺指数抑制率呈升高趋势,从高到低依次为达菲组、白及提取物高、中、低剂量组。白及提取物高剂量组肺指数抑制率最高达35.8%,而达菲组最高可达47.2%。见表5。

表2 MLD50测定结果Tab.2 Results of MLD50determination

表3 白及提取物对小鼠的毒性Tab.3 Toxicity of Bletilla striata extract on mice
2.4 各组小鼠肺组织病理形态学变化比较 流感病毒感染第7天,正常对照组及DMSO组小鼠支气管结构完整,肺泡、肺泡囊、肺泡管、肺泡隔形态完整,支气管上皮完整,管腔内无分泌物且无炎性细胞渗出。模型组小鼠肺组织可见大量中性粒细胞、单核细胞、淋巴细胞等炎性细胞浸润,组织间可见大量红细胞渗出、肺泡壁增厚、肺间质结构破坏等肺间质性炎症表现。达菲组和白及提取物高剂量组肺间质炎症缓解,肺组织形态结构较为完整,有少量淋巴细胞渗出,伴少量红细胞漏出;中剂量组与模型组比较,仍显示出一定的改善趋势;低剂量组病理学改善不明显。见图1。
2.5 各组小鼠肺组织中病毒载量变化比较 正常对照组与DMSO组小鼠肺组织中无流感病毒检出。感染后第1、3、5、7天,模型组小鼠肺组织Ct值分别为26.02、15.93、13.63、13.57,表明病毒载量随着时间的延长而不断增加。白及提取物高剂量组Ct值分别为25.76、20.26、18.17、18.41;中剂量组 Ct值分别为25.23、17.29、17.09、16.31; 低 剂 量 组 Ct 值 分 别 为25.99、17.15、15.56、14.74;达菲组 Ct值分别为 25.61、21.06、19.18、19.54。Ct值均不断减小,表明病毒载量随着时间的延长而不断增加。与模型组比较,第1天时达菲组及白及提取物高、中、低剂量组Ct值均无统计学差异(P>0.05);第 3、5、7 天时达菲组及白及提取物高剂量组Ct值高于模型组,差异有统计学意义(P<0.01);第5、7天中剂量组Ct值高于模型组,差异具有统计学意义(P<0.01);第5天低剂量组Ct值高于模型组,差异具有统计学意义(P<0.05)。见图2。上述结果表明,白及提取物可以抑制小鼠肺组织中流感病毒复制,其中以白及提取物高剂量组效果最明显,感染第3天即开始起效。

表4 各组小鼠肺指数比较(%)Tab.4 Comparison of lung index in each group(%)

表5 各组小鼠肺指数抑制率比较(%)Tab.5 Comparison of inhibition ratio of lung index in each group(%)
2.6 各组小鼠血清IL-2含量比较 与正常对照组比较,模型组小鼠血清中 IL-2含量降低,感染后第1、3 天差异具有统计学意义(P<0.01,P<0.05),第 5、7天差异则无统计学意义(P>0.05)。与模型组比较,白及提取物各剂量组和达菲组小鼠血清中IL-2含量均有不同程度升高,第1、3、5、7天白及提取物高剂量组和达菲组小鼠血清中IL-2含量均高于模型组,差异有统计学意义(P<0.01);中剂量组IL-2含量高于模型组,除第3天外,差异有统计学意义(P<0.05);低剂量组差异均无统计学意义(P>0.05)。与白及提取物高剂量组比较,中剂量组IL-2含量降低,其中第1、5天差异有统计学意义(P<0.05);白及提取物低剂量组第1、3、5、7天IL-2含量均低于高剂量组,差异具有统计学意义(P<0.01,P<0.05)。白及提取物中、低剂量组各时间点差异均无统计学意义(P>0.05)。见表6。
2.7 各组小鼠血清IFN-α、IFN-β含量比较 感染后第1~3天,模型组、白及提取物各剂量组和达菲组小鼠血清中IFN-α含量明显升高,到第5~7天又逐渐下降。与正常对照组比较,模型组小鼠血清中IFN-α含量升高,其中第3、5天差异有统计学意义(P<0.01,P<0.05),第 1、7 天差异无统计学意义(P>0.05)。与模型组比较,第1、3、5天白及提取物高剂量组和达菲组IFN-α含量升高,差异有统计学意义(P<0.01);第1、3天白及提取物中、低剂量组IFN-α含量升高,差异有统计学意义(P<0.01,P<0.05)。与白及提取物高剂量组比较,中剂量组IFN-α含量降低,但各时间点均无统计学差异(P>0.05);低剂量组IFN-α含量降低,第 3、5 天差异具有统计学意义(P<0.05),第 1、7天均无统计学差异(P>0.05)。白及提取物中、低剂量组比较,差异均无统计学意义(P>0.05)。见表7。
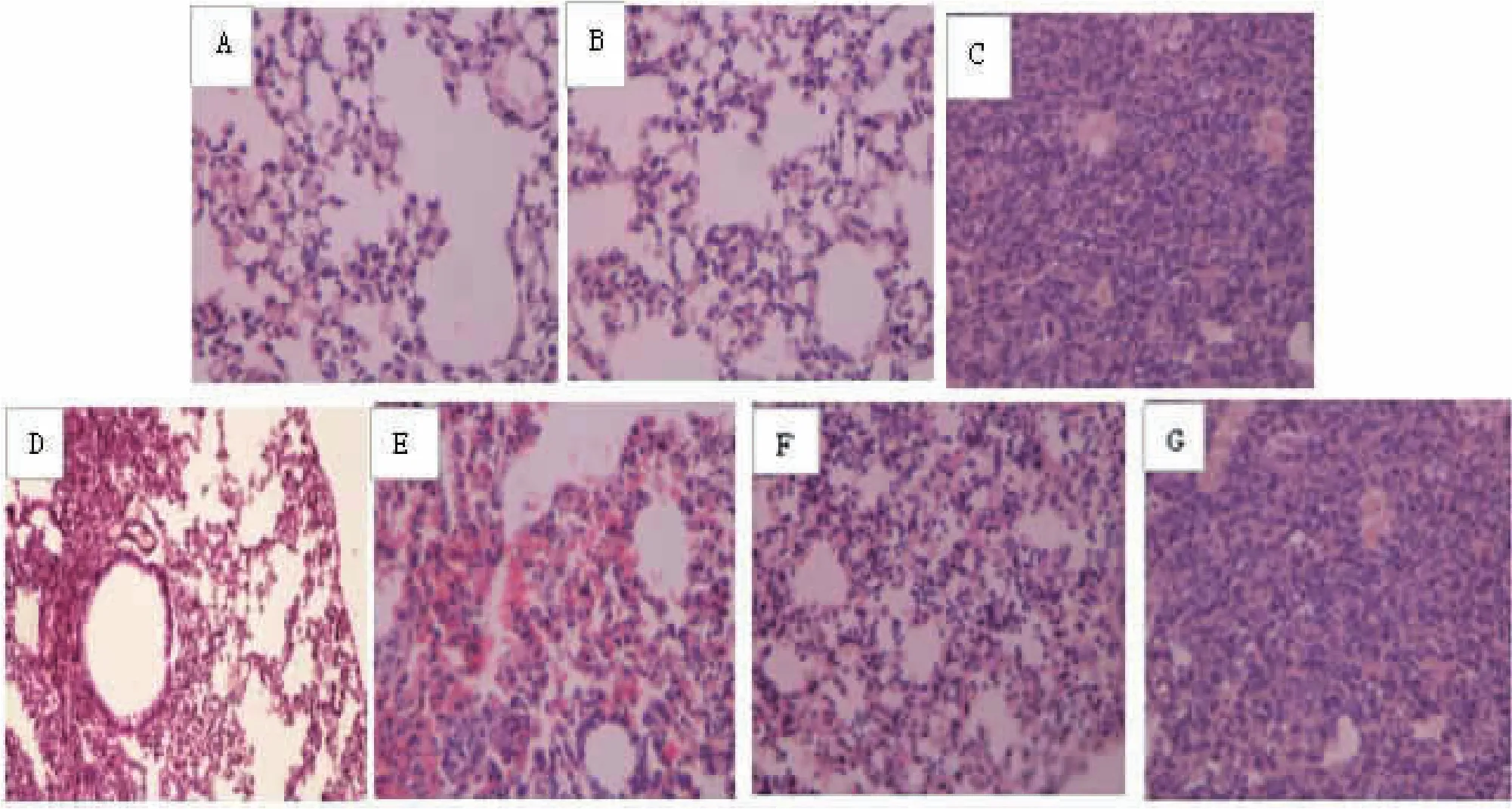
图1 流感病毒感染第7天各组小鼠肺组织病理改变(HE染色,40×)Fig.1 Pathological changes of mice lung tissue on the 7th day of influenza virus infection in each group(HE stain,40×)
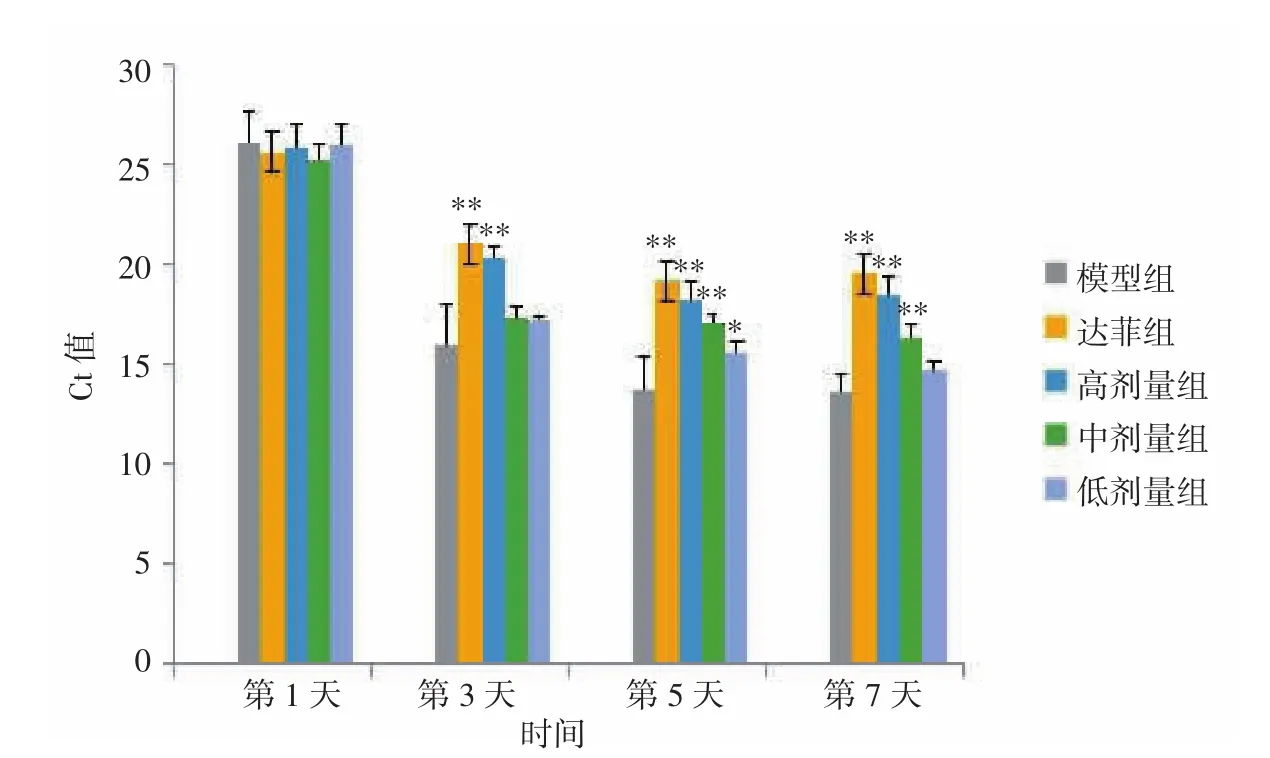
图2 各组小鼠肺组织中病毒载量变化比较Fig.2 Comparison of viral load of lung tissue in each group
感染后第1~3天,模型组、白及提取物各剂量组和达菲组小鼠血清中IFN-β含量明显升高,到第5~7天又逐渐下降。与正常对照组比较,模型组小鼠血清中IFN-β含量升高,差异有统计学意义(P<0.01)。与模型组比较,第1、3、5、7天白及提取物高、中剂量组、达菲组IFN-β含量升高,差异均有统计学意义(P<0.01),第5天白及提取物低剂量组差异具有统计学意义(P<0.05)。白及提取物各剂量组间比较,相同时点随着剂量增高,IFN-β含量随之升高,组间差异有统计学意义(P<0.01)。见表 8。
表6 各组小鼠血清 IL-2 含量比较(±s,pg·mL-1)Tab.6 Comparison of serum IL-2 content in each group(±s,pg·mL-1)

表6 各组小鼠血清 IL-2 含量比较(±s,pg·mL-1)Tab.6 Comparison of serum IL-2 content in each group(±s,pg·mL-1)
注:与正常对照组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与白及提取物高剂量组比较,#P<0.05,##P<0.01Note:Compared with normal control group,△P<0.05,△△P<0.01;compared with model group,*P<0.05,**P<0.01;compared with Bletilla striata extract high dose group,#P<0.05,##P<0.01
组别IL-2含量第1天 第3天 第5天 第7天正常对照组DMSO组模型组达菲组白及提取物高剂量组白及提取物中剂量组白及提取物低剂量组126.86±0.66 123.85±1.14 115.11±1.33△△132.44±4.57**131.07±2.10**124.02±2.79*#120.98±0.49##124.54±2.53 126.13±3.22 117.74±2.98△134.33±3.31**130.92±3.30**125.25±3.62 120.45±1.69##124.96±1.43 124.89±0.90 115.61±6.75 132.62±6.32**131.76±0.71**124.50±2.71*#121.17±0.47##123.56±3.64 124.13±2.08 116.18±3.70 134.81±3.23**130.25±4.24**125.44±2.77*119.22±3.85#
表7 各组小鼠血清 IFN-α 含量比较(±s,pg·mL-1)Tab.7 Comparison of serum IFN-α content in each group(±s,pg·mL-1)
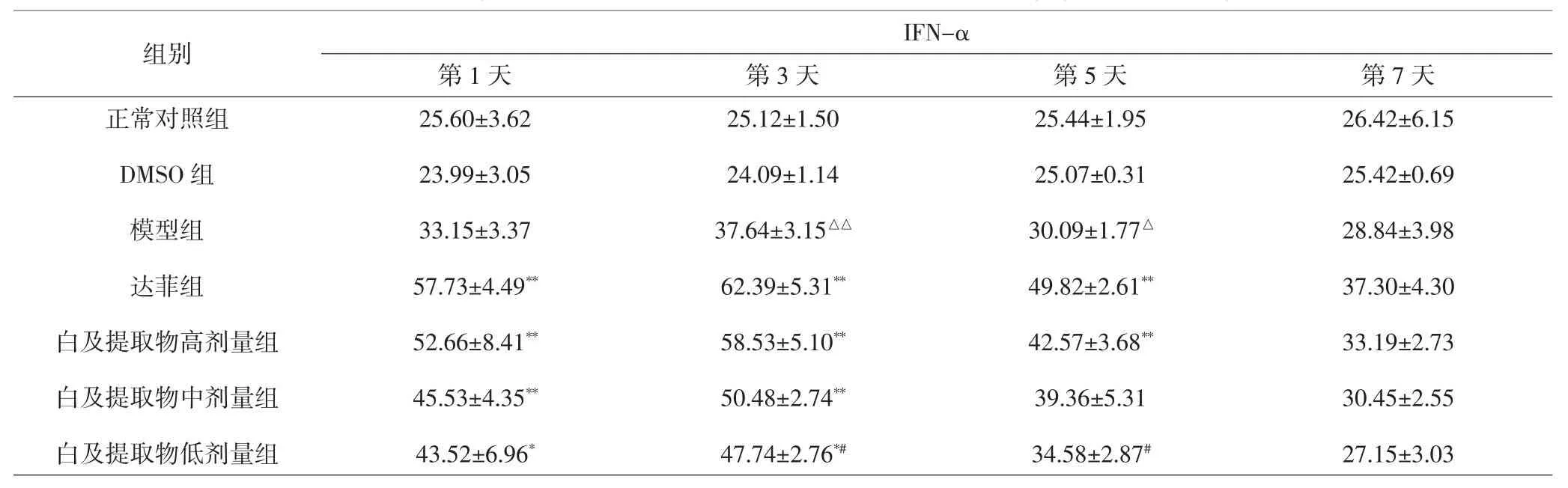
表7 各组小鼠血清 IFN-α 含量比较(±s,pg·mL-1)Tab.7 Comparison of serum IFN-α content in each group(±s,pg·mL-1)
注:与正常对照组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与白及提取物高剂量组比较,#P<0.05Note:Compared with normal control group,△P<0.05,△△P<0.01;compared with model group,*P<0.05,**P<0.01;compared with Bletilla striata extract high dose group,#P<0.05
组别IFN-α第1天 第3天 第5天 第7天正常对照组DMSO组模型组达菲组白及提取物高剂量组白及提取物中剂量组白及提取物低剂量组25.60±3.62 23.99±3.05 33.15±3.37 57.73±4.49**52.66±8.41**45.53±4.35**43.52±6.96*25.12±1.50 24.09±1.14 37.64±3.15△△62.39±5.31**58.53±5.10**50.48±2.74**47.74±2.76*#25.44±1.95 25.07±0.31 30.09±1.77△49.82±2.61**42.57±3.68**39.36±5.31 34.58±2.87#26.42±6.15 25.42±0.69 28.84±3.98 37.30±4.30 33.19±2.73 30.45±2.55 27.15±3.03
3 讨论
近年来,我国各地多次流感大爆发,全国各地均成为流感高发地区。由于流感病毒传播速度快,极易发生抗原突变,目前尚无有效的手段来预防流感的爆发和传播。奥司他韦(达菲)为临床治疗流感的常用药,但目前流感病毒普遍对其存在耐药性,急需开发新型抗流感药物[18]。
兰科植物白及(Bletilla striata)又名白芨、甘根,为传统中药,味苦、甘,性凉。白及的化学成分包括联苄、二氢菲、联苯、菲、类固醇及其他皂苷、黄酮类化合物等[19-21]。已有研究表明,白及中的联苄类化合物及黄酮类化合物成分具有抗病毒作用,可见白及中多种成分均具有抗流感病毒的潜力[22-23]。
本研究建立了流感病毒鼠肺适应株感染小鼠模型,以肺指数、肺指数抑制率、肺组织病毒载量、肺脏病理形态学改变以及血清中炎症因子含量来综合评价白及提取物小鼠体内抗流感病毒药效。实验结果表明,白及提取物高、中剂量组可以在第5、7天显著降低模型小鼠的肺指数,达菲组在第3、5、7天显著降低模型小鼠的肺指数,而其他各组对模型小鼠的肺指数无明显影响;白及提取物高剂量组可在第3、5、7天降低肺脏病毒载量,并能够改善病毒感染所致机体肺组织病理形态学改变,减少肺组织中的中性粒细胞、淋巴细胞浸润,减轻肺泡壁充血以及肺泡扩张等。
在小鼠血清中,白及提取物各剂量组和达菲组小鼠血清中IL-2、INF-α、INF-β含量均有不同程度升高。IL-2由T细胞产生,以自分泌和旁分泌方式发挥效应,主要生物学功能包括活化T细胞,促进细胞因子产生;刺激自然杀伤细胞(natural killer cell,NK cell)和淋巴因子激活的杀伤细胞(lymphokine-activated killer cell,LAK cell)等多种杀伤细胞增殖分化,并诱导其产生细胞因子;促进B细胞增殖和分泌抗体;激活巨噬细胞等。INF-α、INF-β是免疫细胞抗病毒免疫应答时产生的细胞因子,通过干扰病毒基因转录或病毒蛋白组分的翻译,从而阻止或限制病毒感染;同时能调节机体免疫系统。
表8 各组小鼠血清 IFN-β 含量比较(±s,pg·mL-1)Tab.8 Comparison of serum IFN-β content in each group(x±s,pg·mL-1)

表8 各组小鼠血清 IFN-β 含量比较(±s,pg·mL-1)Tab.8 Comparison of serum IFN-β content in each group(x±s,pg·mL-1)
注:与正常对照组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与白及提取物高剂量组比较,##P<0.01;与白及提取物中剂量组比较,◆◆P<0.01Note:Compared with normal control group,△△P<0.01;compared with model group,*P<0.05,**P<0.01;compared with Bletilla striata extract high dose group,##P<0.01;compared with Bletilla striata extract medium dose group,◆◆P<0.01
组别IFN-β第1天 第3天 第5天 第7天正常对照组DMSO组模型组达菲组白及提取物高剂量组白及提取物中剂量组白及提取物低剂量组115.44±1.27 116.51±1.62 128.34±4.41△△159.61±4.17**156.09±0.19**150.17±1.70**##128.05±2.12##◆◆115.87±4.95 116.75±3.96 157.51±7.29△△208.01±0.50**195.89±3.31**183.67±2.40**##163.60±2.78##◆◆114.26±1.99 114.96±7.92 143.56±2.17△△187.11±6.43**177.16±2.13**166.35±2.81**##150.65±1.39*##◆◆116.50±2.64 116.86±2.13 134.19±3.50△△173.79±2.60**163.13±2.18**144.68±2.34**##138.81±0.63##◆◆
本研究表明,白及提取物在小鼠体内能有效拮抗流感病毒,能够降低小鼠肺指数、肺组织病毒载量、改善病毒感染所致机体肺组织病理形态学改变,其机制可能是促进IL-2、INF-α、INF-β分泌,增强和调节小鼠细胞免疫功能,从而达到抗流感病毒感染的效果。研究结果提示,白及提取物中有效成分极有可能发展成为抗流感病毒新药,需进一步深入研究。
