SiO2 纳米颗粒与十六烷基二甲基乙基溴化铵协同构建CO2/水乳液及其表征
2019-09-02朱梦雅胡冬冬
朱梦雅,胡冬冬,包 磊,赵 玲,刘 涛
(华东理工大学 化学工程联合国家重点实验室,上海 200237)
超临界二氧化碳作为一种替代挥发性有机溶剂的绿色溶剂[1],与水构建的微乳液即CO2/水(C/W)乳液体系[2-3]在乳液模板剂制备[4]、原油采收[5]、生物支架[6]、天然气水合物置换开采[7]等方面具有广泛应用。乳液的界面自由能较大,要获得稳定的乳液必须向体系中加入乳化剂。传统的乳化剂主要包括含氟类[8]、含硅类[9]以及少量碳氢类表面活性剂[10-11]。但它们存在价格昂贵、不易降解或构建的乳液不稳定等缺点,因此寻找一种环境友好、形成乳液稳定性高的乳化剂成为亟待解决的问题。
20 世纪初,Ramsden[12]发现固体颗粒可以构建高稳定性乳液。Worthen 等[13]利用亲水型SiO2与辛酰胺丙基甜菜碱协同稳定C/W 泡沫。Zheng等[14]利用月桂基酰胺丙基甜菜碱(LAPB)与SiO2构建了内相体积分数为98%的C/W 泡沫。Guo 等[15]利用亲水型SiO2或纳米黏土与α-烯烃磺酸钠及LAPB 协同稳定CO2泡沫。目前对于纳米颗粒稳定C/W 乳液的研究局限于如何构建乳液,而关于水溶液中表面活性剂在颗粒表面的吸附情况及其对所构建乳液的稳定性的影响尚未深入研究。
本工作利用SiO2纳米颗粒与阳离子表面活性剂十六烷基二甲基乙基溴化铵(EHDAB)协同构建了C/W 乳液,通过破乳时间、Zeta 电位、吸附等温线、界面张力以及表观黏度的测定研究了表面活性剂EHDAB 在SiO2颗粒表面的吸附以及所构建乳液的稳定性。
1 实验部分
1.1 原料
高纯CO2:纯度99.99%(w),法国液化空气公司;EHDAB:纯度98%,阿拉丁试剂公司;纳米SiO2:比表面积200 m2/g,Evonik Degussa 公司;实验用水均为去离子水。
1.2 EHDAB/SiO2 混合分散体系的制备
配制一定浓度的EHDAB 水溶液,加入SiO2纳米颗粒,利用HN-1000D 型(上海汗诺仪器有限公司)超声分散仪在500 W 功率下超声处理30 min,得到EHDAB/SiO2混合分散体系,超声处理的工作时间和休息时间的间隔均设定为3 s,以避免分散体系过热,然后将该分散体系静置备用。
1.3 乳液制备及稳定性测试
将定量EHDAB/SiO2混合分散体系置于自主设计搭建的高压乳化釜中(釜体积为20 mL,最大可承受压力为40 MPa),控温20 ℃,通过注射增压泵缓慢注入高压CO2至设定压力10 MPa。通过磁力搅拌设备对乳化釜进行搅拌,直至白色的乳状液充满乳化釜,该乳状液为C/W 乳液,继续搅拌一定时间后关闭搅拌并开始计时,乳液中析出5 mL液体所需时间记为乳液半衰期。实验构建体积比为50∶50 的C/W 乳液,稳定时间以半衰期为标准。
1.4 测试表征
将EHDAB/SiO2混合分散体系振荡分散均匀,利用英国马尔文仪器有限公司Nano-ZS 型激光散射仪测量分散液中SiO2纳米颗粒的电位与粒径分布,每个试样至少测量5 次,取平均值。
将EHDAB/SiO2混合分散体系转移至离心试管中,在10 000 r/min 的转速下离心分离60 min,取上层清液,采用TOC-VCPN 型(日本岛津有限公司)总有机碳分析仪通过有机碳谱(TOC)分析上层清液中EHDAB 的浓度,计算得到EHDAB 在SiO2颗粒表面的吸附量,每个试样测试5 次后取平均值,测试温度均为25 ℃。
利用Dataphysics 公司OCA 20 型张力仪通过悬滴法测定不同条件下分散体系的表面张力,测试温度均为25 ℃,每个试样测试5 次后取平均值。
乳液的表观黏度采用自制的高压落球黏度仪测量[16]。
2 结果与讨论
2.1 乳液稳定性
SiO2纳米颗粒质量浓度为0.1×10-2g/mL,将其与EHDAB 协同构建体积比为50∶50 的C/W 乳液。乳液半衰期随EHDAB 含量的变化见图1。从图1a 可看出,随EHDAB 含量的增大,EHDAB 构建的乳液的稳定性先增加后趋于稳定,当EHDAB含量高于0.1×10-2g/mL 时,乳液稳定性达到平台值,其中,20 ℃时乳液的最长稳定时间为7.5 h,50℃时乳液的最长稳定时间降低至4.6 h。从图1b 可看出,对于EHDAB/SiO2协同构建的C/W 乳液,当EHDAB 含量低于0.01×10-2g/mL 时,随EHDAB含量的增加,乳液稳定性增加。当EHDAB 含量为0.01×10-2g/mL 时,乳液稳定性达到最佳值(此时EHDAB 与SiO2的质量浓度比为0.1),其中,20℃时的稳定时间为28 h,50 ℃的稳定时间为25 h。此后随EHDAB 含量继续升高,乳液稳定性反而下降。当EHDAB 含量升至0.1×10-2g/mL,乳液稳定性达到平台值。造成这种现象的原因是由于亲水型SiO2纳米颗粒带负电荷,它利用静电吸引力吸附EHDAB,调节颗粒润湿性构建乳液。当EHDAB含量较低时,无法形成足够多的具有合适润湿性的纳米颗粒,此时乳液主要通过EHDAB 稳定;随着EHDAB 含量的增大,EHDAB 的离子基由于静电作用吸附在纳米颗粒表面,疏水基朝向外侧,使纳米颗粒表面的疏水性增加,吸附了EHDAB 的纳米颗粒更容易转移至乳液界面,从而提高乳液稳定性;但继续增加EHDAB 含量,EHDAB 在纳米颗粒表面缔合形成胶束,此时纳米颗粒表面吸附双层EHDAB,造成纳米颗粒从界面脱附进入主体相,乳液又通过EHDAB 稳定,因此乳液稳定性开始降低。对比图1a 与1b 发现,当EHDAB 含量相同时,EHDAB/SiO2构建的C/W 乳液的稳定性随温度的变化较小,说明该乳液具有较好的热稳定性。

图1 乳液半衰期随EHDAB 含量的变化Fig.1 Half-life of emulsion changed with different EHDAB concentration.Condition:SiO2 content 0.1×10-2 g/mL.EHDAB:hexadecyl dimethyl ethyl ammonium bromide.a C/W emulsion stabilized by EHDAB;b C/W emulsion stabilized by EHDAB/SiO2
控制体系压力10 MPa,采用0.04×10-2g/mL的EHDAB 与0.1×10-2g/mL 的SiO2协同构建C/W乳液,研究分散相体积分数和温度对乳液稳定性的影响,结果见图2。

图2 EHDAB/SiO2 构建的C/W 乳液半衰期随温度(a)及分散相体积分数(b)的变化Fig.2 Half-life at different temperatures(a) and dispersed phase volume fraction(b) of C/W emulsion stabilized by EHDAB/SiO2.
从图2 可看出,随温度的升高,乳液稳定性降低,但降幅较小。对于由表面活性剂稳定的乳液,一方面,液滴的热运动随温度的升高而加剧,运动速率的增加使得液滴间碰撞的频率加大,加速乳液的破乳;另一方面,液滴周围液膜中的水流失速率也受高温影响,随温度升高,液滴周围液膜黏度减小,导致水流失速率加快,进一步引起乳液的絮凝和凝聚[17],乳液稳定性变差。而对于EHDAB/SiO2构建的C/W 乳液,固体颗粒在乳液液滴表面紧密排布,形成了一层致密膜,阻隔了乳液液滴之间的碰撞聚并;同时,颗粒乳化剂吸附在液滴表面也增加了乳液液滴之间的相互斥力[18],因此,两者共同作用使乳液的稳定性随温度的变化较小。从图2b 可看出,随分散相比的增大,即水体积的减小,形成的乳液变得不稳定。这是由于随着分散相比的增大,乳液液滴尺寸变大,尺寸分布变宽,液滴单位表面所吸附的SiO2颗粒数目减少,促进乳液的Ostwald熟化,因此乳液稳定性降低。
2.2 SiO2 在EHDAB 溶液中的Zeta 电位与粒径分布
SiO2在EHDAB 溶液中的Zeta 电位与粒径分布见图3。

图3 EHDAB 含量对SiO2 颗粒聚集体Zeta 电位(a)及粒径(b)的影响Fig.3 The effect of EHDAB concentration on the Zeta potential(a) and the particles diameter(b) of SiO2 particle aggregate.Condition:SiO2 content 0.1×10-2 g/mL.
在不加入EHDAB 时,初始SiO2颗粒分散体系的Zeta 电位为-36 mV,此时颗粒可在体系中稳定分散。从图3 可看出,在强静电作用下,随着EHDAB 含量的增加,分散体系的Zeta 电位迅速增加。当EHDAB 含量为0.01×10-2g/mL,SiO2纳米颗粒质量浓度为0.1×10-2g/mL,即EHDAB 与SiO2的质量浓度比为0.1 时,体系到达零电位点,此时,纳米颗粒表面电荷完全被所吸附的EHDAB中和,颗粒完全聚集,聚集体尺寸达到最大值。当EHDAB 含量超过0.01×10-2g/mL 时,体系的Zeta 电位随EHDAB 含量的增大而逐渐转为正值,颗粒重新分散。这是由于当EHDAB 含量较低时,EHDAB 通过相反电荷之间的静电作用吸附在SiO2纳米颗粒表面,降低了阻止粒子间相互紧密靠近的静电能垒,从而促进了颗粒的凝聚,分散体的稳定性也随之降低。进一步增加EHDAB 含量,EHDAB 又转变为反絮凝剂,EHDAB 的双层吸附产生了一个与EHDAB 所带电荷相同的电势,增加了颗粒间的静电斥力,促使粒子再分散,分散体系重新变得稳定。
当体系到达零电位点时,乳液稳定性最高,原因在于纳米颗粒表面电荷完全被所吸附的EHDAB中和,颗粒之间静电斥力降为零,更容易吸附于C/W 乳液的界面,而且此时聚集体直径达到最大值,吸附能也随之增强,因此所构建的乳液最稳定。
2.3 EHDAB 在SiO2 颗粒表面的吸附量
EHDAB 在SiO2纳米颗粒表面上的吸附见图4。从图4 可看出,EHDAB 在SiO2颗粒表面上的吸附等温线基本呈现出两阶段吸附特征,即典型的‘S’形特征,这与双层吸附模型相吻合。根据双层吸附理论可知,EHDAB 在SiO2纳米粒子表面的吸附主要受静电力和疏水相互作用的控制。当EHDAB含量低于0.01×10-2g/mL 时,EHDAB 分子通过静电作用以单个离子形式吸附在颗粒表面形成半胶束,在此阶段EHDAB 吸附在纳米颗粒表面,其疏水基指向主体相水溶液中,从而在纳米颗粒表面形成疏水区。当EHDAB 含量高于0.01×10-2g/mL时,EHDAB 通过疏水相互作用在纳米颗粒表面双层吸附,第2 层EHDAB 分子通过疏水链与第1 层EHDAB 的疏水链缔合,使亲水头指向体相溶液中。当EHDAB 含量高于0.1×10-2g/mL 时,EHDAB在纳米颗粒表面的吸附达到饱和,此时吸附平衡曲线达到平台值。

图4 EHDAB 在SiO2 颗粒表面的吸附等温线Fig.4 The adsorption isothermal of EHDAB on the surface of SiO2 particles.Γ:difference between the initial concentrations divided by the mass of the silica nanoparticles.
2.4 EHDAB/SiO2 分散体系的表面张力
EHDAB 在SiO2纳米颗粒表面发生吸附后,体系中的EHDAB 有效浓度将会降低,因而降低表面张力的能力也会降低。EHDAB 溶液、EHDAB/SiO2分散体系及EHDAB/SiO2分散体系上清液的表面张力见图5。
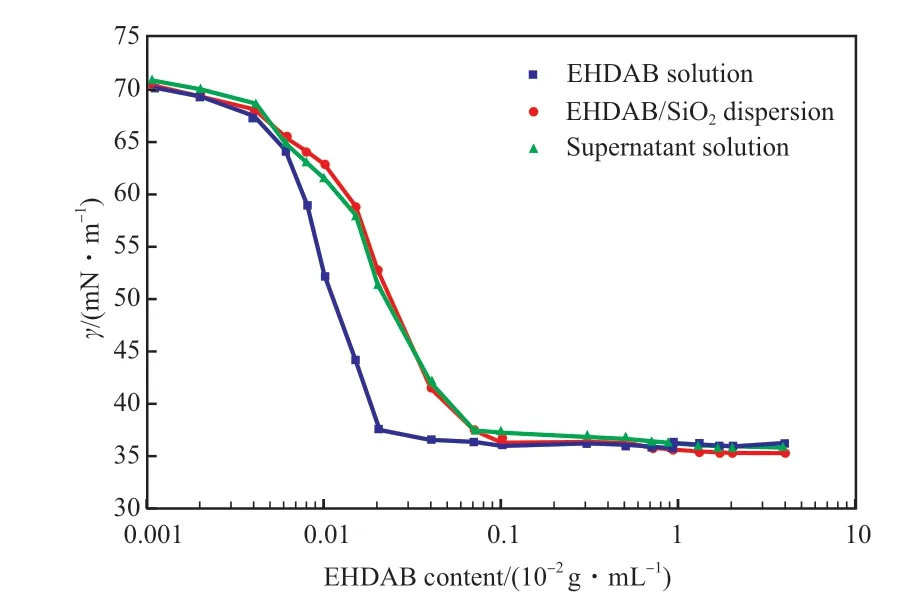
图5 EHDAB 含量对表面张力的影响Fig.5 The effect of EHDAB concentration on the surface tension(γ).Condition:SiO2 content 0.1×10-2 g/mL.
从图5 可看出,当EHDAB 含量较低时,SiO2纳米颗粒的加入对表面张力的影响不大。随EHDAB含量的增大,由于EHDAB 吸附在SiO2颗粒表面从而降低了它在体系中的有效浓度,因此EHDAB/SiO2分散体系的表面张力略高于EHDAB 溶液。继续增加EHDAB 含量,EHDAB 在纳米颗粒表面的吸附达到饱和,最终EHDAB 溶液与EHDAB/SiO2分散体系的表面张力相同。EHDAB/SiO2分散体系上清液与EHDAB/SiO2分散体系的表面张力曲线几乎重合,说明SiO2纳米颗粒对体系的表面张力没有影响,体系的表面张力主要由游离的EHDAB控制。因此,对于EHDAB/SiO2构建的C/W 乳液,EHDAB 主要用于乳液的形成,SiO2纳米颗粒主要用于增强乳液的稳定性。
2.5 C/W 乳液的表观黏度
不同水溶液和乳液的表观黏度见表1。从表1可看出,SiO2纳米颗粒的加入提高了乳液的黏度,增加了乳液的稳定性,而SiO2纳米颗粒的加入并不能明显提高水溶液的黏度。固体颗粒稳定乳液的机理主要包括机械阻隔机理与三维黏弹粒子网络机理,三维黏弹粒子网络机理认为颗粒间相互作用形成了三维网络结构,增加了连续相黏度,导致液滴迁移速率降低。但通过测试连续相的黏度发现,SiO2纳米颗粒含量为0.1×10-2g/mL 时,连续相的黏度并没有明显提高,说明在连续相中还未形成三维网络结构,因此认为在纳米颗粒浓度较低的情况下,固体颗粒稳定乳液的机理主要为机械阻隔机理。

表1 不同水溶液及乳液的表观黏度Table 1 The apparent viscosity of different aqueous solutions and C/W emulsions
3 结论
1)EHDAB/SiO2构建的乳液的稳定性比EHDAB 构建的乳液显著提高。对于EHDAB/SiO2构建的乳液,随EHDAB 含量的增加,乳液稳定性先增加后降低,然后趋于稳定,而且稳定性随温度变化较小。
2)EHDAB 与SiO2的质量浓度比为0.1 时,体系到达零电位点,聚集体直径达到最大值,EHDAB/SiO2构建的乳液稳定性最高。
3)当SiO2纳米颗粒浓度较低时,SiO2纳米颗粒与EHDAB 协同构建乳液,EHDAB 主要用于乳液的形成,SiO2纳米颗粒则用于增强乳液的稳定性,固体颗粒稳定乳液的机理主要为机械阻隔机理。

扫码了解更多相关
专题研究信息
