不同生长优势等级云南松针叶表型多样性分析
2019-08-30蔡年辉李亚麒许玉兰汪梦婷王亚楠王大玮
蔡年辉 李亚麒 许玉兰 李 伟 汪梦婷 陈 诗 王亚楠 王大玮
( 1. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650233;2. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650233;3. 云南吉成园林科技股份有限公司,云南 红河 652300)
云南松(Pinus yunnanensis)是我国云贵高原的主要乡土树种和重要用材树种[1-3],在分布区域的林业生产和生态经济建设中具有举足轻重的作用[3]。目前云南松种质资源的退化比较明显,遗传改良工作迫在眉捷,然而种质资源的准确、系统评价对其保护与利用比较重要。可利用的各种遗传标记包括形态学标记、细胞学标记、同工酶标记和分子标记等,其中形态学标记是比较快捷的途径,也是种质资源多样性评价方面不可或缺的,是遗传多样性研究的重要内容[4]。对于云南松种质资源有过相关的研究报道,对其不同地理分布区域和不同海拔梯度群体进行了研究,群体间表型分化均很低,地理距离、生态距离等引起针叶性状变异的趋势不明显[5-6]。综合来看,现有对云南松种质资源的表型遗传多样性以群体间和群体内的评价居多。在林分中,个体的生长因遗传基础或环境因素产生了分化,呈现出不同生长优势等级,如优势木、中等木、被压木或劣势木等[7-9],而不同生长优势等级间的遗传多样性尚不清楚,在林木经营管理中,可能因优势度的不同采取不一样的经营管理措施,有必要分析不同优势等级林木间的遗传多样性变化。鉴于此,本研究在样地内林木生长测定的基础上,按照树高和胸径(地径)生长因子,将样株划分为优势木、中等木和劣势木3类,对其针叶表型性状的测定,进而进行遗传多样性的评价,以期为该树种的经营管理、利用研究提供有效信息。
1 材料与方法
1.1 研究对象
在全面踏查的基础上,在云南省双江县云南松林分设置3个30 m×30 m样地。分别对样地内的云南松进行每木检尺,测定时将林冠层和更新层分开进行,胸径大于或等于5 cm的云南松视为林冠层;将胸径小于5 cm的云南松视为更新层[10],林冠层测量树高和胸径,更新层测量树高和地径。参照梅婷婷等[11]研究,以树高和胸径(地径)为主要分类因子,将样地内林冠层和更新层各样株按树高和胸径(地径)划分为3类:优势木、中等木和劣势木。以样地中云南松针叶为研究对象。
1.2 性状测定
采集样地中每株云南松树冠中上部位2年生针叶,用自封袋保存并进行单株编号。对采集针叶每株随机抽取健康完整的10束用于表型测定,直尺测量针叶长和叶鞘长,精确到0.1 cm;游标卡尺测量针叶粗和针叶束粗,精确到0.01 mm;计算针叶长/针叶粗、针叶长/叶鞘长和针叶束粗/针叶粗。
1.3 统计分析
依据上述样品的分类,每个样地按林冠层和更新层,每层分优势木、中等木和劣势木3类,3个样地共计18组针叶束数据。各组数据测定的数量如表1所示。

表 1 各样地测定的针叶束数据统计Table 1 Needle beam statistics measured in each plot
所采用SAS 9.0软件对各性状进行巢式方差分析,线形模型为:

式中:Yikj为第i个组第j个单株第k个观测值,μ为总平均值,Si为组效应(固定),T(i)j为组内单株效应(随机);ε(ij)k为试验误差,分析云南松针叶表型变异特征,并计算表型分化系数[12],计算公式为:
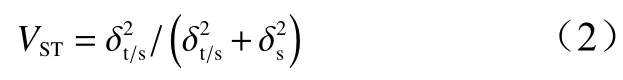
VST表示组间变异占遗传总变异的百分比。
采用 Bio-Dap 软件计算针叶性状多样性Shannon-Wiener指数[13-14]:

式中:Pi为某性状第i个级别出现的概率。
对数据采用Excel软件进行统计,运用SPSS 19.0进行方差分析、相关性分析,并计算平均值、标准差以及变异系数,其中以变异系数来分析各生长优势等级内的变异情况。
2 结果与分析
2.1 不同生长优势等级云南松针叶表型性状特征
将各个样地内林冠层和更新层的针叶性状单独进行分析,计算云南松不同生长优势等级针叶表型性状特征。结果表明(表2),在林冠层,3个样地的针叶长均表现为优势木最低,其次是中等木,以劣势木最高;针叶长/针叶粗在样地1和样地2也表现出与针叶长相似的变化规律。针叶粗和针叶束粗在3个样地的变化规律不一致,样地1表现为:优势木>中等木>劣势木,样地2表现为:优势木>劣势木>中等木,样地3表现为:劣势木>中等木>优势木,但总体各生长优势等级间的差异较小。同样地,针叶长/叶鞘长在样地1、样地2和样地3分别表现为:优势木<中等木<劣势木、优势木<中等木<劣势木、劣势木<优势木<中等木。

表 2 不同生长优势等级云南松针叶的表型性状Table 2 Phenotypic traits of P. yunnanensis needles with different growth dominant grades
在更新层,样地3除叶鞘长和针叶长/叶鞘长外,其余5个性状表现为:优势木>劣势木>中等木。针叶长和针叶束粗在样地1表现为:优势木>中等木>劣势木、在样地2表现为:优势木>劣势木>中等木;针叶粗在样地1和样地2均表现为:优势木>中等木>劣势木;叶鞘长样地1和样地2均表现为:劣势木>优势木>中等木;针叶长/针叶粗在样地1和样地2依次表现为:优势木>劣势木>中等木和劣势木>优势木>中等木。总体来看,以针叶长/针叶粗的变化波动较大,而其他指标的变异在不同生长优势等级间差异均较小。
2.2 不同生长优势等级内云南松针叶性状变异系数分析
对云南松不同生长优势等级云南松针叶表型性状的变异程度进行分析,以3个样地同一生长优势等级的变异系数均值计算,结果见图1。由图1可知,同一林层同一生长优势等级各性状的变异波动有所不同,林冠层优势木和中等木中,各针叶性状的变异系数波动表现较为相似,除针叶长/针叶粗和针叶束粗/针叶粗外,其余5个性状均表现为:针叶长/叶鞘长 > 叶鞘长 > 针叶长 > 针叶粗 > 针叶束粗。其中优势木变化于13.28%~20.74%,平均16.96%;中等木波动于14.56%~20.00%,平均16.87%。劣势木表现为:针叶长/叶鞘长 > 叶鞘长 > 针叶束粗 > 针叶长/针叶粗 > 针叶粗 > 针叶长 > 针叶束粗/针叶粗,变异系数波动于13.41%~17.79%,平均15.58%。3个生长优势等级均表现为以针叶长/叶鞘长的变异系数最大,而低值出现不一致,优势木为针叶束粗、中等木和劣势木为针叶束粗/针叶粗。同一林层同一性状不同生长优势等级的变动也不一致,针叶长、叶鞘长和针叶长/叶鞘长均表现为:优势木>中等木>劣势木;针叶粗、针叶长/针叶粗和针叶束粗/针叶粗均表现为:中等木>优势木>劣势木;针叶束粗表现为:劣势木>中等木>优势木。7个性状的平均值比较来看,优势木(16.96%)和中等木(16.87%)比较接近,以劣势木(15.58%)稍低。
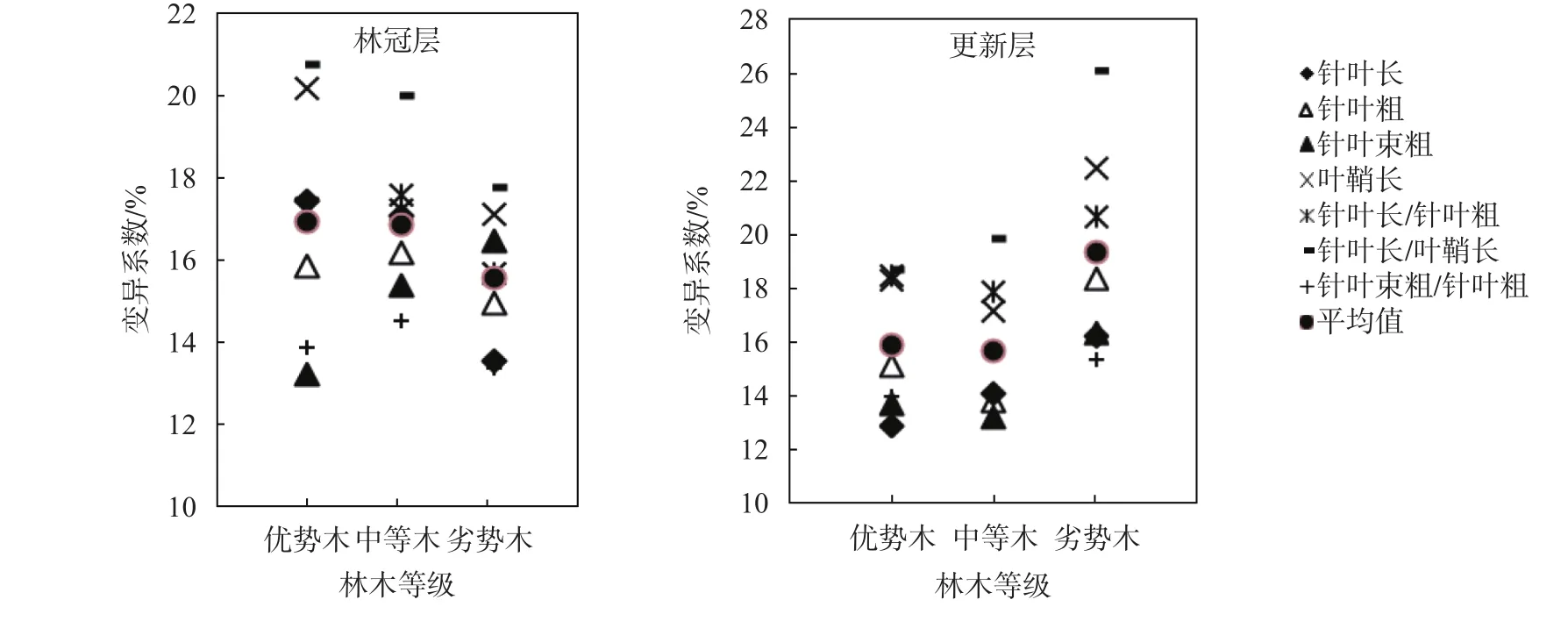
图 1 云南松不同优势等级针叶表型性状变异系数Fig. 1 Variation coefficients of needles phenotypic traits in the different dominance hierarchies of P. yunnanensis
更新层的变化有所不一样,在优势木和中等木,各个性状的变异系数较低,而劣势木7个性状的变异系数均较高,总体平均值表现为:优势木(15.88%)和中等木(15.71%)比较接近,以劣势木(19.35%)较高。
变异系数可间接反映变异的丰富程度,综合来看,林冠层以优势木和中等木的变异较丰富,而更新层则以劣势木的变异更丰富。
2.3 不同生长优势等级内云南松针叶性状Shannon-Wiener指数分析
在前述分析的基础上,进一步对各组林木的多样性指数进行比较(图2),结果表明,林冠层优势木7个性状的Shannon-Wiener指数变化于1.342 4~1.427 0,平均为1.399 5 ;中等木变化于1.357 1~1.432 9,平均为1.394 1;劣势木为1.340 5~1.443 4,平均为1.412 7。不同生长优势等级Shannon-Wiener指数最高值均为叶鞘长,低值优势木和中等木出现在针叶粗,劣势木出现在针叶长/叶鞘长。从平均值来看,以优势木和中等木较为接近,而劣势木稍高。

图 2 不同生长优势等级云南松针叶表型性状Shannon-Wiener指数Fig. 2 Shannon-Wiener index of needles phenotypic traits in the different dominance hierarchies of P. yunnanensis
更新层各性状的Shannon-Wiener指数变化表现为,在优势木,最高出现在针叶长/叶鞘长,为1.462 3,最低出现在针叶束粗/针叶粗,为1.405 2;在中等木和劣势木,最低值出现在叶鞘长,分别为1.255 2和1.330 7,而高值出现的性状不一,中等木以针叶长/针叶粗最高(1.430 9),劣势木以针叶粗最高(1.443 6)。从各个性状的平均值比较,表现为优势木>劣势木>中等木。
对不同生长优势等级间的进行方差分析,各性状的多样性指数差异较小(P>0.05),性状间分布较均匀。
2.4 不同生长优势等级云南松针叶性状表型分化
进一步进行方差分析,分别对每个样地的3类林木进行巢式方差分析,估算方差分量及其方差分量百分比,进而求算表型分化系数,结果见表3。结果表明,在各样地的林冠层和更新层的每个性状均表现为不同生长优势等级间的方差分量远低于各等级内的方差分量,林冠层7个性状平均组间方差分量(6.67%)远低于组内方差分量(51.90%);更新层3个样地组间的方差分量为5.02%,组内平均为42.80%,同样表现为组间的方差分量远低于组内,即云南松针叶表型性状的变异主要存在于不同生长优势等级内。
从表型分化系数也可以看出,各性状的表型分化存在波动,但总体均表现低于50%,3个样地林冠层表型分化系数为5.71%~13.14%,平均9.85%。更新层平均表型分化系数也较低(9.08%),进一步表明云南松针叶表型性状的变异主要存在于组内(不同生长优势等级内),而组间的变异较少,即组内变异是云南松针叶性状的主要变异来源。

表 3 云南松不同优势等级针叶表型性状方差分量分析Table 3 Variance components of P. yunnanensis in the different dominance hierarchies %
3 结论与讨论
表型性状的评价是种质资源遗传多样性评价的基本手段,目前的应用较为广泛[15-17]。叶片的形态特征变化可反映其对环境的适应性变化[18-19],云南松针叶性状是进行表型多样性评价的重要部位之一,且易于采样与测定,前期的研究利用针叶进行遗传变异的评价也反映其可行性[5-6]。变异系数和多样性指数都是反映遗传多样性的指标[20],本研究表明,各性状在不同生长等级间的变异系数波动于13.28%~20.74%,以优势木的针叶粗表现最低、以优势木的针叶长/叶鞘长最高。多样性指数不仅能够反映变异范围的大小,而且能反映出基因型频率的分布,在形态多样性的研究中,多样性指数越高,表明形态性状的多样性越丰富,其中Shannon-Wiener多样性指数广泛应用于表型性状多样性评价[20]。测定的7个针叶性状中,以劣势木中叶鞘长的Shannon-Wiener多样性指数最低(1.340 5)、以劣势木的针叶长/叶鞘长最高(1.443 4)。总的来看,不同性状间的变异系数或多样性指数差异不大,但不同性状对揭示各生长优势等级林木遗传多样性的贡献不一样。因此,综合多个性状能反映各等级林木间的遗传变异。
不同生长优势等级林木间的Shannon-Wiener多样性指数比较来看,优势木各性状间的变异系数波动于1.342 4~1.427 0,平均1.399 5;中等木波动于1.357 1~1.432 9,平均1.394 1;劣势木为1.340 5~1.443 4,平均1.412 7。综合多个性状的均值比较,表现为劣势木>优势木>中等木。这可能与云南松不同生长等级林木间所占的林层位置和环境条件有关,表型性状受基因型、基因型与环境互作以及环境选择压等方面的影响,劣势木在林层中处于下层,受环境的影响较大,如光照、温度、光合有效辐射等[21],在这样的选择压下,提高遗传变异来适应环境条件。上层的优势木占据一定的空间优势,接受更多光照,从环境中获得较多的资源,提高对环境干扰的恢复能力和环境改变的缓冲能力[8-9,22],表现出遗传变异和适应能力的提高[23]。但是,总体来看,它们之间的差异不显著,即不同生长优势等级对云南松针叶表型性状的遗传变异影响较小。
云南松不同生长优势等级林木间的方差分量所占比例波动于3.16%~9.13%,各组内的方差分量所占比例为51.45%~52.80%,总体来看,组间方差分量(6.67%)远低于组内方差分量(51.90%)。表型分化系数也可以看出,尽管各性状的表型分化存在波动,但总体均表现低于50%,3个样地表型分化系数为5.71%~13.14%,平均9.85%。较低的表型分化系数进一步表明不同生长优势等级对其遗传多样性的影响较小。云南松为风媒异花授粉植物,花粉流或种子流均可削弱群体间的遗传分化,差异变小[24-25]。
综合来看,不同生长优势等级林木间的遗传分化较低,遗传多样性差异较小,即林木生长分化对遗传多样性的影响较小。但是,云南松分布生境多为高山陡坡,天然更新仍为主要重建方式,以优势木作为更新母树,有望下代获得较高的遗传改良潜力。
[ 参 考 文 献 ]
[1]中国科学院昆明植物研究所. 云南植物志: 第4卷:种子植物[M]. 北京: 科学出版社, 1986.
[2]中国科学院中国植物志编辑委员会. 中国植物志: 第7 卷 [M]. 北京: 科学出版社, 1961.
[3]金振洲, 彭鉴. 云南松[M]. 昆明: 云南科技出版社,2004.
[4]李鸿雁, 李俊, 黄帆, 等. 内蒙古78份葱属野生种表型遗传多样性分析 [J]. 植物遗传资源学报, 2017,18(4): 620-628.
[5]徐杨, 周丽, 蔡年辉, 等. 云南松不同海拔群体的针叶性状表型多样性研究 [J]. 云南农业大学学报(自然科学), 2016, 31(1): 109-114.
[6]Xu Y L, Woeste K, Cai N H, et al. Variation in needle and cone traits in natural populations of Pinus yunnanensis [J]. Journal of Forestry Research, 2016, 27(1):41-49.
[7]李巍, 王传宽, 张全智. 林木分化对兴安落叶松异速生长方程和生物量分配的影响 [J]. 生态学报, 2015,35(6): 1679-1687.
[8]刘家霖, 满秀玲, 胡悦. 兴安落叶松天然林不同分化等级林木树干液流对综合环境因子的响应 [J]. 林业科学研究, 2016, 29(5): 726-734.
[9]万艳芳, 于澎涛, 刘贤德, 等. 祁连山青海云杉树干液流密度的优势度差异 [J]. 生态学报, 2017, 37(9):3106-3114.
[10]蔡年辉, 李根前, 束传林, 等. 云南松天然林区植物群落结构的空间动态研究 [J]. 西北植物学报, 2006,26(10): 2119-2124.
[11]梅婷婷, 王传宽, 赵平, 等. 木荷树干液流的密度特征 [J]. 林业科学, 2010, 46(1): 40-47.
[12]葛颂, 王明庥, 陈岳武. 用同工酶研究马尾松群体的遗传结构 [J]. 林业科学, 1988, 24(4): 399-409.
[13]Shannon C E, Weiner W. The Mathematical Theory of Communication[M]. Urbana: U niversity of Illinois Press, 1949.
[14]Pielou E C. The measurement of diversity in different types of biological collections [J]. Journal of Theoretical Biology, 1966, 13: 131-144.
[15]邓丽丽, 朱霞, 和润喜, 等. 云南松不同茎干类型种实性状表型多样性比较 [J]. 种子, 2017, 36(3): 4-9.
[16]邱财生, 邓欣, 龙松华, 等. 亚麻种质资源的表型多样性分析 [J]. 种子, 2015, 34(12): 55-57.
[17]柳江群, 尹明宇, 左丝雨, 等. 长柄扁桃天然种群表型变异 [J]. 植物生态学报, 2017, 41(10): 1091-1102.
[18]Ali M A, Jabran K, Awan S I, et al. Morpho-physiological diversity and its implications for improving drought tolerance in grain sorghum at different growth stages [J]. Australian Journal of Crop Science, 2011,5(3): 311-320.
[19]Wahid N, González-Martínez S C, El Hadrami I, et al.Variation of morphological traits in natural populations of maritime Pine (Pinus pinaster Ait.) in Morocco [J]. Annals of Forest Science, 2006, 63(1):83-92.
[20]李晓曼, 段蒙蒙, 王鹏, 等. 栽培萝卜植株地上部表型多样性分析 [J]. 植物遗传资源学报, 2018, 19(4):668-675.
[21]陈波, 鲁绍伟, 李少宁. 不同优势等级杨树人工林吸收臭氧特征 [J]. 北京林业大学学报, 2015, 37(7): 29-36.
[22]李振华, 王彦辉, 于澎涛, 等. 华北落叶松液流速率的优势度差异及其对林分蒸腾估计的影响 [J]. 林业科学研究, 2015, 28(1): 8-16.
[23]Scarano D, Rubio F, Ruiz J J, et al. Morphological and genetic diversity among and within common bean(Phaseolus vulgaris L.) landraces from the Campania region (Southern Italy) [J]. Scientia Horticulturae,2014, 180: 72-78.
[24]Mandák B, Hadincová V, Mahelka V, et al. European invasion of north american Pinus strobus at large and fine scales: high genetic diversity and fine-scale genetic clustering over time in the adventive range [J]. PLoS One, 2013, 8(7): e68514.
[25]Xu Y L, Cai N H, Woeste K, et al. Genetic diversity and population structure of Pinus yunnanensis by simple sequence repeat markers [J]. Forest Science,2016, 62(1): 38-47.
