SpyGlass DS胆道镜联合射频消融在肝外胆管癌诊治中的应用*
2019-08-29郭享王宏光王曼彤郭庆梅李明洋陶丽莹沈宇佳
郭享,王宏光,王曼彤,郭庆梅,李明洋,陶丽莹,沈宇佳
(吉林省吉林市人民医院 消化内镜中心,吉林 吉林 132001)
肝外胆管癌患者早期无典型症状,进展期时常出现梗阻性黄疸,外科手术切除率较低,总体预后差。目前,内镜下逆行胰胆管造影(endoscopic retrograde cholangiography,ERCP)是诊治肝外胆管癌的重要手段,ERCP细胞学刷检是确诊肝外胆管癌的基本方法,但其不能直视胆道黏膜,导致敏感度较低,有一定的局限性。本科于2017年9月在国内率先引进SpyGlass DS胆道镜,通过十二指肠镜将其送入胆管,直视下观察胆管病变及活检,病理学检查证实胆管癌、不能外科手术的患者,随后接受胆管腔内射频消融(radiofrequency ablation,RFA)治疗。现报道如下:
1 资料与方法
1.1 一般资料
选取2017年10月-2018年6月吉林市人民医院消化中心经CT或磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)疑诊胆管癌的15例患者,对其进行SpyGlass DS胆道镜检查及活检病理学检查。15例患者中,男8例,女7例,年龄44~77岁,平均(66.8±10.0)岁,黄疸指数35.5~ 441.7μmol/L。
RFA治疗纳入标准:①无法行胆管癌根治切除术;②患者年龄、性别不限;③合并严重脏器功能障碍无法耐受外科手术;④自愿接受RFA治疗,并于术前签署知情同意书。
1.2 设备器械
Pentax ED-3270TK4.2电子十二指肠镜、Pentax EG-3270UK2.8超声胃镜、ERCP相关附件(乳头括约肌切开刀、导丝、扩张球囊和鼻胆引流管等)、Boston Scientific SpyGlass DS胆道镜及相关附件(SpyScope DS成像导管和SpyBite活检钳等)、ERBE高频电外科系统VIO200D和HabibTMEndo HPB射频导管等。
1.3 方法
十二指肠镜经口进镜至十二指肠降段,拉直镜身,以乳头括约肌切开刀带导丝经十二指肠乳头行胆管插管,插管成功后留置导丝,对乳头括约肌进行切开和扩张。将SpyGlass DS成像导管的手柄部分绑定于十二指肠镜上,将成像导管经十二指肠镜工作孔道插入胆管,先用灭菌水对病变远端胆管进行灌洗,以获得清晰的镜下视野,再将SpyGlass DS成像导管推送至病变部位,进行直视下观察拍照,测量狭窄段胆管直径,并用SpyBite活检钳对病变部位进行直视下活检,观察无活动性出血后,退镜。病理细胞学检查可见恶性细胞或病理组织学为腺癌,即明确胆管癌诊断。十二指肠镜进镜,方法同前,将射频消融电极定位在肿瘤所在的部位,调节输出功率为10 W,对肿瘤组织进行射频消融治疗,单次消融时间180 s,肿瘤组织凝固坏死,SpyGlass DS直视下再次测量胆管直径后,置入鼻胆引流管,并于十二指肠乳头开口处剪断鼻胆管,作为支架内引流治疗。
1.4 术后处理及观察指标
术后禁食,静脉补液、抑酸、抗感染治疗,观察患者有无发热、腹痛、腹胀、呕血和黑便等症状,术后3和7 d复查黄疸指数,下降超过50.0%,临床判断为黄疸缓解后出院,对患者进行随访。
2 结果
15例患者成功进行SpyGlass DS胆道镜检查,并完成直视下观察胆管病变及活检,病理学检查证实胆管恶性肿瘤。
2.1 肿瘤部位
肝门部胆管癌3例,其中Bismuth Ⅰ型2例,Bismuth Ⅱ型1例,Bismuth Ⅱ型MRCP所示见图1;远端胆管癌12例,其中中段胆管癌3例,低位胆管癌9例。低位胆管癌特征见图2。
2.2 肿瘤的类型和病理学分型
硬化型胆管癌6例(图3A),结节型胆管癌6例(图3B),乳头型胆管癌3例(图3C)。4例患者病理细胞学见恶性细胞,11例病理组织学为胆管腺癌,病理学结果见图4。
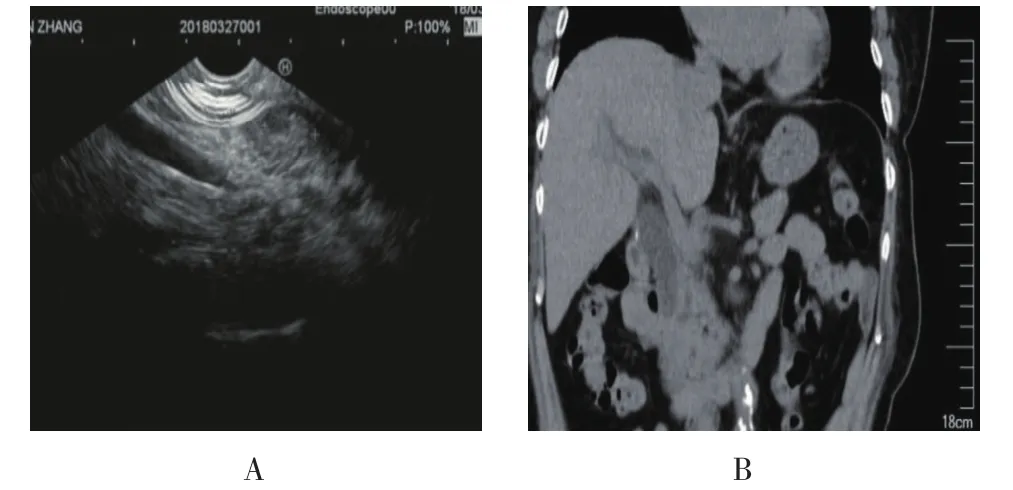
图2 低位胆管癌Fig.2 Lower cholangiocarcinoma

图3 胆管癌Fig.3 Cholangiocarcinoma
2.3 治疗
3例患者接受外科手术治疗,12例患者接受胆管腔内RFA治疗,RFA前胆管直径(1.5±0.5)mm,RFA术后胆管肿瘤组织凝固坏死,呈白色(图5),胆管直径(5.5±1.5)mm,平均操作时间(36.8±4.2)min,术后无出血、穿孔、胆管炎和胰腺炎等并发症。12例患者全部达到黄疸缓解,其中10例术后第3天黄疸缓解,2例术后第7天黄疸缓解。
2.4 随访结果
术后3个月,无再发黄疸;术后6个月,1例再发黄疸,再次行RFA治疗,并置入胆管金属支架。见图6。无死亡病例。
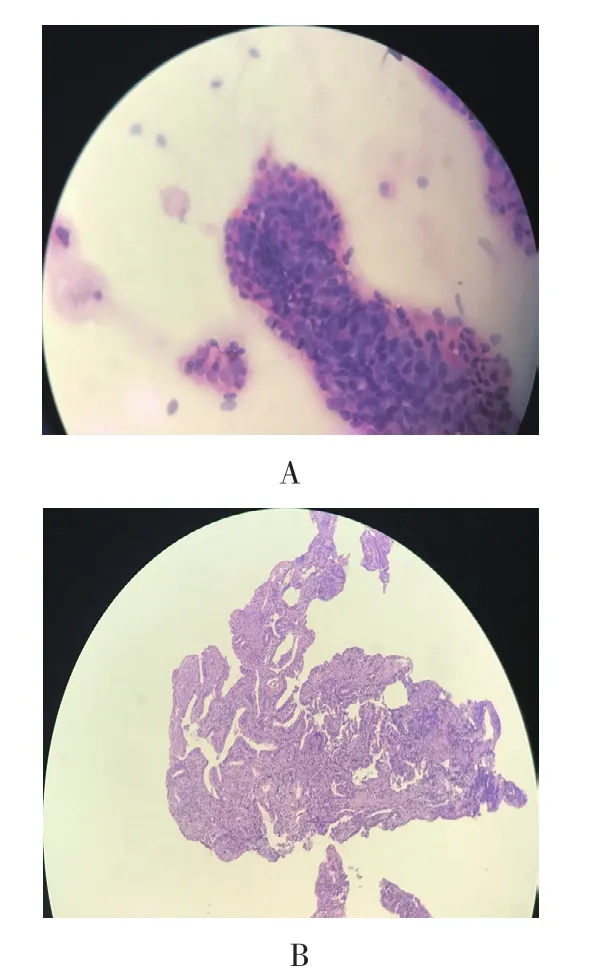
图4 病理学检查所示Fig.4 Imaging of pathological examination
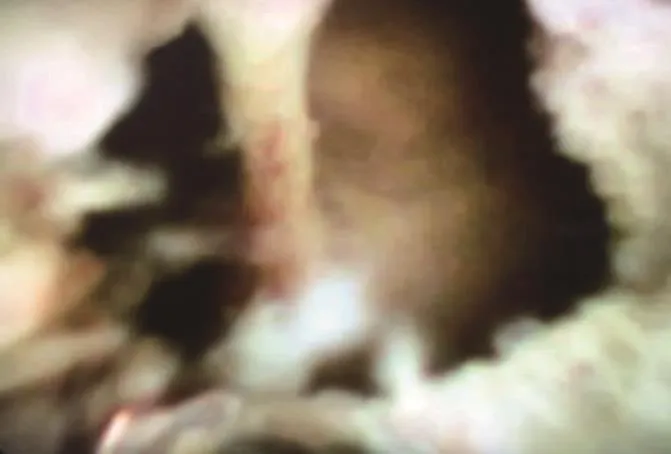
图5 RFA术后Fig.5 Imaging of after radiofrequency ablation
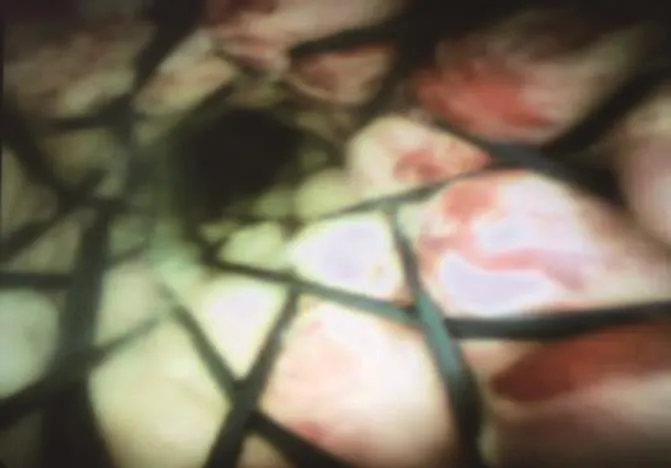
图6 RFA术后置入胆管金属支架Fig.6 Endoscopic metal biliary endoprothesis after radiofrequency ablation
3 讨论
胆管癌是胆管系统被覆上皮发生的恶性肿瘤,肝外胆管癌又以胆囊管与肝总管汇合点为界,分为肝门部胆管癌和远端胆管癌。肝外胆管癌的发病率居肝胆恶性肿瘤的第2位,仅次于肝细胞癌,无痛性黄疸是最常见的表现,但早期无典型症状,一旦出现梗阻性黄疸等症状时,癌症常处于进展期,外科手术切除率较低[1],总体预后差。
以多种内镜为基础的辅助检查方法提高了肝外胆管癌诊断的准确率,ERCP单纯造影诊断并不可靠,细胞学检查是确诊肝外胆管癌的基本方法,其特异度较高,但敏感度较低[2]。胆管内超声(intraductal ultrasonography,IDUS)被用于诊断胆管癌,主要表现为胆管壁的不规则低回声浸润,但无法取得肿瘤组织。超声内镜引导下细针穿刺(endoscopic ultrasonography guiled fine needle aspiration,EUS-FNA)可获取肿瘤组织,敏感度和准确率更高[3],但操作难度大,有一定的并发症。
2007年,CHEN等[4]首次报道了第一代SpyGlass胆道镜在胆管疾病诊断及治疗中的临床可行性,对20例患者的病变组织进行活检,其中19例(95.0%)标本量足够,证实在临床实际应用中,SpyGlass直视下活检是可行的,并且能够为病理诊断提供足够的标本量。
SpyGlass DS是第二代SpyGlass胆道镜系统,成像技术已经从纤维光学成像发展为电子光学成像,不仅镜下直视图像更加清晰,而且活检的敏感性和特异性也明显提高[5-7]。在ERCP基础上,经过十二指肠镜的工作孔道,在导丝引导下进入胆管,不仅能直视观察胆管病变,还可通过SpyBite活检钳对病变进行精准取样,进行病理学检查。一项包含456例患者的系统性回顾性研究[5]显示,SpyGlass胆道镜帮助诊断恶性胆管梗阻,尤其是胆管癌的价值显著,其引导的活组织检查的敏感度和特异度达到66.2%和97.0%。美国一项多中心回顾性研究[7]纳入了105例行SpyGlass DS诊治的病例,其中44例不明原因胆管狭窄患者进行SpyGlass DS直视下活检,活检成功率97.7%,诊断恶性肿瘤的敏感度和特异度分别为85.0%和100.0%。本研究对临床疑诊胆管癌的15例患者成功地进行了SpyGlass DS胆道镜检查,不同类型的胆管癌内镜下形态各异,硬化型和结节型各有6例,占大多数,乳头型有3例,少见,均在镜下取足够量组织标本行现场病理学检查,活检成功率100.0%,病理均证实为胆管恶性肿瘤,敏感度和特异度均为100.0%。
对于胆管癌的治疗,可以经ERCP途径插入射频探头,在胆管癌局部产生高温,当温度超过60℃时,肿瘤细胞发生凝固坏死,从而延缓肿瘤进展。2011年,STEEL等[8]首次报道了RFA在人类胆道肿瘤中的应用,对22例晚期胆管癌患者实施了内镜介导的胆管腔内RFA治疗,安全有效,近期疗效确切。国内有研究[9]表明,对于无法手术治疗的胆道恶性梗阻,ERCP下可成功、安全地进行腔内RFA治疗,本科曾于2015年开展第一代SpyGlass胆道镜下RFA治疗胆道恶性梗阻,32例患者接受胆管腔内RFA联合胆管支架引流,平均操作时间48 min,术后6和12个月胆管支架通畅率更高[10]。本研究对12例胆管癌患者均成功实施了胆管腔内RFA治疗,较以往的报道[10]操作时间明显减少,且无胆道出血、胆漏和胆管炎发生,提示RFA安全可行;SpyGlass DS胆道镜直视下,观察狭窄段胆管的直径较前明显增加,提示RFA能明显改善胆管狭窄;黄疸全部达到缓解,其中2例术后第7天黄疸缓解的患者均为肝门部胆管癌,提示临床高位胆道梗阻需要更长的引流时间;RFA术后3个月无再发黄疸,术后6个月仅1例再发黄疸,提示RFA能够有效延长胆管支架通畅时间。
综上所述,SpyGlass DS胆道镜能实现胆管直视化,能成功完成镜下活检病理学检查,大大提高了肝外胆管癌诊断的准确率,并进一步证实胆管腔内RFA治疗安全可行,其临床疗效肯定,有望在临床上更广泛地应用。
