支气管镜下肺泡灌洗液半乳甘露聚糖试验联合(1,3)-β-D葡聚糖检测对肺曲霉菌病的诊断价值*
2019-08-29潘玲卢岳虹宋策谭玉萍冯原杨红梅陆彩云杨益宝梁炜冯玉清苏齐鉴罗珍贞
潘玲,卢岳虹,宋策,谭玉萍,冯原,杨红梅,陆彩云,杨益宝,梁炜,冯玉清,苏齐鉴,罗珍贞
(广西中医药大学附属瑞康医院 呼吸内科,广西 南宁 530001)
肺曲霉菌病主要由烟曲霉引起,曲霉菌可以直接侵入支气管和肺组织引起深部真菌感染,最重要的危险因素是长期粒细胞缺乏。近年来,由于广谱抗生素、激素等药物的广泛应用,以及重症监护病房疾病的严重性和复杂性增加,导致肺曲霉菌病发生率升高[1-2]。肺曲霉菌病发病隐匿,症状及影像学表现无特异性,进展快,病死率高。传统诊断的痰培养存在培养时间长、阳性率低等弊端,而诊断金标准是组织病理学检查,多通过经皮肺穿刺、经支气管镜肺活检和开胸肺活检等有创操作获取标本,虽然可获得肺部真菌感染的组织学证据,但具有侵袭性和风险性[3]。肺曲霉菌病极易漏诊或误诊,从而导致患者错失最佳治疗时机。因此,寻找新的有效诊断措施,对肺曲霉菌病的治疗及提高生存率极为重要。本研究在支气管镜下使用支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)血清半乳甘露聚糖(galactomannan,GM)检测(GM试验)与(1,3)-β-D葡聚糖检测(G试验),分析两种试验的效果,为肺曲霉菌病患者的诊断提供依据。
1 资料与方法
1.1 一般资料
纳入2013年5月-2016年12月在广西中医药大学附属瑞康医院住院确诊为肺曲霉菌病的患者30例为研究组。其中,男19例,女11例;年龄26~83岁,平均(55.67±17.04)岁。另选取同期于我院住院肺部非真菌感染的患者30例为对照组。其中,男17例,女13例;年龄20~82岁,平均(59.03±19.63)岁。两组患者性别和年龄比较,差异无统计学意义(P>0.05)。患者或患者家属均签订相关知情同意书后进行相关治疗和研究。
1.2 诊断标准
参照欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(EORTC/MSG)[4]和2007年我国的肺真菌病诊断和治疗专家共识[5]。确诊标准:经组织病理学检查诊断为肺曲霉菌病。
1.3 样本采集与处理
所有研究对象均在支气管镜下采集BALF,并同时采集血清标本进行GM试验和G试验。采集BALF方法如下:患者无纤支镜禁忌证,与患者或患家属签署知情同意书,采集前4 h禁水、禁食,2%利多卡因喷雾局麻咽部和鼻腔,待麻醉生效后,经鼻腔置入纤支镜,先观察正常或病变较轻一侧,再对病灶部位进行刷片、活检及灌洗。灌洗液为灭菌生理盐水,每次10 ml,连续灌洗3或4次后,采用负压收集灌洗液至灭菌痰液收集器,行病原菌培养和相关检查。本院检验科采用由北京金山川科技发展有限公司生产的试剂盒测定支气管BALF及血清中的(1,3)-β-D-葡聚糖含量。BALF及血清GM试验外送至武汉康圣达医学检验所检验。操作过程严格遵守无菌操作。
1.4 GM试验及G试验结果判定
结果分析按照厂家推荐标准,BALF及血清的GM试验以待测标本的指数≥0.5为诊断界值;BALF及血清的G试验以检测值大于20 pg/ml为阳性作为判定标准。计算单项试验和联合试验的灵敏度、特异度、阳性预测值、阴性预测值和准确度等指标。
1.5 统计学方法
采用SPSS 20.0软件对数据进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料以率表示,比较采用χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 BALF以及血清G试验和GM试验结果
研究组中,BALF GM试验阳性21例,G试验阳性25例;血清GM试验阳性19例,G试验阳性23例;BALF GM联合G试验阳性27例;血清GM联合G试验阳性26例。见表1。研究组的GM试验和G试验检测值高于对照组,差异有统计学意义(P<0.05)。见表2。
2.2 敏感度和特异度分析
BALF GM试验联合G试验检测灵敏度、特异性、阳性预测值、阴性预测值和准确度分别为90.0%、93.3%、93.1%、93.3%和91.0%。BALF GM试验联合G试验检测诊断肺曲霉菌病的敏感度、特异度、阳性预测值、阴性预测值及准确度均高于其他各项。见表3。

表1 BALF以及血清GM和G试验单项检测和联合检测阳性率比较 例(%)Table1 Comparison of positive rates of BALF,serum GM and G test by single test and combined test n(%)
表2 BALF以及血清GM试验和G试验检测值比较 (±s)Table2 Comparison of test values of BALF and serum GM test and G test (±s)

表2 BALF以及血清GM试验和G试验检测值比较 (±s)Table2 Comparison of test values of BALF and serum GM test and G test (±s)
组别 BALF GM试验/(ng/ml) BALF G试验/(pg/ml) 血清GM试验/(ng/ml) 血清G试验/(pg/ml)研究组(n =30) 1.82±1.78 37.40±18.68 0.87±0.68 26.17±12.67对照组(n =30) 0.24±0.20 14.90±13.18 0.34±0.28 12.97±7.64 t值 4.24 5.43 4.40 4.21 P值 0.000 0.000 0.000 0.000
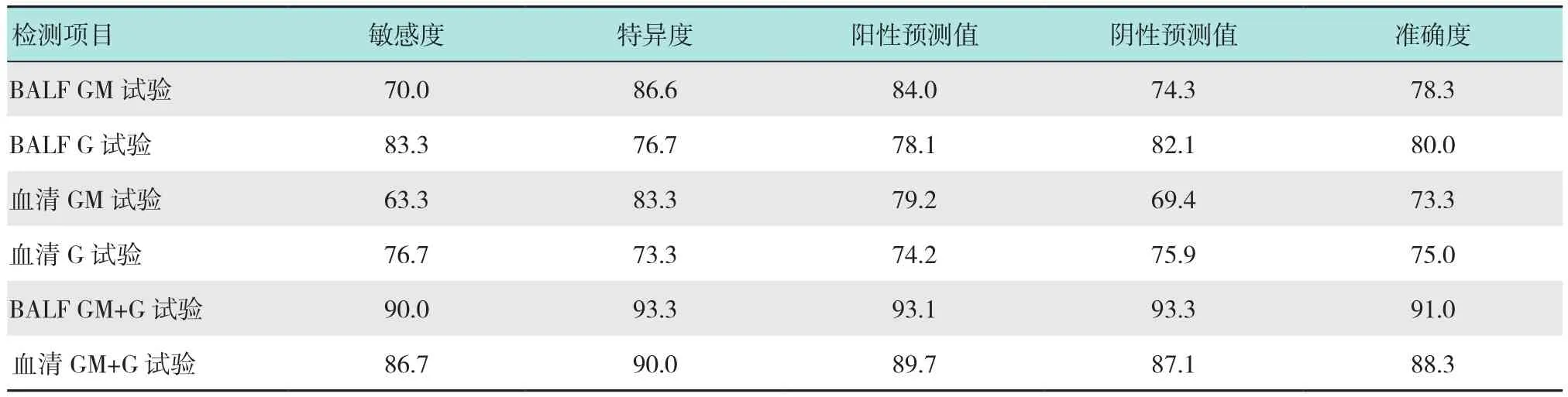
表3 BALF以及血清GM试验和G试验单项及联合检测结果 %Table3 Single and combined results of BALF and serum GM test and G test %
3 讨论
已有研究[6]表明,肺曲霉菌病有较高的病死率,尤其在粒细胞缺乏的患者中,有高达80%~100%的死亡是由于感染曲霉、镰刀霉和毛孢子菌所致。近年来,发现非粒细胞缺乏患者同样易发生曲霉菌感染,且病死率较高。肺曲霉菌病无特殊临床表现,且痰培养、肺影像学检查以及病理检查等方法耗时较长、特异性较低以及存在有创性[7],导致肺曲霉病的诊断在临床上仍然较困难,尤其是对于那些没有中性粒细胞减少的患者。因此,有效的诊断是治疗肺曲霉菌病、提高生存率的关键。
GM是曲霉菌细胞壁的多糖组分,在真菌菌丝侵袭组织的过程中,真菌细胞壁的多糖组分GM被释放出来,其在体液中较易被检测到,并在临床或放射学征象出现之前就能检测[8]。因此,BALF和血清中GM抗原的检测是诊断肺曲霉病的可靠手段。欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(EORTC/MSG)[4]已批准采用GM酶免疫检测阳性作为侵袭性曲霉病诊断的重要标准。然而,GM释放到血液中的水平相对较低,通常在肺曲霉病早期或真菌病变较轻时无法被检测到。BALF直接从肺曲霉病靶器官灌洗而来,BALF中检测GM的概率较高[9]。BALF标本GM检测敏感度较高,具有较好的诊断价值[10]。在受到哌拉西林/他唑巴坦或阿莫西林/克拉维甲酸等半合成青霉素影响时,或者肠道黏膜屏障受损时,GM可通过受损部位进入血液,造成血清GM试验结果的假阳性。免疫功能正常的肺曲霉病患者,白细胞会吞噬GM抗原,可造成GM试验假阴性。目前,国内已有较多的研究[11-12]报道了GM试验假阳性及假阴性病例。(1,3)-β-D-葡聚糖是一种存在于真菌细胞壁中的物质,当真菌侵入机体时,真菌细胞壁中的(1,3)-β-D-葡聚糖大量释放,使血液或其他体液中(1,3)-β-D-葡聚糖含量升高[13]。G试验可用于广谱真菌感染诊断,但无法区分曲霉与酵母菌感染,结果易受到白蛋白、磺胺类或一些细菌感染的影响,可能造成假阳性[14]。肺部真菌感染早期,(1,3)-β-D-葡聚糖未进入血液中,导致早期血清G试验无法检测到,而BALF G试验易受口咽部真菌定植影响,诊断的准确性有偏差,同样存在假阴性的可能[15]。因此,BALF GM试验联合G试验可以弥补单项检测的不足,对于诊断肺曲霉菌病有一定的优势。
本研究中,研究组在支气管镜下采集BALF行GM联合G试验检测,阳性率均高于单项的GM试验、G试验以及血清GM联合G试验;BALF GM联合G试验检测灵敏度、特异度、阳性预测值、阴性预测值和准确度分别为90.0%、93.3%、93.1%、93.3%和91.0%。说明BALF GM联合G试验能有效提高诊断肺曲霉菌病的敏感度、特异度、阳性预测值、阴性预测值及准确度,降低了假阳性率和假阴性率,可以尽量避免漏诊情况的发生,弥补了单项检测的缺点。本研究中,BALF以及血清GM试验的敏感性均低于G试验,特异度均高于G试验。若两者联合检测,均为阴性,可排除侵袭性真菌感染;均为阳性,诊断侵袭性真菌感染的可能性很大。本研究结果表明,支气管镜下采集BALF行GM联合G试验,对于诊断肺曲霉菌病优于单独的GM试验、G试验以及血清GM联合G试验。联合检测可以弥补单项检测的不足,有准确率高、灵敏度高和特异度高等优点,有助于肺曲霉菌病的早期诊断。
综上所述,支气管镜下BALF GM联合G试验检测,对肺曲霉菌病的早期诊断临床价值较高,可作为诊断肺曲霉菌病的重要辅助诊断指标。
