鲤鱼鱼鳞蛋白酶解液对鲤鱼肉冷藏期间品质变化的影响
2019-08-28杜慧颖李美娜李婷婷
杜慧颖,赵 爽,李美娜,马 堃,李婷婷
(大连民族大学生命科学学院,辽宁大连 116600)
鲤鱼(Cyprinuscarpio)又名鲤拐子、鲤子、毛子,红鱼等,为鲤科鲤属食草性淡水鱼类。其多栖息于江河、湖泊、水库、池沼中水草丛生的水体底层,是我国淡水渔业中的重要养殖品种[1]。鲤鱼营养价值丰富,鱼肉中含有大量氨基酸平衡的优质蛋白,其脂肪多为人体必需的多不饱和脂肪酸,还含有钾、钙等微量元素,肉质鲜美,因而深受消费者喜爱[2-4]。但由于其组织柔嫩、体内组织酶类活性强,极易发生腐败变质,因此开展鲤鱼保鲜研究意义重大。
鱼鳞中的蛋白质含量高达70%,主要包括胶原蛋白和鱼鳞硬蛋白。鱼鳞胶原蛋白中含有丰富的甘氨酸和脯氨酸,水解产物中含有大量的生理活性肽,在保健和美容方面应用前景广阔。鱼鳞硬蛋白中含有大量的疏水性氨基酸,其经酶解后,含疏水氨基酸的肽释放,并参与到酶解产物的抗氧化过程中,使其具有较强的抗氧化作用[5-6]。这些肽分子量小、水溶性好、易吸收,其生理特性在食品和医疗等方面具有极大的应用价值,同时也能实现资源再利用,并减少环境污染。
天然抗氧化剂是指能改善食品品质和色、香、味以及为防腐和加工工艺的需求而加入的从天然食材中提取得到的物质,相比其他抗氧化剂,其本身及分解产物均无毒无害、稳定性好、使用方便且价格便宜[7]。蒋妍等[8]研究的草鱼鱼鳞酶解液对鲢鱼鱼丸贮藏及品质特性的影响实验,李凯风等[9]将草鱼鱼鳞酶解液作为基料的涂膜剂实验,均证实鱼鳞酶解液在食品保鲜方面有巨大的开发及应用潜能。本文以新鲜鲤鱼肉为实验对象,将其分别浸渍在不同浓度的鲤鱼鱼鳞蛋白酶解液中,通过相关指标测定,综合评价蛋白酶解液对鲤鱼肉冷藏期间品质变化的影响,为鲤鱼鱼鳞蛋白酶解液在水产品保鲜及相关领域中的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
新鲜鲤鱼 购于大连开发区沃尔玛超市,活体运至实验室,每条鱼的体长为(35±5) cm质量为(1200±50) g;碱性蛋白酶(1∶200000) 北京索莱宝科技有限公司;1,1-二苯基-2-苦肼基自由基 梯希爱化成工业发展有限公司;浓盐酸、氢氧化钠、三氯甲烷、95%乙醇及乙醇 大连凯美化工有限公司;乙二胺四乙酸二钠 北京化工厂。
SHZ-D(Ⅲ)高速分散均质机 上海昂尼仪器仪表有限公司;UV-2100型紫外可见分光光度计 尤尼柯上海仪器有限公司;冷冻干燥机 宁波新芝生物科技股份有限公司; BR4i台式高速冷冻离心机 法国Jouan;T-25匀浆机 德国IKA;Lambda 25紫外可见分光光度计 美国Perkin Elmer。
1.2 实验方法
1.2.1 鲤鱼鱼鳞蛋白酶解液制备 参考冯建慧等[10]法并稍作修改。整个提取操作均在4 ℃下进行,将剪碎的鲤鱼鱼鳞以1∶30 (g/mL)比例浸入1.0 mol/L HCl溶液中搅拌2 h,期间更换新鲜的HCl溶液1次,结束后用超纯水清洗至中性,烘干;然后将清洗后的鱼鳞以1∶15 (g/mL)比例浸入0.2 mol/L NaOH溶液中搅拌24 h,除去鱼鳞中的杂蛋白,期间不断更换新鲜的NaOH溶液,结束后用超纯水清洗至中性;按底物浓度15.2%的比例加入超纯水,100 ℃水浴加热2 min,调节体系pH为10.0,在水浴锅预热30 min后按比例加入4980 U/g碱性蛋白酶,51.2 ℃下水浴酶解5.1 h后,100 ℃水浴加热灭酶10 min,用3层纱布过滤,滤液10000×g离心15 min取上清液,冷冻干燥成粉,用超纯水配置成不同浓度的鲤鱼鱼鳞蛋白酶解液。
1.2.2 鲤鱼样品处理 将鲤鱼去头,去尾,去皮,取背部鱼肉切成长2 cm、宽1.5 cm、厚15 mm的鱼肉块,以无菌水浸渍处理的鲤鱼鱼肉为空白组,以不同浓度鲤鱼鱼鳞蛋白酶解液(0.01、0.03、0.04 g/mL)浸渍处理的鲤鱼鱼肉为处理组,采用普通蒸煮袋包装于4 ℃贮藏。
1.2.3 DPPH自由基清除率的测定 用95%乙醇配制浓度为0.1 mmol/L的DPPH溶液,避光保存。取2.5 mL DPPH溶液与等体积的不同浓度鲤鱼鱼鳞蛋白酶解液混匀(0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10 g/mL),暗室常温静置30 min,在517 nm下以2.5 mL的超纯水和等体积的95%乙醇混合液为对照,测吸光度,由公式1计算DPPH自由基清除率。
式(1)
式中:AC为2.5 mL DPPH溶液+2.5 mL超纯水吸光度;Ai为2.5 mL DPPH溶液+2.5 mL样品液吸光度;Aj为2.5 mL样品液+2.5 mL 95%乙醇吸光度。
1.2.4 细菌总数测定 菌落总数的测定根据GB 4789.2-2016[11]中检测方法进行菌落总数的测定。使用平板计数法,采用平板倾注法计数测定。
1.2.5 可溶性蛋白含量的测定 参考李学英等[12]的方法并稍作修改。在0.5 g对照组及处理组鲤鱼肉中添加10 mL 50 mmol/L的Tris-HCl缓冲液(含0.6 M KCl,pH7.4)高速匀浆1 min,匀浆液5 ℃下10000×g离心8 min,取上清液用0.6 mol/L KCl溶液稀释10倍,使用双缩脲法测定其蛋白质浓度。
1.2.6 蒸煮损失率的测定 参考蒋妍等[8]的方法并稍作修改。将5 g鱼肉(M1)用真空封口机封口后放入100 ℃沸水中10 min,取出后放入底部垫有纱布的离心管中,在4000×g,4 ℃下离心10 min后记重(M2),由公式2计算其蒸煮损失率。
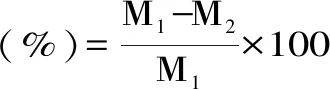
式(2)
1.2.7 汁液流失率测定 参考李学英等[12]的方法并稍作修改。准确称取5 g鱼肉置于底部垫有纱布的离心管中,4000×g,4 ℃离心10 min后记重,汁液流失率由公式3计算:
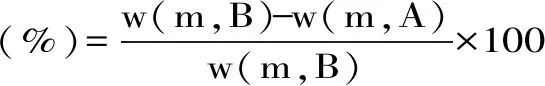
式(3)
式中:w(m,B)为离心前肉块质量(g);w(m,A)为离心后肉块质量(g)。
1.2.8 TBA测定 参考Siu等[13]的方法并稍作修改。称取10 g碎鱼肉与25 mL超纯水混匀匀浆后,加入25 mL 5% TCA溶液,静置30 min后过滤,所得滤液用5% TCA定容至50 mL。取5 mL 0.02 mol/L TBA溶液加入含5.00 mL上述所得滤液的具塞试管中,并于80 ℃恒温水浴40 min,冷却至室温后,测定其在532 nm处的吸光值A。TBA值用丙二醇(MDA)的质量分数表示,单位为mg/kg样品。
1.2.9 酸价测定 参考李婷婷等[14]的方法并稍作修改。准确称取5.00 g样品与15 mL三氯甲烷-甲醇(体积比2∶1)混合,涡旋振荡2 min后超声提取15 min,以4500 r/min 离心6 min,取上清液使用。
称取3.0~5.0 g所提油样,与50 mL体积比2∶1的中性乙醚-乙醇溶液混匀,以酚酞为指示液,用氢氧化钾标准滴定液(0.050 mol/L)滴定至初现微红色,且0.5 min内不褪色,记录数据,由公4计算其酸价值。
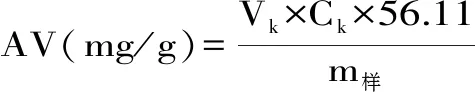
式(4)
式中:Vk为消耗氢氧化钾标准滴定液体积(mL);Ck为氢氧化钾标准滴定的实际浓度(mol/L);m样为样品质量(g)。
1.2.10 肌原纤维蛋白游离巯基与总巯基含量的测定 参考Youngsawatdigul[15]的方法并加以修改。将鱼肉样品经组织粉碎后加入5倍体积的10 mmol/L Tris-HCl(pH7.2)缓冲液中,高速均质3次,每次30 s,在5000×g,4 ℃条件下离心10 min,取沉淀按上述过程反复3次,在最后一次沉淀中加入5倍体积的10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH7.2),高速均质,在4500×g,4 ℃条件下离心10 min,取上清液为肌原纤维蛋白液,采用双缩脲法测定蛋白质浓度。
取5 mg/mL蛋白溶液1 mL于试管中并添加9 mL磷酸盐缓冲液(含0.6 mol/L KCl,10 mmol/L EDTA,8 mol/L尿素,浓度为50 mmol/L,pH=7.0)。取5 mL上述混合液加入0.5 mL 0.1% 2-硝基苯甲酸,25 ℃保温25 min,波长为412 nm测吸光度即为总巯基的吸光度。游离巯基含量是在不含尿素的条件下4 ℃反应l h,由公式5算蛋白质总巯基含量。
蛋白质总巯基含量(nmol/mg)=(A×V磷酸盐×109)/(ε×b×V蛋白质×C蛋白质)
式(5)
式中:A为吸光值;V磷酸盐为磷酸盐缓冲液(L)为0.005 L;ε为13600 L/(mol·cm);b为光程为1 cm;V蛋白质为取样蛋白质(mL);C蛋白质为取样蛋白质的浓度(mg/mL)。
1.3 数据处理
采用Orgin 2018绘图并用SPSS 19.0对数据进行分析,p<0.01为差异极显著,p<0.05为差异显著。
2 结果与分析
2.1 DPPH自由基清除率测定结果
鱼肉中含有大量的蛋白质和脂类物质,极易在加工和贮藏过程中发生蛋白质氧化和脂质氧化[16]。DPPH自由基是体外抗氧化实验中最常用的对象。DPPH法操作简单,结果稳定,重现性好,因此,可以采用自由基被清除的程度来评价一种物质的抗氧化能力,当自由基清除率越大,对应的该物质抗氧化能力越强[17]。图1为不同浓度的鲤鱼鱼鳞蛋白酶解液的DPPH自由基清除率,当鲤鱼鱼鳞蛋白酶解液浓度小于0.03 g/mL时,DPPH自由基清除率能力随浓度的增加大幅度增加,原因可能是随着浓度的的增加,有抗氧化能力的多肽含量也相对增加,进而拥有较高DPPH自由基清除能力。但当鲤鱼鱼鳞蛋白酶解液浓度大于0.03 g/mL时,DPPH自由基清除率呈先减小后小幅度增加趋势,可能是蛋白酶解液中的多肽与DPPH自由基结合达到饱和,有抗氧化能力的多肽比例下降,DPPH自由基清除能力下降。为证明鲤鱼鱼鳞蛋白酶解液抗氧化能力与浓度有关且与无菌水浸渍处理的对照组鲤鱼鱼肉相比有显著效果,因此,选取DPPH自由基清除能力很强的0.03和0.04 g/mL以及DPPH自由基清除能力最弱的0.01 g/mL鲤鱼鱼鳞蛋白酶解液作为实验组。
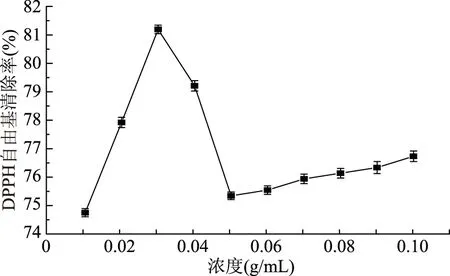
图1 不同浓度鲤鱼鱼鳞蛋白酶解液的DPPH自由基清除率
2.2 菌落总数测定结果
由图2可知,不同处理组鲤鱼鱼肉的的细菌总数随保藏时间的延长而增加。各组初期增加缓慢,空白组在第4 d迅速增加,而处理组在第6 d后才显著上升。这是由于内源性酶的降解使鱼肉体内的细菌处于抑制或生长缓慢的状况,而在保藏后期,鱼肉体内细菌进入对数生长期,代谢作用快速,细菌总数持续上升。参考蒋妍等[8]测定标准,一级鲜度≤4.01lg CFU/g,二级鲜度为4.01~6.01lg CFU/g,变质肉≥6.01lg CFU/g。如图2所示空白组的鱼肉在第6 d开始发生变质,而处理组在第6 d后细菌总数的增长趋势相对平缓,直到保藏结束仍处于二级鲜度。其中浓度为0.03 g/mL的处理组的细菌总数变化最缓慢,在8~10 d菌落总数才才明显增加。鲤鱼鱼鳞蛋白酶解液中具有抗氧化功能的多肽,这类抗氧化多肽具有一定的抑菌性,而且抗氧化能力越高其抑菌效果越好,因此0.03 g/mL鲤鱼鱼鳞蛋白酶解液具有较好的抑制鲤鱼鱼肉细菌增长的效果,0.04和0.01 g/mL次之。
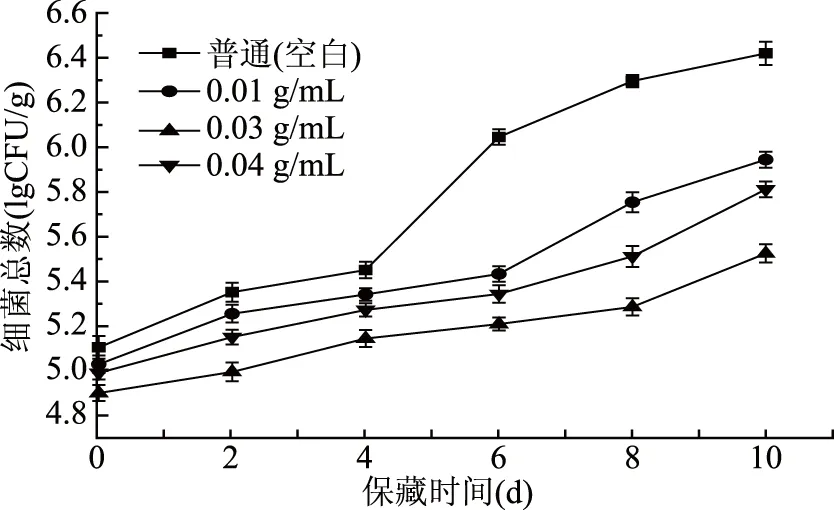
图2 保藏过程中不同处理组鲤鱼鱼肉细菌总数变化
2.3 可溶性蛋白含量测定结果
如图3所示,4 ℃冷藏期间,处理组和空白组的蛋白质溶解度持续下降,空白组的蛋白质溶解度低于处理组的蛋白质溶解度且下降趋势较快,这可能是由于丰富的氧离子促进了蛋白质氧化,而蛋白质氧化聚集导致鲤鱼肌肉蛋白结构变化从而导致其品质的变化[18]。其中浓度为0.03 g/mL具有最强抗氧化性鲤鱼鱼鳞蛋白酶解液的蛋白溶解度下降最慢。因此,鲤鱼鱼鳞蛋白酶解液可抑制鱼肉蛋白氧化,减缓鱼肉的变质。
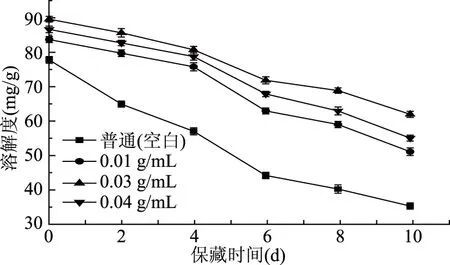
图3 保藏过程中不同处理组鲤鱼鱼肉的溶解度变化
2.4 蒸煮损失率测定结果
水分蒸煮损失率反映了蒸煮过程中肉制品中的水分流失[19]。由图4可知,不同处理组鲤鱼鱼肉的蒸煮损失率随着保藏时间延长逐渐增加,可能由于冷藏期间鱼肉蛋白降解系水能力减弱或者微生物分解鱼体肌肉,从而增加水分流失[9]。其中浓度为0.03 g/mL具有最强抗氧化性鲤鱼鱼鳞蛋白酶解液的蒸煮损失率最低,0.04 g/mL次之,空白组最高,说明鲤鱼鱼鳞蛋白酶解液具有一定的保留鱼肉水分的能力。
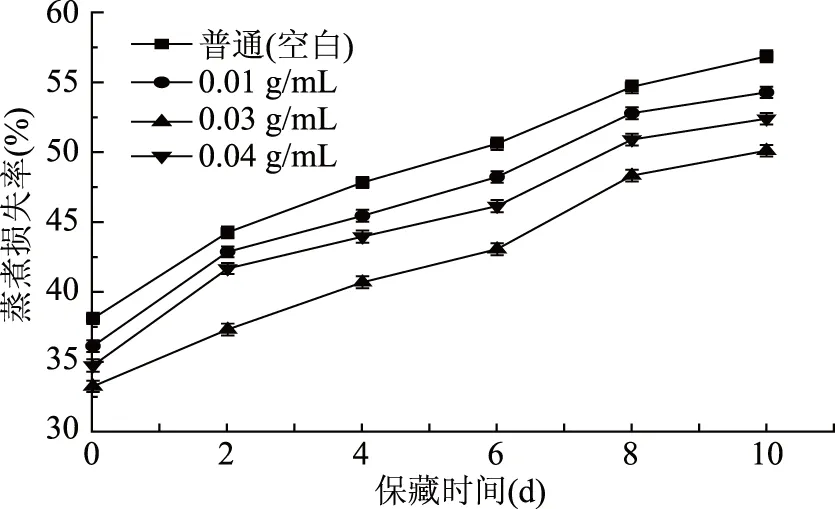
图4 保藏过程中不同处理组鲤鱼鱼肉的蒸煮损失率变化
2.5 汁液流失率测定结果
从图5可知,不同处理组鲤鱼鱼肉的汁液流失率随着保藏时间延长逐渐增加,空白组的鲤鱼鱼肉汁液流失率高于处理组,这可能是由于蛋白质氧化和变性,削弱了肌肉组织保留水的能力,从而导致汁液流失率较高[12]。此外,在冷藏期间的0~6 d空白组的汁液流失率的变化显著高于处理组的鲤鱼鱼肉变化(p<0.05),其中浓度为0.03 g/mL处理组汁液损失率增长最缓慢。结果表明,鲤鱼鱼鳞胶原蛋白酶解液可延缓组织中的蛋白质变性,增强鱼肉的保水能力,延长鱼肉的保鲜期。
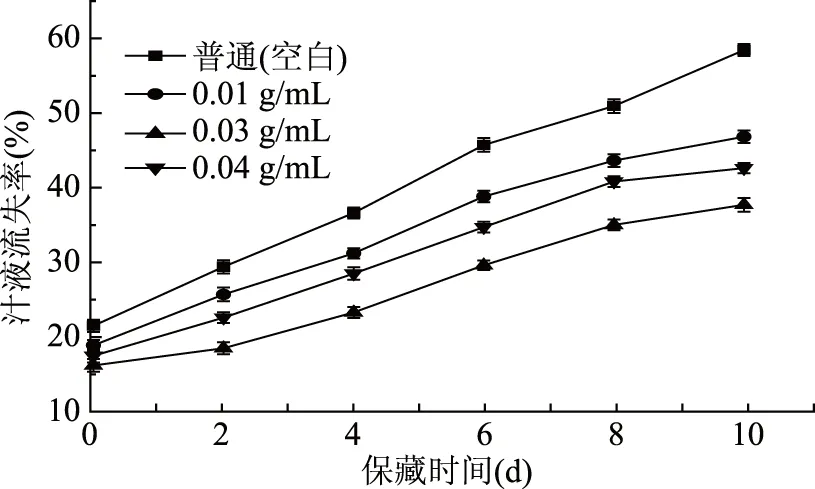
图5 保藏过程中不同处理组鲤鱼鱼肉的汁液流失率变化
2.6 TBA测定结果
TBA值用于测定食品中脂质的氧化酸败程度,特别是肉类和水产品中脂肪的氧化酸败程度。当TBA值达到2.00 mg/kg时,鱼肉会产生令人厌恶的味道[20]。是由于贮藏时间的延长,脂肪酸(特别是不饱和脂肪酸)的自动氧化增加了鲤鱼鱼肉脂肪氧化酸败的程度,产生无色无味的脂质氢过氧化物,进一步降解形成醛、酮、醇和其他具有特殊气味的小分子[21-22]。从图6可知,不同处理组鲤鱼鱼肉的TBA值随保藏时间的增加而增大,可能是随着贮藏期延长引起氧化加剧,导致乳化体系中脂肪球周围的蛋白膜降解[23-24]。新鲜鲤鱼初始TBA值为0.26 mg/kg,略低于李凯风等[9]鲫鱼的0.28 mg/kg和李婷婷等[14]大黄鱼的0.30 mg/kg。在第6 d时对照组的TBA值接近2.00 mg/kg,鱼肉发生腐败变质,浓度为0.01和0.04 g/mL的处理组在第10 d发生变质,而浓度为0.03 g/mL处理组的效果最佳,TBA值上升幅度最小,并且在第10 d时仍未发生腐败变质。说明鲤鱼鱼鳞的蛋白酶解液能减缓脂肪氧化,抑制中间产物的降解,保持鱼肉的新鲜度,使鱼肉的保藏期延长4 d。
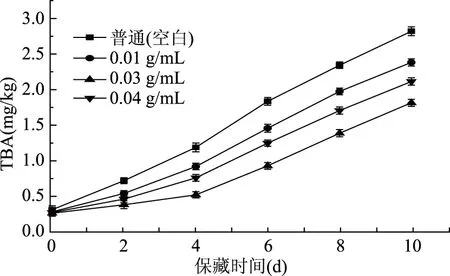
图6 保藏过程中不同处理组鲤鱼鱼肉的TBA变化
2.7 酸价测定结果
酸价是测定肉类和脂肪中游离脂肪酸含量的指标。在动物油脂中,酸价越小代表着脂肪的新鲜度和质量越好。如图7所示冷藏期间空白组和处理组的鲤鱼鱼肉酸价呈增加趋势,空白组在6~10 d内酸价增长迅速,而处理组的酸价增长平缓直到第10 d酸价仍低于空白组。浓度为0.03 g/mL的处理组酸价增加最慢,抑制效果最好。所以鲤鱼鱼鳞的蛋白酶解液有效抑制鲤鱼肉质中的脂肪氧化,减缓脂肪酸败,延长货架期,保持肉质的新鲜品质。
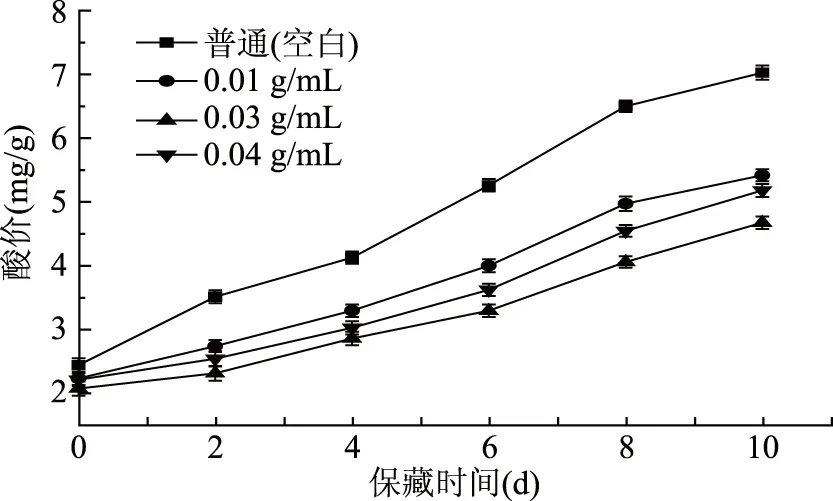
图7 保藏过程中不同处理组鲤鱼鱼肉的酸价变化
2.8 肌原纤维蛋白总巯基和游离巯基含量测定结果
巯基氧化会使蛋白质形成二硫键,进一步发展形成交联网状结构,影响肉的质构[25]。如图8所示,在冷藏期间对照组的总巯基含量下降31%,这与Eymard等[26]发现金属盒包装的竹夹鱼碎肉在贮藏期间总巯基含量显著下降的结果一致,而浓度为0.03 g/mL的处理组总巯基含量仅下降20%,虽然不同处理组的鲤鱼鱼肉肌原纤维蛋白总巯基含量呈下降趋势,但随着保藏时间延长,处理组的肌原纤维蛋白显示了更好的稳定性,其总巯基含量下降趋势平缓于空白组。
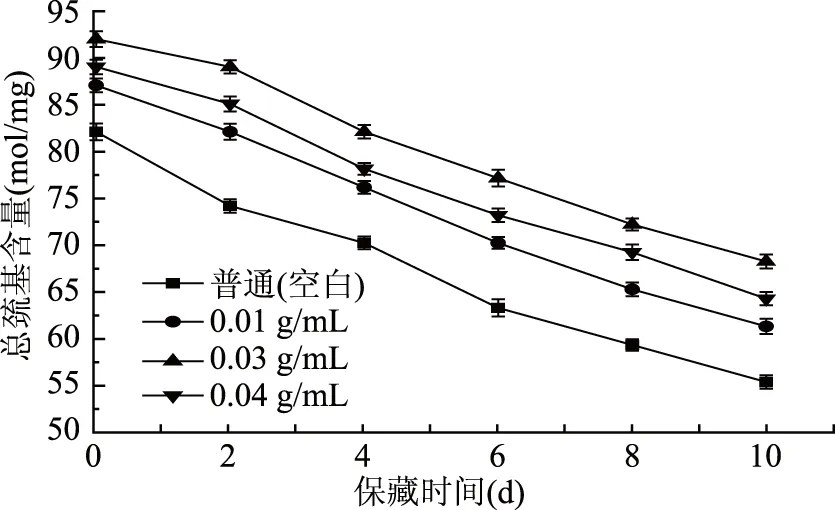
图8 保藏过程中不同处理组鲤鱼鱼肉的总巯基含量变化
如图9所示,对照组和处理组的游离巯基含量呈先增加后下降趋势。冷藏初期空白组游离巯基上升速度最快,在第6 d达到最高值。冷藏后期,空白组游离巯基含量下降速度迅速,游离巯基含量也由降到最低。这是蛋白质变性导致蛋白质结构变化使得巯基外露,巯基含量增加,而蛋白质氧化导致的活性巯基降低也对巯基有一定的消耗[26-27],说明具有一定的抗氧化性鲤鱼鱼鳞蛋白酶解液能够减缓蛋白质氧化,对于鱼肉肌原纤维蛋白中的游离巯基具有一定的稳定性。
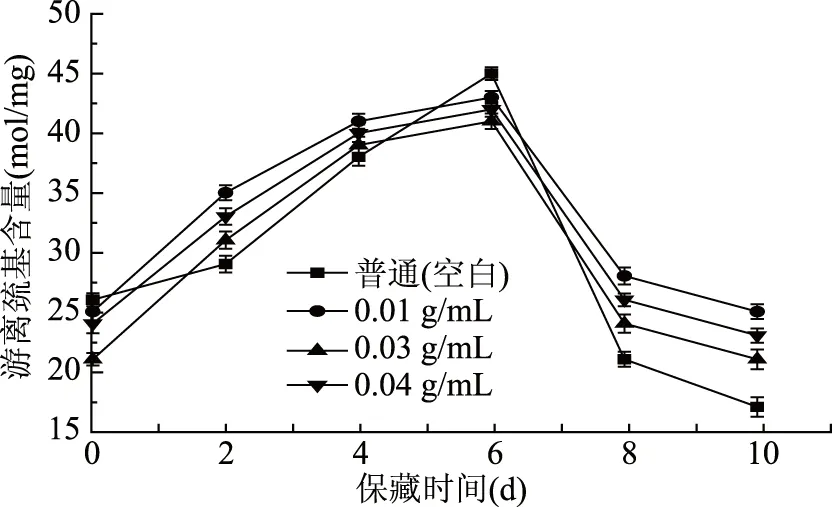
图9 保藏过程中不同处理组鲤鱼鱼肉的游离巯基含量变化
3 结论
通过对不同浓度鲤鱼鱼鳞蛋白酶解液(0.01、0.03、0.04 g/mL)和对照组的菌落总数、可溶性蛋白含量、蒸煮损失率、汁液流失率、TBA值、酸价、总巯基与游离巯基含量等指标对比,说明具有一定的抗氧化能力的鲤鱼鱼鳞的蛋白酶解液,可以有效抑制鲤鱼肉细菌增长、肉质氧化,延缓脂肪酸败,同时保持鱼肉的新鲜度。同时0.03 g/mL鲤鱼鱼鳞蛋白酶解液的处理效果最佳,使鲤鱼鱼肉的保藏期延长4 d。综上所述,鲤鱼鱼鳞蛋白酶解液的应用不仅促进了水产废弃物的资源利用,减少了环境危害,还为水产保鲜剂的开发奠定了一定的基础。
