虎杖白藜芦醇、槲皮素异构体联用抗生素对耐药金黄色葡萄球菌的抑制作用
2019-08-28陈尚岳纪亚明李玉环于海霞谢敬亮舒挥文孙颖玲张妙良薛喜才
陈尚岳,纪亚明,李玉环,于海霞,谢敬亮,舒挥文,孙颖玲,张妙良,薛喜才,何 羽
(北京小汤山医院,北京 102211)
耐药性金黄色葡萄球菌(MRSA)是临床上最常见的病原菌之一,自1961年被发现以来,其耐药比例逐年上升[1]。由于广谱抗生素的普遍使用,MRSA目前对苯唑西林、红霉素、头孢曲松、头孢唑林以及β内酞胺类均表现出不同程度的耐药性,已成为目前现有抗生素难以控制的致病菌之一[2-3],给医护工作人员造成了极大的困难。因此,寻找新的抑菌策略或药物对MRSA进行有效的防治成为目前该领域的研究热点。
MRSA的敏感抗生素主要有万古霉素、替考拉宁、去甲万古霉素等,且国内尚未发现耐药例子;但以上抗生素存在价格昂贵、肾毒性大等缺点,临床用药时需谨慎选择[4]。为了克服以上难题,近年来采用联合用药方式对MRSA进行防治取得了良好的效果,如克拉维酸与阿莫西林或替卡西林联用可有效增强抗生素的抑菌效果[5],万古霉素联用苯唑西林对MRSA的杀菌效果可达90%以上等[6],已成为目前MRSA防治的重要手段。然而,多数药物为抗生素间的联用,无形间增加了出现新型耐药菌株的风险,因此,寻找某种既可增强抗生素抑菌作用,又能降低细菌耐药风险的药物是目前需要迫切解决的问题。
有报道指出,多酚类化合物中的白藜芦醇和槲皮素异构体等,可有效地阻碍细菌的外排机制,增强抗生素的抑菌效果[7],且该类化合物通常还具有抗炎,抗过敏,抗真菌,抗微生物和抗氧化等多种药理学性质[8-10]。为了评估白藜芦醇、槲皮素异构体与抗生素联用是否具有增强抗生素的抑菌作用,本文选用虎杖白藜芦醇、槲皮素异构体与不同抑菌机理的抗生素进行联合用药,通过微量稀释法和K-B扩散法探究联合用药的抑菌效果,为多酚类化合物与抗生素的联合用药研究提供进一步的理论参考。
1 材料与方法
1.1 材料和仪器
测试细菌MRSA(MJMC001型) 由第三军医大学西南医院提供;小鼠肺成纤维细胞系的L929细胞株 上海素尔生物科技有限公司;环丙沙星(CIP)、苯唑西林(OXA)、红霉素(ERY)为抗生素类,槲皮素异构体(MOR)、虎杖白藜芦醇(RES)为黄酮类药物,二甲基亚砜(DMSO,100%) 购自美国sigma公司;肉汤培养基(Mueller-Hinton) 上海西宝生物科技股份有限公司;尼龙网 南京建成生物科技有限公司。
高压蒸汽灭菌锅(GI54D型) 厦门致微仪器;紫外分光光度计(TU-1901)北京普析;酶标仪(BS~1101型) 美国Bio-Tek;恒温摇床(HZ250LBG型) 武汉瑞华仪器;Accuri C6流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 菌液的配制 将适量MRSA菌株接入肉汤培养基(MH)中进行扩大培养,接种量1%,于150 r/min,37 ℃条件下恒温培养4 h,当OD600为0.4时(对数生长期),取出菌液稀释至终浓度为1.0×107CFU/mL备用。
1.2.2 药液的配制 采用10%(v∶v)的二甲基亚砜(DMSO)溶解药品,并统一稀释至5000 mg/L备用。
1.2.3 单药的最低抑菌浓度测定 最低抑菌浓度(MIC)即抑制细菌生长的最低药物使用浓度,CIP、OXA、ERY、MOR、和RES单用的MIC采用微量稀释法测定[11]。在96孔板中,每孔加入180 μL 新鲜MH培养液,后加入10 μL药液(终浓度为抗生素:50~500 mg/L;多酚类化合物1000~5000 mg/L)和10 μL菌液(约105CFU/mL),空白孔中加入190 μL新鲜MH培养液和10 μL药液,每组设置三个平行,样品添加完成后,37 ℃下培养24 h,检测OD600值(或观察无菌生长)确定各药物单用时的MIC。
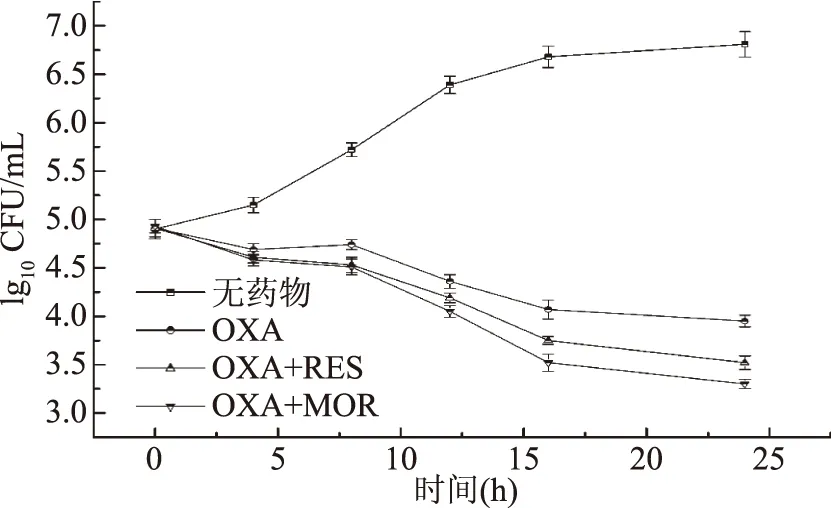
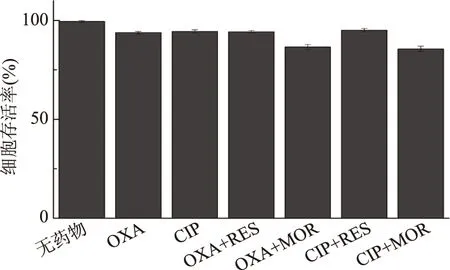
1.2.4 联合用药的抑菌试验 本实验通过微量稀释法和K-B扩散法测定RES、MOR与抗生素联用的抑菌效果,并与单药的抑菌效果进行比较。考虑到两种不同化合物之间可能存在相互作用而最终出现对MRSA不同的抑制作用[12],本实验将联合用药的抑菌作用分为协同、促进、无关和拮抗作用。以抑菌指数(FIC)作为判断依据,若FIC≤ 0. 5,则为协同作用,当0. 5 1.2.4.1 微量稀释法 根据Bonapace等[11]的测定方法,在酶标版上,每孔加入180 μL新鲜培养液,5 μL抗生素药液(使终浓度为1/8 ~ 2 MIC),5 μL的RES、MOR(使终浓度为1/4 ~ 2 MIC)和10 μL菌液(约105CFU/mL),另以20 μL DMSO作为空白对照。37 ℃下培养24 h,检测OD600值(或无菌生长)确定联合用药的MIC(抗生素/RES、MOR)。 1.2.4.2 K-B法 参考Pfaller等[14]的优化方法,根据微量稀释法所得药物联用的MIC,在含有RES或MOR的MH琼脂平板(90 mm)中,将MRSA菌液均匀地涂抹于平板上,随后接入无菌纸片,向纸片中加入10 μL抗生素(联用MIC),另以不加RES或MOR的MH平板作为空白组,37 ℃下培养24 h后,记录抑制圈直径(IZD)大小。 1.2.5 联合用药的杀菌实验 参考Bonapace等[11]的实验方法,在10 mL新鲜MH培养基中,加入组合药(OXA+RES、OXA+MOR、CIP+RES、CIP+MOR)液100 μL(终浓度为联用MIC),随后接入100 μL菌液(终浓度约为105CFU/mL),另以不加任何药物的MH培养液作为空白对照,以抗生素单用(MIC)作为阴性对照(OXA、CIP),于37 ℃,150 r/min下恒温摇床培养,分别在0、4、8、12、16和24 h取样100 μL,以无菌水稀释至1 mL后,经300目尼龙网过滤,采用流式细胞仪进行活细胞计数,并绘制联合用药对MRSA的杀菌曲线。 1.2.6 细胞毒性实验 本实验以小鼠肺成纤维细胞系的L929细胞株作为实验对象,采用MTS法评估有效抑菌药物组合的细胞毒性[15]。首先将细胞株接种于高糖DMEM培养基中,置于37 ℃、5% CO2、饱和湿度的培养箱中培养24 h,细胞贴壁生长,继续孵育5~7 d后以0.25%胰蛋白酶消化传代。选取对数期的细胞作为实验对象,并将细胞悬液浓度统一稀释至1.0×106CFU/mL备用。 在96孔酶标板上每孔接入100 μL细胞悬液(约105CFU/mL),并于5% CO2、饱和湿度的培养箱中培养24 h 后加药处理(OXA、OXA+MOR、OXA+RES、CIP、CIP+MOR、CIP+RES),对照组不加任何药物。继续培养24 h后加入MTS溶液20μL继续培养4 h,于490 nm下测定其吸光值(OD值)[16,17],计算细胞存活率[18]。 细胞存活率(%)=(加药OD值-对照OD值)×100/对照OD值 联合用药的抑菌效果采用Oringin 9.0进行拟合分析,杀菌曲线的活菌计数采用Accuri C6软件(流式细胞仪自带软件)进行统计分析。 药物单用时的MIC如图1所示,RES和MOR的MIC分别为4500和3000 mg/L,ERY、OXA和CIP的MIC分别为250、200、100 mg/L。根据张芳等[19]和Nakaune等[20]的研究结果,RES可干扰细菌细胞壁合成,抑制细菌代谢的磷酸化水平、NF-xB核转移和N-FB的相关信号通路,并影响细菌的基因转运机制,从而达到抑菌效果。MOR的抑菌机理目前还不清楚,但关于槲皮素及其衍生物的抑菌作用,已有相关报道[21-23],且郭艳华等[24]的研究发现,通过化学改性后的槲皮素,不仅克服了其水溶性差等缺点,还增强了其抑菌作用。ERY可与敏感细菌50S核蛋白体亚基可逆性结合,通过抑制核蛋白体受体部位的正常结合,阻碍细菌蛋白质的合成而达到抑菌效果[25]。OXA属于青霉素类抗生素,主要通过抑制细菌细胞壁的合成而发挥杀菌作用[26]。而CIP作为一种喹诺酮类药物,是DNA旋转酶的抑制剂,可作用于细菌的DNA旋转酶,干扰DNA超螺旋结构的解旋过程,从而阻碍DNA的复制,起到了慢效杀菌的作用[27]。 图1 单药的MIC值 联合用药的抑菌效果如表1所示。通过K-B法测得药物单用(MIC)IZD的大小顺序为CIP>ERY>OXA>MOR>RES,由微量稀释法测得ERY联用RES、MOR的FIC分别为2和1.5,这表明ERY联用RES或MOR不能增强ERY对MRSA的抑菌作用,且ERY联用RES的IZD(12.1 mm)与单药IZD(15.3 mm)相比缩小了26.4%,表现为拮抗效应。这可能是由于ERY与RES发生了某种相互作用,使得有效药物浓度降低,从而导致ERY对MRSA的抑制作用减弱[28]。然而OXA、CIP与RES、MOR的联合用药均可不同程度地增强抗生素对MRSA的抑制作用,抑菌指数为0.5≤ FIC ≤1.0,抗生素的使用量减少了50%~75%,其中CIP联用MOR的抑菌效果最优,抑菌指数为0.5,CIP用量减少75%,表现为药物协同作用。这表明RES、MOR均可作为OXA或CIP的增强剂,对抗生素的抑菌作用具有显著的促进效应(p<0.05)。然而不同的是,三种抗生素联用RES或MOR的IZD值呈现出高度一致的缩小趋势,根据鲁晓翔[29]的研究发现,虽然多酚类化合物具有广泛的抑菌活性,但却不具备专一性,其对MRSA可能是非定向作用,因此最终导致IZD出现缩小的现象。 表1 药物联用对MRSA的抑制效果 OXA联用RES、MOR的杀菌曲线如图2所示。当OXA(1/2 MIC)与RES(1/4 MIC)或MOR(1/2 MIC)联用时,杀菌作用极显著增强(p<0.01)。在时间为24 h时,OXA单用、OXA联用RES、OXA联用MOR的活菌数仍呈现出递减趋势,因此,OXA联合用药的杀菌强弱顺序为:OXA+MOR>OXA+RES>OXA。一般认为,OXA作为一种青霉素类抗生素,主要是抑制MRSA细胞壁合成[19],而RES除可干扰细胞壁合成外,还可影响细菌IxBa磷酸化水平,逆转细菌的耐药机制,因此与OXA联用起到增强杀菌作用的效果。关于MOR的抑菌机理目前尚不清楚。Yoshizumi等[30]的研究发现,槲皮素衍生物可抑制细胞磷脂酰肌醇3-激酶介导的c-Jun N-末端激酶的活性,有利于心血管疾病的治疗。但关于MOR是否具有同样的抑菌机理还有待进一步深入研究。 图2 苯唑西林联用白藜芦醇或槲皮素异构体的杀菌曲线 CIP联用RES、MOR的杀菌曲线如图3所示,CIP作为一种慢效杀菌的喹诺酮类抗生素,RES或MOR联用时,其杀菌效果显著增强,活菌数量下降明显。在24 h时,CIP单用(MIC)、CIP联用RES、CIP联用MOR条件下的活菌数亦呈现递减趋势,其杀菌强弱顺序为:CIP+MOR>CIP+RES>CIP。由于RES可抑制细胞壁的合成,影响细胞膜的信号转导和通透性[31],因此RES与CIP联用时,CIP作用于MRSA胞内的药物浓度加大,因此对MRSA胞内DNA活动的抑制作用增强,从而导致杀菌效果的显著提升,这与宋晓言等[32]研究30 味中药提取物与CIP联用对猪源链球菌的体外抑菌结果相类似。然而,关于MOR对CIP的增强效应及其抑菌机理还有待深入研究。 图3 环丙沙星联用白藜芦醇、槲皮素异构体的杀菌曲线 有效抑菌药物组合的细胞毒性试验结果如图4所示。OXA或CIP单用时,小鼠细胞的存活率分别为93.8%和94.5%,这表明两种抗生素对小鼠细胞均具有轻微细胞毒性,然而OXA联用RES和CIP联用RES的细胞存活率分别为95.3%和96.1%,因此,RES与两种抗生素的联合用药均不会增加对小鼠纤维细胞的毒性作用,且细胞存活率有所上升。这可能与RES本身所具有的抗氧化、清除氧自由基等药理学特性有关[33]。而当MOR与OXA或CIP联用时,细胞存活率与抗生素单用相比分别降低了8.9%和7.2%,这表明MOR与两种抗生素的联用呈现出微弱细胞毒性增加的现象。根据Hou等[34]的研究发现,MOR在大鼠体内的药代动力学与槲皮素相比具有较大差异,药物残留浓度较高,因此对细胞具有一定的毒性作用。然而,Ferry等[35]研究认为,MOR对人体细胞的毒性有限,与抗生素药物联用时不会引起细胞的损伤或凋亡。因此,关于MOR的细胞毒性机理还需要进行后续研究。 图4 有效抑菌药物组合的细胞毒性 本文旨在探究联合用药对MRSA的抑制作用,并寻找新的抑菌药物组合或抗生素增强剂。通过微量稀释法发现虎杖白藜芦醇和槲皮素异构体对MRSA均具有天然抑菌活性,其MIC分别为4500和3000 mg/L。药物联用的实验结果表明红霉素联用虎杖白藜芦醇或槲皮素异构体均不能增强抗生素对MRSA的抑制作用,表现为无关或拮抗效应。而苯唑西林或环丙沙星与虎杖白藜芦醇、槲皮素异构体联合用药均可增强对MRSA的抑菌作用,抗生素使用量与单药相比降低了50%~75%,其中最佳抑菌组合为环丙沙星联用槲皮素异构体,联用MIC为环丙沙星25 mg/L,槲皮素异构体750 mg/L,抑菌指数(FIC)为0.5,表现为药物协同作用。 有效的抑菌药物组合细胞毒性实验结果表明,虎杖白藜芦醇与苯唑西林或环丙沙星的联合用药均不会增加对小鼠L929细胞的毒性作用。而槲皮素异构体联用苯唑西林或环丙沙星时,小鼠L929细胞存活率与抗生素单用相比分别降低了8.9%和7.2%,这表明槲皮素异构体与两种抗生素的联用对小鼠的细胞毒性有所增加。本文为进一步研究白藜芦醇、槲皮素异构体联用抗生素的抑菌作用和抑菌机理奠定了基础。1.3 数据处理
2 结果与分析
2.1 单药MIC结果

2.2 联合用药的抑菌效果
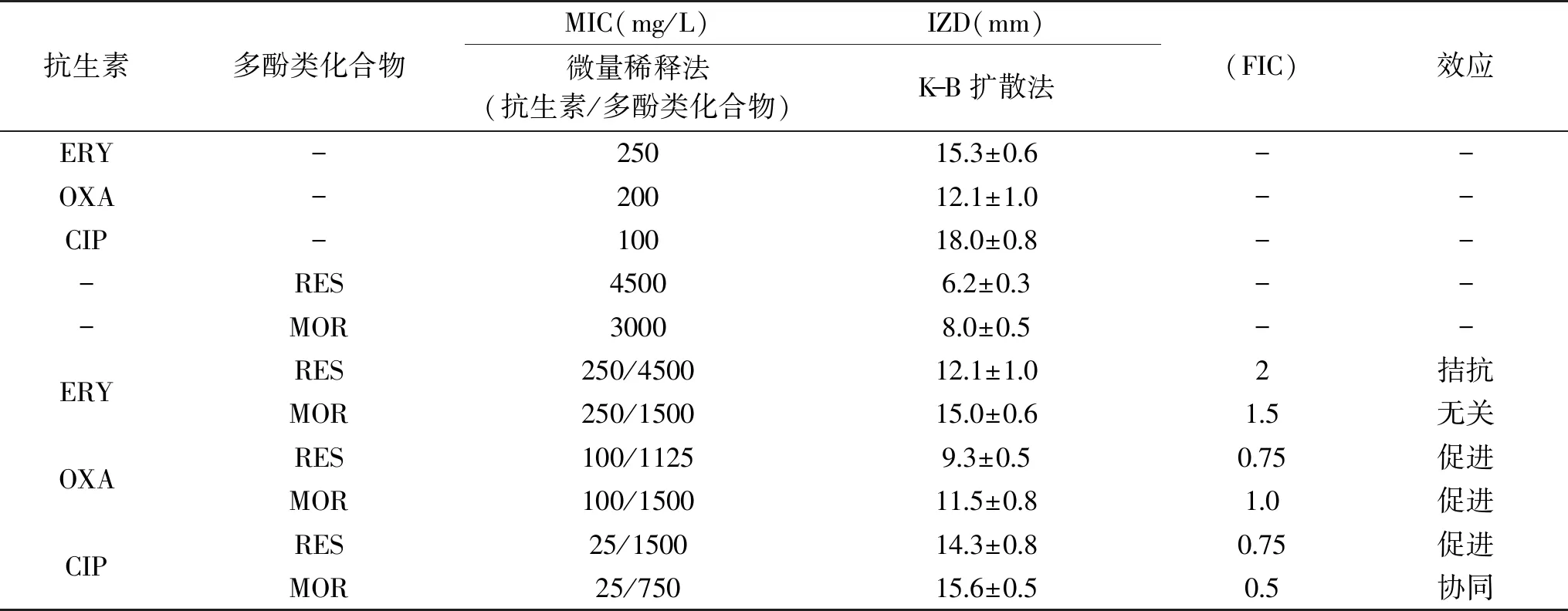
2.3 联合用药的杀菌曲线
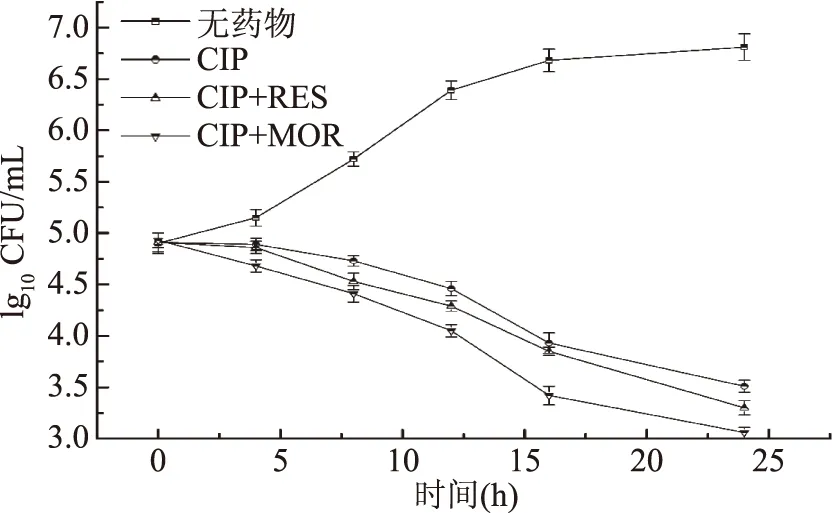
2.4 细胞毒性研究结果
3 结论
