高活性副干酪乳杆菌冻干菌粉的制备及工艺优化
2019-08-28张雅硕侯一超张紫薇满朝新姜毓君
张雅硕,侯一超,张紫薇,满朝新,姜毓君
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
近年来,随着乳酸菌作用机制的不断研究,乳酸菌被广泛应用于食品行业、医药行业、轻工业及畜禽生产业等众多领域,这也促进了发酵剂种类的更新。目前制作乳酸菌发酵剂的方法有很多,主要有真空干燥、喷雾干燥、真空冷冻干燥和流化床干燥等,但应用较为广泛和有效的是真空冷冻干燥技术。真空冷冻干燥主要分为三步,首先是产品的预冻,让发酵剂中的水分冻结成冰,但预冻的速度和时间因菌种而异;其次是升华干燥,也称为第一阶段干燥,通过降低真空度,使环境中水的蒸汽压降低,冰晶直接转化为水蒸气从制品中溢出;最后是解析干燥阶段,主要是除去产品中结合水,使制品的水分含量达到要求,利于储藏。
在真空冷冻干燥过程中,乳酸菌主要经受两种刺激,即冷冻和干燥,为了减少这两个过程对微生物造成的损伤,必须采取有效的措施。其中,保护剂的应用是第一保护策略[1]。乳酸菌冻干保护剂可按照不同的方式进行分类,按相对分子量大小可分为两类[2-3],一类是低分子量化合物(如糖类、醇类和抗氧化剂等),这类物质在冷冻干燥过程中能够进入细胞,与水分子相互作用,增加溶液的黏度,弱化水的结晶过程,从而减少细胞损伤;另一类是高分子量化合物(如脱脂奶粉、可溶性淀粉和聚合物类等),这类物质能够在冻干时使溶液呈过冷状态,降低细胞外溶质浓度,避免由于盐类浓缩而使细胞脱水,从而减少细胞发生渗透性休克、细胞壁和细胞膜塌陷、蛋白质盐析变性等不良后果。在真空冷冻干燥过程中,低分子量保护剂发挥直接作用,高分子量保护剂起到促进前者的保护作用,因此高分子和小分子保护剂配合使用,会使乳酸菌在冻干期间维持较高的活性。由于微生物细胞结构和大小有差异,因此需要根据菌株的特异性而选择合适的冻干保护剂[4]。此外,改变工艺参数,如预冻温度、预冻时间等也可以减少真空冷冻干燥对细胞造成的损伤[5]。本研究以副干酪乳杆菌为研究对象,对保护剂配方和真空冷冻干燥工艺参数进行优化,以确定制备副干酪乳杆菌冻干菌粉的最佳工艺。
1 材料与方法
1.1 材料与仪器
副干酪乳杆菌(Lactobacillusparacasei) 分离自我国传统发酵稀奶油,本实验室保存;MRS液体培养基:葡萄糖20 g,蛋白胨10 g,牛肉浸粉8 g,乙酸钠5 g,酵母浸粉4 g,磷酸氢二钾2 g,柠檬酸氢二钾2 g,硫酸镁0.2 g,硫酸锰0.04 g,吐温-80 1 mL,加蒸馏水至1000 mL,调pH为7.0~7.2,于121 ℃下灭菌15 min;MRS计数培养基:向MRS液体培养基中加入1.5%~2.0%(w/v)琼脂粉;海藻糖 Sigma生物试剂有限公司;乳糖 北京索来宝科技有限公司;蔗糖 上海楷洋生物技术有限公司;麦芽糊精 上海瑞永生物科技有限公司;酵母粉 北京奥博星生物技术有限公司;可溶性淀粉 天津基准化学试剂有限公司;聚乙烯吡咯烷酮(PVP K-30)、谷胱甘肽(GSH) 生工生物工程(上海)股份有限公司;明胶 天津市永大化学试剂开发中心;维生素C 天津市光复科技发展有限公司;脱脂奶粉 市售。
3K15型高速离心机 美国SIGMA公司;ALPHA 1-4 LSC plus型真空冷冻干燥机 德国CHRIST公司;S-3400N型扫描电子显微镜、E-1010型离子溅射镀膜仪 日本日立公司;酶标仪 瑞士TECAN公司;BXM-30R型立式压力蒸汽灭菌器 上海博讯医疗生物仪器股份有限公司;PL2002型电子天平(0.01 g)、MS-TS型分析天平(0.0001 g)、Delta320型pH计 梅特勒-托利多仪器有限公司
1.2 实验方法
1.2.1 工艺流程 菌种活化→扩大培养→菌体收集→洗涤→离心收集→菌体悬浮液配制(添加冻干保护剂溶液)→活菌计数→真空冷冻干燥→存活因子的测定。
1.2.2 工艺操作要点
1.2.2.1 菌体的活化、生长曲线的测定及扩大培养 将副干酪乳杆菌以2%的接种量接种到新鲜的MRS液体培养基中,37 ℃培养18 h,用接种环蘸取少量菌液于MRS固体平板上三区划线,37 ℃培养48 h,挑取典型的单菌落接种于新鲜的MRS液体培养基中培养18 h,以此反复3次,第三代得到的菌液作为工作液。
将活化好的副干酪乳杆菌按2%的接种量接种至100 mL MRS液体培养基中,在37 ℃下培养24 h。每隔2 h测定一次菌液的OD620值,以时间为横坐标,OD620值为纵坐标建立菌株的生长曲线。
将活化三次后的菌液,以2%的接种量接种至锥形瓶进行扩大培养[6]。
1.2.2.2 菌体的收集 将培养好的菌液置于离心机中,5000×g 4 ℃条件下离心10 min,弃上清液,用0.85%无菌生理盐水洗涤菌体两次后,再以同样的条件离心即得菌体沉淀。
1.2.2.3 菌体细胞的真空冷冻干燥法制备 保护剂溶液的配制:将大分子保护剂、糖类、聚合物类中的一种或几种保护剂按一定的浓度用蒸馏水溶解,搅拌均匀,于115 ℃下灭菌15 min,置于4 ℃冰箱中保存备用;维生素C、谷胱甘肽采用膜孔径为0.22 μm的滤膜过滤除菌。
真空冷冻干燥:在5000×g 4 ℃条件下离心10 min收集菌体沉淀,按菌液(未离心前体积)与保护剂比例(v/v)为1∶1加入不同配方的保护剂溶液,计算初始细胞活菌数后分装进行冰箱预冻(-80 ℃,2 h),冻结完全后将预冻好的样品放入冷阱温度为-53.2 ℃,真空度为0.162 mbar的真空冷冻干燥机内冻干24 h,然后置于-20 ℃冰箱中保存备用。
1.2.3 单因素实验
1.2.3.1 冻干保护剂种类的选择 单一冻干保护剂的选择:分别选用以下保护剂[7-9]与菌体充分混匀,观察菌体的存活情况。
大分子保护剂:分别选用脱脂奶粉、酵母粉、可溶性淀粉、麦芽糊精进行试验,浓度均为10%。
糖类保护剂:分别选用海藻糖、蔗糖、乳糖进行试验,浓度均为10%。
聚合物类保护剂:分别选用PVP K-30、明胶进行试验,浓度均为5%。
抗氧化剂类保护剂:分别选用维生素C、GSH进行试验,浓度均为1%。
1.2.3.2 冻干保护剂浓度的选择 根据上述试验结果,以冻干菌粉的菌体存活因子为指标,选择保护效果最好的四种保护剂,分别设置不同的浓度梯度进行试验,以确定其加入的最适浓度。其中脱脂奶粉、蔗糖浓度为0、5%、10%、15%、20%;PVP K-30浓度为0、1%、3%、5%、7%、9%;GSH浓度为0、0.4%、0.7%、1.0%、1.3%、1.6%。
1.2.4 复合冻干保护剂浓度的筛选 选择单因素优化后的真空冷冻干燥保护剂及其相应浓度,以存活因子为指标,通过正交试验L9(34)选出效果最佳的冻干保护剂配方,试验因素水平如表1。
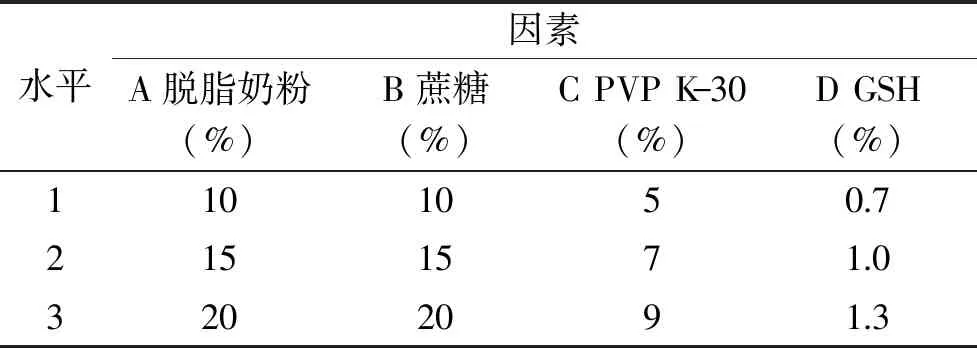
表1 保护剂正交因素水平表
1.2.5 预冷温度的确定 取生长到指数中期的菌液,用无菌生理盐水洗两次,重悬于等体积新鲜的MRS肉汤中,分别放置于4、10、15、20 ℃温度下处理2 h,再置于37 ℃培养箱中培养至稳定期。对照组为培养至稳定期的菌液。收集各处理条件下的样品,按照1.2.2.3进行真空冷冻干燥处理,并计算菌体的存活因子。
1.2.6 真空冷冻干燥保护剂pH的选择 将筛选出来的复合保护剂用灭菌的乙酸或氨水分别调pH为5.0、5.5、6.0、6.5、7.0、7.5,在37 ℃下与菌体平衡20 min后进行真空冷冻干燥,计算出菌体的存活因子。
1.2.7 菌液和保护剂比例的确定 按照上述优化的试验方法,以菌液/保护剂为1∶1、1∶1.5、1∶2、1∶2.5、1∶3 (v/v)的比例,研究其对菌体冻干存活因子的影响。
1.2.8 冻干厚度的确定 在上述菌液和保护剂添加比例的基础上,对冻干厚度进行研究。将菌泥和保护剂振荡混匀后,以不同的厚度(0.3、0.4、0.5、0.6、0.7 cm)装入玻璃平皿中,置于真空冷冻干燥机内进行冻干,计算其存活因子,确定出最佳的冻干厚度。
1.2.9 预冻方式的选择 按照上述优化的试验方法,将样品分别置于-20 ℃冷冻2 h,-80 ℃冷冻2 h,-196 ℃冷冻15 min,然后真空冷冻干燥24 h,测菌体存活因子[10-11]。
1.2.10 菌粉电镜观察 将未添加保护剂组菌粉和添加复合保护剂组菌粉粘贴在样品台上,采用E-1010型离子溅射镀膜仪镀一层厚度约为150 Å的金属铂膜,使用S-3400N型扫描电镜进行观察并拍照。
1.2.11 测定方法 副干酪乳杆菌活菌数测定:将冻干前副干酪乳杆菌菌液及冻干后复水恢复活性的样品进行10倍梯度连续稀释,取10-6、10-7、10-8之间稀释梯度进行平板涂布,37 ℃培养48 h,选择菌落数在30~300 CFU/mL之间的培养皿进行计数。
冻干存活因子的测定:用上述平板计数法分别测定冻干前和冻干后的活菌数,计算菌体的冻干存活因子[12]。冻干前活菌数为菌液中的活菌数;冻干后活菌数为冻干菌粉悬浮于10%的蔗糖溶液中,于37 ℃复水30 min后,恢复活性后的活菌数。
冻干存活因子=[1-(lg冻干前活菌数-lg冻干后活菌数)/lg冻干前活菌数]
冻干前活菌数(CFU)=冻干前菌浓(CFU/mL)×v
冻干后活菌数(CFU)=冻干后菌浓(CFU/g)×m
式中:v代表冻干前菌液体积,mL; m代表冻干后菌粉质量,g。
1.3 数据处理
采用Excel 2010(Microsoft office 2010)软件处理试验数据,结果表示为平均值±标准差。采用SPSS statistic 20.0软件对数据进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 副干酪乳杆菌生长曲线的绘制
由图1可知,副干酪乳杆菌生长过程中,0~4 h为延迟期,4~16 h为对数期,16~24 h为稳定期。菌体进入稳定期,结构和生理都发生了很大变化,包括应激蛋白、膜组成和细胞壁结构的表达水平的变化,使菌抗性增加[7],因此,选择16 h为收获期。
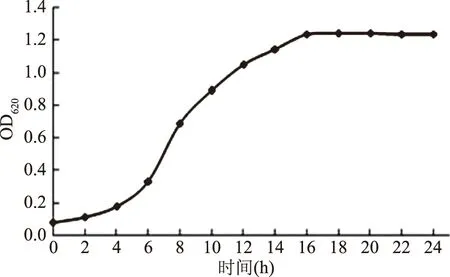
图1 副干酪乳杆菌生长曲线
2.2 冻干保护剂的优化
2.2.1 不同类型保护剂对副干酪乳杆菌的冻干保护 图2为不同种类保护剂对副干酪乳杆菌冻干存活因子的影响,从图2可以看出,所选择的大分子物质能够显著(p<0.05)提高菌体的存活因子,但不同的保护剂保护效果不同。其中脱脂奶粉的保护效果最好,显著(p<0.05)高于酵母粉、可溶性淀粉和麦芽糊精的保护作用。这可能是因为脱脂奶粉不仅像其它大分子物质一样在菌体表面形成保护层,并且脱脂奶粉中的乳清蛋白在菌体外形成蛋白膜,对细胞加以保护,并可以固定冻干的酶类,防止由于细胞壁蛋白质损伤而引起的胞内物质渗漏[6];同时,乳中其他成分(乳糖、钙、磷等)也可以起到保护作用[12-13]。因此,本试验选择脱脂奶粉为大分子保护剂。
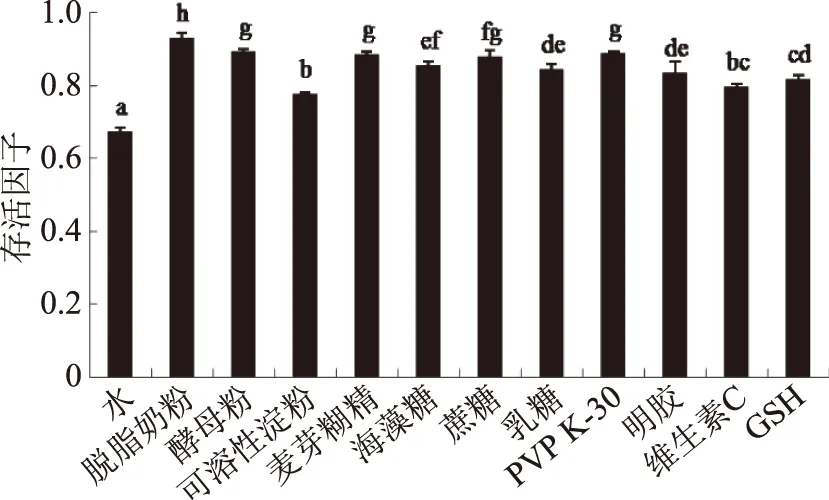
图2 不同类型保护剂对副干酪乳杆菌冻干菌粉存活因子的影响
糖类保护剂也能显著提高菌体的存活因子,其中蔗糖保护效果最优。在冻干过程中,蔗糖可以形成高粘度、低流动性的玻璃态基质,将蛋白质分子支撑起来,使之不易变性[14]。蔗糖分子的多个羟基,在冻干过程中可取代水分子与菌体表面的自由基联结或与菌体蛋白质形成氢键,从而对细菌的细胞膜和蛋白质的完整性起到保护作用[15]。此外蔗糖可以促进菌体分散,还可以作为细胞今后生长用的碳源[16]。
聚合物类保护剂在冻结过程中优先析出,可以提高溶液的粘度,抑制pH的降低。在聚合物类保护剂中PVP K-30保护效果最好。作为国家批准的新型安全食品添加剂,PVP K-30可以用作保护剂、分散剂、粘合剂和给药剂等[17]。在真空冷冻干燥过程中,PVP K-30可以提高蛋白质和氨基酸的稳定性。同时,它也是一种非渗透性保护剂,可以与糖类间氢键作用,抑制糖类从玻璃态转变成结晶态,从而增加糖的物理稳定性[18]。
抗氧化剂类保护剂在冻干过程中可以通过自身氧化而消耗环境中的氧,减少乳酸菌与氧的接触,防止样品氧化[19]。试验中GSH的保护效果较好。有研究表明,GSH作为冻干保护剂在保护细胞的同时减少了饱和脂肪酸的链长,进而保持细胞流动性。同时GSH减少细胞膜脂肪酸被氧化,并促使细菌有效地适应冻干过程[20]。
综上所述,本试验的单一保护剂确定为脱脂奶粉、蔗糖、PVP K-30和GSH。
2.2.2 冻干保护剂浓度筛选 分别考察了脱脂奶粉、蔗糖、PVP K-30、GSH 4种保护剂不同浓度对菌体冻干后细胞存活因子的影响,结果如图3所示。
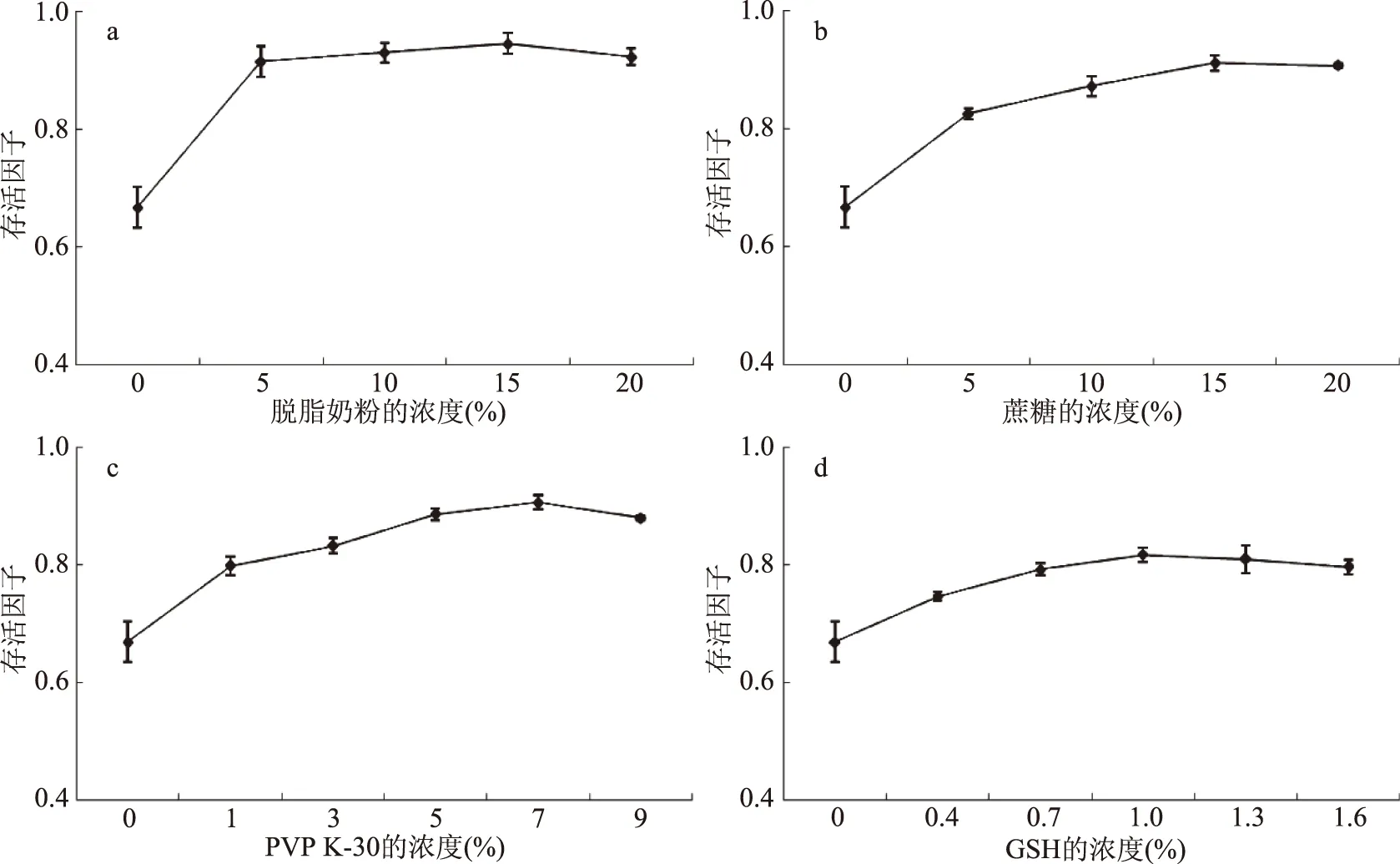
图3 不同浓度保护剂对乳酸菌冻干活力的影响
由图3a可以看出,脱脂奶粉的添加提高了副干酪乳杆菌冻干菌粉的存活因子,其中浓度为15%时冻干效果最好,存活因子最高,继续增大脱脂奶粉的浓度,保护效果逐渐减少。由图3b可知,随着蔗糖浓度的增加,菌体冻干存活因子也提高,但蔗糖浓度高于15%时,冻干菌的存活因子出现下降趋势,因此蔗糖浓度为15%时存活因子最高,菌的活性最好。由图3c可以看出,当PVP K-30浓度低于7%时,随着PVP K-30浓度的增加,冻干菌体的存活因子也呈上升趋势,当PVP K-30浓度为7%时,保护效果最好。由图3d可以看出,当GSH浓度为0.4%~1.0%时,冻干菌的存活因子随浓度的增加而上升,当GSH浓度为1.0%~1.6%时,冻干菌的存活因子随浓度的增加而下降,因此GSH浓度为1%时存活因子最高。由此可以看出,副干酪乳杆菌冻干存活因子与各保护剂浓度之间并不是线性增长关系,其趋势为先升高后下降。保护剂浓度较低时,随着浓度的升高,细胞活力不断提高,但到一定浓度后,随着保护剂质量浓度的增加,细胞活力反而下降。出现这一现象的原因可能是当保护剂浓度过高时,细胞内蛋白质聚合程度加剧,形成较强的玻璃化结构,对冻干菌粉的低温储藏不利,导致复水效果差[21]。因此,据图中结果可知保护剂脱脂奶粉15%、蔗糖15%、PVP K-30 7%、GSH 1%为最佳浓度,以此作为正交试验的依据。
2.2.3 冻干保护剂正交试验 单独使用某种保护剂的效果并不理想,为进一步提高菌体存活因子,需对冻干保护剂进行复配试验。以上试验已确定4种最佳保护剂及其浓度,采用正交试验的优化方式,进行保护剂配方的确定。
由表2可知,四种保护剂对副干酪乳杆菌的极差R的大小顺序为RA>RD>RC>RB,由直观分析可知,冻干存活因子最高的保护剂组合为A2B3C2D3,即脱脂奶粉15%,蔗糖20%,PVP-K30 7%,GSH 1.3%。为了验证由正交试验得到的最佳保护剂是否能得到最高的存活因子,按照直观分析得到的保护剂组合(A2B3C2D3)进行了验证试验,副干酪乳杆菌的冻干存活因子为(0.977±0.002),高于正交试验中得到的结果,因此认为正交试验优化结果有效[22]。
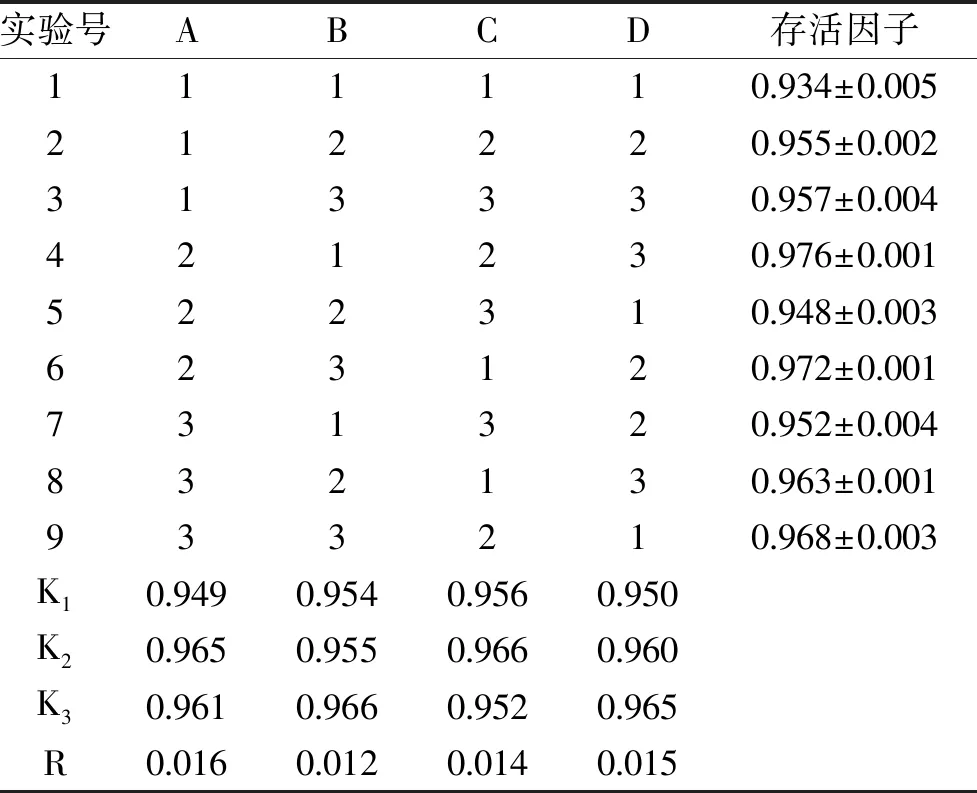
表2 副干酪乳杆菌冻干保护剂正交试验结果
2.3 预冷温度对副干酪乳杆菌冻干活力的影响
国内外研究表明,影响乳酸菌冻干存活的因素有很多,如菌株间的差异,培养方式的不同,冻干前的预处理,保护剂的选择等都会影响乳酸菌活力。在冻干之前,对乳酸菌进行胁迫处理,可以提高其对环境的抗性。各种胁迫包括温度胁迫(热胁迫和冷胁迫)、渗透压胁迫、酸胁迫和饥饿胁迫等[23]。乳酸菌在生长过程中受到胁迫,会引起细胞的某种生理变化,这些变化可以促进乳酸菌提前产生抵御冷冻干燥的细胞机制,适应不良环境,从而提高干燥的活力。Shao等[24]通过冷胁迫提高了德氏乳杆菌亚种保加利亚乳杆菌ND02的冻干活性。Zhang等[25]发现,在冷冻干燥之前,对酒类酒球菌进行冷胁迫、乙醇胁迫和酸胁迫后,菌体细胞膜不饱和脂肪酸/饱和脂肪酸的比例上升,环丙烯脂肪酸含量增加,增强细胞应激能力,提高了酒类酒球菌的冷冻干燥活性。
由图4可以看出,经过预冷处理后的细胞,真空冷冻干燥后存活因子都普遍升高。当冷胁迫温度为4 ℃时,与未处理组相比,菌体存活因子升高幅度不大。可能是在4 ℃下,细胞的代谢迟缓,不会或很少产生应激反应。10 ℃冷激的菌体细胞存活因子较对照组提高0.003,效果比4 ℃稍好。15 ℃冷激效果最佳,菌体细胞冻干后存活因子达到0.984,但20 ℃时冷激产生效果有所下降,可能是预冷温度升高,乳酸菌受到的刺激减小,从而产生抗冷冻干燥的物质减少所造成的。所以选择15 ℃ 2 h作为预冷处理。
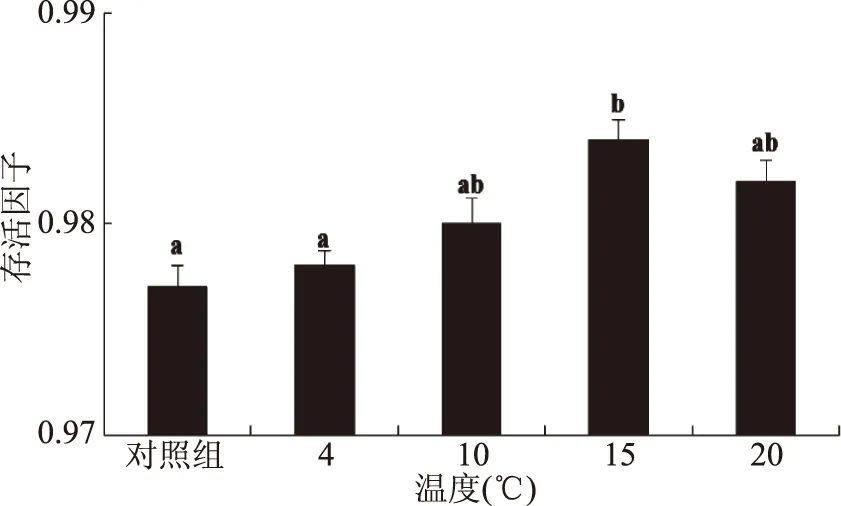
图4 不同预冷条件对副干酪乳杆菌冻干存活因子的影响
2.4 复合保护剂pH的选择
保护剂的pH对乳酸菌的冻干存活有一定的影响,适宜的pH有利于菌体在冻干过程中保持较高活力[26]。如图5所示,在pH为6.5时,菌体冻干后存活因子最高,pH过低时不利于菌体保持活力,当pH高于6.5时,菌体存活因子下降,可能是因为偏离乳酸菌生长的最适pH,不利于菌体冷冻干燥,所以最终选择保护剂pH为6.5。
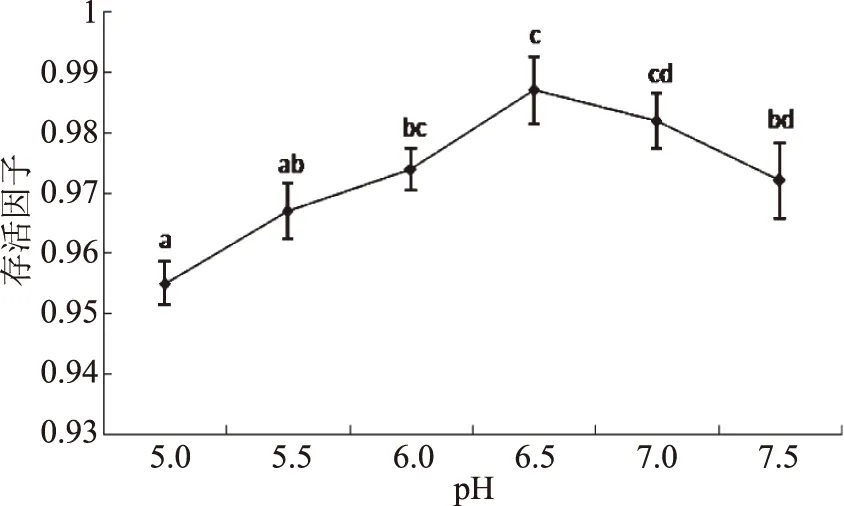
图5 保护剂pH对副干酪乳杆菌冻干存活的影响
2.5 菌液和保护剂比例对菌体冻干存活的影响
菌液和冻干保护剂比例会影响乳酸菌的冻干活性。由图6可知,当菌液和保护剂比例为1∶1.5 (v/v)时,菌体的冻干存活因子最大,随着保护剂比例的增加,菌体存活因子下降,一方面可能是因为保护剂浓度过高,细胞的通透性下降,水分挥发受阻,导致较多冰晶生成,从而造成细胞死亡率增大;另一方面可能是因为保护剂过多,单位体积或质量菌粉活菌数减少。因此,选择菌液和保护剂比例为1∶1.5 (v/v)时为最佳配比。
图6 菌液和保护剂比例对副干酪乳杆菌冻干存活的影响
2.6 冻干物料厚度对菌体冻干存活因子的影响
如图7所示,从冻干厚度来看,随着厚度的增加,菌体存活因子不断上升,当厚度达到0.5 cm时,存活因子达到最大值,为(0.994±0.004),但继续增加厚度,菌体的冻干活性下降。当物料厚度不足时,冷冻的菌体从低温冰箱中取出放入真空冷冻干燥机过程中容易融化,再重新冻结时,造成菌体损伤,而物料厚度足够厚时,相对不易融化,减少了二次冻结对菌体的损伤。而当物料厚度过厚时,细胞失去结合水难度增加,菌粉的水分含量增加,不利于储存。因此,选择0.5 cm为最佳冻干厚度。
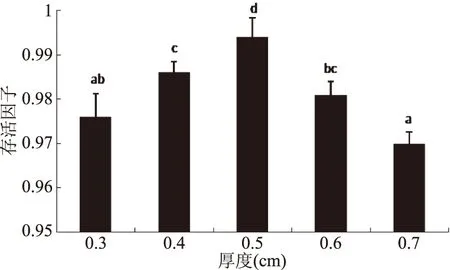
图7 物料冻干厚度对菌体存活因子的影响
2.7 预冻方式的确定
预冻温度是制作冻干菌粉的关键参数之一,细胞外冰晶的形成可能会破坏细胞膜,从而降低乳酸菌细胞的活力[1]。并且,冷冻速率会影响冰晶的成核,快速冷冻可以产生较小的冰晶,对细胞的不利影响减小[27]。所以,预冻温度的确定对乳酸菌冻干发酵剂的制备有重要意义。由图8结果显示,当用液氮预冻时,副干酪乳杆菌的存活因子达到(0.998±0.001),显著(p<0.05)高于-20 ℃预冻效果,也高于-80 ℃预冻(0.995±0.002)效果。这可能是因为在-20 ℃条件下预冻,形成的冰晶大,在干燥阶段,升华速度慢,从而导致菌体活力下降。此外,液氮预冻所需时间比-80 ℃短,因此选择液氮下处理15 min为最佳预冻方式。
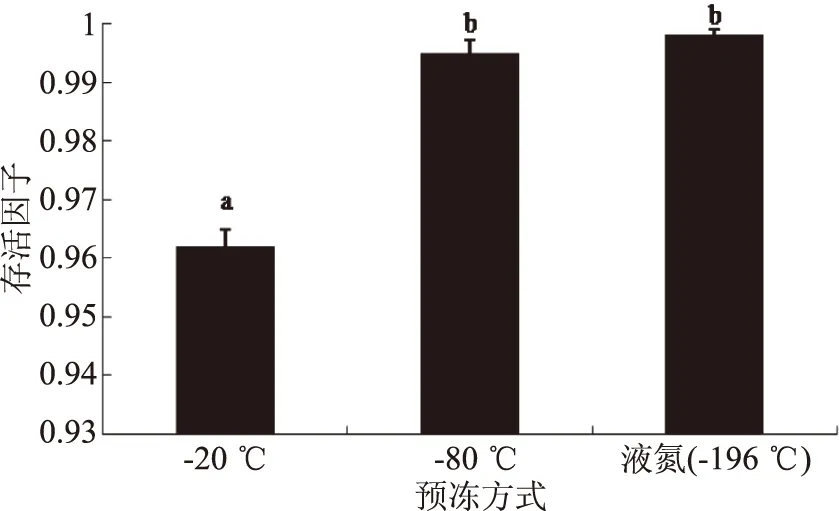
图8 预冻方式对副干酪乳杆菌存活因子的影响
2.8 冻干菌粉微观结构的电镜观察
通过扫描电镜图9可知,未添加保护剂的菌粉部分细胞明显破裂,变形严重,细胞之间相互堆积,胞间有丝状物相互黏连,这可能是由于细胞变形或破裂后内容物泄露所造成的。而添加保护剂的冻干菌粉中保护剂与菌体分布均匀,菌体清晰,形态饱满,呈杆状,菌体均被覆盖在薄的涂层下,这在一定程度给细胞膜提供了保护效应,减少了与外界的接触,避免了氧化损伤,从而维持细胞结构的完整性。
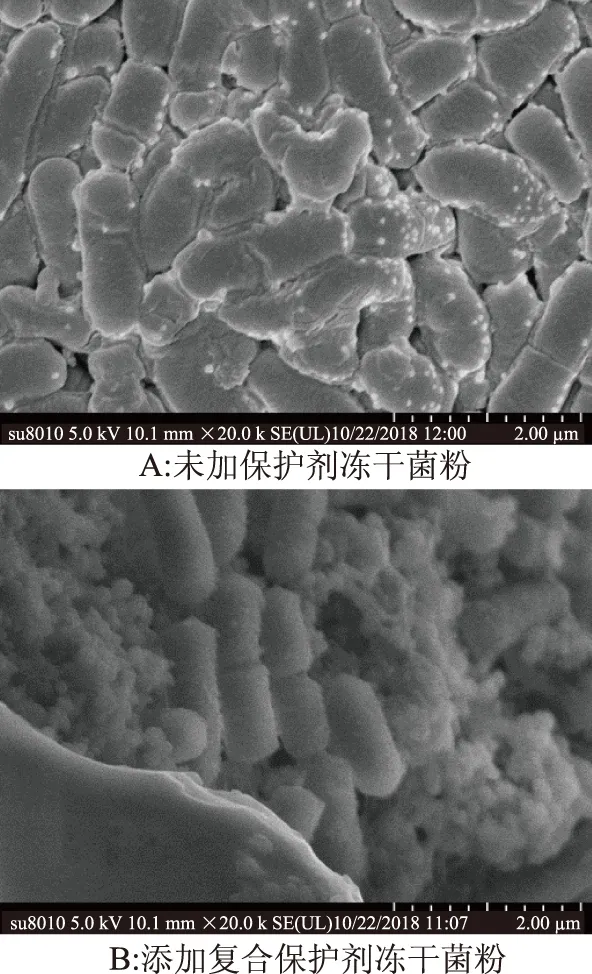
图9 扫描电镜图(×200000)
3 结论
本研究以副干酪乳杆菌为对象,对其冻干菌剂的制备进行探究。单一保护剂因其作用的局限性而不能满足保护的要求,通过正交试验,确定了副干酪乳杆菌冻干保护剂最佳配方为:脱脂奶粉15%,蔗糖20%,PVP K-30 7%,GSH 1.3%。单因素试验确定了副干酪乳杆菌真空冷冻干燥的工艺参数为:在15 ℃下预冷2 h,保护剂pH为6.5,菌液和保护剂的比例(v/v)为1∶1.5,冻干厚度为0.5 cm,预冻方式采用液氮(-196 ℃)冷冻15 min。在此条件下,副干酪乳杆菌经真空冷冻干燥后存活因子达(0.998±0.001),活菌数为(2.35±0.02)×1011CFU/g。通过扫描电镜观察发现,未添加保护剂的菌粉细胞表面褶皱破裂,造成细胞内容物泄露,而添加了复合保护剂的细胞经过真空冷冻干燥后,细胞仍保持完整结构,菌体结合相对疏松,有利于冻干菌粉复水。
