铁皮石斛花色苷稳定性及热降解动力学研究
2019-08-28马奕瑜陈静慧王洪新
马奕瑜,陈静慧,王洪新,2,*,陈 钎,张 敏
(1.江南大学食品学院,江苏无锡 214122;2.国家功能食品工程技术研究中心,江苏无锡 214122;3.无锡食品科技园石斛生物科技有限公司,江苏无锡 214122)
铁皮石斛(Dendrobiumofficinale)为兰科(Orchidadeae)石斛属(Dendrobium)多年生草本植物,主要存在于福建、安徽、浙江、广西、云南等地[1]。研究发现,铁皮石斛具有抗疲劳、抗肿瘤、提高免疫力、降血脂等功效[2]。随着研究日益深入,铁皮石斛制品也逐渐多样化,常见的有铁皮石斛枫斗、石斛颗粒、石斛茶及石斛酒等。然而,野生铁皮石斛因对生长条件要求严苛,人为采摘严重过度,致其数量骤减,因此,1987年正式将其列为国家二级保护植物。鉴于此,国内外学者开始关注铁皮石斛人工种植模式的研究,目前已有大棚栽培、树上仿野生栽培、岩壁仿野生栽培等模式[3]。研究发现在特定仿野生模式下栽培得到的铁皮石斛出现茎紫化现象,含有花色苷类物质[4-5]。
花色苷是一种水溶性的天然色素,广泛存在于花、果实、叶片中,一般由花青素通过糖苷键与一个或多个糖基结合而成[6]。花色苷易受化学结构、温度、pH、光照、氧气等影响,从而导致分子发生异构、聚合和降解,直接影响花色苷颜色[7]。目前,专家学者对铁皮石斛多糖、生物碱等展开了较为全面的研究,但花色苷方面的研究报道较少。在铁皮石斛产品实际加工过程中,花色苷的稳定性会受到产品成分、加工工艺等影响,如食品添加剂和热处理过程。因此铁皮石斛花色苷稳定性和热降解性质的研究,对铁皮石斛产品的品质评价及工业化生产具有重要意义。
本实验选用树上仿野生栽培铁皮石斛为原料,考察不同pH、温度、光照、H2O2、Na2SO3、甜味剂和防腐剂对其花色苷稳定性的影响,并且建立热降解动力学模型,为有效控制铁皮石斛深加工产品实际生产过程中的花色苷降解提供理论依据。
1 材料与方法
1.1 材料与仪器
铁皮石斛茎干条 由无锡食品科技园提供;盐酸、甲酸、氢氧化钠、无水乙醇、过氧化氢、亚硫酸钠、氯化钾、乙酸钠、蔗糖、葡萄糖、苯甲酸钠、山梨酸钾 国药集团化学试剂有限公司。
400Y多功能粉碎机 铂欧五金厂;AR224CN型电子天平、STARTER 3100型pH计 奥豪斯仪器(上海)有限公司;HH-4型恒温水浴锅 常州赛普实验仪器厂;BC-R501C型旋转蒸发器 上海贝凯生物化工设备有限公司;SHZ-DIII型循环水真空泵 上海羌强实业发展有限公司;SCIENTZ-10N型真空冷冻干燥机 宁波新芝生物科技有限公司;UV-2100型紫外分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 铁皮石斛花色苷冻干粉的制备 将铁皮石斛干粉以料液比1∶100 (m/V)加入70%乙醇(含0.1% HCl)溶液,4 ℃避光提取24 h,抽滤后于50 ℃减压浓缩得浓缩液。将浓缩液上样于经过预处理的AB-8型大孔树脂[8],用3倍柱体积0.5%甲酸溶液洗去多糖、蛋白质等杂质,再用3倍柱体积70%乙醇溶液(含1%甲酸)进一步洗脱,50 ℃减压浓缩,转入真空冷冻干燥机中冻干,得铁皮石斛花色苷粉末[9]。
1.2.2 pH对铁皮石斛花色苷稳定性的影响 配制1 mg/mL的铁皮石斛花色苷溶液,调节pH分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0,于50 ℃水浴进行避光热处理,每隔1 h取样,测定此时溶液中的花色苷残留率。
1.2.3 温度对铁皮石斛花色苷稳定性的影响 配制1 mg/mL的铁皮石斛花色苷溶液,调节pH分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0,分别在50、60、70、80、90 ℃水浴进行避光热处理,每隔1 h取样,测定此时溶液中的花色苷残留率。
1.2.4 光照对铁皮石斛花色苷稳定性的影响 配制pH为2.0、浓度为1 mg/mL的花色苷溶液,分别置于25 ℃的避光和自然光条件下,每隔2 d取样,测定此时溶液中的花色苷残留率。
1.2.5 氧化还原剂对铁皮石斛花色苷稳定性的影响 配制pH为2.0、浓度为1 mg/mL的花色苷溶液,分别向试管中加入H2O2,使其终浓度为0.0、0.5%、1.0%、1.5%、2.0%、3.0%,25 ℃避光静置75 min,每隔15 min取样,测定此时溶液中的花色苷残留率。
配制pH为2.0、浓度为1 mg/mL的花色苷溶液,分别向试管中加入Na2SO3,使其终浓度为0.00、0.05%、0.10%、0.15%、0.20%,25 ℃避光静置10 h,每隔2 h取样,测定此时溶液中的花色苷残留率。
1.2.6 糖和防腐剂对铁皮石斛花色苷稳定性的影响 配制pH为2.0、浓度为1 mg/mL的花色苷溶液,分别向试管中加入蔗糖和葡萄糖,使其终浓度为0、2%、4%、6%、8%、10%,25 ℃避光静置10 h,测定溶液中的花色苷残留率。
配制pH为2.0、浓度为1 mg/mL的花色苷溶液,分别向试管中加入山梨酸钾和苯甲酸钠,使其终浓度为0.00、0.01%、0.05%、0.10%、0.20%,25 ℃避光静置10 h,测定溶液中的花色苷残留率。
1.2.7 花色苷含量的测定 采用pH示差法[10]。取2组1 mL的花色苷溶液,分别加入9 mL pH1.0和pH4.5的缓冲溶液,避光反应50 min,于530和700 nm处测定吸光值。
1.2.8 花色苷残留率及热降解动力学参数的计算 花色苷的残留率根据式(1)计算。
式(1)
式中:C0为初始时刻溶液中的花色苷含量,mg/L;t为加热时间,h;Ct为在一定温度下加热t时后溶液中的花色苷含量,mg/L。
假定本实验中铁皮石斛花色苷的降解符合零级或一级动力学模型,根据式(2)(零级)和式(3)(一级)计算降解速率k[11-12],根据式(4)计算半衰期t1/2。
式(2)
式(3)
式(4)
反应活化能Ea根据Arrhenlus方程式(5)计算[13]。
式(5)
式中:Ea为活化能,kJ/mol;R为气体常数,R=8.314 J/mol·K;T为绝对温度,K;K0为频率因子,h-1。
花色苷的递减时间D值、温度系数Q10和Z值分别通过式(6)、(7)和(8)计算[14]。
式(6)
式(7)
T=-Zlgt1/2+b
式(8)
式中:k为T ℃下的降解速率,h-1;T为温度, ℃。
不同温度下的焓变ΔH、吉布斯自由能ΔG和熵ΔS分别通过方程(9)、(10)和(11)计算[15]。
ΔH=Ea-RT
式(9)
式(10)
式(11)
式中:Ea为活化能,kJ/mol;h为普朗克常数,h=6.6262×10-34J/s;kB为玻尔兹曼常数,kB=1.3806×10-23J/K;T为绝对温度,K;k为降解速率,h-1。
1.3 数据处理
实验数据采用SPSS 22.0分析软件进行ANOVA单因素方差分析及差异显著性分析,采用Origin 8.6软件进行线性回归分析及绘制图表。实验重复三次。
2 结果与分析
2.1 pH对铁皮石斛花色苷稳定性的影响
由图1可知,不同pH铁皮石斛花色苷经50 ℃热处理5 h,均出现了不同水平的降解。pH1.0~3.0的降解程度明显低于其他pH条件,其中,pH2.0的试样在50 ℃加热5 h后花色苷降解了3.67%,而pH8.0的试样降解了51.40%。原因可能为在pH<3.0时,花色苷主要存在形式为稳定的红色吡喃阳离子,而pH4.0~8.0时,主要存在形式为不稳定的无色甲醇假碱或查尔酮[16]。结果表明,铁皮石斛花色苷在酸性条件下较为稳定。
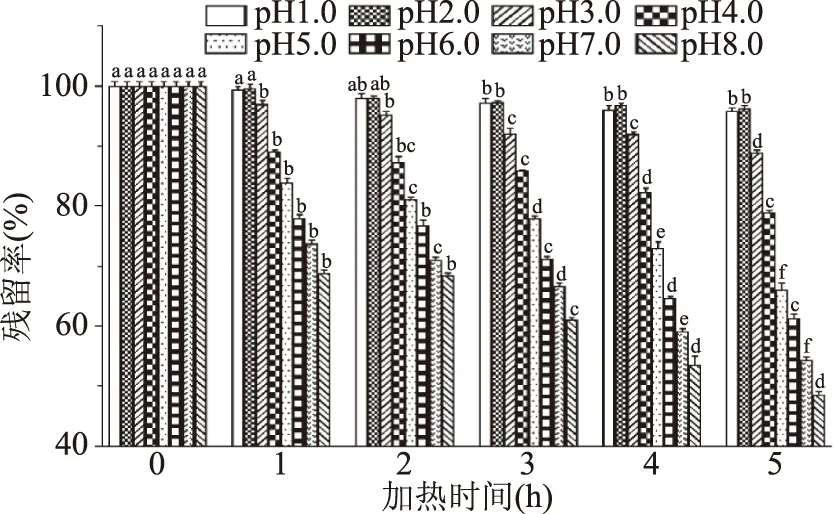
图1 pH对铁皮石斛花色苷稳定性的影响
2.2 温度对铁皮石斛花色苷稳定性的影响
从图2中可以看出,在不同pH体系下,铁皮石斛花色苷在不同温度下进行热处理5 h后均出现了不同水平的降解,且高温条件下降解更为严重。50 ℃加热5 h,pH1.0~8.0试样分别有95.95%、96.33%、88.94%、78.96%、66.13%、61.33%、54.32%、48.60%的花色苷残留。随着温度升高,90 ℃加热5 h,pH1.0~8.0试样仅有48.22%、40.51%、29.72%、24.43%、14.29%、11.22%、7.0%、3.67%的花色苷残留。这一结果与在红肉桃[17]、蓝莓[18]中花色苷的热稳定性研究相一致,即升温会使花色苷降解程度增大。由此可知,低温条件有利于维持铁皮石斛花色苷的稳定。
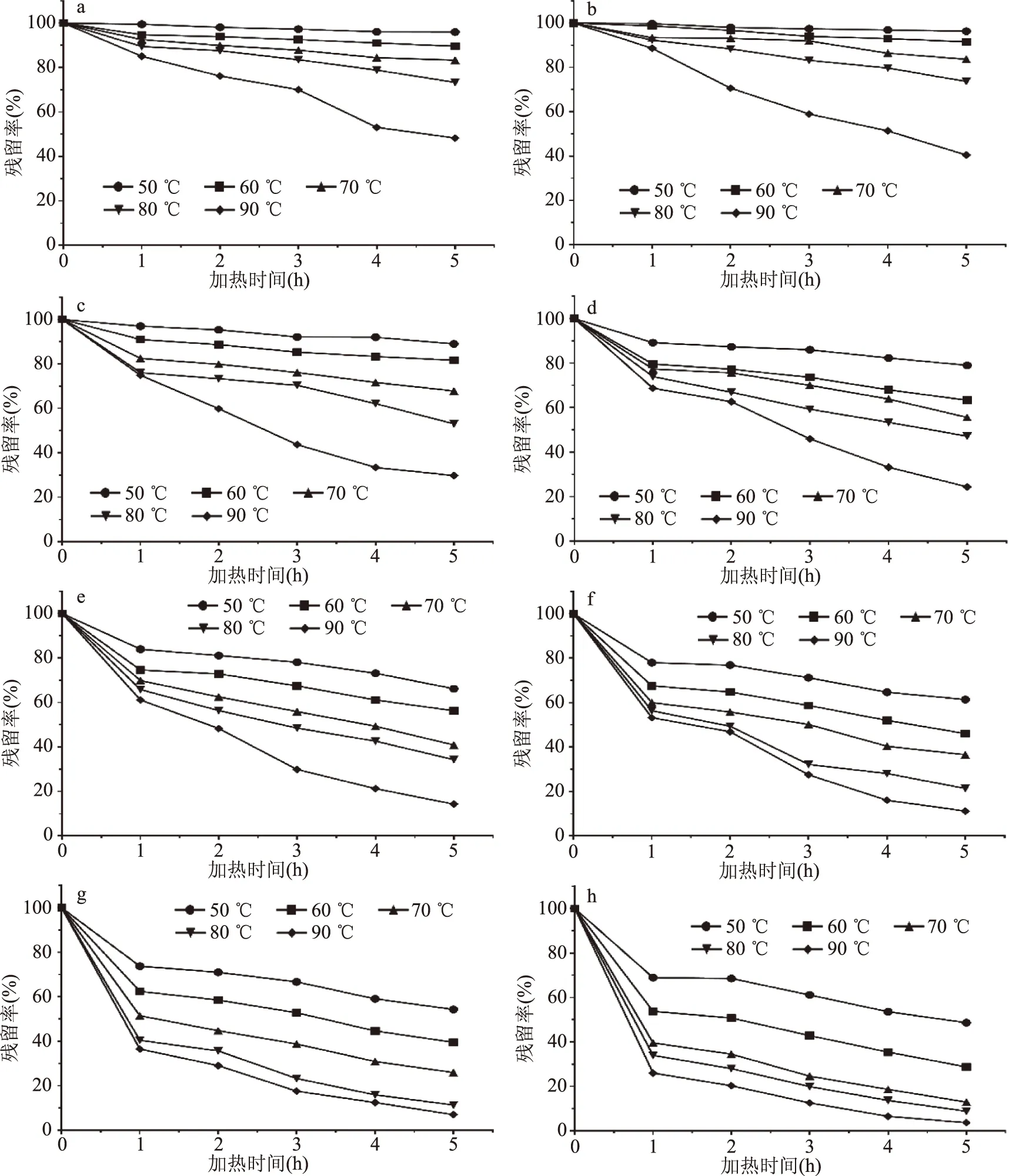
图2 温度对铁皮石斛花色苷稳定性的影响
2.3 不同pH和温度下铁皮石斛花色苷热降解动力学研究
假定本实验中铁皮石斛花色苷的降解与零级或一级动力学模型相符,在一定pH和温度条件下,比较降解速率常数k可以得知降解反应的快慢,比较决定系数R2以得知反应级数[19]。由表1可知,在不同pH体系下,铁皮石斛花色苷的热降解速率均随着温度的升高而增加,且铁皮石斛花色苷的降解在各个热处理温度下均与一级动力学反应模型相符(R2<0.9)。与不同来源如黑莓[11]、紫甘蓝[13]、马铃薯[20]等的花色苷降解动力学结果相似。
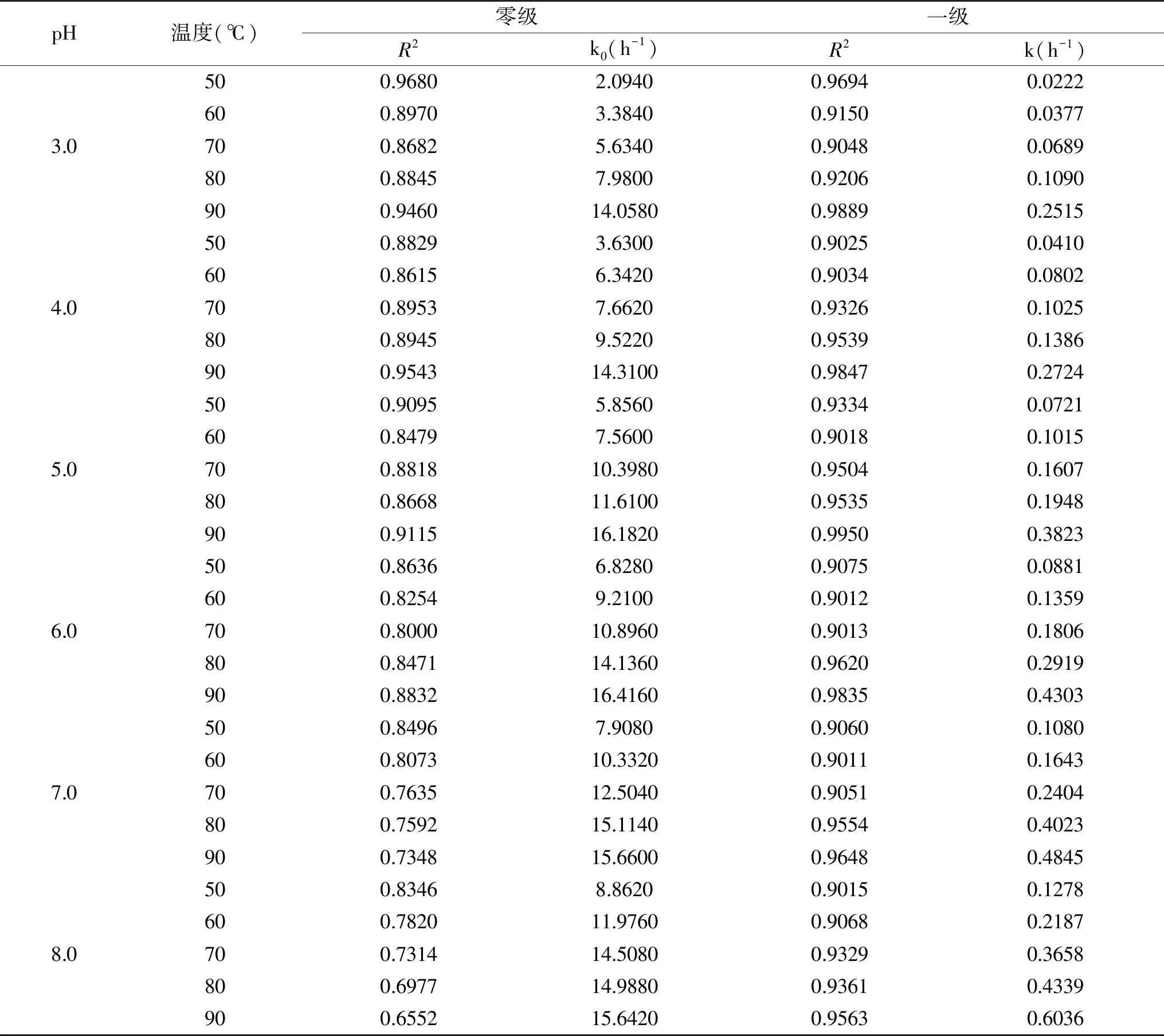
续表
由表2可知,在不同pH体系下,铁皮石斛花色苷热降解速率k均随温度的升高而增加,半衰期t1/2随之减小。pH1.0~8.0体系中,活化能Ea分别为64.54、71.66、57.55、42.25、38.79、38.35、38.09、37.17 kJ/mol,pH2.0时Ea最大,Z值最小,表明在此条件下热降解所需的能量最高,反应最难以进行。与本结果相似,蒋新龙[21]在黑米花色苷中研究发现,无论体系为较低酸度(pH4.5)或较高酸度(pH1.0),皆会加速花色苷热降解。此外,当pH为1.0~6.0时,Q10随温度升高而增加,表明与较低热处理条件相比,在高温情况下,加热温度每上升10 ℃,降解速率变化更快,而pH7.0和8.0的结果则相反,原因可能是当环境pH为中性或碱性时,花色苷的结构向另一种结构转变,引起热稳定性的改变[22]。
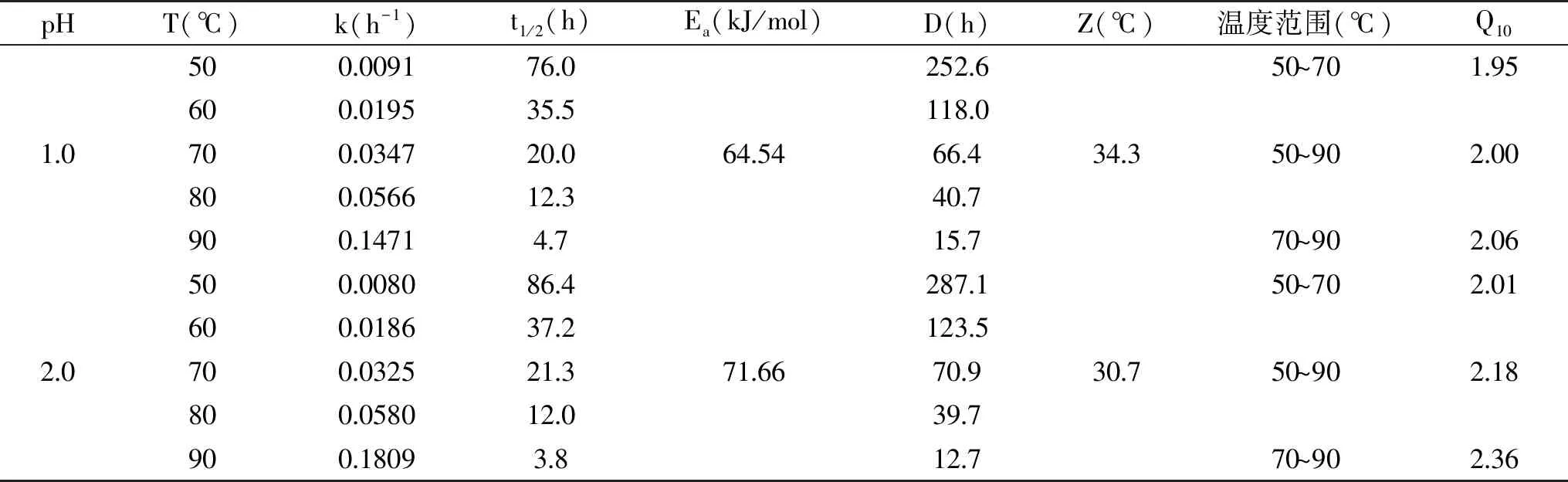
表2 不同pH花色苷溶液在50~90 ℃热处理条件下动力学参数
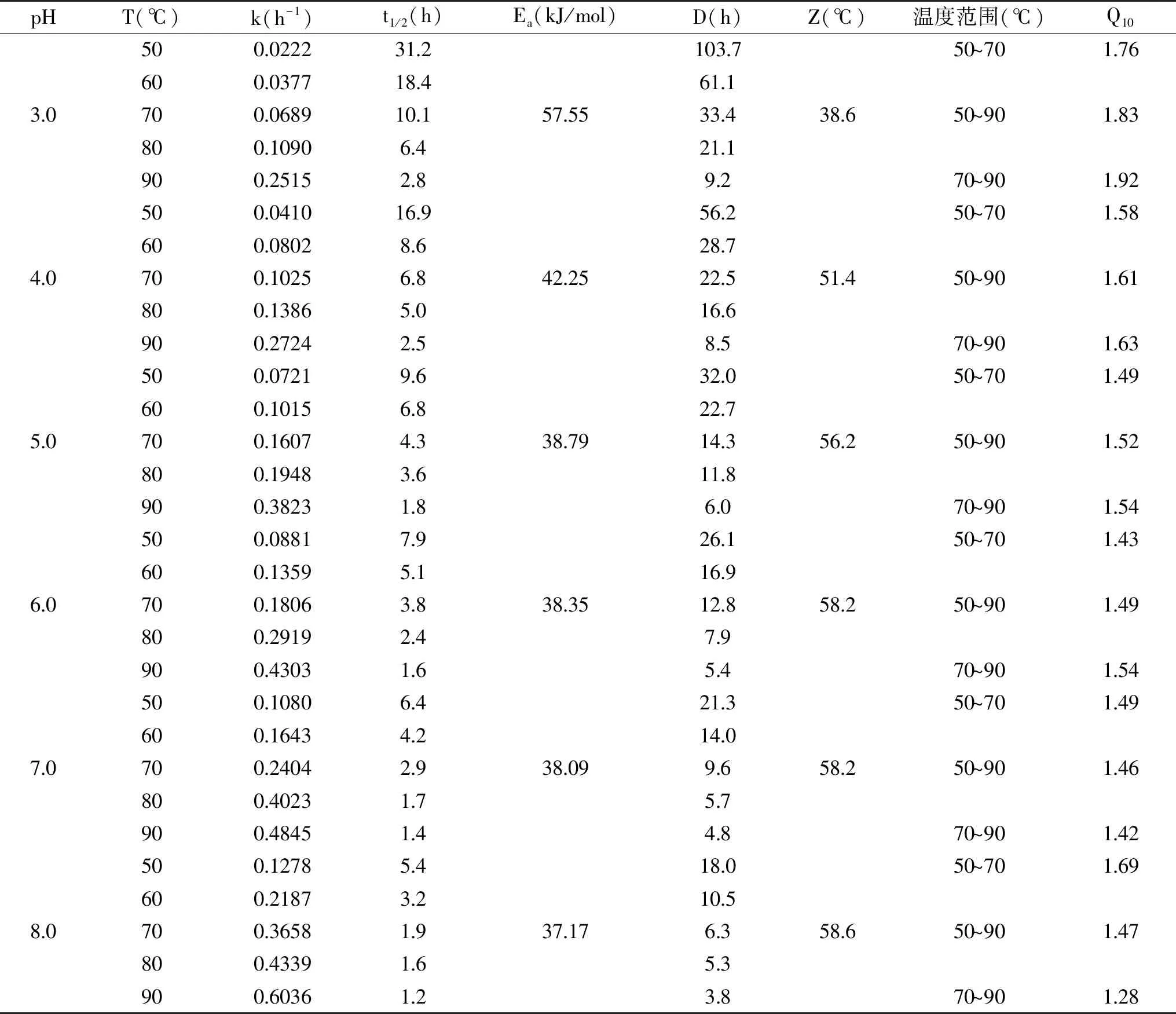
续表
ΔH为反应物和活化络合物之间的能量差[23]。由表3可知,在一定pH条件下,ΔH受温度变化影响较小,说明降解过程中的势垒大小与温度无关[14]。此外,ΔH均为正值,表明降解过程为吸热反应,反应温度越高,供应能量越多,越有利于活化络合物的形成。
ΔG为体系的自由能变化,可用于判断反应能否自发进行[15]。由表3可知,在一定pH条件下,ΔG均为正值,且受温度变化影响较小(95.89~107.68 kJ/mol),说明降解反应为非自发反应。
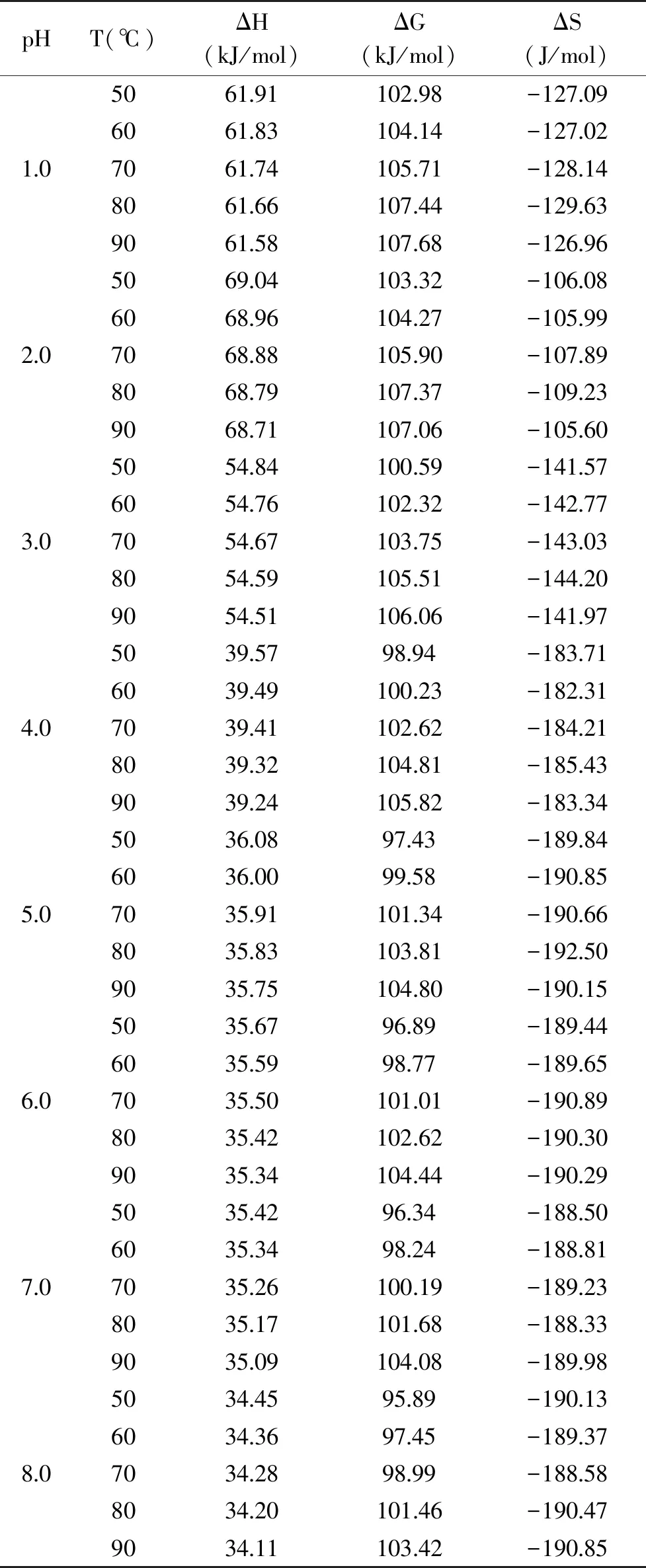
表3 不同pH花色苷溶液在50~90 ℃热处理条件下热力学参数
ΔS为体系的熵变化,体现了反应系统到其自身热力学平衡之间的距离。当pH条件固定不变时,ΔS受温度变化影响较小。pH8.0时ΔS的绝对值为188.58~190.85 J/mol,明显高于pH2.0时ΔS的绝对值105.60~109.23 J/mol,这表明铁皮石斛花色苷在pH2.0对温度较不敏感。当环境pH较低时,初始系统与其自身热力学平衡之间的距离较短,铁皮石斛花色苷发生降解的概率较低[24]。
2.4 光照对铁皮石斛花色苷稳定性的影响
由图3中可知,避光和自然光条件下的铁皮石斛花色苷均出现了不同水平的降解,且自然光下的降解程度明显高于避光条件。在避光和自然光条件下各自贮存20 d,花色苷残留率为77.14%和21.90%。光照强度加大,花色苷容易出现酰基脱落的情况,致使稳定性降低[18]。说明避光环境有利于铁皮石斛花色苷的稳定性,实际加工和储存过程中应防止阳光照射。
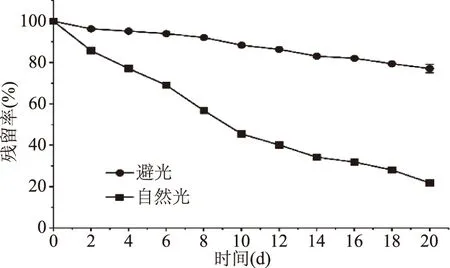
图3 光照对铁皮石斛花色苷稳定性的影响
2.5 氧化还原剂对铁皮石斛花色苷稳定性的影响
由图4可知,铁皮石斛花色苷在添加不同体积分数的H2O2后,均出现了较为严重的降解,且降解程度随着H2O2体积分数的增大而增大。经3.0% H2O2处理75 min后,花色苷残留率为7.20%。0.0~3.0% H2O2条件下花色苷降解速率k分别为0.0001、0.0156、0.0216、0.0240、0.0274、0.0317 min-1,半衰期t1/2分别为6931、44、32、29、25、22 min。这是因为H2O2会攻击花色苷的C位,吡喃阳离子遭受破坏,形成无色查尔酮物质,并进一步发生降解[25]。
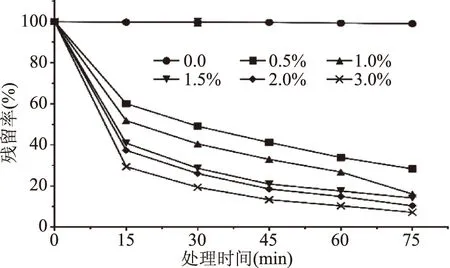
图4 H2O2浓度对铁皮石斛花色苷稳定性的影响
由图5可知,不同质量分数的Na2SO3对铁皮石斛花色苷的降解影响不同。室温避光处理10 h后,与空白组相比,0.20% Na2SO3组的花色苷残留率高出1.56%,而0.10%和0.15% Na2SO3组的花色苷残留率分别降低了5.35%和1.24%。这说明0.20% Na2SO3可延缓花色苷发生降解,而其他添加量的Na2SO3加快了降解速度。
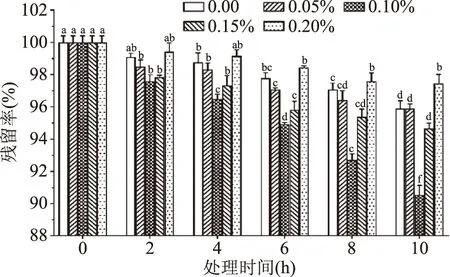
图5 Na2SO3浓度对铁皮石斛花色苷稳定性的影响
2.6 糖和防腐剂对铁皮石斛花色苷稳定性的影响
由图6可知,添加不同质量分数的蔗糖和葡萄糖,铁皮石斛花色苷均发生了不同水平的降解,且降解程度随着质量浓度的增大而增大。原因可能是蔗糖、葡萄糖等及其降解产物会导致花色苷降解,Daravingas等[26]研究发现葡萄糖、蔗糖等能以一样的方式加快花色苷降解,作为糖的典型降解产物,糠醛对花色苷的降解比羟甲基糠醛更重要。
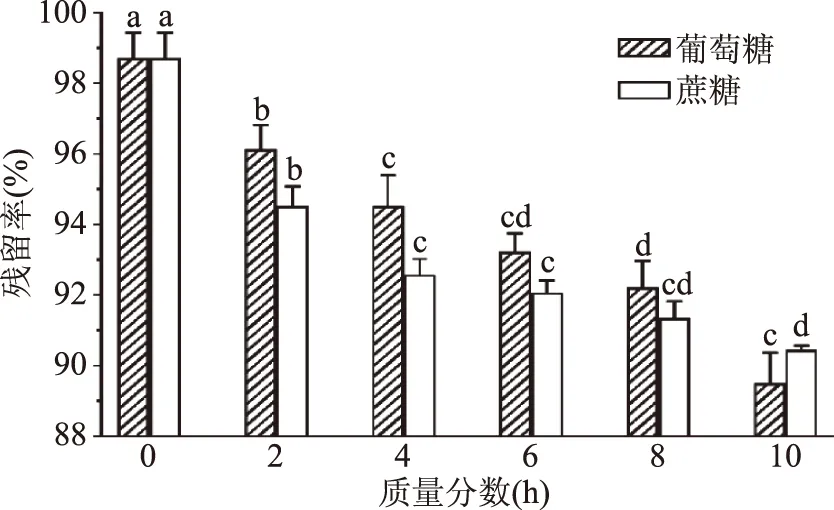
图6 蔗糖和葡萄糖对铁皮石斛花色苷稳定性的影响
由图7可知,铁皮石斛花色苷在添加不同质量分数的山梨酸钾和苯甲酸钠后,均出现不同水平的降解,降解程度随着质量分数的增大而增大,但两者对其影响差别不大。
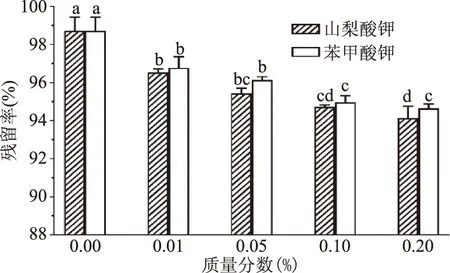
图7 山梨酸钾和苯甲酸钠对铁皮石斛花色苷稳定性的影响
3 结论
铁皮石斛花色苷的热稳定性受pH影响较大,酸性条件下热稳定性较强。花色苷的热降解与一级动力学模型相符,降解速率随温度上升而增大,半衰期则随之减小;在不同pH体系中,花色苷的活化能不同,pH8.0时活化能最小为37.17 kJ/mol,pH2.0时活化能最大为71.66 kJ/mol;通过热力学分析可知铁皮石斛花色苷的降解反应为吸热非自发反应。铁皮石斛花色苷对光照较为敏感,自然光条件条件会加速花色苷降解。H2O2促进铁皮石斛花色苷的降解,降解速率随H2O2体积分数的增加而增加。不同质量分数的Na2SO3对花色苷降解的影响不同,经0.2% Na2SO3处理后残留率升高了1.56%,而添加0.10%、0.15% Na2SO3的花色苷残留率降低。葡萄糖、蔗糖和防腐剂山梨酸钾、苯甲酸钠均会加快花色苷降解。建议铁皮石斛深加工产品在实际加工、生产及贮藏过程中,控制pH为酸性,尽可能使用破坏性较小的辅料或食品添加剂,且于低温和避光环境下进行贮藏。
