氯咪巴唑在鱼体的富集和代谢动力学
2019-08-28马艳芳周漪波窦文渊贾雨薇赵建亮应光国
姚 理,马艳芳,周漪波,窦文渊,贾雨薇,赵建亮*,应光国
氯咪巴唑在鱼体的富集和代谢动力学
姚 理1,3,马艳芳1,周漪波1,窦文渊1,贾雨薇2,赵建亮2*,应光国2
(1.中国广州分析测试中心,广东省化学危害应急检测技术重点实验室,广东 广州 510070;2.华南师范大学环境研究院,广东省化学品污染与环境安全重点实验室,广东 广州 510006;3.中国科学院广州地球化学研究所,广东 广州 510640)
选取中国南方地区典型生物尼罗罗非鱼作为受试生物,将其置于氯咪巴唑含量为2.00ng/mL的水体中暴露7d,考察氯咪巴唑在罗非鱼体内不同部位(鳃、肝脏、胆汁和血浆)的吸收和清除动力学过程,比较了氯咪巴唑在鱼体内不同部位的吸收和清除动力学速率.罗非鱼暴露于氯咪巴唑水溶液3d后,鱼体鳃、肝脏、胆汁和血浆中的氯咪巴唑达到最高浓度,分别为2.91ng/g,33.7ng/g,4.84ng/mL和2.58ng/mL;结束暴露3d后,氯咪巴唑在鳃、胆汁和血浆中的稳定浓度低于方法检测限,在肝脏中的稳定浓度为1.28ng/g.鱼体鳃、肝脏、胆汁和血浆中氯咪巴唑的吸收动力学常数u分别为0.069,0.813,0.286和0.136h-1;清除动力学常数e分别为0.033,0.029,0.082和0.060h-1;半衰期1/2分别为21.1,23.9,8.51和11.6h.氯咪巴唑在罗非鱼体内的吸收/清除动力学过程均符合伪一级动力学方程,方程的相关系数2范围为0.75~0.98.氯咪巴唑在鱼体鳃、肝脏、胆汁和血浆中的稳态生物富集系数对数值logBCFss分别为0.50,1.56,0.72和0.45,低于氯咪巴唑在野生罗非鱼体内的富集系数.
氯咪巴唑;吸收动力学;清除动力学;生物富集
氯咪巴唑是一种典型的唑类杀真菌剂,其主要通过非竞争性阻断酶中羊毛甾醇14-去甲基化酶(也称为真菌)的合成,从而抑制等离子体真菌细胞膜的重要组成部分麦角固醇的生物合成,使真菌细胞死亡[1-2].氯咪巴唑作为抑菌剂和抗头皮屑的活性成分普遍添加到洗发水等个人护理品中[3-4].据调查,含氯咪巴唑的洗发水在中国和欧洲各国均广泛销售[5],氯咪巴唑在中国的年使用量为3800t[6].统计表明,氯咪巴唑在普通洗发水中的含量最高可达2.0%,其质量浓度大约为15mg/mL[7].洗发水使用以后,其中的氯咪巴唑大部分随家用生活废水进入城市污水处理系统[8].但是,目前各污水处理厂常用的污水处理工艺并不能将氯咪巴唑完全去除,其水相去除率仅为34%~76%[9],未被完全去除的氯咪巴唑随污水处理厂出水重新进入受纳水环境[10].
进入环境后,氯咪巴唑对各级水生生物均存在不同程度的毒性效应,其生态毒性逐渐引起关注[11-12].氯咪巴唑对绿藻()、浮萍()、大型蚤()、斑马鱼胚胎()等均存在生长或行为抑制效应,其中对绿藻的半数生长抑制效应浓度(EC50)低至0.087μg/ mL[7,11].氯咪巴唑的持续排放对水生生态系统构成威胁.目前有关氯咪巴唑在生物体内的含量水平及富集潜力研究较少,前期少量调查研究表明,氯咪巴唑能在珠江流域和长江流域野生鱼体肌肉和肝脏中富集,最高检出浓度可达358ng/g[13].实验室内关于氯咪巴唑的研究主要集中在其生物毒性效应评价及微生物降解能力方面[11,14-15],缺乏氯咪巴唑在生物体内的代谢转化机制研究.
本文研究了环境相关暴露浓度下,氯咪巴唑在我国常见生物尼罗罗非鱼()鳃、肝脏、胆汁和血浆中的吸收、清除动力学过程及稳态富集水平.旨在为氯咪巴唑的生态风险及人体健康风险评价提供理论支持,为氯咪巴唑的环境管理工作提供科学依据.
1 材料和方法
1.1 仪器和试剂
安捷伦1200系列高效液相色谱-6460系列三重四级杆串联质谱联用仪(UPLC-MS/MS,美国安捷伦公司);MGS-2200系列平行氮吹仪(日本EYELA公司).氯咪巴唑标准品和同位素内标抑霉唑-D5从Dr.Ehrenstorfer公司(德国)购买,其纯度均大于95%.色谱纯甲醇、乙腈、二甲基亚砜从Merck公司(德国)购买.分析纯肝素钠、三卡因甲基磺酸盐、乙酸、乙酸钠、乙酸铵和甲酸从CNW公司(德国)购买.Captiva蛋白质/磷脂吸附管、QuEChERS盐析试剂盒(无水乙酸钠+无水硫酸镁)和分散固相萃取试剂盒(无水硫酸镁+-丙基乙二胺PAS+C18)从Agilent公司(美国)购买,实验用水为超纯水.
1.2 实验设计
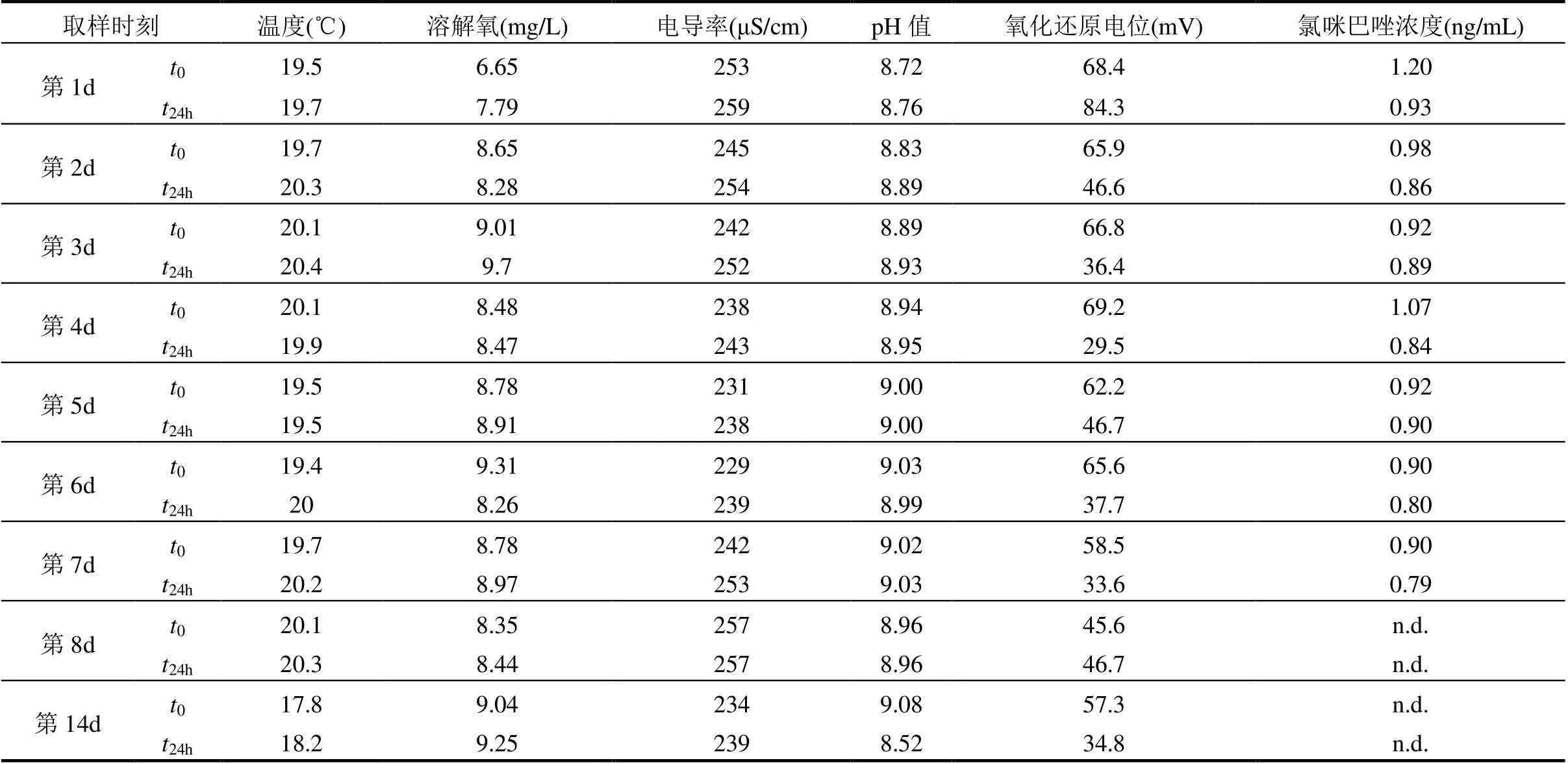
表1 暴露组溶液水质参数及氯咪巴唑的浓度
注:0为实验过程中,每天换水后5min内测量值;24h为实验过程中,每天换水后24h测量值; n.d.表示未检出.
选取5个月龄左右的尼罗罗非鱼()作为受试生物.从南方某渔业公司获得受试生物后,曝气运回实验室,置于100L干净的塑料桶中驯养至少4周,然后用于暴露试验.驯养过程中,每天投放个体质量1.0%的基础营养饲料喂养受试生物,观察并记录进食情况、死亡率、异常行为、鱼肤色等指标.结束驯养后,选择进食正常,状态活泼的罗非鱼用于暴露实验,研究鱼体内氯咪巴唑的吸收和清除动力学过程.暴露容器为180L的透明玻璃鱼缸,暴露溶液为预曝气脱氯的纯净水,暴露溶液体积为150L,每缸投放罗非鱼数量为25条.吸收和清除动力学试验周期为14d,分为7d吸收期和7d清除期.试验周期内持续适量曝氧,温度控制在(26±1)℃,光暗周期保持为14h:10h.投食后,每隔12h清理一次缸内粪便以保持水质清洁,实验过程中记录的相关水质参数如表1所示.

表2 代谢动力学试验所用鱼样品信息
注: 肝重和鳃重表示用于提取的样品重量.
7d吸收期实验中,氯咪巴唑的理论暴露浓度设为2.00ng/mL,暴露开始的0h时刻,取2条未染药的罗非鱼作为初始时刻样品.然后,将600μL浓度为500μg/mL的氯咪巴唑标准溶液(溶剂为二甲基亚砜DMSO)溶于1L洁净的超纯水中,充分溶解后,缓慢均匀加入150L鱼缸中开始暴露.以后的6d吸收期实验中,每24h换水75L,再补加300μL浓度为500μg/mL的氯咪巴唑标准溶液(溶于1L干净纯净水),直至7d吸收期结束.7d吸收期实验结束后,将鱼缸内的受试生物全部转移到不含氯咪巴唑的150L干净水体中,开始7d清除期试验,7d清除期内,每24h换水75L.在14d的吸收动力学和清除动力学试验过程中,于试验过程中的第1,3,5,7,8,10,12和14d取样2条(2个平行),立即通过三卡因甲基磺酸盐进行麻醉,称重,量体长,并尽快解剖取组织,所用样品基本信息如表2所示.
1.3 样品前处理和仪器分析
前处理:根据前期建立的组织提取方法,鳃和肝脏采用QuEChERS方法提取[16];胆汁和血浆采用溶剂沉淀,并通过吸附管去除蛋白质/磷脂质,其中,胆汁通过分散固相萃取进一步净化[17].取一份鳃或肝脏样品,依次加入40ng内标,5mL超纯水和两颗陶瓷匀浆子涡旋30s.然后加入10mL乙腈(含1%乙酸)和盐析试剂,立即用手剧烈摇晃1min.3500r/min离心10min后,取7mL上层有机相采用分散固相萃取试剂进行净化.3500r/min离心10min后,取5mL净化液通过氮气吹至近干,采用200μL甲醇/水(:=1:1)溶液定容.取50μL血浆或50μL胆汁,依次加入40ng内标和500μL乙腈(含1%乙酸),涡旋混合30s.将混合液加入Captiva蛋白质/磷脂吸附管,加载压力25~50kPa过滤,收集滤液.继续加入200μL乙腈(含1%乙酸)润洗管壁,收集并合并滤液.随后,血浆滤液直接通过氮气吹至近干,采用200μL甲醇/水(:=1:1)溶液定容;胆汁滤液加入乙腈(含1%乙酸)稀释至6mL,随后采用分散固相萃取试剂净化.3500r/min离心10min,取3mL净化液通过氮气吹至近干,采用200μL甲醇/水(:=1:1)溶液定容.水体中的氯咪巴唑萃取过程:取2mL暴露水溶液,依次采用3mL正己烷溶液萃取3次,合并萃取液,通过氮气吹至近干,采用200μL甲醇/水(:=1:1)溶液定容.
仪器分析:生物提取液和水溶液中的氯咪巴唑采用UPLC-MS/MS在电喷雾离子源正离子模式下进行分析,利用安捷伦SB-C18柱(3.0×100mm,1.8μm)进行液相色谱分离,进样体积5μL,流动相为含0.05%甲酸和5mmol/L乙酸铵的水溶液(A)和甲醇(B),梯度洗脱程序为: 0min时刻50% B;5min时刻80% B;6.5min时刻90% B,并保持5min,分析单个样品总时长11.5min.流动相流速0.3mL/min,色谱柱温度保持40℃.离子源参数为:毛细管电压4500V,喷雾电压500V,喷雾气体温度250℃,氯咪巴唑在多反应离子监测模式(MRM)下的碎裂电压为115V,定量离子对为293.1>69.1,对应的离子碰撞能量为20eV,定性离子对为293.1>41.1,对应的离子碰撞能量为44eV.
1.4 质量控制与保证
生物提取液和水溶液中氯咪巴唑的浓度通过内标法进行定性和定量分析,采用抑霉唑-D5作为同位素标记内标.配制目标物氯咪巴唑浓度分别为0.1ng/mL,0.5ng/mL,1ng/mL,2ng/mL,5ng/mL,10ng/mL,20ng/mL,50ng/mL,100ng/mL,内标抑霉唑-D5浓度均为20ng/mL的标准曲线溶液,标准曲线相关系数2大于0.998.每批样品分析过程中均同时设置空白加标、程序空白和溶剂空白,用于评价仪器状态并检查携带污染和背景空白.空白加标中氯咪巴唑的回收率为86%~113%.采用前期建立的提取方法,氯咪巴唑在鱼体鳃、肝脏、胆汁和血浆中的最低检测限MQLs分别为0.3,1.16,0.8和0.76ng/g.数据分析过程中,通过保留时间偏差£5%,离子比例偏差£20%作为定性分析的依据.
1.5 数据分析
1.5.1 动力学参数 采用Sigma plot软件,以吸收期、清除期的采样时间点为横坐标,以各采样时间点氯咪巴唑在鱼体内不同部位的浓度为纵坐标作图,得到鱼体内不同部位中氯咪巴唑的浓度随实验时刻的变化曲线.根据经典的伪一级动力学模型对曲线进行拟合[18],获得鱼体内不同部位对氯咪巴唑的吸收、清除动力学方程.根据动力学方程的相关系数,计算得到氯咪巴唑在鱼体内不同部位的吸收动力学常数u、清除动力学常数e和清除半衰期1/2[19-20].其中,u、e和1/2分别通过以下公式进行计算:


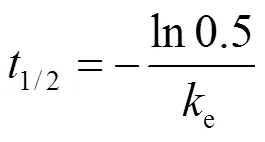
式中:w为暴露水体中氯咪巴唑的浓度,单位为ng/mL;c和0分别为时刻和清除期实验开始时氯咪巴唑在鱼体内不同部位中的浓度: 鳃、肝脏中氯咪巴唑的浓度单位为ng/g,胆汁、血浆中氯咪巴唑的浓度单位为ng/mL;为暴露时间,h;u和e单位为h-1;1/2为氯咪巴唑在鱼体内不同部位的半衰期,h.
1.5.2 生物富集系数 采用OECD推荐的计算方法[21],根据氯咪巴唑在鱼体内的吸收和清除动力学方程,可以计算获得氯咪巴唑在鱼体内的动力学生物富集系数BCFK和稳态生物富集系数BCFss,其中BCFK和BCFss分别通过以下公式进行计算:


式中:u和e为根据式(1)~(3)计算得到的氯咪巴唑在鱼体内的吸收动力学常数和清除动力学常数, h-1;f为氯咪巴唑在鱼体鳃、肝脏、胆汁和血浆中的稳定浓度,ng/g或ng/mL;w为氯咪巴唑在暴露水体中的实测稳定浓度,ng/mL.
氯咪巴唑在鱼体内不同部位的浓度数据采用安捷伦Muss Hunter软件进行采集和计算,数据结果采用Excel软件进行分析.动力学方程参数采用Sigma Plot软件进行非线性曲线拟合,通过判定系数2来评价动力学模型的拟合优度.动力学曲线图采用Origin软件进行绘制.
2 结果与讨论
2.1 氯咪巴唑的吸收动力学特征
如图1所示,吸收期的第72h(即第3d),氯咪巴唑在鱼体内中的浓度达到最大值;吸收期的第72h~168h暴露结束(即第7d),氯咪巴唑在鱼体内的浓度保持稳定.氯咪巴唑在鳃和肝脏、胆汁和血浆中的稳定浓度分别为2.91和33.7ng/g、4.84和2.58ng/mL.根据曲线非线性拟合结果,氯咪巴唑在鱼体鳃、肝脏、胆汁和血浆中的吸收动力学过程均符合伪一级动力学方程,方程拟合结果的相关系数2分别为0.75,0.83,0.90和0.96.氯咪巴唑在罗非鱼体内的吸收动力学方程如表3所示,通过方程参数可以获得氯咪巴唑在罗非鱼鳃、肝脏、胆汁和血浆中的吸收动力学常数u分别为0.069,0.813, 0.286和0.136h-1.比较可知:氯咪巴唑在肝脏中u最高,相比鳃中的u高一个数量级,相比胆汁和血浆分别高2倍和5倍,说明相比其他部位,罗非鱼肝脏更容易吸收氯咪巴唑.前期研究指出,水体中羟基安定、美索巴莫、四溴双酚A在鱼体肝脏中的浓度和吸收速率也高于脑、胆汁、鳃、肌肉等部位,这可能是由于肝脏作为解毒器官,更容易吸收外源性污染物[20,22].
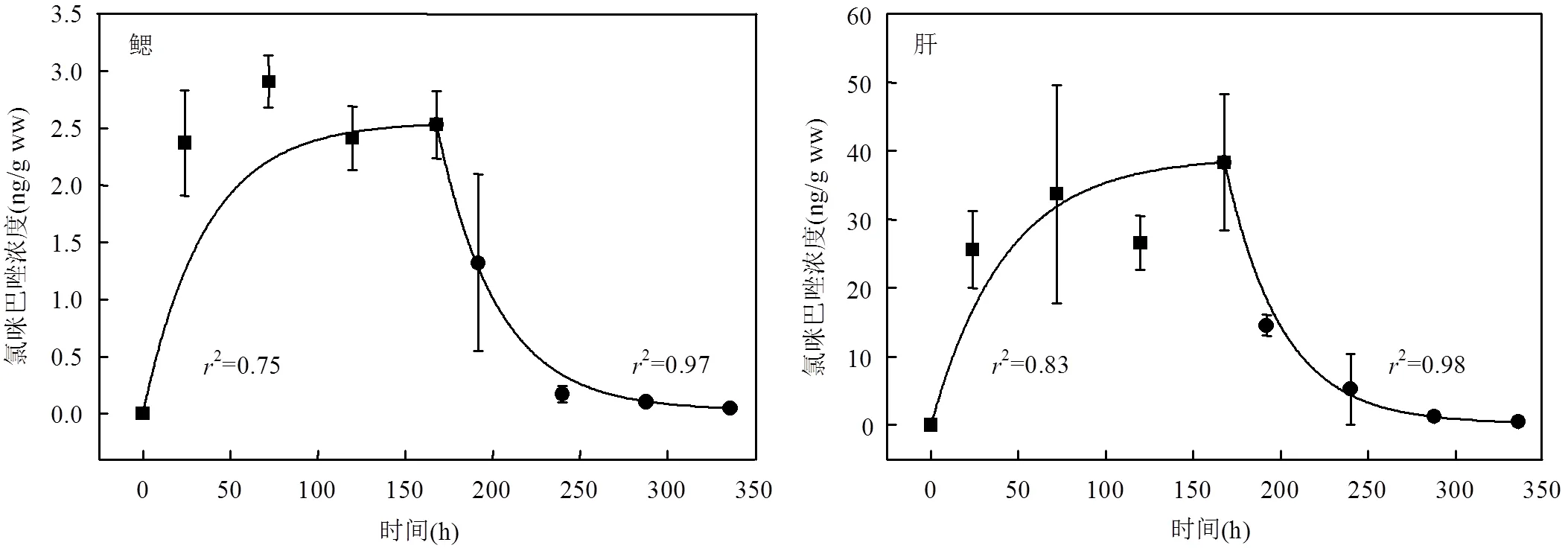
2.2 氯咪巴唑的清除动力学特征
如图1所示,清除期的第72h(即第3d),氯咪巴唑在鱼体内中的浓度达到最低值;清除期的第72h~ 168h实验结束(即第7d),氯咪巴唑在鱼体内的浓度保持稳定.氯咪巴唑在鳃、肝脏、胆汁和血浆中的稳定浓度分别为0.10ng/g ( 表3 氯咪巴唑的吸收和清除动力学拟合方程 与氯咪巴唑不同的是,羟基安定和美索巴莫在鱼体肝脏中的1/2分别为18.1和47.5h;羟基安定和美索巴莫在鱼体胆汁中的1/2分别为72.2和84.5h,鱼体肝脏代谢是羟基安定和美索巴莫的主要代谢途径[20].说明外源性小分子污染物在鱼体内的代谢机制存在差异,这可能与污染物本身的性质有关,有待进一步研究. 根据OECD推荐的方法,计算获得氯咪巴唑在罗非鱼鳃、肝脏、胆汁和血浆中的动力学生物富集系数对数值logBCFK分别为0.32,1.45,0.54和0.36;根据表1中氯咪巴唑在暴露水体中的浓度,计算获得7d吸收动力学实验过程中,氯咪巴唑在暴露水体中的平均浓度为0.92ng/mL.从而计算获得氯咪巴唑在罗非鱼鳃、肝脏、胆汁和血浆中的稳态生物富集系数对数值logBCFss分别为0.50,1.56,0.72和0.45.氯咪巴唑在鱼体鳃、肝脏、胆汁和血浆中的动力学生物富集系数logBCFK和稳态生物富集系数logBCFss比较接近.说明7d吸收动力学实验过程中,氯咪巴唑在鱼体内已经达到吸收/清除动力学平衡[21].比较可知,氯咪巴唑在肝脏中的生物富集水平较高,在鳃和血浆中的生物富集水平较低.根据前期的调查结果,氯咪巴唑在长江、珠江流域野生罗非鱼肝脏中的生物富集系数对数值logBAF平均值为2.42[13].比较而言,实验室暴露条件下氯咪巴唑在罗非鱼体内的生物富集水平低于野外暴露添加下罗非鱼体内的生物富集水平.这可能是由于氯咪巴唑在地表水、藻类中均存在污染[24],野生鱼类分别通过捕食低等水生动植物被动摄取,以及鳃呼吸主动吸收这两种途径,同时从食物和地表水中摄入氯咪巴唑[25].由于氯咪巴唑不断排入受纳环境,导致氯咪巴唑在环境中持续存在,并不断被野生鱼类摄入,而生物体对污染物的清除速率有限,导致氯咪巴唑在鱼体内不断累积,最终导致野外调查获得的logBAF高于实验室单一水体暴露时鱼体内氯咪巴唑的logBCFss. 3.1 氯咪巴唑在罗非鱼鳃、肝脏、胆汁和血浆4种组织中的吸收和清除动力学过程均符合伪一级动力学方程.鱼体肝脏吸收氯咪巴唑的速率远高于鳃,胆汁的肝肠循环是氯咪巴唑的重要代谢途径. 3.2 罗非鱼在浓度为2ng/mL的氯咪巴唑水体中暴露3d后,氯咪巴唑在各组织部位的稳定浓度顺序为肝脏>胆汁>鳃、血浆.结束暴露3d后,氯咪巴唑在鳃、胆汁和血浆中的稳定浓度已 3.3 氯咪巴唑在鱼体内不同部位的富集能力存在差异,较易在肝脏中富集,在鳃和血浆中的富集水平较低.实验室暴露条件下氯咪巴唑在罗非鱼体内的生物富集水平低于野外暴露添加下罗非鱼体内的生物富集水平. [1] Zarn J A, Bruschweiler B J, Schlatter J R, et al. Azole fungicides affect mammalian steroidogenesis by inhibiting sterol 14alpha-demethylase and aromatase [J]. Environmental health perspectives, 2003,111(3): 255-261. [2] Pople J E, Moore A E, Talbot D C. S, et al. Climbazole increases expression of cornified envelope proteins in primary keratinocytes [J]. International Journal of Cosmetic Science, 2014,36(5):419-426. [3] Schwartz J R, Bacon R A, Shah R, et al. Therapeutic efficacy of anti- dandruff shampoos: a randomized clinical trial comparing products based on potentiated zinc pyrithione and zinc pyrithione/climbazole [J]. International Journal of Cosmetic Science, 2013,35(4):381-387. [4] Turner G A, Matheson J R, Li G Z,et al. Enhanced efficacy and sensory properties of an anti-dandruff shampoo containing zinc pyrithione and climbazole [J]. International Journal of Cosmetic Science, 2013,35(1):78-83. [5] Perez-Rivera A A, Hu T, Aardema M J, et al. Evaluation of the genotoxicity of the imidazole antifungal climbazole: comparison to published results for other azole compounds [J]. Mutation Research/ Genetic Toxicology and Environmental Mutagenesis, 2009,672(1):27- 39. [6] Gouin T, Van-Egmond R, Price O R, et al. Prioritising chemicals used in personal care products in China for environmental risk assessment: application of the RAIDAR model [J]. Environmental Pollution, 2012,165:208-214. [7] SCCP (Scientific Committee on Consumer Products), Opinion on climbazole 2009: http://eceuropaeu/health/ph_risk/committees/04_ sccp/docs/sccp_o_164pdf. [8] Chen Z F, Ying G G. Occurrence, fate and ecological risk of five typical azole fungicides as therapeutic and personal care products in the environment: A review [J]. Environment International, 2015,84: 142-153. [9] Liu W R, Yang Y Y, Liu Y S, et al. Biocides in wastewater treatment plants: mass balance analysis and pollution load estimation [J]. Journal of Hazardous Materials, 2017,329:310-320. [10] Zhang Q Q, Ying G G, Chen Z F, et al. Multimedia fate modeling and risk assessment of a commonly used azole fungicide climbazole at the river basin scale in China [J]. Science of the Total Environment, 2015, 520:39-48. [11] Richter E, Wick A, Ternes T A, et al. Ecotoxicity of climbazole, a fungicide contained in antidandruff shampoo [J]. Environmental Toxicology and Chemistry, 2013,32(12):2816-2825. [12] Westlund P, Nasuhoglu D, Isazadeh S, et al. Investigation of acute and chronic toxicity trends of pesticides using high-throughput bioluminescence assay based on the test organism vibrio fischeri [J]. Archives of Environmental Contamination and Toxicology, 2018,74(4): 557-567. [13] Yao L, Zhao J L, Liu Y S, et al. Personal care products in wild fish in two main Chinese rivers: Bioaccumulation potential and human health risks [J]. Science of The Total Environment, 2018,621:1093-1102. [14] Richter E, Roller E, Kunkel U, et al. Phytotoxicity of wastewater-born micropollutants –characterisation of three antimycotics and a cationic surfactant [J]. Environmental Pollution, 2016,208:512-522. [15] Brienza M, Chiron S. Enantioselective reductive transformation of climbazole: a concept towards quantitative biodegradation assessment in anaerobic biological treatment processes [J]. Water Research 2017,116:203-210. [16] Yao L, Zhao J L, Liu Y S, et al. Simultaneous determination of 24personal care products in fish muscle and liver tissues using QuEChERS extraction coupled with ultra pressure liquid chromatography-tandem mass spectrometry and gas chromatography- mass spectrometer analyses [J]. Analytical and Bioanalytical Chemistry, 2016,408(28):8177-8193. [17] Yao L, Lv Y Z, Zhang L J, et al. Determination of 24personal care products in fish bile using hybrid solvent precipitation and dispersive solid phase extraction cleanup with ultrahigh performance liquid chromatography-tandem mass spectrometry and gas chromatography- mass spectrometry [J]. Journal of Chromatography A, 2018,1551: 29-40. [18] Landrum P F, Lydy M J, Lee H. Toxicokinetics in aquatic systems: model comparisons and use in hazard assessment [J]. Environmental Toxicology and Chemistry, 1992,11(12):1709-1725. [19] Kobayashi J, Kinoshita K, Mizukawa K, et al. Dietary uptake kinetics of polychlorinated biphenyls from sediment-contaminated sandworms in a marine benthic fish () [J]. Chemosphere, 2011,82(5):745-750. [20] Zhao J L, Furlong E T, Schoenfuss H L, et al. Uptake and disposition of select pharmaceuticals by bluegill exposed at constant concentrations in a flow-through aquatic exposure system [J]. Environmental Science & Technology, 2017,51(8):4434-4444. [21] OECD (Organization for Economic Cooperation and Development). Bioaccumulation in fish: aqueous and dietary exposure OECD, Paris, 2012 http://wwwoecdorg/chemicalsafety/testing/49190738pdf. [22] 杨苏文,徐范范,赵明东.四溴双酚A在鲫鱼不同器官中的分布、富集及病理研究 [J]. 中国环境科学, 2013,33(4):741-747. Yang S W, Xu F F, Zhao M D. Distribution and bioaccumulation of tetrabromobisphenol A intissues and its pathological effect [J]. China Environmental Science, 2013,33(4):741- 747. [23] Trauner M, Boyer J L. Bile salt transporters: molecular characterization, function, and regulation [J]. Physiological Reviews, 2003,83(2):633-671. [24] Pan C G, Peng F J, Ying G G. Removal, biotransformation and toxicity variations of climbazole by freshwater algae[J]. Environmental Pollution, 2018,240:534-540. [25] Tanoue R, Nomiyama K, Nakamura H, et al. Uptake and tissue distribution of pharmaceuticals and personal care products in wild fish from treated-wastewater-impacted streams [J]. Environmental Science & Technology, 2015,49(19):11649-11658. The bioaccumulation and metabolic kinetics of climbazole in fish. YAO Li1,3, MA Yan-fang1, ZHOU Yi-bo1, DOU Wen-yuan1, JIA Yu-wei2, ZHAO Jian-liang2*, YING Guang-guo2 (1.Guangdong Provincial Key Laboratory of Emergency Test for Dangerous Chemical, China National Analytical Center (Guangzhou), Guangzhou 510070, China;2.Guangdong Provincial Key Laboratory of Chemical Pollution and Environmental Safety, the Environmental Research Institute, South China Normal University, Guangzhou 510006, China;3.Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China)., 2019,39(8):3501~3507 We used a typical fish species in South China, tilapia, to investigate the uptake and elimination kinetics of climbazole in fish gill, liver, bile and plasma following a 7-d exposure to aqueous solution of climbazole at the concentration of 2.00ng/mL. We also compared the uptake and elimination rates of climbazole in fish tissues. In the uptake process, the climbazole concentration reached the maximum after 3days of exposure, at which point the concentration in fish gill, liver, bile and plasma were up to 2.91ng/g, 33.7ng/g, 4.84ng/mL and 2.58ng/mL, respectively. In the elimination process, the climbazole was nearly eliminated in fish after 3days, with the climbazole concentrations lower than MQLs in fish gill, bile and plasma, and of 1.21ng/g in fish liver. The uptake kinetic constants (u) of climbazole in fish gill, liver, bile and plasma were 0.069, 0.813, 0.286 and 0.136h-1, respectively; while the corresponding elimination kinetic constants (e) were 0.033, 0.029, 0.082 and 0.060h-1, respectively. The half-time values of climbazole in fish gill, liver, bile and plasma were 21.1, 23.9, 8.51 and 11.6h, respectively. The uptake and elimination processes of climbazole in fish tissues followed the pseudo first-order kinetic model, with the correlation coefficients2in the range of 0.75~0.98. The log bioconcentration factor of climbazole at steady state in fish gill, liver, bile and plasma were 0.50, 1.56, 0.72 and 0.45, respectively, which were lower than those in wild tilapia fish. climbazole;uptake kinetics;elimination kinetics;bioaccumulation X503.22 A 1000-6923(2019)08-3501-07 姚 理(1990-),女,湖南益阳人,助理研究员,博士,主要从事新型污染物的生物富集及代谢转化研究.发表论文10余篇. 2019-01-15 广东省科学院发展专项资金资助项目(2019GDASYL- 0103022);国家自然科学基金资助项目(41877360) * 责任作者, 研究员, jianliang.zhao@m.scnu.edu.cn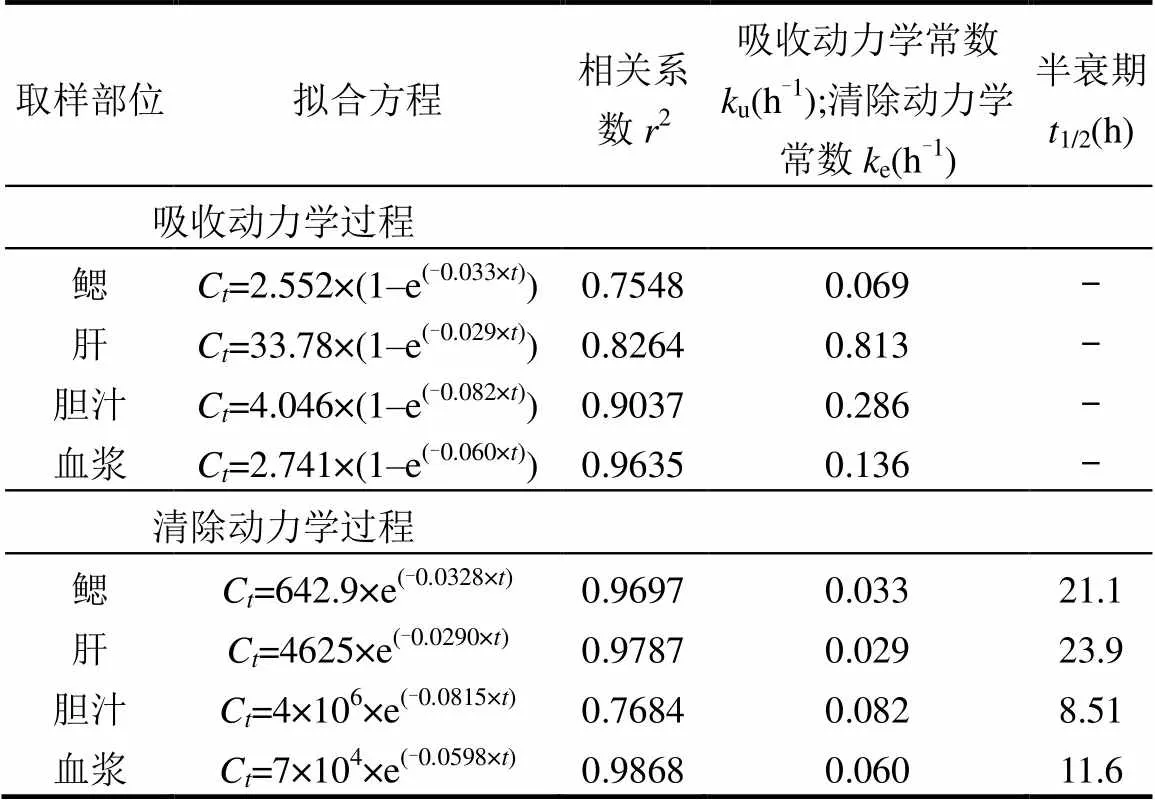
2.3 氯咪巴唑的鱼体富集规律
3 结论
