不同浓度蓝藻水华在好氧条件下的光合作用
2019-08-28王小冬刘兴国陆诗敏秦伯强曾宪磊顾兆俊
王小冬,刘兴国,陆诗敏,秦伯强,刘 翀,曾宪磊,顾兆俊
不同浓度蓝藻水华在好氧条件下的光合作用
王小冬1,刘兴国1,陆诗敏1,秦伯强2*,刘 翀1,曾宪磊1,顾兆俊1
(1.中国水产科学研究院渔业机械仪器研究所,上海 200092;2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008)
为研究不同浓度蓝藻水华在曝气形成的好氧条件下的光合作用,本文按叶绿素a(Chla)浓度32.5,346.8,1413.7和14250.0μg/L设4个处理组(从低到高编号依次为I、II、III和IV)进行实验.结果表明,各处理Chla浓度均总体呈下降趋势,但均未出现发黑或发褐现象;各处理溶氧、pH值、NH4+-N浓度和最大光合作用能力v/m均有一定差异(<0.05).快速光响应曲线的特征参数α、ETRmax和k表明,处理I、II和III中出现较高的绿藻、硅/甲藻的光能利用效率(<0.05),而处理IV中所有藻类的光能利用效率较低(<0.05).曝气增氧可以防止高浓度蓝藻水华形成黑水团;蓝藻水华初始Chla浓度约为32.5、346.8、1413.7μg/L时,在曝气形成的好氧条件下,蓝藻水华中会出现其它藻类如绿藻、硅/甲藻的生长,即藻类群落结构朝着多样化变化,对蓝藻水华形成控制.
曝气;好氧;光合作用活性;蓝藻水华;硅藻
随着水体富营养,无论是浅水湖泊还是水产养殖池塘均易暴发蓝藻水华[1-3].蓝藻水华堆积危害了水生态系统,如抑制沉水植物生长[4-5]和漂浮植物光合作用[6],还可能因缺氧或厌氧条件的形成产生黑水团(湖泛)[3,7],并可能进一步恶化成生态灾害[1].
因此,藻源性黑水团的形成受到极大关注[3,7-15],众多研究成功模拟了蓝藻水华堆积腐烂形成黑水团的过程[10-12].范成新[9]归纳总结了太湖湖泛的形成主要由蓝藻水华在缺氧或者厌氧条件下腐烂导致,并认为湖泛的消退需要风浪湖流等供氧.但是就提高水体溶氧以消除水体黑臭现象的研究较少[16-17],尤其缺乏好氧条件下蓝藻水华的变化研究.因此,本研究开展了不同浓度蓝藻门微囊藻属()水华在曝气形成的好氧条件下的变化实验,通过监测浮游藻类的光合作用活性[2,18-21]以说明不同浓度蓝藻水华在好氧条件下的变化趋势,这对于全面了解蓝藻水华形成后的变化并丰富蓝藻水华水体生态多样性研究有重要作用.
1 材料与方法
1.1 实验设计
2018年8月9日从上海市松江区主养团头鲂()的池塘中获取蓝藻水华,该水华是蓝藻门微囊藻属水华,其中优势种类是铜绿微囊藻().采用200目的尼龙滤网捞取蓝藻水华,获得浓缩后的高浓度蓝藻水华浆,其中微囊藻属的生物量比例约为99%,另含有很少量的鱼腥藻属()、颤藻属().利用大量自来水在滤网中淋洗微囊藻水华,以尽量将蓝藻水华中含有的溶解性氮磷营养盐稀释至自来水中的水平.当天所用自来水的总氮、总磷浓度分别为1.495和0.045mg/L.
将利用自来水淋洗后的蓝藻水华转移至10L的无色广口玻璃瓶中,于玻璃温室中进行实验.实验于2018年10月19日结束,共进行71d.
实验按叶绿素a(Chla)浓度分4个处理组(依次编号为: I、II、III、IV),每个处理组3个重复. 4个处理中微囊藻浓度从I~IV依次升高,用自来水稀释时,处理III、II和I中Chla浓度依次是处理IV的0.1倍、0.02倍和0.002倍.具体各处理初始时的Chla和总氮(TN)、总磷(TP)浓度见表1.实验期间不添加营养盐.
每个处理瓶均使用一个气泡石进行空气曝气,以尽量维持较多藻类悬浮在水体中,第0~14d、30~71d的曝气量为约0.4m3/h,第15~29d的曝气量减小为约0.2m3/h.

表1 初始时各处理的TN、TP和Chla浓度
1.2 水质指标测定
实验期间测定水温(WT)、溶解氧(DO)、pH值、盐度(Sal)、氨氮(NH4+-N)、TN和TP.
下午14:00左右采用多参数水质分析仪YSI professional plus(Yellow Spring Instruments,USA)原位测定WT、pH值、DO、Sal、NH4+-N,实验前期基本为每2-3d测定一次,后期基本为每3-5d测定一次;TN、TP采用碱性过硫酸钾联合消解法测定[22],在初始、第40d、第64d时各测定1次.
1.3 Chla和光合作用活性测定
Chla和浮游藻类的光合作用活性采用Phyto-PAM荧光仪(Walz,Effeltrich,Germany)测定,配套的软件是PhytoWin2.13.由于处理III和IV在20d左右Chla均有明显降低,因此从8月31日即第22d开始测定光合作用活性.
光合作用活性的表征值选用v/m值,即为光系统PSII的最大光量子产量(=v/m)(该值反映了浮游藻类的潜在最大光合作用能力[21]),以及快速光响应曲线(RLC).
测定时取水样3.0mL装入测量杯中,充分暗适应(15min)后选择自动调节信号强度Gain,在Setting窗中设置Meas. Freq.为2,点击SAT-Pulse(饱和脉冲Saturation Pulse),获得v/m(此时的为v/m),软件共测定了4个波长(470,520,645和665nm)的v/m,取其平均值作为该浮游藻类样品的v/m值.将仪器设定为每隔20s加以强度逐渐增大的光化光 (AL),同时记录光量子产量,得到快速光响应曲线RLC.利用Phyto-PAM分析软件可以直接读取RLC的3个特征参数: α(线性区段斜率,反映光能的利用效率)、ETRmax(最大电子传递速率,表示浮游藻类潜在最大光合速率)和Ik(饱和光照强度点,表示浮游藻类耐受强光的能力)[23].
1.4 数据比较
各处理间数据的比较采用软件SPSS16.0的一般线性分析模型中的双因素方差分析(ANOVA).对各处理Chla、WT、DO、Sal、pH值、NH4+-N进行比较时,先开平方以增加数据齐性[24],采用LSD法进行验后比较,差异显著水平选择α=0.05.采用软件Origin 8.0作图,作图中的数据表示采用(平均值±标准差).
2 结果与分析
2.1 水质指标
如图1所示,通过方差分析,各处理间WT有差异,处理IV明显高于其它3个处理(<0.05),而且处理III显著高于处理I(<0.05),但是处理I和II之间、处理II和III之间又无显著差异(>0.05).DO方面,处理IV显著低于其它3个处理(<0.05),而处理I和III之间无显著差异(>0.05),并且处理II同时高于处理I和III(<0.05);Sal方面,处理I和II之间无显著差异(>0.05),而这2个处理同时低于处理III(< 0.05),处理I、II和III又均低于处理IV(<0.05);pH值方面,4个处理的pH值间均有显著差异,其由高到低的排列顺序是II>I>IV>III(<0.05).
4个处理间的NH4+-N浓度均有显著差异,其由高到低的排列顺序是IV>III>II>I(<0.05)(图1(e)).实验期间处理I、II、III、IV的TN平均值分别为(2.348±0.671),(7.749±3.720),(60.493±2.228)和(444.247± 115.976)mg/L,TP平均值分别为(0.070±0.039), (0.579±0.299), (5.047±0.345)和(48.822±3.620)mg/L (图1(f)).
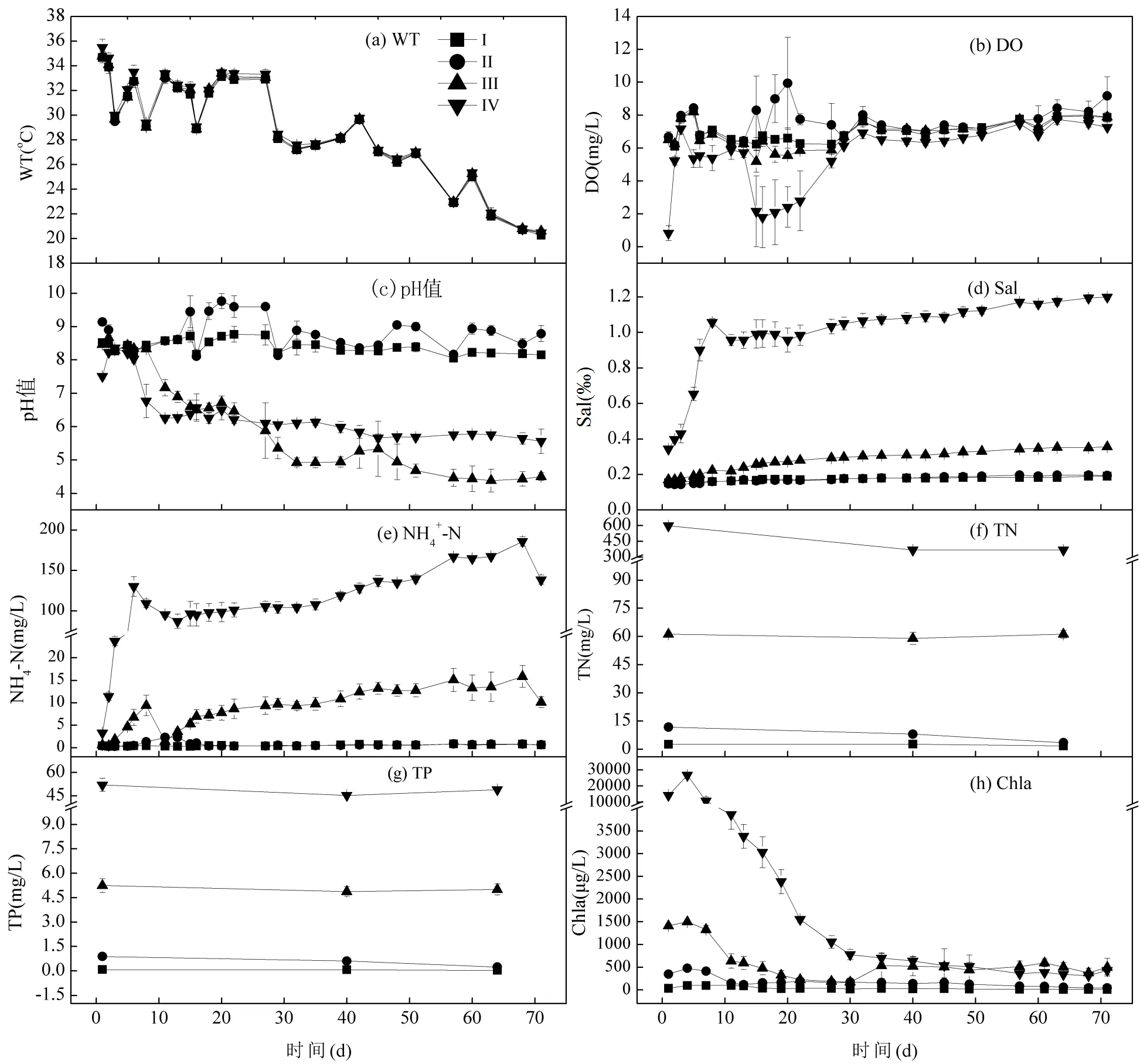
图1 各处理的WT, DO, Sal, pH值, NH4+-N, TN, TP和Chla随时间的变化情况
2.2 Chla浓度
实验过程中,4个处理均未出现变黑或者变褐现象,即使是藻类浓度最高的处理IV中水体仍带有绿色,也未散发出刺鼻的恶臭性气味,即均未形成黑水团.
处理III和IV中Chla在前30d基本呈下降趋势,在35d后处理III和IV的Chla水平比较接近(图1(h)),于是分成2个阶段进行比较.在第30d时,处理III中Chla降低至250μg/L左右,而第35d时又上升到500μg/L左右,之后维持相对稳定.对4个处理前30d的Chla方差分析表明,4个处理间Chla均有显著差异,从高到低排列是IV>III>II>I(<0.05);在第35d~71d,处理IV和III之间Chla无显著差异(>0.05),而这2个处理均高于处理II(<0.05),处理II又显著高于处理I(<0.05).
2.3 光合作用活性
从8月31日即第22d开始进行光合作用活性的测定,处理I、II、III、IV的v/m平均值大小分别为(0.371±0.016),(0.503±0.013),(0.593±0.013), (0.066±0.013),各处理间v/m均有显著差异,从高到低的顺序是III>II>I>IV(<0.05)(图2).
从反映光能利用效率的α看,最明显的规律是处理III中蓝藻的α最高,在第30d后其能稳定维持在0.24左右(图3(a));处理II和III在第22~45d出现了明显的硅/甲藻的光合作用活性,尤其是处理II中硅/甲藻的α值达到0.20左右.
对各处理α的方差分析表明,处理I、II和IV之间蓝藻的α均无显著差异(>0.05),且这3个处理均小于处理III(<0.05);而处理I和II之间绿藻的α均有显著差异(<0.05),但它们均高于处理III,同时,处理I、II和III又明显高于处理IV(<0.05);硅/甲藻的α方面,处理II和III之间无显著差异(>0.05),处理I和IV之间无显著差异(>0.05),且处理II和III均显著高于处理I和IV(<0.05).

图2 各处理浮游藻类Fv/Fm值随时间的变化
对各处理ETRmax的方差分析表明,处理I、II和IV之间蓝藻的ETRmax无显著差异(>0.05),且这3个处理均低于处理III(<0.05);绿藻的ETRmax方面,处理I和II之间无显著差异(>0.05),处理III和IV之间无显著差异(>0.05),且处理I和II明显高于处理III和IV(<0.05);硅/甲藻的ETRmax方面,处理I、II和IV之间无显著差异(>0.05),处理III和IV之间无显著差异(>0.05),但处理III同时显著高于处理I和II(<0.05)(图3(b)).
即在表示浮游藻类潜在最大光合速率ETRmax方面,处理I中主要源于绿藻,其次是硅/甲藻,蓝藻几乎为0;处理II中主要源于绿藻,蓝藻几乎监测不到,并在第22~45d有硅/甲藻的;处理III中主要源于蓝藻和硅/甲藻,并在第22~45d有绿藻的;处理IV中主要源于硅/甲藻,蓝藻和绿藻的较小.
对各处理k的方差分析表明,处理I和II中蓝藻的k无显著差异(>0.05),且它们均显著低于处理IV(<0.05),同时这3个处理均显著低于处理III(<0.05);处理I、II和IV中绿藻的k无显著差异(>0.05),且这3个处理均显著大于处理III(<0.05);处理I、II和III中硅/甲藻的k无显著差异(>0.05),且处理IV又同时显著高于处理I和II(<0.05),处理III和IV之间无显著差异(>0.05)(图3(c)).
可见,由浮游藻类对强光耐受能力的k,4个处理中均主要是绿藻和硅/甲藻表现出对强光有较强的耐受,蓝藻对强光的耐受值反而较低(图3(c)).
从快速光响应曲线RLC的3个特征参数可见,处理I中主要是绿藻有较好的光能利用效率,蓝藻、硅/甲藻比较低;处理II在第22~45d主要是硅/甲藻的光能利用效率比较高,在45d之后,是以绿藻的光能利用效率为主,蓝藻的光能利用效率一直低;处理III在第30~71d中蓝藻的光能利用率一直较高,硅/甲藻的光能利用率也比较高,并在第22~45d绿藻也有较高的光能利用率;而处理IV中所有藻类的光能利用效率都很低.从蓝藻对光能的利用效率看,仅有处理III中的蓝藻有较好的光能利用效率.
3 讨论
生物质浓度是造成黑水团发生的重要物质基础[9],因此模拟蓝藻水华聚集形成黑水团的基础条件是蓝藻水华堆积的浓度[8,10,12-15].表示蓝藻水华堆积浓度的形式有多种,如微囊藻细胞密度(cells/L)与Chla浓度[8]、单位面积中鲜蓝藻浆的质量(g/m2)[10,12,14-15]、单位体积中鲜蓝藻浆的质量(g/L)[13]等.这些不同表示方法因微囊藻群体具备漂浮在水面的特性而在相应条件下均有意义,只是难以直接比较不同方法表示的浓度大小.在本实验中,处理IV的Chla浓度介于尚丽霞等[8]的中等浓度和高等浓度之间,表明处理IV的浓度已经足够高,适合进行蓝藻水华堆积实验.实验过程中各个处理均未形成水体发黑的现象,尤其是高浓度的处理IV和III中Chla浓度在实验的后期仍比较高,这表明在曝气形成的好氧条件下,即使是高浓度的蓝藻水华也不会形成腐烂发黑的黑水团现象.
低DO是促成水体黑水团发生的重要环境因子[3,7-9].本实验过程中4个处理的曝气量尽量一致,但是各处理间DO存在一定差异(图1),表明相同曝气量条件下,藻类浓度不同会导致水体DO存在差异.其原因是水体DO是藻类光合作用产氧、呼吸作用耗氧与曝气增氧等之间平衡的结果.并且在第15~30d各处理曝气量较弱时,DO有一定的分异,其中处理IV的DO约为2mg/L,而处理II中高达9~ 10mg/L,表明没有足量的曝气时,蓝藻水华浓度高的处理IV中易出现低DO现象,这与蓝藻水华堆积模拟黑水团的过程中出现低DO类似[3,7-9].而后续给与足够曝气时又可以形成好氧条件.这进一步表明高浓度的蓝藻水华在曝气形成的高DO条件下可以不形成黑水团.
pH值方面,藻类浓度高的处理III和IV中基本低于7,与藻类浓度低的处理I和II形成明显不同的变化趋势(图1).pH值逐渐低于7的现象在有机质腐烂过程中很常见[25],其本质是多糖、含氮有机化合物、脂肪和脂肪酸等大分子物质在有氧环境下被细菌分解为小分子有机酸等[25],也是蓝藻水华堆积腐烂过程中的一种现象[8,13].从而,处理III和IV中pH值低于7的现象表明其中藻类存在一定程度的腐烂降解.
Sal方面,处理IV显著高于处理III(<0.05),处理III又显著高于处理II和I(<0.05)(图1),表明较高的蓝藻浓度下,水体容易出现较多的离子.由于系统无沉积物或者其它的营养盐来源,可以肯定引起Sal增加的这些离子来源于蓝藻水华的降解.NH4+-N与Sal的变化趋势接近(图1),而且蓝藻水华降解出现NH4+-N浓度升高的现象是普遍的[26-27],这进一步表明,在曝气形成的好氧环境下,高浓度蓝藻水华依然会发生腐烂降解并释放出可溶性营养盐,这与蓝藻水华浓度高的处理III和IV中Chla在实验第20d左右开始明显下降(图1(h))的变化趋势相吻合.
本实验中,即使是蓝藻浓度高的处理III和IV中也未形成黑水团,并且在71d的时间里仍然维持较高的Chla浓度(图1(h)),表明好氧条件有利于高浓度蓝藻水华维持相对稳定.从而,提高水体DO可以预防高浓度蓝藻水华腐烂形成黑水团,只是藻类浓度高时,好氧条件下依然会发生藻类的部分降解.
蓝藻水华堆积不一定形成黑水团[9],其原因可能与水体DO浓度有关.在一些浅水湖泊或水产养殖池塘中,某些区域往往会存在氧气充足的好氧环境,比如2011年8月对蓝藻水华大量暴发时太湖梅梁湾湖区的DO饱和度DOS的监测表明,梅梁湾各水层DOS的平均值最小值为67.68%,最大值为252.05%,总体平均值为101.65%[28],这表明蓝藻水华大量暴发时水体DO依然可以比较充足,没有因水体缺氧发生黑水团.池塘养殖中为了维持养殖对象所需的DO水平,常常选用增氧设备为水体增氧,不容易在养殖池塘中出现蓝藻水华引起的黑水团.
而好氧条件下不同浓度蓝藻水华的具体变化可由藻类光合作用活性判断.对滆湖和骆马湖春季浮游藻类光合作用活性的研究表明,滆湖蓝藻和硅藻的v/m分别为0.36~0.52和0.27~0.53,骆马湖绿藻和硅藻的v/m分别为0.45~0.65和0.41~0.49[18];对太湖春季和秋季浮游藻类的光合作用活性研究表明,春季蓝藻、绿藻和硅/甲藻的v/m分别为0.35~0.49、0.34~0.68和0.09~0.56;秋季则分别为0.34~0.53、0.55~0.68和0.28~0.61[19].可见,处理I、II和III中浮游藻类的v/m均在文献中这些常见的范围内[18-19],但处理IV中v/m平均值仅0.066(图2),表明处理IV中浮游藻类的光合作用很弱,这与前面发现的该处理中藻类存在腐烂降解相一致.
该实验中,处理III的v/m值最高,处理IV的最低(图2),这表明,虽然处理IV的Chla显著高于处理III(前30d里)或者与处理III无显著差异(在第35~71d)(图1(h)),但是处理IV中浮游藻类的潜在最大光合作用能力显著低于处理III(图2).结合Chla和v/m值的变化趋势,可见初始时藻类浓度最高的处理IV中藻类在前30d内发生了腐烂降解后变得相对稳定;处理III中藻类在前30d内也发生了腐烂降解,随后又出现了藻类的生长;藻类浓度较低的处理II和处理I中,处理II中藻类生长明显好于处理I.
各处理中藻类群落结构的变化可由快速光响应曲线RLC的3个特征参数进一步判断.图3表明,在曝气形成的好氧条件下,不是所有浓度的蓝藻水华能维持蓝藻优势,有些浓度的蓝藻水华中出现了其它藻类如绿藻、硅/甲藻的生长:处理I主要是绿藻有较好的光能利用效率;处理II在第22~45d主要是硅/甲藻的光能利用效率比较高,在45d之后,以绿藻的光能利用效率为主;处理III在第30~71d除了蓝藻外,硅/甲藻的光能利用率也比较高,并在第22~45d绿藻也有较高的光能利用率.即初始蓝藻水华浓度较低的处理I、II、III中藻类群落结构会朝着多样化变化.这表明,好氧条件下蓝藻水华中浮游藻类群落结构的变化与蓝藻水华浓度有关.对太湖蓝藻水华暴发过程中藻类群落的分析表明,蓝藻水华中仍然含有绿藻和硅藻等[29-30],这可能与合适的蓝藻水华浓度及太湖的风浪扰动常常为水体创造了好氧条件有关.
本实验的曝气改变水体DO时还促进了水体扰动,可对藻类产生影响.水体扰动对藻类的影响研究较多,如Zhou等[31]利用太湖蓝藻水华水体进行实验时,发现扰动在短期内促进了微囊藻和有毒微囊藻的生长,但是,当扰动长达10d时会促进蓝藻向硅藻和绿藻转变.在一些深水湖泊中,强烈的扰动往往能够促进浮游植物优势种类由蓝藻向硅藻和绿藻转变[32],这是由于扰动减少了浮游植物沉降而有利于非上浮性的藻类生长,蓝藻能上浮的特性在扰动环境中并不能发挥作用.不能自由活动的硅藻和绿藻比蓝藻更能适应扰动环境中不稳定的光照条件,不能自由活动的硅藻和绿藻在扰动后还可以减少沉底[33],因此其他藻类能在扰动中获得相应竞争优势[32].
本实验结果表明,曝气形成的好氧条件能够减缓高浓度蓝藻的降解,防止水体出现黑水团,还能促进较低浓度蓝藻水华中藻类朝多样化发展.关于水体复氧技术的研究表明,复氧能改善富营养化湖泊的局部黑臭现象[16-17].本研究对丰富蓝藻水华水体生态多样性研究有重要作用,也有利于开辟蓝藻水华控制、治理和资源化利用(如以蓝藻水华作为基础物质培养绿藻、硅藻等)的新途径.
4 结论
4.1 曝气形成的好氧条件下,初始蓝藻水华Chla浓度高达1413.7和14250.0μg/L时,存在一定程度的腐烂降解,但没有形成黑水团.
4.2 好氧条件下蓝藻水华中藻类群落结构的变化与蓝藻水华浓度有关.在蓝藻水华初始Chla浓度为14250.0μg/L时,蓝藻在前30d内发生腐烂降解后变得相对稳定,但藻类的光合作用很弱;蓝藻水华初始Chla浓度为32.5,346.8,1413.7μg/L时,在曝气形成的好氧条件下,蓝藻水华中会出现其它藻类如绿藻、硅/甲藻的生长,即藻类群落结构朝着多样化变化.
[1] 吴庆龙,谢 平,杨柳燕,等.湖泊蓝藻水华生态灾害形成机理及防治的基础研究 [J]. 地球科学进展, 2008,23(11):1115-1123. Wu Q L, Xie P, Yang L Y, et al. Ecological consequences of cyanobacetrial blooms in Lakes and their countermeasures [J]. Advances in earth science, 2008,23(11):1115-1123.
[2] 李大命,周 军,唐晟凯,等.河蟹养殖池塘微囊藻水华毒性及其光合作用活性特征 [J]. 湖泊科学, 2015,27(1):113-118. Li D M, Zhou J, Tang S K, et al. Toxicity and photochemical activity of Microcystis bloom in crab cultivation pond [J]. Journal of lake science, 2015,27(1):113-118.
[3] 陆桂华,马 倩.太湖水域“湖泛”及其成因研究 [J]. 水科学进展, 2009,20(3):438-442. Lu G H, Ma Q. Analysis on the causes of forming black water cluster in Taihu Lake [J]. Advances in water science, 2009,20(3):438-442.
[4] 刘丽贞,秦伯强,朱广伟,等.太湖蓝藻死亡腐烂产物对狐尾藻和水质的影响 [J]. 生态学报, 2012,32(10):3154-3159. Liu L Z, Qin B Q, Zhu G W, et al. Effect of decomposition products of cyanobacteria onand water quality in Lake Taihu, China [J]. Acta ecologica sinica, 2012,32(10):3154-3159.
[5] 何 虎,何宇虹,姬娅婵,等.蓝藻堆积和螺类牧食对苦草生长的影响[J]. 生态学报, 2012,32(17):5562-5567. He H, He Y H, Ji Y C, et al. Effects of cyanobacterial accumulation and snail grazing on the growth of[J]. Acta ecologica sinica, 2012,32(17):5562-5567.
[6] 包先明,顾东祥,吴婷婷,等.藻华聚集的环境效应:对漂浮植物水葫芦光合作用的影响 [J]. 环境科学, 2015,36(6):2070-2076. Bao X M, Gu D X, Wu T T, et al. Environmental effects of algae bloom cluster: impact on the floating plant water hyacinth photosynthesis [J]. Environmental science, 2015,36(6):2070-2076.
[7] 邢 鹏,胡万婷,吴瑜凡,等.浅水湖泊湖泛(黑水团)中的微生物生态学研究进展 [J]. 湖泊科学, 2015,27(4):567-574. Xing P, Hu W T, Wu Y F, et al. Major progress in microbial ecology of hypoxia in the shallow eutrophic lakes [J]. Journal of lake sciences, 2015,27(4):567-574.
[8] 尚丽霞,柯 凡,李文朝,等.高密度蓝藻厌氧分解过程与污染物释放实验研究 [J]. 湖泊科学, 2013,25(1):47-54. Shang L X, Ke F, Li W C, et al. Laboratory research on the contaminants release during the anaerobic decomposition of high-density cyanobacteria [J]. Journal of lake sciences, 2013,25(1):47-54.
[9] 范成新.太湖湖泛形成研究进展与展望 [J]. 湖泊科学, 2015,27(4):553-566. Fan C X. Progress and prospect in formation of black bloom in Lake Taihu: A review [J]. Journal of lake sciences, 2015,27(4):553-566.
[10] 申秋实,邵世光,王兆德,等.太湖月亮湾湖泛发生过程模拟及水土物化性质的响应 [J]. 水科学进展, 2011,22(5):710-719. Shen Q S, Shao S G, Wang Z D, et al. Simulation of black bloom in Moon Bay of Lake Taihu and physical and chemical responses of water and sediment [J]. Advances in water science, 2011,22(5):710- 719.
[11] 刘国锋,范成新,张 雷,等.藻源性黑水团环境效应Ⅲ:对水-沉积物界面处Fe-S-P循环的影响 [J]. 中国环境科学, 2014,34(12):3199- 3206. Liu G F, Fan C X, Zhang L, et al. Environment effects of algae-caused black spots III: impacts on Fe- S- P cycle in water-sediment interface [J]. China environmental science, 2014,34(12):3199-3206.
[12] 邵世光,薛联青,刘 成,等.藻源性湖泛发生过程的季节差异 [J]. 中国环境科学, 2015,35(8):2511-2516. Shao S G, Xue L Q, Liu C, et al. Seasonal differences in the process of algae-induced black bloom [J]. China environmental science, 2015,35(8):2511-2516.
[13] 吴婷婷,刘国锋,韩士群,等.蓝藻水华聚集对水葫芦生理生态的影响 [J]. 环境科学, 2015,36(1):114-120. Wu T T, Liu G F, Han S Q, et al. Impacts of algal blooms accumulation on physiological ecology of water hyacinth [J]. Environmental science, 2015,36(1):114-120.
[14] 李佐琛,段洪涛,申秋实,等.藻源性湖泛发生过程CDOM变化对水色的影响 [J]. 湖泊科学, 2015,27(4):616-622. Li Z C, Duan H T, Shen Q S, et al. The changes of water color induced by chromophoric dissolved organic matter(CDOM) during the formation of black blooms [J]. Journal of lake sciences, 2015, 27(4):616-622.
[15] 李佐琛,段洪涛,张玉超,等.藻源型湖泛发生过程水色变化规律 [J]. 中国环境科学, 2015,35(2):524-532. Li Z C, Duan H T, Zhang Y C, et al. Variations in optical properties and water color during the formation of black bloom waters: a laboratory experiment [J]. China environmental science, 2015,35(2): 524-532.
[16] 刘海洪,李先宁,宋海亮.浅水湖泊防控黑臭水体复氧技术 [J]. 东南大学学报(自然科学版), 2015,45(3):526-530. Liu H H, Li X N, Song H L. Re-oxygenation technology for prevention and control of black water in shallow lakes [J]. Journal of Southeast University, 2015,45(3):526-530.
[17] 刘海洪.富营养化湖泊局部黑臭水体复氧技术研究 [D]. 南京:东南大学, 2017. Liu H H. Re-oxygenation technology for prevention and control of black water in eutrophic lakes [D]. Nanjing: Southeast University, 2017.
[18] 李大命,阳 振,于 洋,等.滆湖和骆马湖春季浮游藻类光合作用活性的研究 [J]. 湖泊科学, 2013,25(5):688-694. Li D M, Yang Z, Yu Y, et al. Photosynthetic activity of phytoplankton in Lake Gehu and Lake Luoma in spring [J]. Journal of lake science, 2013,25(5):688-694.
[19] 李大命,于 洋,张彤晴,等.太湖春季和秋季浮游藻类的光合作用活性 [J]. 环境科学研究, 2014,27(8):848-856. Li D M, Yu Y, Zhang T Q, et al. Photochemical activity of phytoplankton in Taihu Lake in spring and autumn [J]. Research of environmental sciences, 2014,27(8):48-856.
[20] Goto N, Kihira M, Ishida N. Seasonal distribution of photosynthetically active phytoplankton using pulse amplitude modulated fluorometry in the large monomictic Lake Biwa, Japan [J]. Chemical Papers, 2008,62(5):480-486.
[21] Zhang M, Kong F X, Wu X D, et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing [J]. Hydrobiologia, 2008,603(1):267-278.
[22] Gross A, Boyd C E. A digestion procedure for the simultaneous determination of total nitrogen and total phosphorus in pond water [J]. Journal of World Aquaculture Society, 1998,29(3):300-303.
[23] Ralph P J, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity [J]. Aquatic Botany, 2005,82(3):222-237.
[24] Underwood A J. Experiments in ecology: Their logical design and interpretation using analysis of variance [M]. Cambridge: Cambridge University Press, 1997:189-192.
[25] 刘 慧.现代食品微生物学 [M]. 北京:中国轻工业出版社, 2004: 138-146. Liu H. Modern food microbiology [M]. Beijing: China light industry press, 2004:138-146.
[26] 刘国锋,申秋实,张 雷,等.藻源性黑水团环境效应:对水-沉积物界面氮磷变化的驱动作用 [J]. 环境科学, 2010,31(12):2917-2924. Liu G F, Shen Q S, Zhang L, et al. Environment effects of algae-caused black spots: driving effects on the N, P changes in the water-sediment interface [J]. 2010,31(12):2917-2924.
[27] 刘 颢,汤祥明,高 光,等.太湖藻源性颗粒物分解过程中氨基酸的变化特征 [J]. 湖泊科学, 2017,29(1):95-104. Liu H, Tang X M, G Guang, et al. Characteristics of amino acids during the process of algae-originated particles decomposition in Lake Taihu [J]. Journal of lake sciences, 2017,29(1):95-104.
[28] 赵林林,朱广伟,许 海.太湖梅梁湾理化指标分层的空间分布特征 [J]. 环境科学研究, 2013,26(7):721-727. Zhao L L, Zhu G W, Xu H. Spatial distribution of the physicochemical parameter stratification in Meiliang Bay, Lake Taihu, China [J]. Reserach of environmental sciences, 2013,26(7):721-727.
[29] Chen Y, Qin B, Teubner K, et al. Long-term dynamics of phytoplankton assemblages:-domination in Lake Taihu, a large shallow lake in China [J]. Journal of Plankton Research, 2003,25: 445-453.
[30] 刘 霞,陆晓华,陈宇炜.太湖浮游硅藻时空演化与环境因子的关系 [J]. 环境科学学报, 2012,32(4):1-7. Liu X, Lu X H, Chen Y W. Long-term evolution of planktonic diatoms and their relationships with environmental factors in Lake Taihu [J]. Acta scientiae circumstantiae, 2012,32(4):1-7.
[31] Zhou J, Qin B, Casenave C, et al. Effects of wind wave turbulence on the phytoplankton community composition in large, shallow Lake Taihu [J]. Environmental Science and Pollution Research, 2015,22(16): 12737-12746.
[32] Visser P M, Ibelings B W, Van Der Veer B, et al. Artificial mixing prevents nuisance blooms of the cyanobacterium, in Lake Nieuwe Meer, the Netherlands [J]. Freshwater Biology, 1996,36(2): 435-450.
[33] Hüisman J, Sharples J, Stroom J M, et al. Changes in turbulent mixing shift competition for light between phytoplankton species [J]. Ecology, 2004,85(11):2960-2970.
Photosynthetic activities of cyanobacterial blooms of different concentrations under aerobic conditions with aeration.
WANG Xiao-dong1, LIU Xing-guo1, LU Shi-min1, QIN Bo-qiang2*, LIU Chong1, ZENG Xian-lei1, GU Zhao-jun1
(1.Fishery Machinery and Instrument Research Institute, Chinese Academy of Fisheries Sciences, Shanghai 200092, China;2.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China)., 2019,39(8):3412~3419
An experiment was conducted to study the photosynthetic activity of different concentrations of cyanobacterial blooms under aerobic conditions formed by aeration. Four treatments (I, II, III and IV) were set up according to chlorophyll a (Chla) concentration, which was 32.5, 346.8, 1413.7 and 14250.0ug/L, respectively.The results showed that the Chla concentration of all treatments decreased, but no blackening or browning phenomenon occurred. There were some differences in DO, pH value, NH4+-N concentration and maximum photosynthetic capacityv/mamong the treatments (<0.05).The characteristic parameters α, ETRmaxand Ikof the algal Rapid Response Light Curve showed that higher photosynthetic efficiency of green algae, diatom/dinoflagellate was achieved in treatments I, II and III, but lower photosynthetic efficiency of all algae in treatment IV (<0.05). Aeration can prevent high concentration of cyanobacterial bloom from forming black bloom. When the initial Chla concentration of cyanobacterial bloom was 32.5, 346.8 and 1413.7ug/L, respectively, the growth of green algae and diatom/dinoflagellate would occur in cyanobacterial bloom, showing that the algal community composition diversified under aerobic conditions, which can control the cyanobacterial blooms.
aeration;aerobic;photosynthetic activity;cyanobacterial blooms;diatom
X172
A
1000-6923(2019)08-3412-08
王小冬(1981-),女,湖南隆回人,副研究员,博士,主要从事水环境生态与工程研究.发表论文50余篇.
2019-01-22
国家自然科学基金资助项目(41401580);国家科技基础条件平台资助项目(2019DKA30470);中国水产科学研究院国际合作资助项目(2017GH10)
* 责任作者, 研究员, qinbq@niglas.ac.cn
