铁基双金属强化降解地下水中四氯化碳
2019-08-28朱雪强韩宝平
朱雪强,韩宝平
铁基双金属强化降解地下水中四氯化碳
朱雪强1*,韩宝平2
(1.中国矿业大学环境与测绘学院,江苏 徐州 221116;2.江苏师范大学地理测绘与城乡规划学院,江苏 徐州 221116)
采用沉积置换法制备了微米级的Ni-Fe、Cu-Fe、Ag-Fe双金属颗粒,应用扫描电镜(SEM)、X射线光电子能谱(XPS)分析了其表面特征,考察了负载金属类型、金属负载量对铁基双金属降解四氯化碳(CCl4)的影响.结果表明:Ni、Cu、Ag等催化金属非均匀地负载在铁基体上,双金属颗粒表面发生了氧化.CCl4的降解速率对催化金属的负载量比较敏感,双金属体系Ni、Cu、Ag的适宜负载量分别为1.0wt%、0.8wt%和0.4wt%.CCl4在双金属体系中的降解途径为零价铁颗粒表面的直接还原及催化金属表面的催化加氢还原,以催化加氢还原为主.Ni-Fe、Cu-Fe、Ag-Fe对CCl4的还原降解速率大小顺序与其电偶电池电动势的大小顺序一致,即Ag-Fe对CCl4的降解速率最快,Cu-Fe次之,Ni-Fe最慢.
四氯化碳;铁基双金属;降解;催化加氢还原
氯代烃类是最常见的土壤-地下水污染物,其难降解、易挥发、毒性大,一旦扩散至地下环境介质中,就很难监测和消除,因此土壤—地下水氯代烃污染及修复受到了国内外广泛关注.目前,地下水氯代烃污染修复技术已从传统的抽出处理技术发展出渗透性反应墙(PRB)、原位化学氧化、强化生物降解、基于监测的自然衰减技术等,其中ZVI-PRB(ZVI,零价铁)技术被视为发展最完整的修复技术[1].ZVI对氯代烃还原脱氯反应属于表面反应,电子传递是重要的控制步骤,可以通过减小ZVI粒径以增加ZVI电子密度或在ZVI表面镀上第二种金属形成双金属系统强化电子在ZVI与污染物之间的传递,从而促进氯代烃的还原脱氯[2].ZVI颗粒太小,易发生团聚,从而降低了其对污染物的去除能力[3-4].零价铁双金属体系因反应活性高而被广泛用于地下水中卤代有机物、重金属的处理[5].添加的第二种金属一般具有较高的电极电势,如Pd、Pt、Au、Ni、Cu、Ag、Pb[6],其中Pd具有良好的催化性能和稳定性,因此Pd-Fe可以有效还原降解包括氯代有机物在内的多种污染物,是研究最为广泛的双金属还原剂[7].但是,Pd作为贵金属,其成本大大限制了它的广泛应用.与传统催化金属Au、Pd和Pt相比,Ag相对便宜且具有更高的标准电位,表明Fe和Ag可以形成电位更高、电子转移率更快的电偶[8].另外,相对于Pd-Fe、Ni-Fe,关于Ag-Fe双金属体系对氯代有机物降解的研究较少.因此,本文选择Ni、Cu、Ag作为催化金属,通过置换沉积法制备不同类型的双金属,探讨双金属体系对CCl4的降解性能,揭示双金属体系还原降解CCl4的反应机理和协同机理.
1 材料与方法
1.1 实验材料
NiCl2·6H2O(分析纯),AgNO3(分析纯), CuSO4·6H2O(分析纯),上海国药集团生产;CCl4(分析纯),上海凌峰化学试剂有限公司;甲醇(分析纯),无水乙醇(分析纯),上海苏懿化学试剂有限公司;海绵铁粉,形状不规则,粒径<100目.
1.2 双金属颗粒的制备
采用置换沉积法制备双金属颗粒.制备过程中所用去离子水用氮气曝气20min,去除其中的溶解氧.双金属制备在100mL血清瓶中进行,未进行氮气保护.
1.2.1 Ni-Fe双金属颗粒 按照Cwiertny等的制备方法[9],在100mL NiCl2棕色血清瓶中,添加5g铁粉(未酸洗),置于摇床上振动30min(200r/min),然后真空抽滤得到具有Ni涂层的Ni-Fe双金属颗粒;再将制备的Ni-Fe双金属颗粒用4:1的乙醇-水清洗3次,固体样品于50℃下真空干燥12h,得到Ni-Fe双金属颗粒.Ni的理论负载量通过改变NiCl2溶液的浓度来实现.
1.2.2 Fe-Cu双金属颗粒 按照Lai等的制备方法[10],向100mL CuSO4溶液中添加5g铁粉(未酸洗),置于摇床上振动30min(200r/mim),然后真空抽滤并用4:1的乙醇-水清洗3次;固体样品于50℃下真空干燥12h,得到Cu-Fe双金属颗粒.Cu的理论负载量通过改变CuSO4溶液的浓度来实现.
1.2.3 Ag-Fe双金属颗粒 按照高珊珊等的制备方法[11],先向100mL AgNO3溶液中添加5g铁粉(未酸洗),置于摇床上振动30min(200r/min),然后真空抽滤并用4:1的乙醇-水清洗3次;固体样品于50℃下真空干燥12h,得到Ag-Fe双金属颗粒.Ag的理论负载量通过改变AgNO3溶液的浓度实现.
1.3 双金属体系降解CCl4的批实验
将100mL去离子水(未进行氮气曝气处理)倒入100mL血清瓶中并添加一定量的ZVI双金属,然后注入100μL浓度为2×104mg/L(甲醇促溶)的CCl4,即供试溶液CCl4浓度为20mg/L.然后将反应瓶置于恒温振荡器上,使之在25±0.2℃、200±5r/min下反应.定时用微量取样器取100µL溶液置于装有9.9mL去离子水的20mL顶空瓶中,分析CCl4浓度.
1.4 CCl4测试
采用Agilent 6890N(带G1888自动顶空进样器)气相色谱仪分析CCl4的质量浓度.顶空进样器条件:顶空瓶温度40℃、瓶平衡时间40min、Loop85℃、传输线105℃;仪器运行条件:19091J-413HP-5毛细管色谱柱、电子捕获检测器,进样口温度150℃,检测器温度250℃,载气(99.999%N2)流量2.0mL/min(分流比10:1),程序升温如下:30℃(保持1min, 10℃/min) →80℃(保持1min).外标法定量.
2 结果与讨论
2.1 铁基双金属材料的表征
2.1.1 SEM表征 利用扫描电镜(美国FEI公司Quanta 250型环境扫描电子显微镜,带德国Bruker公司产QUANTAX400-10电制冷能谱仪)分析了双金属材料的表面形态及其表面主要元素组成.供试样品中催化金属的理论负载量均为1.0wt%.如图1所示,负载后的ZVI表面粗糙,表面非均匀地分散有微米级的颗粒,由此在ZVI表面形成了异构盖层,改变了ZVI的表面形貌,增加了反应材料的比表面积,粗糙的表面可以提供更多的活性反应位点.依据EDS结果,推测这些微米级的颗粒为负载的Ni0、Cu0、Ag0(图2),证明了双金属催化还原材料的形成,其含量的差异进一步说明了负载金属颗粒表面的非均质性.从图2还可以看出,双金属材料中以ZVI为主,O元素峰的存在表明在双金属材料制备和保存过程中发生了氧化.
2.1.2 XPS表征 对理论负载量为0.4wt%的Ag-Fe颗粒进行了XPS分析(美国赛默飞公司ESCALAB 250Xi型X射线光电子能谱仪;分峰软件为Xpspeak4.1,Shirley本底扣除法,Lorentzian Gaussian线型分峰拟合),结果如图3所示,Ag3d5/2、Ag3d3/2/的结合能分别为368.13和374.14eV,这表明Ag以Ag0的形式存在[12].711.08和~725.03eV的光电子峰是Fe(III)的Fe 2p3/2和Fe 2p1/2的结合能,表明颗粒表面有Fe3+的存在.氧化物上的氧有3种存在形式,即O2-、OH-和H2O(化学或物理吸附的),每种形态的氧具有不同的结合能[13]. Fe-Ag颗粒表面的OH-/O2-比值(峰面积)为1.03,依据FeOOH的化学计量特征,当OH-/O2-的值(峰面积)为0.9~1.1时,说明颗粒表面的Fe3+氧化物主要是FeOOH[14],这说明在制备和保存过程中双金属颗粒发生了氧化作用.

(a)、(b)为Ni-Fe;(c)、(d)为Cu-Fe;(e)、(f)为Ag-Fe
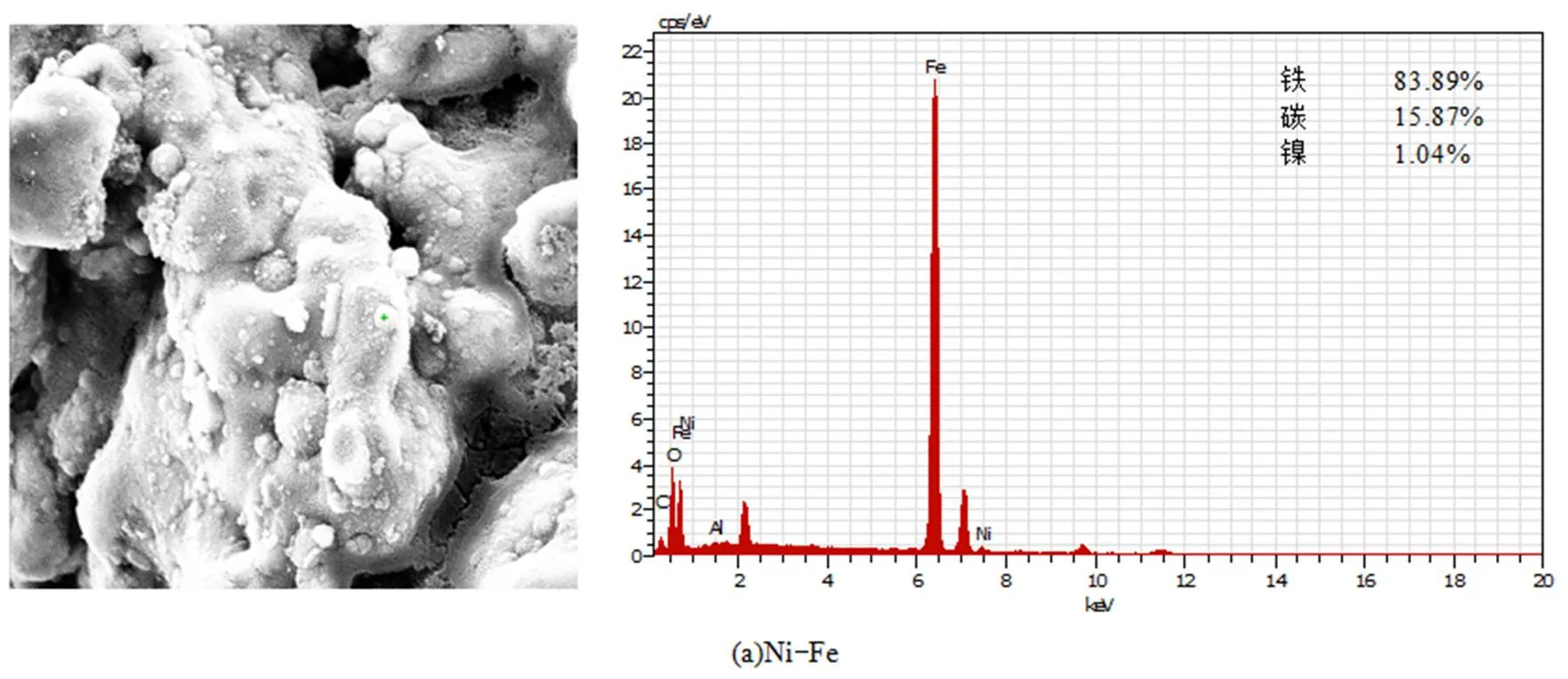

图3 Ag-Fe颗粒的XPS图
Ag负载量为0.4%;(a) Ag负载量为0.4%Fe2P的高分辨率图;(b)O1s的高分辨率图;(c)Ag3d高分辨率图
2.2 铁基双金属体系的四氯化碳降解性能
2.2.1 负载金属类型和负载量对CCl4降解的影响 过渡金属催化剂的类型和含量直接影响到双金属体系对CCl4的还原脱氯效果.图4~图6是Ni-Fe、Cu-Fe、Ag-Fe双金属体系对CCl4降解实验结果,过渡金属催化剂的理论负载量均为0.2wt%、0.4wt%、1.0wt%、2.0wt%和4.0wt%.结果表明,Ni、Cu、Ag的负载可以增加ZVI的反应活性,提高CCl4的还原脱氯速率.图4显示,随着Ni含量的增加,CCl4的降解效率先增加后减小,反应8h,CCl4的降解效率分别为75.03%、72.87%、90.26%、84.59%和65.53%,而ZVI体系的CCl4降解效率仅为59.4%.ZVI对CCl4的还原脱氯动力学可以用准一级反应动力学模型描述[15].
dCCl4/d= -obsCCl4(1)
式中:CCl4为是某一时刻CCl4的浓度,µg/L.obs为表观准一级反应速率常数,h-1.不同Ni负载量(0.0wt%、02wt%、0.4wt%、1.0wt%、2.0wt%、4.0wt%)的obs分别为0.1124h-1(2=0.999)、0.2182h-1(2=0.985)、0.2191h-1(2=0.981)、0.2445h-1(2=0.974)、0.2345h-1(2=0.995)、0.2138h-1(2=0.961).增加双金属量可以增加发生脱氯反应的活性表面[16],在纳米Pd/Fe降解氯代烯烃[17]和微米级Fe/Pd-CEM降解TCE体系中[18]均观察到这种趋势.其强化机理主要包括:①Ni的催化作用,负载在ZVI上的Ni与Fe形成无数微小原电池,加速铁的腐蚀,从而在颗粒表面形成无数个点蚀区域而形成更多的新鲜表面,增加了活性反应点,能够有更多的释放电子区域参与CCl4的还原脱氯,从而强化CCl4的脱氯降解;②ZVI负载Ni后可以减少颗粒表面的铁氧化物,增加铁的有效吸附点位,有利于污染物的吸附[19].同时,Ni是良好的电子导体,当CCl4吸附到ZVI表面的Ni颗粒上,电子可以通过Ni传递给有机物,由此增加了颗粒表面的有效反应区域.③Ni原子表面具有空的电子轨道,对含有未饱和电子对的化学物具有很强的化学吸附能力,在含氯有机物氢解过程中,能促使氢气分子分解成氢原子,且吸附于Ni金属表面,增加了氢原子还原几率[20].具有催化作用的Ni增强了双金属表面原子氢的生成,从而改变了铁的电子特性;随后吸附在Fe-Ni表面的氯代烃的C-Cl发生断裂,Cl被H所取代[21].沉积在ZVI颗粒表面的Ni对CCl4的还原脱氯具有较强的催化作用,随着Ni负载量的增加,在ZVI颗粒表面的Ni数量增多,与基体金属形成更多的Ni-Fe电偶电池,体系的表观准一级反应速率常数明显增加.当催化金属的质量增大到一定程度后,其强化作用趋于平缓,甚至造成降解效率的降低.在本项研究中,负载量为1.0wt%的Ni-Fe体系的CCl4脱氯速率最高,是ZVI体系的2.17倍.
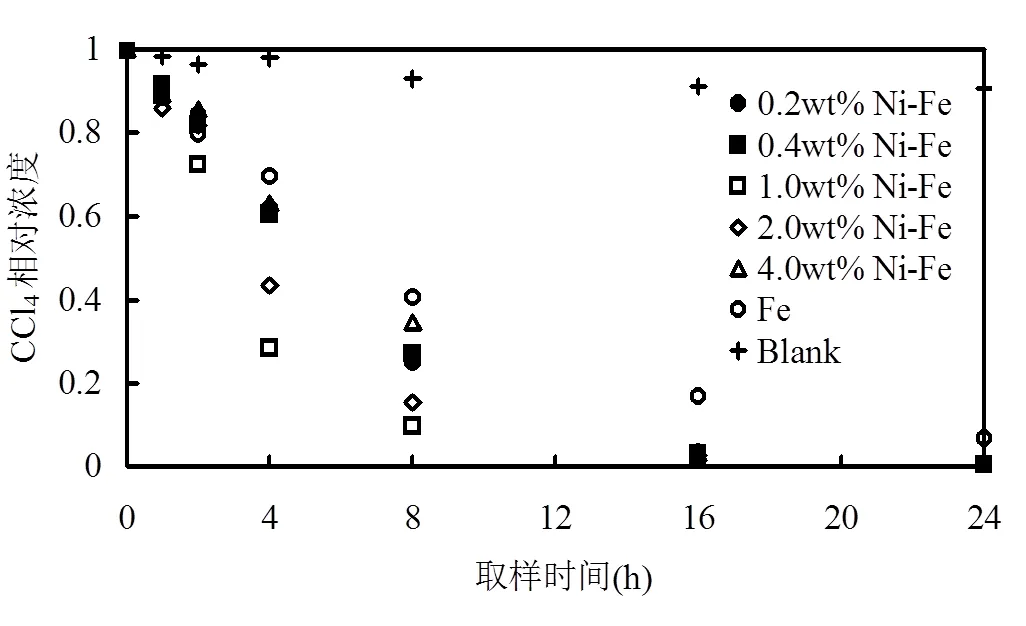
图4 Ni-Fe双金属颗粒对CCl4的降解情况
与Ni-Fe体系相似,Cu-Fe、Ag-Fe 2个双金属体系中CCl4的降解效率随着Cu、Ag负载量的增加也呈现出先增加后减小的趋势(图5、图6).但这2种体系对CCl4的降解速率较Ni-Fe体系高.对于Cu-Fe体系中,反应120min时CCl4的降解率达到90%以上;不同Cu负载量(0.0wt%、0.2wt%、0.4wt%、1.0wt%、2.0wt%、4.0wt%)的obs分别为0.112h-1(2=0.999)、1.261h-1(2=0.999)、1.281h-1(2=0.996)、2.480h-1(2=0.967)、2.345h-1(2=0.958)、2.256h-1(2= 0.944).虽然负载量1.0wt%的Cu-Fe体系的CCl4还原脱氯速率仅略高于负载量为2.0wt%和4.0wt%的,但却明显高于ZVI体系,是ZVI体系的22.1倍.与Fe-Ni体系类似,ZVI的直接还原和Cu的催化加氢是Fe-Ni体系中氯代烃类的主要去除机制[22].
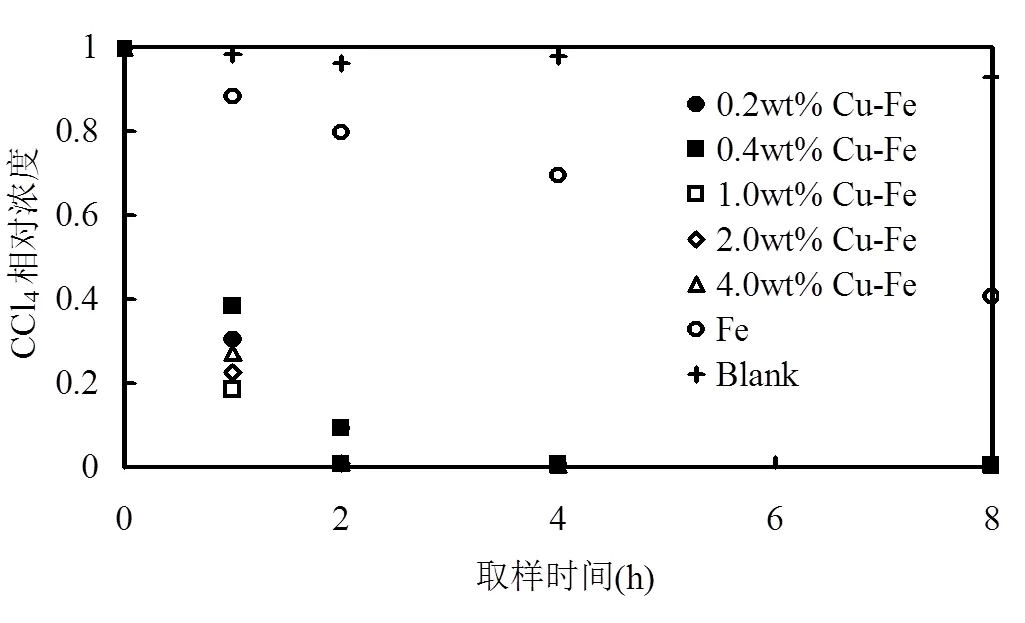
图5 Cu-Fe双金属颗粒对CCl4的降解情况
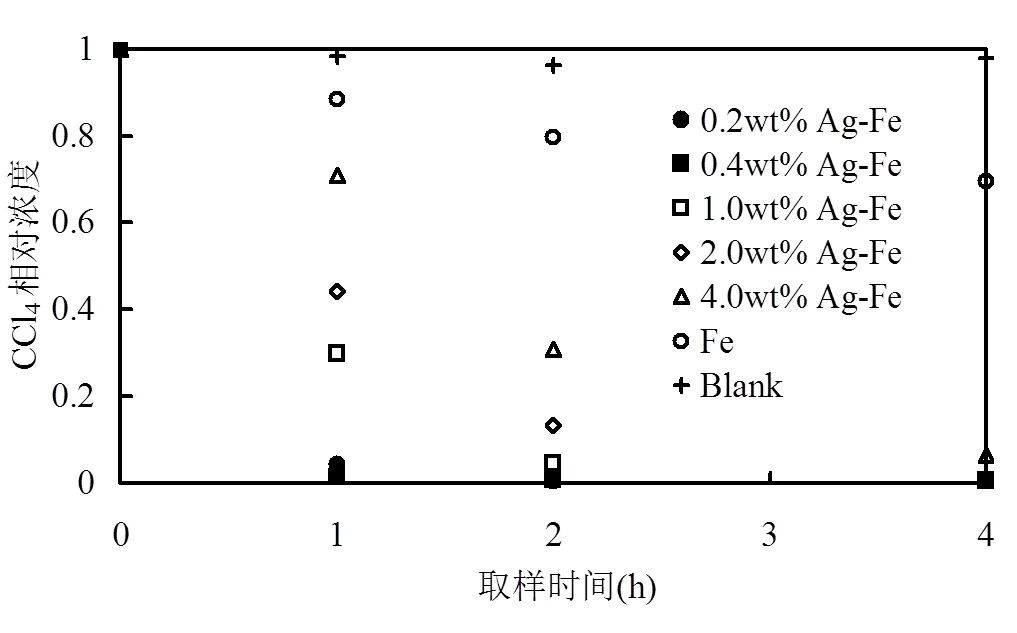
图6 Ag-Fe双金属颗粒对CCl4的降解情况
图6为Ag-Fe双金属颗粒对CCl4的降解,可以看出,反应60min后,负载量为0.2wt%和0.4wt%的体系中CCl4降解效率分别为94.7%和98.6%,而负载量为4.0wt%的Ag-Fe,其CCl4降解效率仅为30.1%.总体来说,Ag负载量低于1.0wt%的体系CCl4降解效果较好.沉积在ZVI颗粒外层的金属Ag在CCl4的还原过程中起着重要的催化作用,它不但可以加速铁的腐蚀和氢气的产生,并且能将所产生的氢气吸附在颗粒外层并加以活化,这会提供更多的表面活性位点,使其反应活性提高,从而提高了降解效率[23].
综上所述,负载Ni、Cu、Ag催化剂,可以强化ZVI对CCl4的还原脱氯效果,双金属体系对CCl4的脱氯降解速率顺序为:Ag-Fe>Cu-Fe>Ni-Fe.这与O'Loughlin等[24]、吴德利等[25]的研究成果类似.实验结果显示:CCl4在双金属体系中的降解途径为ZVI表面的直接还原[式(2)]和催化金属的催化加氢还原[式(3)~式(6)]2种;同时也表明,pH值是影响氯代有机物降解速率的重要参数.
(a)ZVI的直接还原:
Fe0+CCl4+H+→Fe2++CHCl3+Cl-(2)
(b)催化加氢还原:
电子传递:
Fe→Fe2++2e-(3)
2H2O+2e-→H2+2OH-(4)
活化:2M (M=Ni, Cu, Ag) + H2→2M-H*(5)
加氢反应:M-H*+CCl4→M+CHCl3+H+(6)
2.2.2 不同铁基双金属体系对CCl4降解的差异性分析 一般认为,双金属对污染物的去除作用主要包括两种机制[26-27]:(1)通过复合金属(Ni、Cu、Pd)的氧化还原电位诱导ZVI释放出电子,克服了氧化还原反应中电子传递的自我抑制,加速还原脱氯反应;(2)第二种金属作为催化剂,在加氢反应中,可以促进颗粒表面活性氢的生成并改变Fe的电子特性,从而有利于电子和活性氢传递到目标污染物,有效提高加氢脱卤反应效率.溶液中存在不同类型金属元素时,由于其腐蚀电位的差异,导致腐蚀电位较负的金属(阳极)腐蚀速度增大,而腐蚀电位较正的金属(阴极)的腐蚀过程受到抑制,这种现象称之为电偶腐蚀[28].双金属对氯代有机物的还原脱氯行为与电偶腐蚀类似.ZVI是中强还原剂,Fe/Fe2+的标准电极电位为-0.44V.ZVI负载第二种金属后,沉积在ZVI颗粒表面的金属颗粒(如Ni、Cu、Ag)与Fe组成无数微小的腐蚀电池(如图7所示,其中Fe为阳极,第二种金属为阴极),加速了铁的腐蚀和电子释放速率,从而强化了CCl4的脱氯降解作用.Ni/Ni2+、Cu/Cu2+、Ag/Ag+的标准电极电位分别为-0.28,+0.34, +0.80V[29],所以组成Ni-Fe、Cu-Fe、Ag-Fe原电池后,其电池电动势可以达到0.16,0.78,1.24V,因此在上述双金属体系中铁的腐蚀速率大小顺序为Ag- Fe>Cu-Fe>Ni-Fe体系.
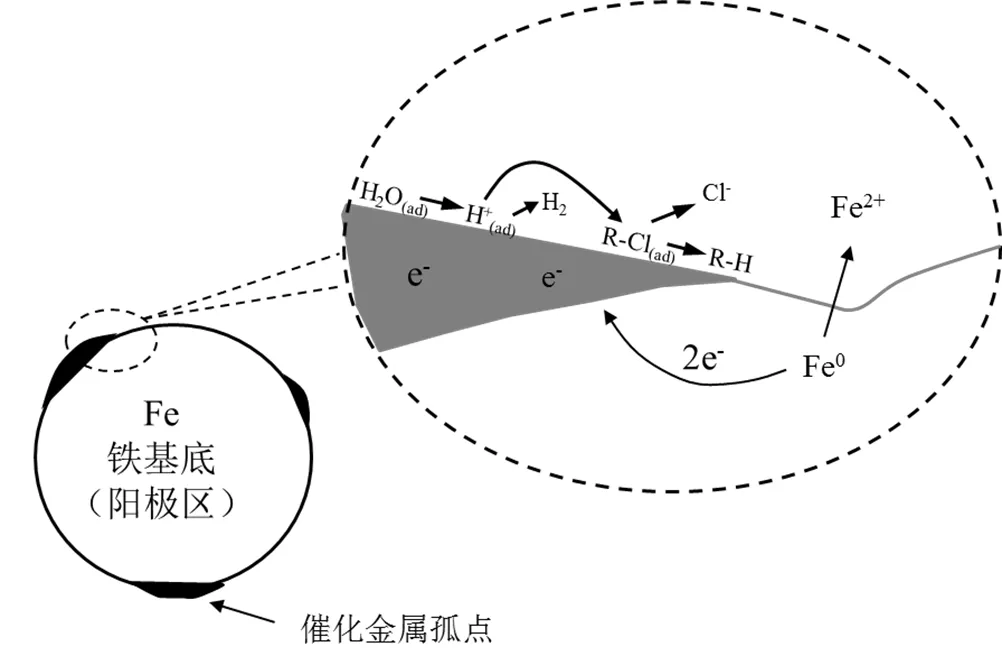
图7 厌氧腐蚀介质中双金属的腐蚀过程示意
3 结论
3.1 采用沉积置换法制备了Ni-Fe、Cu-Fe、Ag-Fe双金属颗粒,通过表面形态及元素组成分析发现催化金属非均匀地沉积在铁基体上,而且双金属颗粒表面发生了氧化.
3.2 催化金属的负载可以明显强化CCl4的还原降解速率,但其负载量具有合理的范围,Ni-Fe中Fe的负载量在1.0wt%、Cu-Fe中Cu的负载量在1.0wt%、Ag-Fe中Ag的负载量在0.4wt%比较适宜. 1.0wt%Ni-Fe体系、1.0wt%Cu-Fe体系对CCl4还原脱氯速率分别是ZVI体系的2.17、22.1倍.
3.3 催化金属的作用包括促进ZVI的电子释放、提供更多的活性反应位点和催化作用. Ni-Fe、Cu-Fe、Ag-Fe对CCl4的还原降解速率大小顺序与其腐蚀原电池电动势的顺序一致,即Ag-Fe对CCl4的降解速率最快,Cu-Fe次之,Ni-Fe最小.
[1] Tratnyek P G, Johnson R L. Nanotechnologies for environmental cleanup [J]. Nano Today, 2006,1(2):44-48.
[2] Brown R A. Chemical oxidation and reduction for chlorinated solvent remediation [A]. In situ remediation of chlorinated solvent plumes [C]. Springer New York, 2010:481-535.
[3] 刘秋龙,杨 昱,夏 甫,等.地下水中阴离子对球磨零价铁除砷影响[J]. 中国环境科学, 2019,39(5):2028-2033. Liu Q L, Yang Y, Xia F, et al. Impact of groundwater anions on the arsenic remove by ball milling zero valent iron [J]. China Environmental Science, 2019,39(5):2028-2033.
[4] 张 瑾,魏才倢,白 鸽,等.多聚物吸附纳米零价铁在多孔介质中的迁移[J]. 中国环境科学, 2018,38(10):149-156.Zhang J, Wei C J, Bai G, et al. Transport of PAA modified nanoscale zero-valent iron in water saturated porous media [J]. China Environmental Science, 2018,38(10):3747-3754.
[5] 林英杰,张 硕,孙力平,等. VB12协同Fe/Cu双金属去除二氯甲烷过程调控与机理[J]. 中国环境科学, 2016,36(9):2650-2657.Lin Y J, Zhang S, Sun L P. Synergistic effect of vitamin B12and Fe/Cu bimetal on reduction of dichloromethane: Mechanism study and process control [J]. China Environmental Science, 2016,36(9):2650- 2657.
[6] Wu H, Feng Q. Fabrication of bimetallic Ag/Fe immobilized on modified biochar for removal of carbon tetrachloride [J]. Journal of Environmental Sciences, 2017,54:346-357.
[7] Xie Y, Cwiertny D M. Chlorinated solvent transformation by palladized zerovalent iron: Mechanistic insights from reductant loading studies and solvent kinetic isotope effects [J]. Environmental Science & Technology, 2013,47(14):7940-7948.
[8] O’Carroll D, Sleep B, Krol M, et al. Nanoscale zero valent iron and bimetallic particles for contaminated site remediation[J]. Advances in Water Resources, 2013,51:104-122.
[9] Cwiertny D M, Bransfield S J, Livi K J, et al. Exploring the influence of granular iron additives on 1,1,1-Trichloroethane Reduction [J]. Environmental Science & Technology, 2006,21(40):6837-6843.
[10] Lai B, Zhang Y, Chen Z, et al. Removal of p-nitrophenol (PNP) in aqueous solution by the micron-scale iron-copper (Fe/Cu) bimetallic particles [J]. Applied Catalysis B: Environmental, 2014,144:816-830.
[11] 高珊珊,李 杰,任明忠,等.超声辅助海绵铁/银双金属降解四溴双酚A及生物毒性初步评价[J]. 兰州交通大学学报, 2013,32(3):122- 127.Gao S S, Li J, Ren M Z, et al. Degradation of tetrabromobisphenol A by granular sponge iron/silver bimetallic particles under the ultrasound irradiation and assessment of its bio-toxicity [J]. Journal of Lanzhou Jiaotong University, 2013,32(3):122-127.
[12] Li X, Zhang W. Sequestration of metal cations with zerovalent iron nanoparticles a study with high resolution X-ray photoelectron spectroscopy (HR-XPS) [J]. The Journal of Physical Chemistry C, 2007,111(19):6939-6946.
[13] Prieto P, Nistor V, Nouneh K, et al. XPS study of silver, nickel and bimetallic silver–nickel nanoparticles prepared by seed-mediated growth [J]. Applied Surface Science, 2012,258(22):8807-8813.
[14] Li X, Zhang W. Iron nanoparticles: the core-shell structure and unique properties for Ni (II) sequestration [J]. Langmuir, 2006,22(10):4638- 4642.
[15] Bae S, Lee W. Influence of riboflavin on nanoscale zero-valent iron reactivity during the degradation of carbon tetrachloride [J]. Environmental Science & Technology, 2014,48(4):2368-2376.
[16] Gotpagar J, Grulke E, Tsang T, et al. Reductive dehalogenation of trichloroethylene using zero-valent iron [J]. Environmental Progress, 1997,16(2):137-143.
[17] Lien H L, Zhang W X. Nanoscale Pd/Fe bimetallic particles: catalytic effects of palladium on hydrodechlorination [J]. Applied Catalysis B: Environmental, 2007,77(1):110-116.
[18] Kim H, Hong H J, Lee Y J, et al. Degradation of trichloroethylene by zero-valent iron immobilized in cationic exchange membrane [J]. Desalination, 2008,223(1):212-220.
[19] Clark C J, Rao P S C, Annable M D. Degradation of perchloroethylene in cosolvent solutions by zero-valent iron [J]. Journal of Hazardous Materials, 2003,B96:65-78.
[20] Shrimali M, Singh K P. New methods of nitrate removal from water [J]. Environmental Pollution, 2001,112(3):351-359.
[21] Schrick B, Blough J L, Jones A D, et al. Hydrodechlorination of trichloroethylene to hydrocarbons using bimetallic nickel–iron nanoparticles [J]. Chemistry of Materials, 2002,14:5140-5147.
[22] Noubactep C, Schöner A. Fe0-based alloys for environmental remediation: Thinking outside the box [J]. Journal of Hazardous Materials, 2009,165(1):1210-1214.
[23] Luo S, Yang S, Wang X, et al. Reductive degradation of tetrabromobisphenol A over iron–silver bimetallic nanoparticles under ultrasound radiation [J]. Chemosphere, 2010,79(6):672-678.
[24] O'Loughlin E J, Kemner K M, Burris D R. Effects of AgI, AuIII, and CuIIon the reductive dechlorination of carbon tetrachloride by green rust [J]. Environmental Science & Technology, 2003,37(13):2905- 2912.
[25] 吴德礼,王红武,樊金红,等.Fe0催化还原转化水中CCl4的实验研究[J]. 环境科学, 2009,29(12):3433-3438. Wu D L, Wang H W, Fang J H, et al. Catalytic Reduction of CCl4in Water by Fe0and Amended Fe0[J]. Environmental Science, 2008, 29(12):3433-3438.
[26] Gavaskar A R. Design and construction techniques for permeable reactive barriers [J]. Journal of Hazardous Materials, 1999,68(1):41- 71.
[27] Liu W J, Qian T T, Jiang H. Bimetallic Fe nanoparticles: Recent advances in synthesis and application in catalytic elimination of environmental pollutants [J]. Chemical Engineering Journal, 2014, 236:448-463.
[28] 王 健,王绍青.铝合金表面电偶腐蚀与电子功函数的关系[J]. 物理化学学报, 2014,30(3):551-558. Wang J, Wang S Q. Correlation between galvanic corrosion and electronic work function of Al alloy surface [J]. Acta Physico-Chimica Sinica, 2014,30(3):551-558.
[29] Brezonik P L, Arnold W A. Water Chemistry [M]. New York: Oxford University Press, 2011:414.
Enhanced degradation of carbon tetrachloride with iron-based bimetallic particles in groundwater.
ZHU Xue-qiang1*, HAN Bao-ping2
(1.School of Environmental Science and Spatial Informatics, China University of Mining and Technology, Xuzhou 221116, China;2.School of Geography & Geomatics and Urban-rural Planning, Jiangsu Normal University, Xuzhou 221116, China)., 2019,39(8):3358~3364
Micro-scale bimetallic Ni-Fe, Cu-Fe, Ag-Fe particles were synthesized by displacement plating. The structures were characterized with scanning electron microscope (SEM) and X-ray photoelectron spectroscopy (XPS). The SEM/XPS results showed Ni, Cu, Ag were non-uniformly deposited on the iron matrix, and the surface of the bimetallic particles were oxidized. The variation of CCl4degradation rate was rather sensitive with the loading ratio of catalytic metal. The suitable loading ratios of Ni, Cu and Ag in Ni-Fe, Cu-Fe and Ag-Fe bimetal were 1.0wt%, 0.8wt% and 0.4wt% respectively. The CCl4degradation pathways in the bimetallic system mainly included direct reduction on zero-valent iron surface and catalytic hydrogenation reduction on catalytic metal surface. Fe-Ag achieved the highest CCl4degradation efficiency among the tested bimetals, followed by Cu-Fe and Ni-Fe.
carbon tetrachloride;iron-based bimetal;degradation;catalytic hydrogenation reduction
X703.5
A
1000-6923(2019)08-3358-07
朱雪强(1979-),男,江苏昆山人,讲师,博士,主要从事土壤地下水污染与修复研究.发表论文20余篇.
2019-01-10
国家自然科学基金资助项目(41472223)
* 责任作者, 讲师, zhuxq0615@163.com
