丽格海棠外植体组织培养的研究
2019-08-28于非
于 非
(黑龙江省农科院园艺分院,哈尔滨150069)
丽格海棠(Begoniaelatior)又名玫瑰海棠,为秋海棠科秋海棠属的多年生草本花卉[1],当今世界著名的盆栽花卉之一,具有极高的观赏及经济价值。其花色鲜艳,花色品种多,不但是优质园林绿化用花,还是优良的家庭用花。据调查仅黑龙江省海棠每年园林绿化用花在2000万盆以上,家庭用盆花每年在50万盆左右。具有较高的观赏和经济价值的室内花卉,开发前景极其广阔[2]。
丽格海棠目前的传统繁育方式是有性繁殖和无性繁殖。有性繁殖即种子播种,由于丽格海棠是杂交的产物,胚胎发育不完全,所以不宜发芽,开花后结籽少,种子发芽率很低,不能保持母本的优良特性等缺点,一般种子播种不作为商业化生产的繁育手段;无性繁育即茎段扦插,丽格海棠对环境条件要求高,分蘖力弱,茎段扦插成活率与繁殖系数低, 种质退化严重[3],并且长期无性繁殖还会造成病毒在植物体内传递累积,严重影响花卉产品的质量和产量,很难满足当前花卉产业发展的要求。本试验通过对丽格海棠不同部位外植体的研究,筛选出适合丽格海棠组织培养快繁的培养基,为建立丽格海棠再生体系奠定基础,提高丽格海棠商品化生产效率提供技术支持[4]。
1 材料与方法
1.1 试验材料
本试验采用丽格海棠品种巴克斯(Barkos),采集地点为黑龙江省农业科学院园艺分院智能化温室。将采集的丽格海棠嫩叶片、叶柄、茎段放于流水下冲洗20 min,置于超净工作台上先用75%的酒精消毒20~30s,蒸馏水冲洗3次。再用0.1%的升汞浸泡摇匀消毒4~6min,蒸馏水冲洗3次,将消毒好的外植体放于经过高温灭菌的蒸馏水中并盖好瓶盖,然后用消过毒的解剖刀对外植体进行切割,叶片切成1cm×1cm大小,叶柄、茎段切成1cm左右,接种到不定芽分生培养基上。
1.2 试验方法
1.2.1 不同部位外植体的不定芽诱导情况。诱导不定芽分生的基础培养基为MS培养基,含 30g/L蔗糖,7g/L琼脂,pH=5.7,添加不同浓度的6-BA、TDZ和2.4-D,共组成6种培养基组合:MS+1mg/L TDZ、MS + 1mg/L TDZ+0.1mg/L 2,4-D、MS+1mg/L TDZ+0.3mg/L 2,4-D、MS+2mg/L TDZ、MS+1mg/L 6-BA+0.1mg/L TDZ、MS+1mg/L 6-BA+0.3mg/L TDZ,每种培养基分别接入不同部位外植体各30个,重复3次,培养室温度26±2℃,光照 1200 lx左右,每天光照 10~12h,4周后观察其不定芽诱导情况。
1.2.2 不定芽的继代增殖。将诱导出已分生的不定芽切下接种到继代增殖培养基中,继代增殖培养基为MS附加6-BA和NAA,共组成9种培养基,MS+1mg/L 6-BA;MS+1mg/L 6-BA+0.1mg/L NAA;MS+1mg/L 6-BA+0.3mg/L NAA;MS+1mg/L 6-BA+0.5mg/L NAA;MS+2mg/L 6-BA;MS+2mg/L 6-BA+0.1mg/L NAA;MS+2mg/L 6-BA+0.3mg/L NAA;MS+mg/L 6-BA+0.5mg/L NAA; MS+3mg/L 6-BA。4周继代一次,观察高度大于2.5cm 的不定芽增殖情况。
1.2.3 组培苗的生根。将高度大于2.5cm的组培苗切下接种到生根培养基中,生根培养基为MS附加IBA和NAA,共组成9种培养基,MS+0.1mg/L IBA;MS+0.1mg/L IBA+0.1mg/L NAA;MS+0.1mg/L IBA+0.3mg/L NAA;MS+0.3mg/L IBA;MS+0.3mg/L IBA+0.1mg/L NAA;MS+0.3mg/L IBA+0.3mg/L NAA;MS+0.5mg/L IBA;MS+0.5mg/L IBA+0.1mg/L NAA; MS+0.5mg/L IBA+0.3mg/L NAA。4周后观察其生根情况。
2 结果与分析
2.1 适宜不同部位外植体不定芽分生的培养基
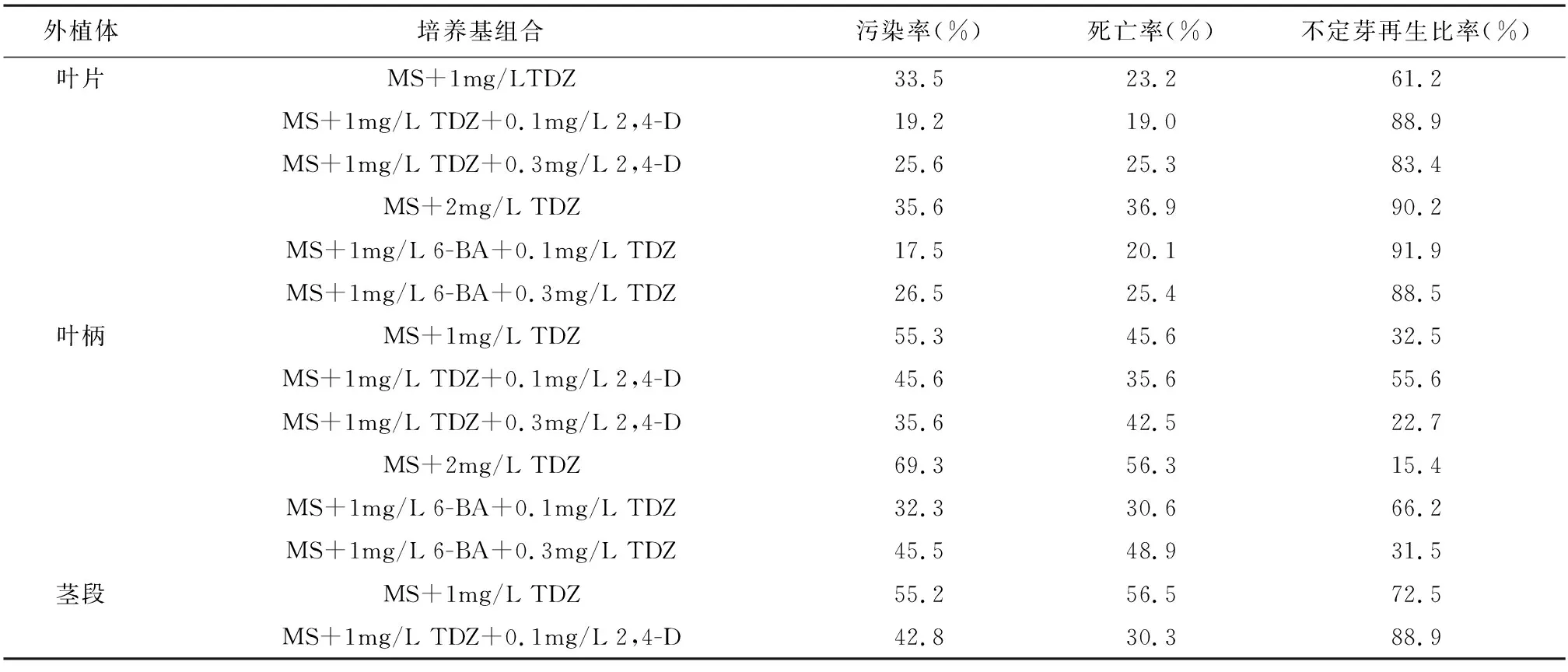
表1 不同部位外植体的不定芽分生情况
续表1

外植体培养基组合污染率(%)死亡率(%)不定芽再生比率(%)MS+1mg/L TDZ+0.3mg/L 2,4-D41.235.665.2MS+2mg/L TDZ59.449.533.2MS+1mg/L 6-BA+0.1mg/L TDZ39.220.587.3MS+1mg/L 6-BA+0.3mg/L TDZ33.536.970.2
由表1可知,丽格海棠不同部位的外植体都有诱导不定芽成功的几率。观察表明,叶片在10d左右周围组织开始膨大变绿形成愈伤,在20d左右就有不定芽产生,其中不定芽可以从愈伤组织里产生也可以直接从叶片上产生。叶片的不定芽再生比率最高可以达到90%左右,最适宜叶片不定芽分生的培养基为MS+1mg/L TDZ+0.1mg/L 2,4-D或MS+1mg/L 6-BA+0.1mg/L TDZ;叶柄在25d左右形成愈伤组织并产生不定芽,叶柄在诱导的过程中污染率和死亡率都较高,并且不定芽再生比率较低,其中最适宜叶柄不定芽分生的培养基为MS+1mg/L 6-BA+0.1mg/L TDZ,再生率为66.2%;茎段在培养30d以后在绿的皮层处和边缘处产生不定芽,茎段在诱导的过程中污染率和死亡率比前两者都高,但是再生率高于叶柄,最适宜茎段不定芽分生的培养基为MS+1mg/L TDZ+0.1mg/L 2,4-D或MS+1mg/L 6-BA+0.1mg/L TDZ,再生率可达88.9%。综上所述,不同部位外植体都可诱导出不定芽,不定芽的再生率叶片>茎段>叶柄。
2.2 不定芽的继代增殖
将诱导出的不定芽切割后转入到继代增殖培养基中,30d后新的不定芽叶子膨胀展开,株高增高显著,苗茎变粗形成小的植株。由表2可知,随着6-BA浓度的增高不定芽分化速度加快和增殖倍数提高但6-BA浓度达到3mg/L时,芽生长势减弱;随着NAA浓度的提高易生成根,根生成后不定芽增殖速度减慢,因此,丽格海棠不定芽增殖的最佳培养基为MS+2mg/L 6-BA+0~0.1mg/L NAA,增殖系数可达5.8。

表2 不定芽的继代增殖
2.3 组培苗的生根
由表3得出IBA浓度的升高对丽格海棠组培苗生根有促进作用,但IBA浓度达到0.3 mg/L以上,对组培苗生长有抑制作用,添加0.1mg/LNAA可以促进组培苗生长,但当NAA浓度达到0.3 mg/L以上,出现叶片枯萎现象,因此,组培苗生根可选用0.1~0.3mg/L IBA,可添加0.1mg/L NAA促进组培苗生长。
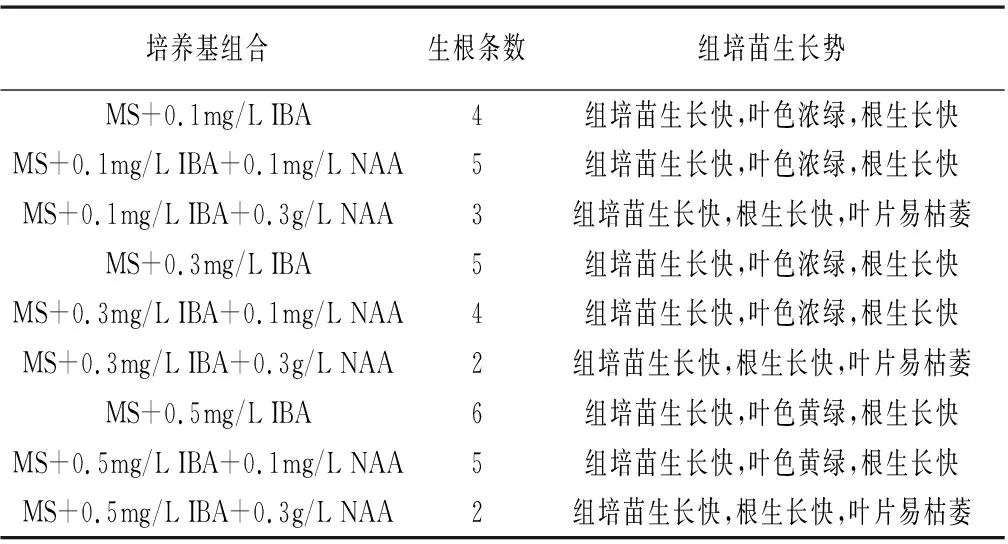
表3 组培苗的生根
3 结论与讨论
外植体的选择是丽格海棠组织培养体系建立的关键。植物细胞具有全能型,所以不同部位的外植体都可能诱导成株,但是不同部位的的外植体再生能力上有较大的区别。本文研究表明:适宜丽格海棠叶片的不定芽再生培养基为MS+1mg/LTDZ+0.1mg/L2,4-D或MS+1mg/L6-BA+0.1mg/LTDZ,培养4周后的不定芽再生率可以达到90.2%;适宜叶柄的不定芽再生培养基为MS+1mg/L6-BA+0.1mg/LTDZ,培养4周后不定芽再生率可达66.2%;适宜茎段的不定芽再生培养基为MS+1mg/LTDZ+0.1mg/L2,4-D或MS+1mg/L6-BA+0.1mg/LTDZ,再生率可达88.9%;该研究对叶片、叶柄和茎段外植体的污染率、死亡率和不定芽再生率进行比较表明,适宜三者的不定芽培养基基本相同,在相同培养基的条件下,叶片的污染率和死亡率都较低,不定芽再生率最高;叶柄的不定芽再生率最低,一般不作为丽格海棠组织培养的外植体选用;茎段的污染率和死亡率最高,但是再生率高于叶柄;所以按不定芽适宜的外植体为叶片>茎段>叶柄。
将培养的不定芽从叶片切下接种到继代增殖培养基上,最佳的不定芽继代增殖培养基激素组合为MS+2mg/L 6-BA+0~0.1mg/L NAA,增殖系数可达5.8,根据具体需求可继续进行增殖,每4周继代1次;将高度为2.5cm以上的组培苗转接到生根培养基上,最佳的生根培养基激素组合为MS + 0.1~0.3mg/L IBA,组培苗生根后且长度达到5cm以上可移栽驯化。实验得出随着细胞分裂素浓度的增加对不定芽再生和增殖均有促进作用,但当浓度超出一定范围时,对不定芽再生和增殖起到了抑制的作用;高浓度的IBA对丽格海棠组培苗的生根和生长有促进作用,但是抑制了组培苗的增长,出现黄叶枯萎现象。因此,在生产中应结合不定芽和组培苗生长势而调节激素浓度。丽格海棠组培苗叶片和茎较脆,在生根时建议切成丛状,利于生根和驯化。
