蝉花多糖提取工艺的优化
2019-08-28黄小忠高大响张雪松宋刚曾凡乐
黄小忠,高大响,张雪松,宋刚,曾凡乐
(江苏农林职业技术学院,江苏 句容 212400)
蝉花(Cordycepscicadae)俗称大蝉草,是一种被麦角菌科真菌感染寄生在幼蝉虫体内形成的一种菌虫复合体。拟青霉菌通过感染蝉幼虫后[1],寄生在虫体内,将虫体内的营养转化成菌丝体,待到环境条件适合时,菌丝分化,从蝉的头部形成子实体,且在子实体的顶端会长出具有繁殖功能的孢子。蝉花是我国传统的药用真菌之一,与冬虫夏草有着相似的功效[2]。经医学研究证明,蝉花具有降血糖及增强免疫力、降血压、抗肿瘤、改善肾功能等作用[3]。
蝉花包括三个结构:菌壳、孢梗束、蝉花孢子。蝉花中的有效成分包括多球壳菌素、核苷类成分、麦角固醇及其过氧化物、环肽化合物、多糖、虫草酸等,其中真菌多糖被广泛应用到医疗方面。多糖的提取方法有水提法、微波法、超声波辅助法、苯酚硫酸法、酶解法等[4],水提法因其操作简单、仪器设备要求不高、所需材料简单而应用广泛。本试验通过对几种提取条件的考察,优化多糖提取工艺,旨在为相关产品开发研究提供参考。
1 材料与方法
1.1 材料
蝉花菌种来自江苏食用菌研究所。
1.2 方法
1.2.1 干燥蝉花菌体准备
将新鲜蝉花子实体用蒸馏水浸泡0.5 h,用软毛刷将菌体上残土去除,再用蒸馏水清洗5次,确保菌体无多余杂质。将沥水后的蝉花菌体平放在铺有干净纸张瓷盘中,60 ℃烘箱中干燥至恒重[5]。
1.2.2 蝉花菌体的粉碎
干燥蝉花菌体经粉碎机粉碎5 min,用40目(孔径0.42 mm)筛子过筛,弃杂质,再用60目(孔径0.25 mm)筛子过筛。菌粉呈棕褐色,无杂质[6]。
1.2.3 料液比单因素试验
取50 mL烧杯空杯称重,然后加入2 g蝉花菌体粉,再分别加入25、20、15、10、5倍纯水,用玻璃棒搅匀,用保鲜膜将烧杯封口并编号,于阴凉干燥的室温下放置6 h,后放进超声细胞破碎仪,调整好高度,破碎仪的探头应在烧杯液体平面下1 cm。调整破碎仪的变幅杆选择开关至Φ6,超声5 s,间隔6 s,温度60 ℃,时间30 min,取出烧杯。保鲜膜封口,60 ℃水浴1 h,将烧杯中的液体移至50 mL离心管,用10 mL纯水洗净残渣至离心管,3 000 r·min-1离心5 min,胶头滴管吸管吸取上清液。将收集好的上清液用旋转蒸发仪60 ℃蒸发浓缩,收集浓缩液,加入4倍浓缩液体积的95%乙醇,保鲜膜封口后于4 ℃冰箱过夜。待多糖沉淀析出后,敞口将烧杯放进60 ℃的水浴锅内挥发酒精,等烧杯中无明显液体后,把烧杯放进60 ℃烘箱干燥4 h,以上每个样品做3个平行样。
1.2.4 预浸泡时间单因素试验
取50 mL烧杯空杯称重,然后加入2 g蝉花菌体粉,再各加入20倍的纯水并搅匀,用保鲜膜将烧杯封口并编号,在阴凉干燥的室温下分别进行3、4、5、6、7 h的预浸泡处理,其余操作同上,每个样品做3个平行样。
1.2.5 超声时间单因素试验
取50 mL烧杯空杯称重,然后加入2 g蝉花菌体粉,再各加入20倍的纯水搅匀,用保鲜膜将烧杯封口并编号,阴凉干燥的室温下放置6 h。将烧杯放进超声细胞破碎仪,调整好高度,破碎仪的探头应在烧杯的液体平面下1 cm。调整破碎仪的变幅杆选择开关至Φ6,60 ℃的条件下分别处理10、20、30、40、50 min。其余操作同上,每个样品做3个平行样。
1.2.6 标准曲线的制作
精密称取适量的葡萄糖,加入纯水定容配制成0.1 mg·mL-1的葡萄糖标准溶液。取7只试管,用吸量管准确吸取分别加入1.1、0.9、0.7、0.5、0.3、0.1、0 mL上述溶液,定容至2.0 mL,加入1.0 mL 6%苯酚溶液混匀,加5.0 mL浓硫酸,混匀静置冷却至室温,沸水浴15 min,冷却至室温。分光光度计测定490 nm处的吸光值,纵坐标是测定的吸光值,横坐标是葡萄糖标准品的质量浓度(mg·mL-1),得到回归方程y=0.194x+0.013 7,R2=0.990 3。
1.2.7 蝉花多糖提取
精密称取适量的蝉花多糖,加入纯水定容配制成0.2 mg·mL-1的多糖溶液,用吸量管准确吸取上述溶液0.5 mL加入到容量瓶中,加水定容至2.0 mL,测定条件参考标准曲线的做法[7-8]。将所得的蝉花多糖吸光值代入上述的回归方程,计算出多糖质量浓度,计算蝉花多糖提取率。
1.2.8 正交试验
由单因素试验可得水浴时间、预浸泡时间、料液比、超声时间等单因素的最适范围,因水提时间单因素与标准曲线比较后显示影响不大,所以正交试验不再做水提时间的设计,选取水提1 h为标准操作时间。表1为设计的正交因素水平,选取预浸泡时间(A)、料液比(B)、超声时间(C)3因素的最典型条件进行正交试验。1~3水平A分别为5.5、6.0和6.5 h,B分别为15、20和25倍,C分别为35、40和45 min。
1.2.9 数据整理
菌粉称取质量、烧杯空杯重量、称取的蝉花多糖质量等精确至0.1/1 000,采用Excel 2010对蝉花多糖提取数据进行统计分析。
2 结果与分析
2.1 单因素
2.1.1 料液比
蝉花多糖的提取率受料液比影响明显。从图1可知,20倍的料液比的提取率最高,表示提取的蝉花多糖含量最高。
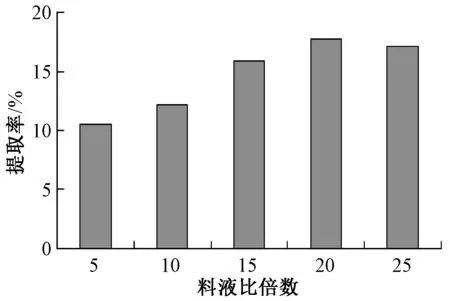
图1 料液比倍数与提取率的关系
2.1.2 预浸泡时间
从图2可知,提取率随着预浸泡时间的增加而增大,到达一定时间后,提取率达到最大值,继续增加浸泡时间,提取率随之减小。6 h的预浸泡时间提取的蝉花多糖提取率最高。

图2 预浸泡时间与提取率的关系
2.1.3 超声时间
超声时间对蝉花多糖的提取有明显影响。从图3可知,10和20 min超声时间时的提取率较低,30 min超声的提取率开始大幅增加,可见超声时间对于蝉花多糖的提取率影响较大。结果表明,40 min超声时提取率达到最大,随后开始降低。
2.2 正交试验
将正交试验设计按照单因素的步骤操作试验,得到的试验结果如表1。
由表1可知,对于蝉花多糖提取率来说,超声时间对其影响最大,其次是料液比因素,最后是预浸泡时间。通过正交试验可得,最好的提取条件为45 min的超声时间、20倍的料液比和6.5 h的预浸泡时间。
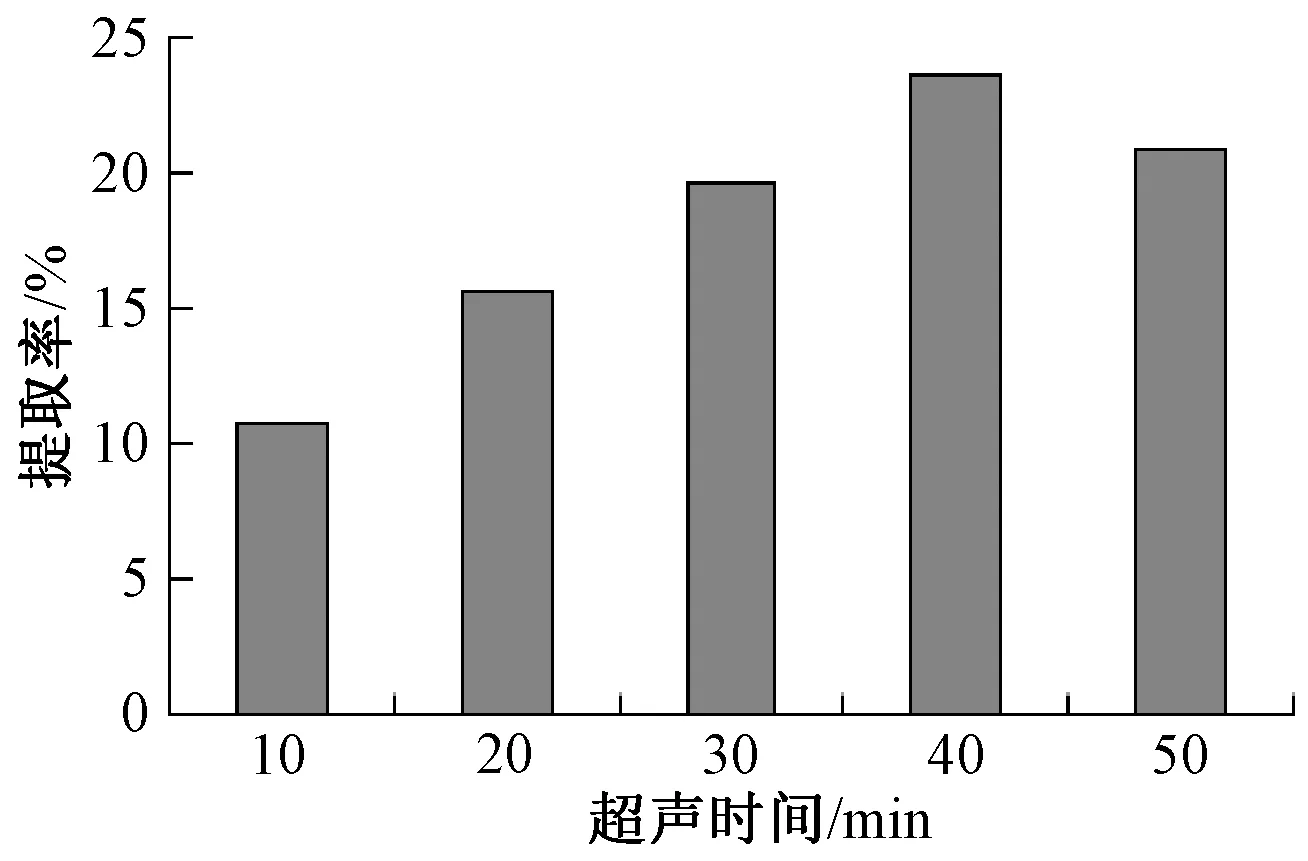
图3 超声时间与提取率的关系

组合号ABC提取率/%111115.2212218.3313327.6421220.2522325.2623117.8731328.1832125.3933220.2K161.263.558.3K268.268.858.7K373.665.681.0K120.421.219.4K221.122.919.6K324.521.927.0R4.11.87.6
2.3 各因子对蝉花多糖提取的影响
2.3.1 超声时间
在45 min的超声时间范围内,蝉花多糖提取率达到最大值,这可能是因为超声处理会使菌粉在溶液中产生空化破裂,提取剂进入菌粉细胞组织内部,使多糖可以更好的溶出。但随着时间的推移,提取剂中的水溶性杂质浓度越来越高,提取剂中的传质阻力越来越大,且破碎仪的工作效率很高,所具有的机械剪切能力很强,会导致多糖中的糖链断裂,其多糖的药理活性会受到影响。超声时间太短不能充分裂解蝉花细胞,试验表明,45 min左右的超声时间为最佳。
2.3.2 预浸泡时间
蝉花粗多糖的提取率在一定范围内会随着预浸
泡时间的增加而增加,3 h的预浸泡时间的提取率较低,6 h预浸泡达到较大值,是前者的2倍之多,而6.5 h后提取率开始降低。随着浸泡时间的增长,提取剂中多糖浓度增大,多糖的传质作用变缓。预浸泡时间太短,多糖不能充分溶解,因此,浸泡时间不宜过长或过短,6.5 h左右最适宜。
2.3.3 料液比
随着提取剂量的增大,蝉花粗多糖的提取率也随着升高,达最大提取率时,料液比是1∶20,之后随着料液比增加,提取率不再增加。如果提取剂比例太小,溶剂不能使菌粉充分浸透,提取率则降低,蝉花粗多糖不能完全被浸泡出来。而溶剂过多,会导致提取浓度过低。试验表明,20倍的料液比是最适比例。
3 小结与讨论
通过正交试验表明,各因素对蝉花多糖提取率的影响程度为超声时间>预浸泡时间>料液比,最优提取条件为45 min超声时间、20倍料液比、6.5 h预浸泡时间,提取率达27.0%。优化多糖提取工艺,打破传统提取方法,探索更好的提取条件,使提取工艺更加方便、快捷、环保,从而提升蝉花开发的价值,该研究为蝉花多糖提取开发提供参考。
