LncRNA PLUTO促进胰岛素转录和分泌的作用及机制研究
2019-08-28张方方
张方方,刘 悦,金 亮
(中国药科大学生命科学与技术学院,南京210009)
糖尿病是世界上最常见的代谢疾病之一。肥胖是2型糖尿病的重要致病因素,但肥胖诱发2型糖尿病的确切机制尚未完全阐明[1-2]。肥胖能降低靶组织(肝脏、脂肪、肌肉)对胰岛素的敏感性,产生胰岛素抵抗,削减胰岛β细胞的功能[3-4]。而胰岛素抵抗和胰岛β细胞功能缺陷是2型糖尿病的两个主要发病机制。人类2型糖尿病易感基因的全基因组数据显示,非编码RNA对2型糖尿病的发生具有重要的作用[5-6],非编码 RNA(noncoding RNA ncRNA)是一大类不具有蛋白编码潜能的RNA转录本[7],主要包含短链非编码 RNA(microRNA,miRNA)和长链非编码 RNA(long noncoding RNA,lncRNA)[8]。LncRNA是一类转录本长度超过200 bp,序列保守性低的RNA,但其在基因组中的定位和功能具有较高的保守性[9]。lncRNA虽然不编码蛋白,但能与特定蛋白结合改变该蛋白的胞质定位,同时lncRNA可以作为miRNA及piRNA的前体小分子,分别从转录及转录后水平参与蛋白质编码基因的调控,目前已有大量文献报道lncRNA的异常表达可导致多种人类疾病的发生,比如皮肤病[10]、冠状动脉疾病[11]及糖尿病[12-14]。
目前在人类和小鼠胰岛β细胞中发现上千种lncRNA[15-17];Arnes等[18]和 You等[19]通过体内外实验证明过表达lncRNA-Meg3可抑制胰岛素合成和分泌;Kallen等[20]研究发现lncRNA H19直接与let-7结合导致胰岛β细胞产生胰岛素抵抗。以上结果均提示lncRNA能够参与胰岛β细胞的功能调控。近年来对lncRNA的研究已经引起广泛关注,但与胰岛β细胞相关的lncRNA研究机制尚不够深入。探索在胰岛β细胞中扮演重要角色的新lncRNA,揭示并完善其调控胰岛β细胞数量及功能的重要机制,是糖尿病研究领域中亟待解决的重要科学问题。
为寻找肥胖模型小鼠胰岛细胞差异表达的lncRNA,探索肥胖诱发2型糖尿病的分子机制,本课题组对转基因肥胖模型小鼠(ob/ob、db/db)及高脂饮食小鼠的胰岛进行了转录组测序,与正常小鼠胰岛细胞相比,肥胖小鼠胰岛细胞中低表达lncRNA PLUTO。利用RT-qPCR对测序数据进行验证,结果表明lncRNA PLUTO的表达模式与测序结果一致;最后在胰岛原代细胞和Min6细胞中过表达或敲降PLUTO,探讨了PLUTO促进胰岛β细胞合成和分泌胰岛素的功能及作用机制。
1 材 料
1.1 细胞和试剂
胰岛β细胞系Min6细胞购自上海生命科学院细胞所。DMEM高糖培养基、胎牛血清(美国Gibco公司),LipofectamineTM2000、Trizol试剂、RIPA裂解溶液、BCA蛋白质定量试剂盒、胰蛋白酶(上海碧云天生物公司);兔抗鼠Pdx1多克隆抗体,GAPDH单克隆抗体(美国Abcam公司);PLUTO Smart Silencer(广州锐博生物科技公司),All-in-one逆转录试剂盒、实时荧光定量RT-qPCR试剂盒(美国Abm公司)。
1.2 动 物
8周龄C57BL/6J小鼠购自扬州大学比较医学中心,许可证号:SCXK(苏)2016-0014。高脂模型组(HFD)小鼠饲喂高脂饲料(D12494,60%脂肪),正常对照组(NCD)小鼠饲喂普通维持饲料(D12450J,10%脂肪),持续喂养12周,高脂饮食小鼠体重为40~45 g,正常饮食小鼠体重为23~25 g。8周龄db/db及ob/ob小鼠购自南京大学模式动物研究所,许可证号分别为:SCXK(苏)2016-0021,SCXK(苏)2016-0001。所有小鼠保持在恒定湿度和温度的清洁级动物饲养中心。室内灯光每隔12h保持开启或关闭,模拟昼夜变化以维持动物正常生物节律。
1.3 仪 器
实时荧光定量PCR仪(美国Roche公司);细胞培养箱(美国Thermo公司);酶标仪(美国Biotek公司);显微图像采集系统(日本Olympus公司);Western blot电泳转膜系统(美国Bio-Rad公司)。
2 方 法
2.1 胰岛β细胞系-Min6细胞培养
2.1.1 完全培养基 高糖DMED含有15%胎牛血清,50μmol/Lβ-巯基已醇,1%青霉素-链霉素。
2.1.2 Min6细胞复苏 将水浴锅升温至37℃,将Min6细胞从液氮中取出,迅速置于37℃水浴锅溶解,然后加入新鲜的完全培养基1 mL,2 300 r/min离心5 min然后弃上清液,加入完全培养基4 mL重悬细胞,将细胞转移至培养瓶于5%CO2,37℃的培养箱培养,24 h后换液。
2.1.3 Min6细胞传代培 显微镜下观察培养瓶中的Min6细胞融合率达到75%以上即可传代;弃去全部培养基并加入0.1 mmol/L PBS洗涤两次,加入胰酶1 mL 37℃消化5 min,加入新鲜的完全培养基1 mL终止消化,将细胞转移至15 mL离心管于2 300 r/min离心5 min,弃上清液,加入新鲜完全培养基2 mL重悬细胞,将细胞转移至两个培养瓶于5%CO2,37℃的培养箱培养,24 h后换液。
2.2 胰岛提取
分别取 HFD、NCD、db/db、ob/ob小鼠,脱颈椎处死小鼠,置于体视显微镜下,用胶带固定,于剑突下作横向切口,开口尽量大,暴露肝脏、胃、十二指肠和脾脏。从十二指肠肠管进针,再从肠内壁刺入十二指肠大乳头,并轻轻插入胰总管约0.8~1 cm,保持针头平直,扎紧胰总管的结扎线,将针头连同胰管一同扎紧,防止倒流。此时胰腺应逐渐膨胀,胰尾开始充盈。注射完毕后,从胰尾开始轻轻分离胰腺包膜。于37℃,1 400 r/min消化28 min,至均匀细沙状(颗粒直径小于1 cm3)终止消化。加入含10%胎牛血清HBSS液5 mL终止消化。用HBSS缓冲液洗涤2遍,用适量HBSS缓冲液重悬胰岛后在显微镜下进行精细挑取,获得纯净的胰岛细胞。
2.3 糖脂刺激Min6细胞及胰岛原代细胞
80个胰岛原代细胞、Min6细胞(1×107个)接种于12孔板,分别用0.5 mmol/L棕榈酸(palmitate)、2.5 mmol/L及25 mmol/L葡萄糖刺激,并于37℃,5%CO2的培养箱内培养48 h。
2.4 核质分离
(1)用细胞刮刀刮取 Min6细胞,2 300 r/min离心5 min,弃上清液,保留沉淀,加入预冷的细胞分馏缓冲液(PARISTMKit,life)400μL,冰浴5 min,2 300 r/min离心5 min,收集上清液,得到细胞质RNA。
(2)细胞沉淀加入预冷的细胞破碎缓冲液400μL,4℃离心10 min,获得细胞核RNA。
2.5 RNA的提取和RT-qPCR实验
用Trizol法提取各胰岛原代细胞和Min6细胞的总RNA进行逆转录,得到cDNA,然后检测其中PLUTO的mRNA表达水平,RT-qPCR反应数据以循环阈值(Ct)记录,实验数据利用ΔΔCt法进行计算,用GAPDH作为内参对照(PLUTO和GAPDH引物序列见表1)。
2.6 质粒构建和脂质体转染
PLUTO全长1 444 bp,构建过表达载体时,使用PCR将PLUTO片段克隆,利用pcDNA3.1(+)真核生物表达质粒,并选择XhoⅠ和BamHⅠ作为双酶切位点(PCR引物见表2),构建成功的过表达质粒命名over-PLUTO;敲除载体使用广州锐博公司设计的 lncRNA Smart Sliencer,用 ddH2O溶解siNC和si-PLUTO干粉至终浓度为20μmol/L。根据LipofectamineTM2000试剂说明书进行转染操作,转染结束后更换新鲜完全培养基,继续培养用于后续实验。

Table 1 Primers used for RT-qPCR of PLUTO and GAPDH genes
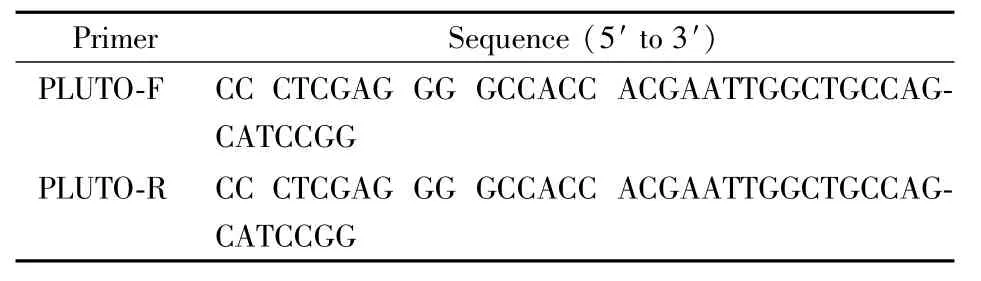
Table 2 Primers used for PCR of PLUTO
2.7 葡萄糖刺激胰岛素分泌实验(GSIS)
胰岛原代细胞和Min6细胞转染over-PLUTO或si-PLUTO 48 h后,弃培养基,用洗涤液(2%血清,2.5 mmol/L葡萄糖的 KRBH缓冲液)300μL洗涤3次,加入饥饿液(10%血清,2.5 mmol/L葡萄糖的KREB缓冲液)200μL饥饿12 h,12 h后弃上清液并洗涤3次,分别用2.5 mmol/L葡萄糖,25 mmol/L葡萄糖工作液诱导2 h;诱导结束后收集全部工作液,1 200 r/min离心5 min并收集上清液,用小鼠胰岛素ELISA试剂盒检测上清液中胰岛素的分泌量,同时用胰酶将细胞全部消化后用BCA试剂盒进行总蛋白定量。以每孔胰岛素含量(μIU)/细胞总蛋白量(mg)进行计算,作为胰岛素分泌能力的评价指标。
2.8 统计学分析
3 结 果
3.1 PLUTO在肥胖小鼠胰岛β细胞中低表达
基于课题组前期高通量测序结果,发现lncRNA-PLUTO在肥胖胰岛β细胞中降低2倍,为了验证该测序结果,利用酶法分离db/db,ob/ob和HFD 3种肥胖模型小鼠的胰岛细胞,通过RT-qPCR分析PLUTO的表达水平。结果显示与同窝出生的db/-小鼠比较,PLUTO在 db/db小鼠中降低 50%(图1-A),与同窝出生的野生型小鼠比较,在ob/ob小鼠胰岛细胞中降低60%(图1-B),与NCD小鼠胰岛细胞相比,在HFD小鼠中PLUTO的表达量下降70%(图1-C);同时发现PLUTO在胰岛细胞特异性高表达(图1-D)。以上结果显示PLUTO在不同肥胖模型小鼠的胰岛细胞中显著降低,但在正常小鼠(C57BL/6J)的胰岛组织中特异性高表达,提示PLUTO可能参与胰岛β细胞功能的调控作用。

Figure 1 Expression levels of PLUTO in the islet of db/db mice(A),ob/ob mice(B),HFD mice(C)and None islet fraction of C57BL/6Jmice(D)by RT-qPCR analysis(±s,n=3)**P<0.005,***P<0.001
3.2 糖脂毒性诱导PLUTO表达量降低
为了探索肥胖诱导PLUTO降低的原因,本研究分别用 0.5 mmol/L棕榈酸、2.5 mmol/L和 25 mmol/L葡萄糖刺激胰岛原代细胞及Min6细胞48 h。48 h后提取细胞RNA经RT-qPCR检测PLUTO的表达水平。结果如图2-A和2-B所示,在胰岛原代细胞内,经0.5 mmol/L棕榈酸刺激后PLUTO的表达量降低 60%,经高糖(25 mmol/L)刺激后PLUTO的表达量降低50%;在Min6细胞中也观察到相同的变化趋势(图2-C,2-D)。

Figure2 Primary isletswere incubated with 0.5mmol/L palmitae(A)and glucose(2.5 and 25 mmol/L,B),The expression levelsof PLUTOwere determined by RT-qPCR.Min6 cellswere incubated with 0.5 mol/L palmitae(C)and glucose(2.5 and 25 mmol/L,D),The expression levels of PLUTO weremeasured by RT-qPCR(±s,n=3)**P<0.005,***P<0.001
3.3 PLUTO的特征研究
为了研究PLUTO调控胰岛β细胞功能的作用及机制,首先通过网站UCSC查询PLUTO的亚型,保守性、蛋白编码能力等。发现在人源PLUTO只有1个亚型,而鼠源PLUTO共有3个亚型,且人源和鼠源PLUTO序列同源性高(图3-A),其中pancreatic and duodenal homeobox factor 1(Pdx1)是PLUTO的相邻基因(图3-B),经蛋白编码能力网站CPAT预测分析发现PLUTO的蛋白编码能力为0(图3-C),以上结果证明PLUTO符合 lncRNA的所有特征,说明PLUTO是一条长度大于200 bp,且不具有蛋白编码能力的长链非编码RNA。
LncRNA在细胞中的定位具有多样性,而lncRNA在靶细胞内发挥的功能与其在细胞中的定位密切相关。为了研究PLUTO在Min6细胞中的亚细胞定位,本研究利用核质分离试剂盒将Min6细胞的细胞核和细胞质进行分离,分别对PLUTO在细胞不同组分中的丰度进行了测定。U6为细胞核的阳性对照,GAPDH为细胞质的阳性对照,RT-qPCR发现PLUTO主要定位于Min6细胞的细胞核内(图3-D)。

Figure 3 (A)PLUTO is located in a large syntenic block on human chromosome13 andmouse chromosome5,there is only one isoform in human but 3 isoforms in mouse;(B)UCSC Genome Browser scheme of the human PLUTO and mouse PLUTO variants;(C)CPAT predicted the ability of PLUTO-encoded proteins;(D)PLUTO is enriched in the Min6 cells nuclear fraction.Levels of PLUTO,GAPDH,and U6 RNA in purified Min6 cells nuclear and cytoplasm fractions were detected by RT-qPCR
3.4 PLUTO促进胰岛素转录和生物合成
为了研究PLUTO是否能调控胰岛β细胞功能,首先在胰岛原代细胞中过表达或敲降PLUTO。利用酶法分离C57BL/6J小鼠的胰岛细胞,通过lipo2000转染 over-PLUTO和 si-PLUTO,转染48 h后,经RT-qPCR分析发现在胰岛原代细胞中PLUTO的表达量上升300倍(图4-A),当敲降PLUTO时,敲降效率为90%(图4-A)。RT-qPCR检测胰岛素基因(Ins1和Ins2)发现过表达PLUTO能够促进胰岛素基因上调,敲降PLUTO时,胰岛素基因表达降低(图4-B,4-C);用酸乙醇抽提液(74%无水乙醇、14%浓盐酸、12%ddH2O)溶解细胞内的胰岛素,采用ELISA检测细胞内胰岛素的含量,结果如图4-D所示,过表达PLUTO后,细胞内的胰岛素含量升高3倍,而敲降PLUTO时,胰岛素含量降低50%。
为进一步研究PLUTO调控胰岛β细胞的功能,接下来利用具有胰岛素分泌能力的β细胞系Min6细胞进行功能考察。经RT-qPCR分析发现在Min6细胞过表达PLUTO,细胞中PLUTO的表达量上升350倍,当敲降PLUTO时,敲除效率为80%(图4-E)。RT-qPCR检测胰岛素基因(Ins1和Ins2),过表达PLUTO促进胰岛素基因表达(图4-F),敲降PLUTO时,胰岛素基因表达降低(图4-G);ELISA检测细胞内胰岛素的含量,结果如图4-H所示,过表达PLUTO,细胞内的胰岛素含量升高1.5倍,而敲降PLUTO时,胰岛素含量降低50%。以上结果表明PLUTO促进胰岛β细胞合成胰岛素。
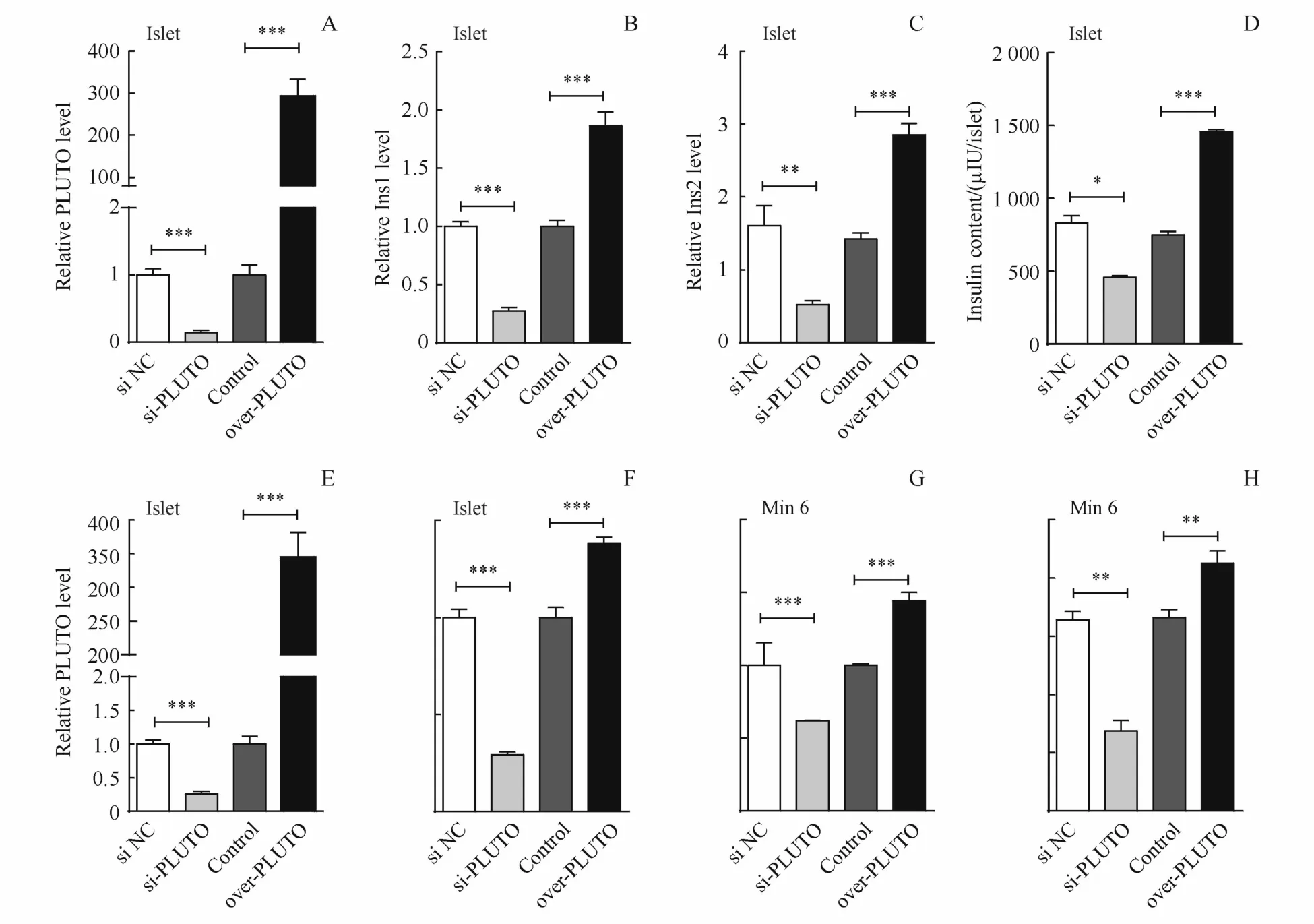
Figure 4 Effect of overexpression or knockdown of PLUTO in primary islets and Min6 cells.Over-PLUTO or si-PLUTO was transfected into primary islets and Min6 cells for 48 h.(A)The transfected efficiencies of PLUTOwere analyzed by RT-qPCR.(B-C)RT-qPCR was carried out to determine the expression levels of Ins1 and Ins2 in primary islets.Insulin contentwas then tested by ELISA in primary islets(D).(E)The transfected efficiencies of PLUTO were analyzed by RT-qPCR,(F-G)RT-qPCR was carried out to determine the expression levels of Ins1 and Ins2 in Min6 cells,and insulin contentwas analyzed by ELISA in Min6 cells(H)(±s,n=3)*P<0.05;**P<0.01,***P<0.001
3.5 PLUTO促进葡萄糖诱导的胰岛素分泌
为研究PLUTO是否能调控胰岛素分泌,首先利用酶法分离胰岛原代细胞(30 islet/孔),在含有100μL 10%FBS的 RPMI 1640培养基内平衡12 h,随后在胰岛细胞中过表达或敲降PLUTO,转染48 h后,用饥饿液(含2.5 mmol/L葡萄糖的HBSS缓冲液)饥饿培养6 h后,分别用2.5 mmol/L和16.7 mmol/L的葡萄糖刺激2 h,收集细胞上清液,用小鼠胰岛素ELISA试剂盒检测上清液中胰岛素的含量,图5-A显示,在高糖或低糖刺激条件下,过表达PLUTO均能促进胰岛原代细胞的胰岛素分泌,而敲降PLUTO后胰岛原代细胞胰岛素分泌能力被抑制。
同时将Min6细胞按照每孔1×106个的密度接种于48孔板,将over-PLUTO或si-PLUTO转染Min6细胞,转染48 h后,进行GSIS实验。结果如图5-B所示,与对照组相比,在低糖及高糖刺激下,过表达PLUTO能显著促进Min6细胞胰岛素分泌,敲降PLUTO能显著抑制Min6细胞胰岛素分泌。以上结果均表明PLUTO促进胰岛素分泌。
3.6 PLUTO靶向Pdx1促进胰岛β细胞功能
LncRNA一般通过调控相邻基因发挥功能,对PLUTO的特征分析发现Pdx1是其相邻基因,如图6-A和6-B所示,在胰岛原代细胞和Min6细胞内过表达PLUTO时,Pdx1的mRNA和蛋白表达量增加,敲降PLUTO时,Pdx1的mRNA和蛋白表达量降低。说明PLUTO可以调控Pdx1的转录和翻译。
为研究PLUTO通过靶向Pdx1调控胰岛β细胞功能,本研究通过开展功能回复实验进行验证。在Min6细胞中转染si-PLUTO和Pdx1过表达载体,结果如图6-C和6-D显示Pdx1可逆转si-PLUTO降低的胰岛素合成和分泌能力。以上结果表明PLUTO是通过靶向Pdx1促进胰岛素合成及分泌。

Figure 5 PLUTO regulates insulin secretion in islets.Over-PLUTO or si-PLUTO was transfected into primary islets and Min6 cells for 48 h.Insulin secretion was analyzed by GSIS assay in islets(A)and in Min6 cells(B)(±s,n=3)*P<0.05,**P<0.01,***P<0.001
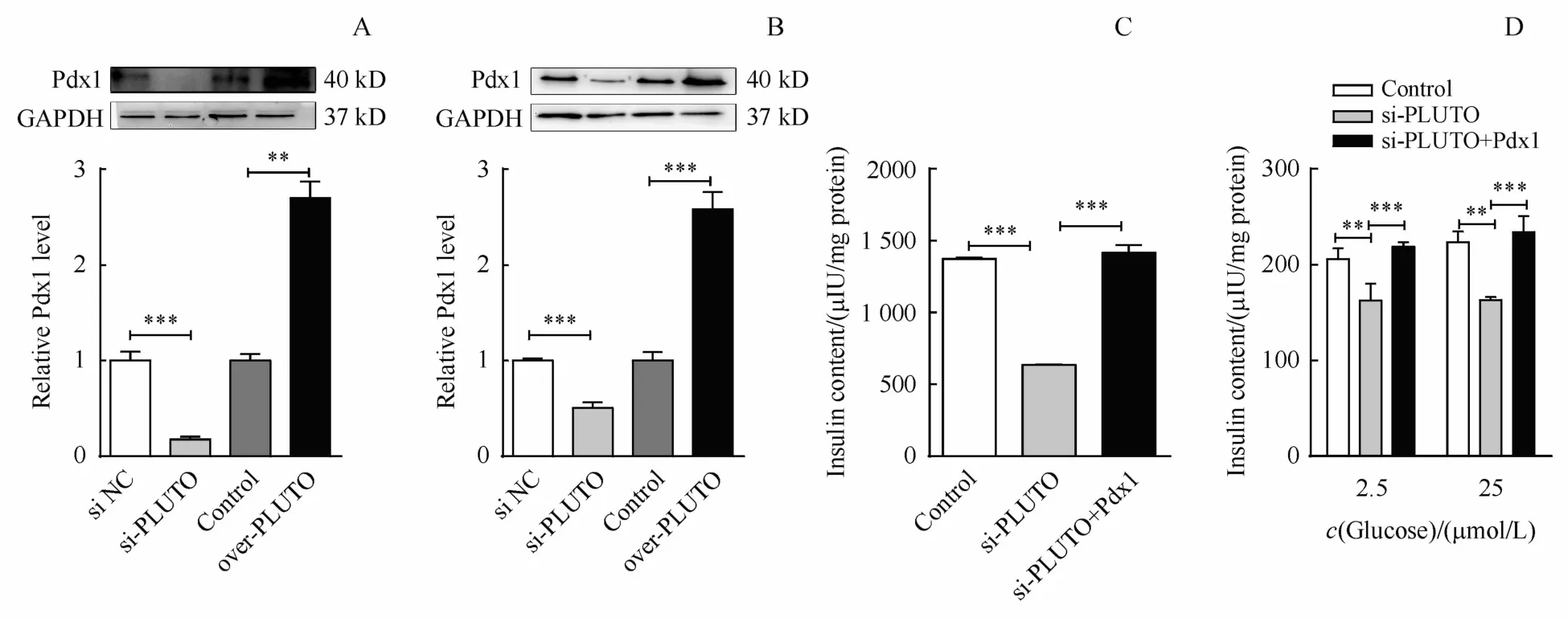
Figure6 PLUTO regulates insulin secretion via Pdx1.Over-PLUTO or si-PLUTO was transfected into primary islets and Min6 cells for 48 h.RT-qPCR and Western blotwere performed to detect the expression levels of Pdx1,in primary islets(A)and Min6 cells(B).Co-transfected si-PLUTO and Pdx1 in Min6 cells for 48 h,insulin content(C)and insulin secretion(D)were analyzed by ELISA(±s,n=3)*P<0.05,**P<0.01,***P<0.001
4 讨 论
LncRNA的作用机制包括:(1)作为信号分子调控其他基因的表达;(2)作为诱饵分子招募RNA结合蛋白,共同实现对目标基因表达的调控;(3)作为引导分子引导RNA结合蛋白复合体定位到调控位点,调节目标基因的表达;(4)作为支架分子招募多种染色质修饰复合体,实现对靶基因的沉默作用,动态调控基因的转录活性[21-23]。LncRNA定位于细胞核或胞浆,在真核细胞内被普遍转录,但不具有蛋白编码功能[24-25]。与编码蛋白质的mRNA相比,lncRNA的表达丰度一般较低,但却具有更强的组织和细胞表达特异性。LncRNA具有不同的亚细胞定位[26],并在不同的细胞定位中起不同的作用,其中细胞核定位表现更为显著。本研究基于课题组前期高通量测序发现在肥胖小鼠胰岛细胞中低表达的lncRNA-PLUTO,利用RT-qPCR对测序结果验证,发现测序结果与RT-qPCR验证结果一致。
在肥胖相关的2型糖尿病发展过程中,β细胞长期暴露于糖脂毒性环境[27]。因此,本文模拟机体肥胖的病理条件,用高浓度的游离脂肪酸(棕榈酸)及高葡萄糖刺激胰岛原代细胞和Min6细胞,分析PLUTO表达量的变化。结果显示,PLUTO表达水平因棕榈酸和葡萄糖浓度升高而降低。该实验结果将有助于阐明肥胖诱导PLUTO低表达的原因。
LncRNA的相邻基因对lncRNA的功能调控发挥主要作用[28],通过对PLUTO的结构特征研究,发现相邻基因为Pdx1[29]。Pdx1可结合胰岛素基因上游核心启动区微增强子的A3/A4元件,被认为是胰岛素基因转录的关键调节因子[30]。本研究实验结果证明过表达PLUTO促进Pdx1转录及翻译;同时功能回复实验也证明Pdx1可逆转PLUTO低表达时胰岛素合成和分泌能力的降低,与文献研究中Pdx1的功能作用相符合。表明PLUTO是通过上调相邻基因Pdx1的转录和翻译实现促进胰岛素合成及分泌的作用。
虽然非编码RNA的研究仍处于实验阶段,但随着研究的深入有望解决非编码RNA成药的局限性问题,本研究结果有望为临床检测和诊断2型糖尿病提供新的生物标志物。另一方面通过干预体内PLUTO的表达水平,达到抑制肥胖,改善2型糖尿病胰岛素抵抗的目的。
