异甘草酸镁在HBV转基因小鼠中的药效学研究
2019-08-28徐宏江赵凯迪张寅生汪纪楠
徐宏江,施 伟,宋 伟,张 颖,赵凯迪,张寅生,杨 玲,汪纪楠
(正大天晴药业集团股份有限公司研究院,江苏省抗病毒靶向药物研究重点实验室,南京210042)
异甘草酸镁具有明显的抗炎和免疫调节效应,临床应用广泛[1-3]。而用于异甘草酸镁药理机制研究的实验模型则局限于体外细胞模型或药物、毒物诱导的肝损伤动物模型,与真实的乙型肝炎病毒(HBV)感染导致的炎性病理损伤机制相差较远,因此使用适当的病毒感染动物模型进行相关研究显得尤为必要。
目前已知除人以外,HBV只能感染猩猩等少数物种[4-5],而用此类动物制作HBV感染模型具有一定的局限性,因此寻找替代动物模型尤为必要。前人已在鸭、鹅、土拨鼠和绒毛猴体内发现了一系列HBV相关的嗜肝病毒[6],其中土拨鼠和北京鸭是已建立的HBV相关动物模型的代表,但主要缺点是其肝病毒种属与人HBV在遗传学上相差较远。研究人员在1985年率先使用受精卵显微注射法构建了部分HBV基因以及全长、1.1倍、1.2倍和2.0倍全长HBV基因组的转基因小鼠模型[7-8],但这些小鼠的HBV复制表达水平不够理想。目前最广泛使用的HBV转基因小鼠是Guidotti等[9]报道的1.3倍全长HBV基因组的转基因小鼠,该品系小鼠体内可产生乙型肝炎表面抗原(HBsAg),乙型肝炎核心抗原(HBcAg),乙型肝炎E抗原(HBeAg)和完整的病毒颗粒,而且HBV复制水平较高,是理想的研究乙型肝炎治疗药物和抗病毒药物筛选的动物模型。
使用HBV转基因小鼠研究抗炎保肝药物时,关键之处在于小鼠肝脏是否会发生类似肝炎的免疫病理损伤。康爱君等[10]研究发现C57BL/6J-Tg(Alb1HBV)44Bri转基因小鼠肝脏产生局部明显的炎症反应且发现两只48周龄小鼠患肝细胞癌。Huang等[11]将1.2倍全长HBV基因组利用腺病毒载体结合水动力法转染野生型C57BL/6小鼠肝细胞,HBsAg表达可持续6个月,并且小鼠肝脏可发生类似肝炎的免疫病理损伤,甚至能够诱发肝癌[12]。因此类似肝炎的免疫病理损伤可能同时与HBV转基因小鼠的遗传背景和日龄相关,即HBV高水平复制表达的持续时间越长,肝脏出现炎性病理损伤的概率越大、程度越深。
本研究采用较大月龄(6月龄)的C57BL/6JTg(Alb1HBV)44Bri转基因小鼠作为研究对象,一方面考察该转基因小鼠的肝脏病理损伤情况,为今后的抗炎保肝药物筛选工作选择适当的动物模型;另一方面在此基础上初步探索了异甘草酸镁的抗炎保肝机制,为今后的深入研究奠定基础。
1 材 料
1.1 药物与试剂
异甘草酸镁注射液(正大天晴药业集团股份有限公司);天门冬氨酸氨基转移酶(AST)测定试剂盒和丙氨酸氨基转移酶(ALT)测定试剂盒(浙江蓝森生物科技有限公司);HBsAg诊断试剂盒(上海荣盛生物药业有限公司);FITCRat Anti-Mouse CD4、APC Rat Anti-Mouse CD8a、CD11b-PE-Cyanine7抗 体、Ly6G-PE抗体、Ly6C-FITC抗体、CBA小鼠Th1/Th2/Th17测定试剂盒(美国 BD公司);CD45-APCVio770抗 体、Rat lgG2a-FITC、Rat lgG2b-APCVio770、FcR Blocking Reagent、10×红细胞裂解液(德国 Miltenyi Biotec公司);F4/80-APC抗体、Rat lgG2a-PE、Rat lgG2a Iso control-APC、Rat lgG2a Iso control PE-Cy7(美国eBioscience公司);其他试剂均为市售分析纯。
1.2 仪 器
XL-300全自动生化仪(德国 ERBA公司);Thermo varioskan LUX多功能酶标仪、NanoDrop 2000C核酸定量仪(美国Thermo公司);LC-480II荧光定量PCR仪(瑞士Roche公司);Accuri C6流式细胞仪、BD FACSCanto II(美国BD公司)。
1.3 动 物
20只雄性清洁级 C57BL/6J-Tg(Alb1HBV)44Bri小鼠购于北京大学医学部(实验动物科学部),许可证号SCXK(京)2011-0012,体质量18~22 g,日龄135~150 d。
1.4 引 物
GAPDH-F引物(GCCAAGAGGGTCATCATCTC);GAPDH-R 引 物 (CCTTCCACAATGCCAAAGTT);50.4-ayw-HBsAg-F引 物 (TGTACCAAACCTTCGGACGG);50.4-ayw-HBsAg-R引物(ATGCTGTACAGACTTGGCCC)。以上引物均为上海生工生物工程有限公司提供。
2 方 法
2.1 动物分组和处理
将饲养30 d(180日龄)的HBV小鼠(d0)称重,随后进行眼眶内眦取血约150μL,分离血清,用XL-300全自动生化仪检测AST和ALT,间隔5 d后(d6)再次取血测定。结合d0和d6天的体重和血清转氨酶测定结果,将小鼠平均分成对照组和异甘草酸镁[15 mg/(kg·d)]组,每组10只。
于分组当天(d6)灌胃给药(异甘草酸镁组)或生理盐水(对照组),给药或生理盐水体积0.1 mL/10 g,1次/天,连续给药 5周,每周(d13、d20、d27、d34、d41)称量体重并于给药前取血约200μL,取血前禁食10~12 h。至第42天,每组留2只,其余小鼠给药前取血、取材用于测定不同指标。用麻醉剂(异氟烷)麻醉后心脏采血,每只动物采2管全血待测血液淋巴细胞分群,部分血液样本分离血清检测HBsAg和细胞因子。心脏采血后处死小鼠,立刻取部分肝脏放入液氮冻存待测HBsAgmRNA;取部分肝脏用10%福尔马林固定,石蜡包埋、切片,用于组织病理学检测。
2.2 随增龄小鼠血清转氨酶检测
每周采集的部分血清按照天门冬氨酸氨基转移酶测定试剂盒和丙氨酸氨基转移酶测定试剂盒说明书进行处理和操作,用全自动生化仪检测血清AST和 ALT。
2.3 随增龄小鼠血清HBsAg检测
将d0和d20采集的血清用酶联免疫吸附法(ELISA)检测血清HBsAg。依据HBV表面抗原诊断试剂盒说明书,采用双抗体夹心法检测HBsAg,采用抗 HBsAg包被板条,用辣根过氧化物酶(HRP)标记的抗HBsAg为酶标记物,以四甲基联苯胺(TMB)和过氧化物为底物。反应终止后用多功能酶标仪读取450 nm波长下吸收度。
2.4 肝组织HBsAgmRNA检测
将d42取材的部分肝脏用Trizol法提取小鼠肝脏组织RNA,用NanoDrop 2000C核酸定量仪进行定量,使用逆转录试剂盒将RNA转录为cDNA,最后使用SYBR Green试剂盒和LC-480II荧光定量PCR仪检测小鼠肝组织中HBsAg基因的表达量。
2.5 肝脏组织病理学检测
将d42取材的部分肝脏固定于10%福尔马林溶液内,常规取材,脱水,石蜡包埋,切片(4μm厚)、苏木精-伊红(HE)染色。光学显微镜下检查:(1)肝细胞有无变性(水肿和脂变)、坏死;(2)肝窦有无淤血,肝小叶及门管区有无炎症;(3)门管区小胆管周围有无纤维组织增生(纤维增生),有无炎细胞浸润等病理改变。根据各种病变由轻到重的程度,依次半定量为0~4分,轻微或极少量“0.5”,轻度或少量“1”,中度或较多“2”,重度或多量“3”,极重度或大量“4”,正常“0”。
2.6 血液淋巴细胞检测
使用流式细胞仪检测外周血中CD4+/CD8+淋巴细胞比例。将d42采集的全血取100μL,对照组不加抗体,CD4单阳组和CD8单阳组分别加入CD4抗体2μL和CD8抗体5μL,异甘草酸镁组加入CD4抗体2μL以及 CD8抗体5μL。混匀,室温避光孵育15 min。各组加入红细胞裂解液2 mL,室温避光孵育 10 min。1 200 r/min离心5 min,去上清液。加入PBS 2 mL洗1次。再加入PBS 0.4 mL重悬,使用流式细胞仪检测。并进行数据的处理。CD4抗体为FITC标记,CD8抗体为APC标记,分别对应流式中的FL1和FL4。
2.7 血清细胞因子检测
将d27、d41采集的全血分离血清,用流式细胞小球微阵列术(CBA)法检测细胞因子。按照CBA小鼠Th1/Th2/Th17测定试剂盒说明书,将待测血清用Assay Diluent稀释6倍后处理操作,用流式细胞仪进行检测,样本数据收集完毕(FCS2.0格式)后,用CBA专用分析软件FCAP Array v1.0进行标准曲线绘制及数据分析。
2.8 统计分析
3 结 果
3.1 异甘草酸镁对血清转氨酶的影响
根据体重和血清转氨酶活性对小鼠进行平均分组,连续给药5周,每周取血一次检测ALT和AST活性变化情况,随日龄增加,ALT和AST活性呈先上升后下降趋势。异甘草酸镁组小鼠血清ALT和AST活性均显著低于对照组(图1-A,B),而体重增加显著高于对照组(图1-C)。

Figure 1 Alanine aminotransferase(ALT)and aspartate aminotransferase(AST)activity and body weight of hepatitis B virus(HBV)transgenic mouse with age(±s,n=10)MgIG:Magnesium isoglycyrrhizinate
3.2 异甘草酸镁对血清HBsAg和肝脏组织HBsAg mRNA的影响
异甘草酸镁组和对照组小鼠随日龄增加,血清HBsAg含量均呈现上升趋势,d20血清HBsAg含量高于d0(无统计学差异)。血清样本间差异比较大,部分血清样本HBsAg含量低,异甘草酸镁组血清HBsAg与对照组无显著差异(图2-A)。
d42小鼠肝脏组织中可稳定检测到HBsAg mRNA,内参基因GAPDH以及HBsAg溶解曲线正常。异甘草酸镁组小鼠肝脏组织HBsAgmRNA与对照组无显著差异(图2-B)。
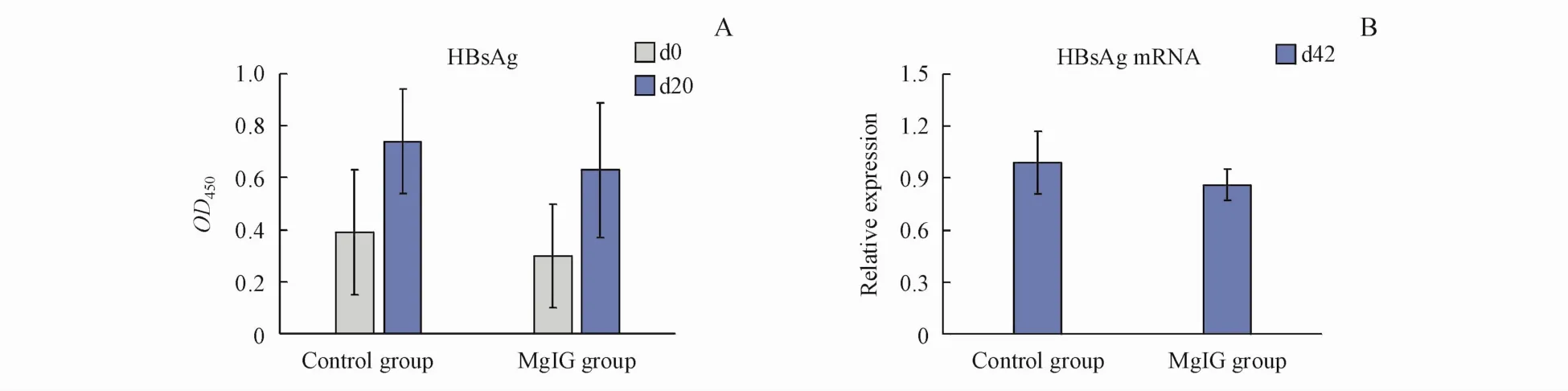
Figure 2 Hepatitis B surface antigen(HBsAg)in serum and HBsAgmRNA in liver tissueA:HBsAg in serum(±s,n=10);B:HBsAgmRNA in liver tissue(±s,n=8)
3.3 异甘草酸镁对肝细胞的保护
异甘草酸镁组和对照组小鼠肝脏的主要病理改变为肝细胞变性,坏死,局灶性炎细胞浸润,这些均为肝炎的形态学改变。异甘草酸镁组小鼠肝脏的病变程度明显轻于对照组。例如对照组1#和5#小鼠(图3-A,3-B)肝细胞可见多处变性、坏死,多数肝细胞内见糖原空泡,肝小叶内见局灶性淋巴细胞浸润。而异甘草酸镁组3#和6#小鼠(图3-C,3-D)肝细胞少数变性、坏死,肝小叶或门管区少量炎细胞浸润,少数肝细胞见核内包涵体。总体来看,对照组小鼠肝脏细胞变性坏死居多,也有炎症,异甘草酸镁组小鼠肝脏细胞只存在炎症,少见变性坏死。
3.4 异甘草酸镁对外周血淋巴细胞和细胞因子的影响
对d42小鼠全血中的淋巴细胞进行分群。与对照组小鼠相比,异甘草酸镁组小鼠全血中的CD4+淋巴细胞比例无显著差异(图4-A),而CD8+淋巴细胞比例显著降低(P<0.05)(图 4-B),CD4+/CD8+比例显著升高(P<0.05)(图 4-C)。此外,使用流式细胞小球微阵列术(CBA)考察了d27和d41天采集血清样本中的白细胞介素4(IL-4)、白细胞介素 6(IL-6)、白细胞介素 10(IL-10)、白细胞介素17(IL-17)、肿瘤坏死因子 α(TNF-α)和干扰素γ(IFN-γ)的浓度变化。结果显示异甘草酸镁能够显著降低外周血中IL-6(图4-D)和TNFα(图4-E)的表达水平(P<0.05),而其他细胞因子由于多数样本中的浓度低于检测限,因此不具有统计学意义。
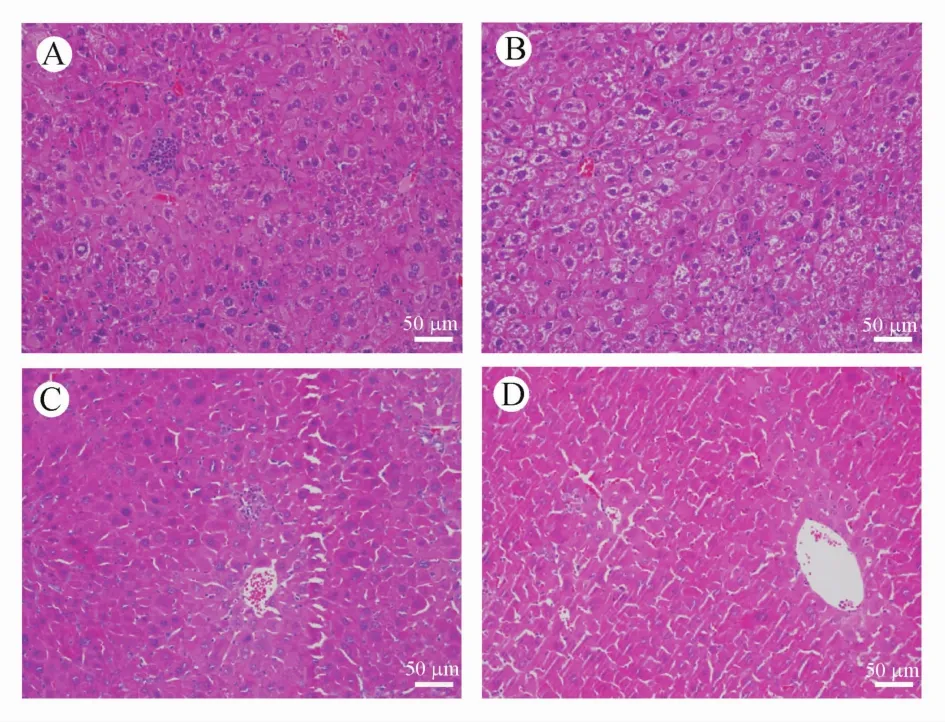
Figure 3 HE staining of liver tissue from HBV transgenicmouseA-B:Control group(d42,n=8);C-D:MgIG group(d42,n=8).Scale bar=50μmol/L
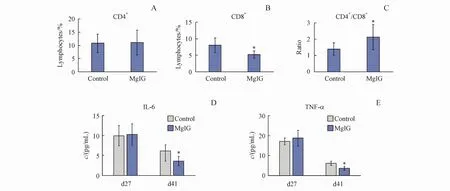
Figure4 Effects ofmagnesium isoglycyrrhizinate on lymphocytes and cytokines in peripheral bloodA:Percentage of CD4+T cell in total peripheral blood lymphocytes(d42,n=8);B:Percentage of CD8+T cell in total peripheral blood lymphocytes(d42,n=8),*P<0.05 vs control group;C:Ratio of CD4+/CD8+(d42,n=8);D:Expression of IL-6 in peripheral blood(±s,n=8);E:Expression of TNF-αin peripheral blood(±s,n=8)*P<0.05 vs control group
4 讨 论
适用于研究抗炎保肝药物药理机制的动物模型需要满足两个基本条件:一是具有持续高水平的HBV复制,二是具有持续性的HBV感染和病理变化特征[13]。本研究表明,C57BL/6J-Tg(Alb1HBV)44Bri小鼠体内HBV基因持续高水平复制,且随日龄增加,血清转氨酶浓度发生明显波动,至215日龄,可见明显的肝脏细胞变性、坏死,肝细胞胞浆中糖原沉积,肝小叶内局灶性炎细胞浸润。因此,该模型适用于异甘草酸镁的药效学研究。
实验结果显示异甘草酸镁可以降低HBV转基因小鼠的血清转氨酶水平,说明小鼠肝脏细胞损伤得到减轻。从血清HBsAg和肝脏组织HBsAgmRNA检测结果可以看出,异甘草酸镁并不影响HBV相关抗原基因的转录和表达。而通过对肝脏的组织病理学研究发现,异甘草酸镁减少了肝脏细胞的炎性细胞浸润和变性坏死,具有抗炎保肝的药效。进一步研究表明,异甘草酸镁能够升高血液中CD4+/CD8+淋巴细胞比例,并且降低了血液中炎性细胞因子的水平。而根据研究报道,细胞毒性T细胞是引起肝细胞损伤的主要因素,CD4+/CD8+淋巴细胞比例降低则是导致淋巴细胞浸润肝脏的主要原因[14]。本研究结果表明了异甘草酸镁可以通过调节体液免疫、减少炎性细胞浸润和炎性细胞因子分泌发挥抗炎保肝药效。
